Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.41 no.5 Toledo Set./Out. 2017
https://dx.doi.org/10.7399/fh.10805
Originales
Uso de medicina complementaria en pacientes oncológicos sometidos a tratamiento quimioterápico intravenoso
1Servicio de Farmacia Hospitalaria, Complejo Hospitalario de Navarra. Spain.
2CIBER Epidemiología y Salud Pública. Spain.
3Instituto de Investigación Sanitaria de Navarra-IdiSNA. Spain.
4Servicio de Farmacia Hospitalaria, Hospital García Orcoyen. Spain.
5Servicio de Oncología Médica, Complejo Hospitalario de Navarra. Spain.
Introducción
El uso de Medicina Alternativa y Complementaria (MAC) entre los pacientes oncológicos es elevado y superior al de la población general1-2. La mayoría de la información procede de Estados Unidos, donde los estudios muestran un consumo de hasta el 90% en estos pacientes3-5. Sin embargo, disponemos de pocos datos en Europa. En el año 2005 se llevó a cabo un estudio europeo en el que participaron 14 países, con una prevalencia de empleo de MAC en pacientes oncológicos del 35,9%, siendo España el cuarto país de menor consumo (29,8%)6.
Se ha asociado el uso de MAC a pacientes jóvenes, mujeres, casadas, con alto nivel educativo e ingresos anuales6-7. En cuanto al tipo de diagnóstico, es más habitual en pacientes con cáncer de mama, pulmón y gastrointestinal8,9. Algunos de los tipos de MAC más populares entre estos pacientes son los suplementos dietéticos, productos de herboristería, homeopatía, vitaminas y minerales10-11. Todas ellas son prácticas de MAC que suponen la ingesta oral de ciertos productos, y podrían por ello afectar a la seguridad terapéutica de los pacientes, ya que se han descrito interacciones entre ciertas sustancias, principalmente plantas, y la quimioterapia12-13.
En nuestro medio se desconoce la prevalencia de empleo de MAC en los pacientes diagnosticados de cáncer y, en concreto, en aquellos que siguen tratamiento, en los que resulta de especial interés por el riesgo de interacción que puede existir.
El objetivo principal de este estudio es determinar la proporción de pacientes oncológicos que utilizan medicina complementaria al tratamiento antineoplásico intravenoso prescrito de acuerdo a la práctica clínica habitual.
Los objetivos secundarios planteados son: analizar el tipo y tiempo de empleo de MAC, las fuentes de información empleadas, conocer los resultados percibidos por los pacientes acerca de los tratamientos complementarios, y realizar una caracterización socio-demográfica y clínica de la población consumidora de MAC.
Métodos
Diseño y pacientes
Se llevó a cabo un estudio observacional, descriptivo y transversal, en el Hospital de Día de Oncología del centro de referencia de la Comunidad Autónoma de Navarra.
Se invitó a participar en el estudio a los pacientes citados a tratamiento durante dos semanas consecutivas de marzo de 2015. Los criterios de inclusión fueron: tener 18 años o más, un diagnóstico de cáncer confirmado y estar recibiendo tratamiento antineoplásico intravenoso en ese momento. Se excluyeron aquellos pacientes que presentaban dificultades lingüísticas tanto en la comprensión oral como escrita del cuestionario.
Se solicitó la firma del consentimiento informado por escrito a los participantes, en la que autorizaban el acceso a la Historia Clínica, y se les entregó una Hoja de Información con un teléfono de contacto.
Las variables estudiadas se obtuvieron mediante un cuestionario guiado por entrevista a pacientes, que se cumplimentaba en las salas de tratamiento, y la Historia Clínica Informatizada. El estudio se llevó a cabo de acuerdo con la Declaración de Helsinki así como con la legislación vigente en España (orden ministerial SAS/3470/2009, de estudios observacionales). El protocolo fue evaluado por el Comité Ético de Investigación Clínica (CEIC) de la Comunidad Autónoma y clasificado por la Agencia Española de Medicamentos y Productos Sanitarios como un “Estudio Posautorización con Otros Diseños diferentes al de seguimiento prospectivo” (EPA-OD).
Cuestionario
Debido a que no existe un cuestionario validado, se diseñó tras una revisión de la literatura y fue evaluado por un oncólogo, dos epidemiólogos y un farmacéutico clínico (Figura 1). Constaba de 9 preguntas y recogía la siguiente información:
Datos socio-demográficos: sexo, edad, lugar de residencia, estado civil y nivel de estudios.
Preguntas sobre el empleo actual de MAC: tipo de MAC utilizada, momento de inicio de MAC (previo o posterior al diagnóstico oncológico), tiempo consumiendo MAC, fuentes de información y resultados percibidos (ningún resultado, mejoría o efectos adversos).
Los tipos de MAC se englobaron en dos grandes grupos, basándose en si la medicina complementaria suponía ingerir algún producto o no: “Ingesta oral de algún producto” u “Otros”. Si marcaban la casilla “Ingesta oral”, se pedía que identificasen si se trataba de productos homeopáticos, hierbas, vitaminas y/o minerales o terapias naturales. No se consideraron como MAC los cambios en la dieta ni los alimentos, a excepción de los formulados comercialmente como cápsulas, comprimidos, etc. y los productos de la medicina tradicional china, que fuesen tomados por el paciente con intención terapéutica. En el caso de rellenar la casilla “Otros”, se solicitaba que escribiesen de qué se trataba (por ejemplo yoga, osteopatía, acupuntura, campos electromagnéticos, etc.) En ambos apartados, había un campo libre para poder hacer cualquier aclaración. El último ítem del cuestionario solicitaba un número de teléfono para que, en caso de autorización, el investigador pudiese ampliar la información acerca del tipo de MAC empleada.
Posteriormente, se recogieron datos clínicos de los pacientes mediante la plataforma de Historia Clínica Informatizada del Servicio Navarro de Salud:
Diagnóstico oncológico (tipo de tumor, estadio y momento del diagnóstico).
Número de líneas de tratamiento oncológico recibidas.
Cirugía y/o Radioterapia como tratamiento del proceso.
Análisis Estadístico
Se empleó el programa IBM SPSS v22 de Windows para realizar el análisis estadístico. Se llevó a cabo un estudio descriptivo mediante análisis de frecuencias y proporciones (Nº, %) para las variables cualitativas, y medidas de posición para las variables cuantitativas edad y tiempo de consumo de MAC.
Se analizaron los potenciales predictores de uso de MAC mediante regresión logística simple. Se estimaron OR crudas y su intervalo de confianza al 95%.
Resultados
Participantes
Durante las dos semanas de muestreo, 539 personas fueron citadas en el Hospital de Día de Oncología para recibir tratamiento intravenoso. No se administró a 58 de ellas (10,8%), de modo que no accedieron a las salas en las que se estaba realizando el estudio, y a 108 personas no se les pudo localizar. Por lo tanto, el estudio se propuso a un total de 373 pacientes.
Hubo 53 personas que libremente decidieron no ser incluidas y otras 4 cumplían criterios de exclusión, debido a la imposibilidad de comprensión del cuestionario por desconocimiento del idioma en tres pacientes y por diagnóstico psiquiátrico en otro caso.
La muestra de este estudio se compone de 316 personas, lo que representa el 84,7% de los pacientes a los que se les propuso. Fue necesario realizar llamadas telefónicas para ampliar la información en 12 (3,8%) casos.
Características sociodemográficas y clínicas
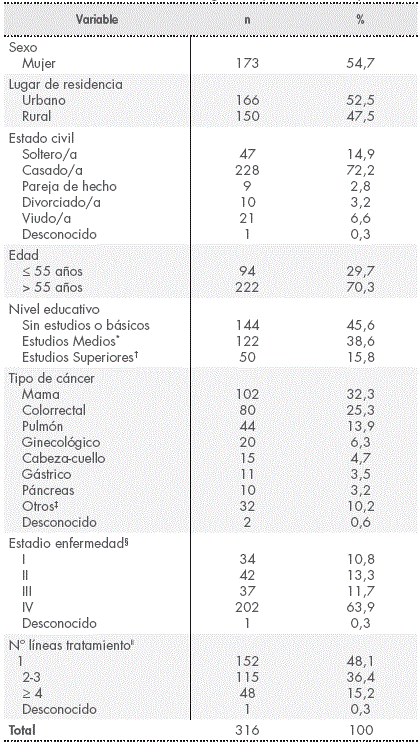
Las características sociodemográficas y clínicas de los pacientes se presentan en la Tabla 1.
Tabla 1 Características sociodemográficas y clínicas de los pacientes
* Se incluyen estudios de Secundaria, Grado Formativo Medio/Superior y Bachillerato.
† Estudios Universitarios.
‡ Tumores con una prevalencia inferior a 10 pacientes en la muestra a estudio.
§ Estadio en el momento de inclusión en el estudio. Basado en la clasificación TNM del “American Joint Committee on Cancer” (AJCC). Disponible en: https://cancerstaging.org/
ǁ Tratamiento quimioterápico, inmuno-oncológico y hormonal.
Un total de 173 mujeres (54,7%) participaron en el estudio, y la edad media de los pacientes fue 61 años (24-85). Cerca de la mitad vivía en zona rural y casi tres cuartas partes de la población estaban casados. El 16% poseía titulación Universitaria.
El diagnóstico oncológico más frecuente fue cáncer de mama (32,3%), seguido de colorrectal y pulmón. La mediana de tiempo transcurrido desde el diagnóstico de la enfermedad fue 12 meses (rango 0-266 meses). Un total de 222 pacientes (70%) habían sido operados para tratar su tumor, y 138 (44%) habían recibido radioterapia. Hubo 10 (3,2%) pacientes que participaban en ensayos clínicos en el momento de su inclusión en el estudio.
Uso de MAC
El uso simultáneo de MAC y el tratamiento convencional con quimioterapia fue referido por 102 pacientes (32,3%).
El 89% de las personas que empleaban MAC tomaban oralmente algún preparado. Los tipos de productos ingeridos con más frecuencia fueron plantas (n=60, 66%), seguido de terapias naturales (n=35, 38,5%), vitaminas/minerales (n=32, 35,2%) y homeopatía (n=16, 17,6%), respectivamente.
Se contabilizaron 51 plantas diferentes. El 11,7% de los pacientes que tomaban plantas empleaba cúrcuma, que fue la más frecuente seguido de uña de gato (8,3%), regaliz (8,3%), tomillo (8,3%), cardo mariano (6,7%), melisa (6,7%) y equinácea (5%). En el caso de terapias naturales, se contabilizaron 33 diferentes, siendo las más comunes hongos terapéuticos procedentes de la medicina tradicional china (14,3%), lactobacillus (14,3%), jalea real (11,4%), propóleo (11,4%), algas como spirulina y blue-green (8,6%), sacharomyces (8,6%), rábano (5,7%), ajo negro (5,7%) y jengibre (5,7%) . De los pacientes que empleaban suplementos vitamínicos, el 50% usaba vitamina C, seguido de vitaminas del grupo B (31,3%) y vitamina E (18,8%). En cuanto a sales minerales, el zinc era empleado por el 21,9% de los pacientes que las tomaban, seguido de magnesio (15,6%), bicarbonato (9,5%) y cobre (9,4%). Los productos homeopáticos más comunes fueron el Suplemento Mineral Milagroso (MMS), consistente en clorito sódico, cicuta y carcinosinum, que era utilizado por el 43,8% que usaba homeopatía, y las Sales de Schussler (31,3%).
Del total de pacientes que afirmaron utilizar MAC, 37 (36,3%) practicaban alguna terapia relacionada con la “medicina de la mente y el cuerpo”, “prácticas de manipulación y basadas en el cuerpo” y/o “medicina sobre energía”. Entre éstas prácticas predominaron el yoga, reiki, aplicación de campos electromagnéticos, baños de agua con sal, acupuntura, hipertermia y ejercicios de relajación.
El 81,4% de los pacientes que empleaban MAC había comenzado a utilizarla tras el diagnóstico de la enfermedad (Tabla 2), siendo la mediana de tiempo de uso de 4,5 meses (0-180 meses).
Tabla 2 Respuestas relativas al uso de Medicina Complementaria
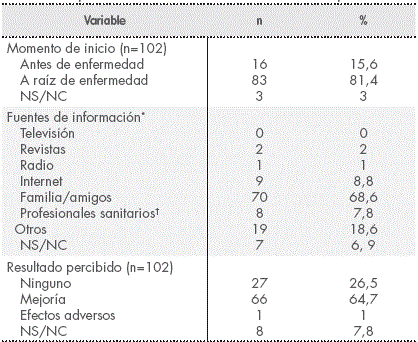
* Más de una fuente de información sobre Medicina Complementaria pudo ser empleada.
† Personal médico, farmacéutico y enfermería.
Abreviaturas: NS/NC, no sabe o no contesta.
El principal modo en el que conocieron la existencia de MAC (Tabla 2), fue través de familiares o amigos. Hubo 4 pacientes que indicaron conocer los productos a través de un Homeópata y 3 a través de Herboristería.
En relación a los resultados percibidos acerca de la MAC (Tabla 2), el 64,7% de las personas que la utilizaban afirmaron experimentar algún tipo de beneficio con la misma. Se indicó un efecto adverso, descrito como acidez de estómago tras la ingesta de un preparado comercial de equinácea y uña de gato. Analizando exclusivamente los pacientes que comenzaron a usar MAC a raíz del diagnóstico oncológico, 52 (63%) referían que la MAC les estaba ayudando en algún aspecto: 24 (29%) consideraban que les aportaba fortaleza física y psíquica, 20 (24,1%) que les ayudaba a paliar los efectos secundarios del tratamiento, 14 (16,9%) que estaba contribuyendo a fortalecer el sistema inmunitario y 2 (2,4%) a luchar contra el cáncer.
Características que influyen en el empleo de MAC
En la Tabla 3 se describen los potenciales predictores de uso de MAC teniendo en cuenta las características sociodemográficas y clínicas estudiadas. El sexo femenino se asoció de manera positiva con el uso de MAC, de manera que se estimó que las mujeres tenían 1,72 veces (IC95% 1,06-2,80; p=0,028) más riesgo de usar MAC que los hombres. La edad también mostró diferencias significativas en el uso de MAC. Teniendo en cuenta la edad como variable continua, ésta mostró un consumo decreciente de MAC por año cumplido (OR: 0,96 IC95% 0,94-0,98; p<0,001). El riesgo de empleo de MAC fue doble en los pacientes con estudios medios respecto a los que carecían de estudios o tenían estudios básicos (IC95% 1,19-3,38; p=0,009).
Tabla 3 Características socio-demográficas y clínicas influyentes en el uso de MAC
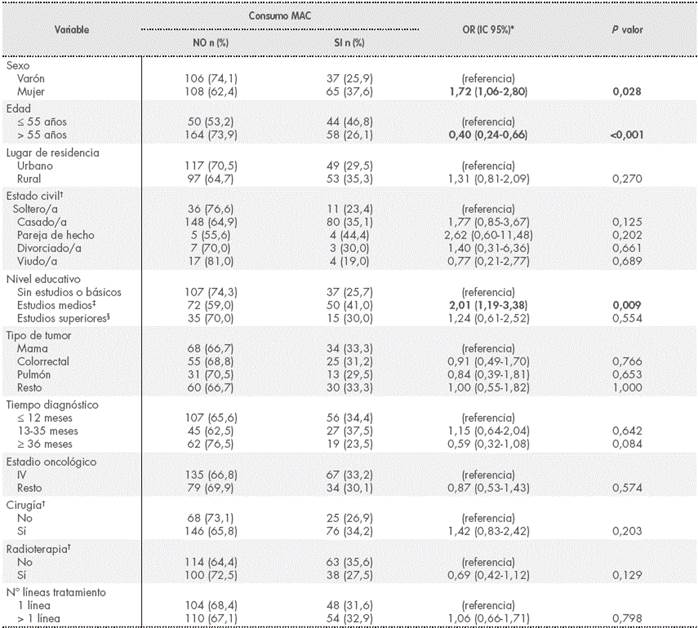
* Odds ratio cruda para estudiar la asociación entre predictores de interés y uso de MAC.
† Incluidos en el análisis 315 pacientes que autorizaron el acceso a su Historia Clínica.
‡ Se incluyen estudios de Secundaria, Grado Formativo Medio/Superior y Bachillerato.
§ Estudios Universitarios.
Abreviaturas: MAC, medicina alternativa y complementaria.
La mitad de los pacientes que formaban parte de ensayos clínicos afirmaron utilizar MAC en el momento del estudio, sin encontrar diferencias estadísticamente significativas en el uso de MAC respecto a los pacientes que no participaban en ensayos (OR: 2,16 IC95% 0,61-7,62).
Discusión
Se dispone de poca información acerca del uso de MAC entre las personas diagnosticadas de cáncer en España. El trabajo actual aporta una evidencia inicial acerca de la frecuencia de empleo de éstas medicinas complementarias y los tipos de prácticas utilizadas. En concreto, lo hace en aquellos pacientes que reciben tratamiento intravenoso, en los que puede existir riesgo de interacción entre la MAC y el mismo.
La prevalencia de consumo de MAC en esta población fue ligeramente superior a la referida para la población global española (29,8%), en el único estudio multicéntrico europeo sobre MAC en pacientes oncológicos que existe hasta la actualidad6. Son datos consistentes con resultados previos de estudios realizados sobre MAC en el campo de la oncología. En el año 1998 se llevó a cabo una revisión sistemática de 26 trabajos con pacientes oncológicos en 13 países, y mostró una media de consumo del 31%14. Sin embargo, debido a la creciente popularidad de la MAC se podía esperar obtener tasas de consumo superiores en este trabajo. De hecho, en población norteamericana se han documentado cifras de empleo de MAC del 64-90% en pacientes oncológicos4,5, y en países asiáticos son cercanas al 50%15,16,17. Estas elevadas cifras de prevalencia pueden relacionarse con la diversidad racial y cultural presente en estos países, y verse influenciadas tanto por las prácticas de MAC occidentales como orientales. A nivel europeo, también se han encontrado cifras elevadas de uso de MAC, entre el 45-51%9,18,19. Sin embargo, en un estudio italiano que preguntaba exclusivamente por el uso actual de MAC, al igual que en nuestro caso, la cifra descendía al 14%20.
La comparación directa de los resultados de este trabajo con estudios previos debe hacerse con precaución, ya que pueden existir diferencias en el tipo y tamaño de muestra, metodológicas, y conceptuales (definición y tipo de terapias consideradas como MAC). En este estudio no se incluyeron a los pacientes oncológicos que no estaban siendo tratados ni a los que seguían tratamiento con quimioterapia oral, por motivos de limitación de personal y temporal. No se incluyeron como MAC las dietas especiales ni zumos especiales contemplados por otros autores21,22, considerándose sólo aquellos alimentos formulados comercialmente como cápsulas, comprimidos, etc. o productos de la medicina tradicional china15. Tampoco se tuvieron en cuenta los batidos hiperproteicos, ya que forman parte del cuidado médico habitual de estos pacientes. En cuanto a las plantas consideradas, cabe señalar que no se definieron como MAC el té blanco, té verde, té rojo y té negro, ante la dificultad que suponía identificar si su uso tenía una intención terapéutica. Esto se diferencia de otros estudios, en los que se documenta el uso de té verde como MAC4,5,6,15. Estas limitaciones en la definición de MAC, y el hecho de evaluar exclusivamente su uso en el momento actual, son posibles causas de la menor prevalencia encontrada en el presente estudio.
Los tipos de MAC más utilizados en la muestra suponían un consumo oral de productos, frente a la realización de prácticas relacionadas con el cuerpo o la mente. Las sustancias más empleadas fueron plantas, terapias naturales y vitaminas/minerales, como ya se ha documentado en otros estudios11,19,23. Este aspecto refleja el atractivo que tienen las terapias y remedios “naturales” para los pacientes, pero son precisamente estas sustancias las que entrañan mayor riesgo6. De hecho, han sido identificadas interacciones farmacocinéticas entre ciertas hierbas y productos naturales con la quimioterapia: el ajo, gingseng, equinácea y la soja son inhibidores del CYP450 en estudios preclínicos24-25, por lo que pueden disminuir la eliminación de los fármacos citostáticos e incrementar como consecuencia su toxicidad. Precisamente el ajo y la equinácea fueron productos utilizados por los pacientes del estudio. Otras sustancias utilizadas y que interaccionan con fármacos quimioterápicos son: regaliz, reishi, rábano y jengibre26. La suplementación vitamínica más frecuente fue la vitamina C, para la que se han descrito interacciones con agentes antineoplásicos como metotrexato o imatinib27.
La mayoría de pacientes (81%) comenzaron la MAC tras el diagnóstico oncológico. Sin embargo, el boca a boca de familiares y amigos parece ser la fuente más importante, al igual que en otros estudios6-7, siendo la consulta al profesional sanitario poco frecuente. Se hace patente la necesidad de concienciación y formación de los profesionales sanitarios en el uso de MAC, para que puedan llegar a ser el referente en el tratamiento integral del paciente. En este aspecto el farmacéutico hospitalario puede desarrollar una labor importante, especialmente en el análisis de interacciones potenciales entre el tratamiento convencional y complementario. Podría ser de utilidad la implantación de sistemas de alerta que contemplen estos productos en los programas informáticos de validación y dispensación farmacéutica.
Una cuarta parte de los pacientes que usaban MAC afirmaba no sentir ninguna mejoría con la misma. A pesar de ello, seguían empleándola; quizá el concepto de “esperanza” pueda ser fundamental en la razón que contribuya al uso de MAC6. Los aspectos beneficiosos más indicados por los pacientes guardan relación con las principales razones que motivan a usar MAC en otros estudios: otorgar buen estado de salud general, bienestar físico y emocional y fortalecer el sistema inmunitario6-7,28. A pesar de que en el cuestionario se preguntaba específicamente por los resultados obtenidos con la MAC, la mejoría percibida por los pacientes podría estar influenciada por los efectos del tratamiento, debido a que la MAC se empleaba a la vez que la quimioterapia.
Hubo tres variables predictoras del uso de MAC: ser mujer, ser joven y tener estudios medios. Las dos primeras se han identificado en otros trabajos 6,29. Sin embargo, también se ha asociado el mayor empleo de MAC a pacientes con estudios superiores6,8 y a estadios avanzados de la enfermedad30.
En este estudio pudo haber ciertas limitaciones. A los pacientes se les solicitaba indicar en el cuestionario el tipo de MAC que empleaban, clasificándolo en una determinada categoría. Puesto que es frecuente que los pacientes utilicen más de un tipo de MAC, puede haber sesgos en relación al recuerdo y al conocimiento del tipo de MAC. Con la intención de minimizarlo, se llevaron a cabo llamadas telefónicas a pacientes que no eran capaces de recordarlo en el momento de la entrevista. Hubiera sido interesante hacer una visita de seguimiento presencial para ver físicamente los productos utilizados y poder categorizarlos. Debido a un problema temporal, no fue posible hacerlo en este estudio. Por otro lado, la participación de dos investigadores en las entrevistas a pacientes implica que pueda haber sesgo del entrevistador, debido a la influencia que pueda tener el diferente modo de comunicación oral y corporal sobre las respuestas del paciente. Para minimizarlo ambos entrevistadores participaron en el diseño del cuestionario, y consensuaron criterios en la definición de MAC y su clasificación.
Un número importante de pacientes en este estudio usaron MAC al mismo tiempo que el tratamiento médico habitual. Debido a que la MAC se basaba fundamentalmente en una ingesta oral de sustancias, existe un riesgo potencial de interacción con la quimioterapia. Al no ser un objetivo del presente estudio, desconocemos la magnitud de este problema. Consideramos necesario concienciar a los profesionales sanitarios sobre la importancia de indagar sobre el empleo de MAC entre los pacientes y poder aconsejarles sobre ello. De acuerdo a este estudio, las mujeres, los jóvenes y las personas con estudios medios son los que más emplean MAC de manera estadísticamente significativa, lo cual puede resultar de ayuda para identificar al potencial usuario de la misma. Sería interesante realizar futuros trabajos para estudiar el uso de MAC en grupos de pacientes con un tipo de cáncer concreto, e indagar en las posibles interacciones entre la MAC y la quimioterapia.
Aportación a la literatura científica
Este es el primer estudio realizado en España, según nuestro conocimiento, que analiza la frecuencia de uso de medicina complementaria entre los pacientes oncológicos que reciben tratamiento médico con quimioterapia. Se ha documentado un uso frecuente de medicina alternativa y complementaria entre estos pacientes, pero la mayoría de la información procede de países norteamericanos. En este trabajo se observa que un tercio de los pacientes que acuden a Hospital de Día a recibir quimioterapia intravenosa emplean simultáneamente otro tipo de prácticas, en su mayoría a base de ingesta de sustancias (89%), sobre todo plantas y terapias naturales. La diversidad de este tipo de productos fue importante, por el elevado contenido de componentes diferentes en un mismo preparado. Este aspecto contrasta con la escasa consulta al profesional sanitario acerca de la medicina complementaria, ya que solo el 8% de los pacientes refirió haber obtenido información a partir del mismo. Los factores que se asociaron al uso de medicina complementaria fueron el sexo (mujer), la edad y el nivel educativo (estudios medios).
Independientemente del posicionamiento de los profesionales sanitarios en el ámbito de la medicina complementaria, este trabajo demuestra que los pacientes la emplean, ante el impacto físico-emocional que conlleva el diagnóstico y tratamiento oncológico. Debido a la elevada prevalencia de estas prácticas y a la escasa consulta observada al profesional sanitario, es importante la formación en este ámbito, para que el profesional pueda llegar a ser un referente en el consejo sobre la efectividad y contraindicación de ciertos usos de medicina complementaria. El papel del farmacéutico hospitalario es relevante en la entrevista al paciente y la revisión de las posibles interacciones entre las sustancias empleadas y la quimioterapia, con el fin de garantizar su seguridad y eficacia.
Bibliography
Mao JJ, Palmer CS, Healy KE, Desai K, Amsterdam J. Complementary and alternative medicine use among cancer survivors: a population-based study. J Cancer Surviv. 2011;5(1):8-17. [ Links ]
Goldstein MS, Brown ER, Ballard-Barbash R, Morgenstern H, Bastani R, Lee J, et al. The use of complementary and alternative medicine among California adults with and without cancer. Evid Based Complement Alternat Med. 2005;2(4):557-65. [ Links ]
Yates JS, Mustian KM, Morrow GR, Gillies LJ, Padmanaban D, Atkins JN, et al. Prevalence of complementary and alternative medicine use in cancer patients during treatment. Support Care Cancer. 2005;13(10):806-11. [ Links ]
Anderson JG, Taylor AG. Use of complementary therapies for cancer symptom management: results of the 2007 National Health Interview Survey. J Altern Complement Med. 2012;18(3):235-41. [ Links ]
Rausch SM, Winegardner F, Kruk KM, Phatak V, Wahner-Roedler DL, Bauer B, et al. Complementary and alternative medicine: use and disclosure in radiation oncology community practice. Support Care Cancer. 2011;19(4):521-9. [ Links ]
Molassiotis A, Fernadez-Ortega P, Pud D, Ozden G, Scott JA, Panteli V, et al. Prevalence of complementary and alternative medicine use in cancer patients during treatment. Ann Oncol. 2005;16(4):655-63. [ Links ]
Helyer LK, Chin S, Chui BK, Fitzgerald B, Verma S, Rakovitch E, et al. The use of complementary and alternative medicines among patients with locally advanced breast cancer-a descriptive study. BMC Cancer. 2006;6:39. [ Links ]
Garland SN, Valentine D, Desai K, Li S, Langer C, Evans T, et al. Complementary and alternative medicine: use and disclosure in radiation oncology community practice. J Altern Complement Med. 2013;19(11):876-81. [ Links ]
Berretta M, Della Pepa C, Tralongo P, Fulvi A, Martellotta F, Lleshi A, et al. Prevalence of complementary and alternative medicine use in cancer patients during treatment. An Italian multicenter survey. Oncotarget. 2017;8(15):24401-14. [ Links ]
Ernst E. Complementary cancer treatments: hope or hazard?. Clin Oncol. (R Coll Radiol). 1995;7(4):259-63. [ Links ]
Huebner J, Micke O, Muecke R, Buentzel J, Prott FJ, Kleeberg U, et al. User rate of complementary and alternative medicine (CAM) of patients visiting a counseling facility for CAM of a German comprehensive cancer center. Anticancer Res. 2014;34(2):943-8. [ Links ]
Block KI. Significance of natural product interactions in oncology. Integr Cancer Ther. 2013;12(1):4-6. [ Links ]
Bossaer JB, Odle BL. Probable etoposide interaction with Echinacea. J Diet Suppl. 2012;9(2):90-5. [ Links ]
Ernst E, Cassileth BR. The prevalence of complementary/alternative medicine in cancer: a systematic review. Cancer. 1998;83(4):777-82. [ Links ]
Hyodo I, Amano N, Eguchi K, Narabayashi M, Imanishi J, Hirai M, et al. Prevalence of complementary and alternative medicine use in cancer patients during treatment. J Clin Oncol. 2005;23(12):2645-54. [ Links ]
Nagashekhara M, Murthy V, Mruthyunjaya AT, Li Ann L. An Empirical Study on Traditional, Complementary and Alternative Medicine Usage among Malaysian Cancer Patients. Asian Pac J Cancer Prev. 2015;16(15):6237-41. [ Links ]
Oyunchimeg B, Hwang JH, Ahmed M, Choi S, Han D. Complementary and alternative medicine use among patients with cancer in Mongolia: a National hospital Survey. BMC Complement Altern Med. 2017;17(1):858. [ Links ]
Molassiotis A, Scott JA, Kearney N, Pud D, Magri M, Selvekerova S, et al. Prevalence of complementary and alternative medicine use in cancer patients during treatment. Support Care Cancer. 2006;14(3):260-7. [ Links ]
Wortmann JK, Bremer A, Eich HT, Wortmann HP, Schuster A, Fuhner J, et al. Use of complementary and alternative medicine by patients with cancer: a cross-sectional study at different points of cancer care. Ann Oncol. 2016;33(7):858. [ Links ]
Johannessen H, von Bornemann Hjelmborg J, Pasquarelli E, Fiorentini G, Di Costanzos F, Miccinesi G. Prevalence in the use of complementary medicine among cancer patients in Tuscany, Italy. Tumori. 2008;94(3):406-10. [ Links ]
Perlman A, Lontok O, Huhmann M, Parrott JS, Simmons LA, Patrick-Miller L. Prevalence and correlates of postdiagnosis initiation of complementary and alternative medicine among patients at a comprehensive cancer center. J Oncol Pract. 2013;9(1):34-41. [ Links ]
Pihlak R, Liivand R, Trelin O, Neissar H, Peterson I, Kivistik S, et al. Complementary medicine use among cancer patients receiving radiotherapy and chemotherapy: methods, sources of information and the need for counselling. Eur J Cancer Care. (Engl). 2014;23(2):249-54. [ Links ]
Yarney J, Donkor A, Opoku SY, Yarney L, Agyeman-Duah I, Abakah AC, et al. Characteristics of users and implications for the use of complementary and alternative medicine in Ghanaian cancer patients undergoing radiotherapy and chemotherapy: a cross-sectional study. BMC Complement Altern Med. 2013;13:16. [ Links ]
Hardy ML. Dietary supplement use in cancer care: help or harm. Hematol Oncol Clin North Am. 2008;22(4):581-617. [ Links ]
Lee CO. Herbs and cytotoxic drugs: recognizing and communicating potentially relevant interactions. J Oncol Pract. 2005;9(4):481-7. [ Links ]
Arslan D, Tural D, Akar E. Herbal administration and interaction of cancer treatment. J Altern Complement Med. 2013;16(11):1466-76. [ Links ]
Collado-Borrell R, Escudero-Vilaplana V, Romero-Jimenez R, Iglesias-Peinado I, Herranz-Alonso A, Sanjurjo-Saez M. Oral antineoplastic agent interactions with medicinal plants and food: an issue to take into account. J Clin Oncol. 2016;142(11):2319-30. [ Links ]
Astin JA, Reilly C, Perkins C, Child WL, Susan GKBCF. Breast cancer patients’ perspectives on and use of complementary and alternative medicine: a study by the Susan G. Komen Breast Cancer Foundation. J Clin Oncol. 2006;4(4):157-69. [ Links ]
Bott J. An analysis of paper-based sources of information on complementary therapies. Complement Ther Clin Pract. 2007;13(1):53-62. [ Links ]
Klafke N, Eliott JA, Wittert GA, Olver IN. Prevalence and predictors of complementary and alternative medicine (CAM) use by men in Australian cancer outpatient services. Ann Oncol. 2012;23(6):1571-8. [ Links ]
Recibido: 11 de Abril de 2017; Aprobado: 08 de Mayo de 2017











 texto em
texto em 



