Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.41 no.5 Toledo Set./Out. 2017
https://dx.doi.org/10.7399/fh.10762
Originales Breves
Evaluación de la toxicidad tras la administración de quimioterapia triple intratecal estandarizada en pacientes onco-hematológicos adultos
1Departamento de Farmacología, Universidad de Murcia. Spain.
2Servicio de Farmacia, Hospital Clínico Universitario Virgen de la Arrixaca, Murcia. Spain.
3Servicio de Hematología, Hospital Clínico Universitario Virgen de la Arrixaca, Murcia. Spain.
Introducción
La infiltración de células neoplásicas en el sistema nervioso central (SNC) es una complicación poco frecuente de los pacientes con leucemias agudas y linfomas no Hodgkin (LNH) pero que cuando aparece está asociada a una elevada morbimortalidad1.
El uso de profilaxis o tratamiento de la infiltración neuromeníngea suele incluirse en los protocolos de tratamiento y, en general, se recomienda la administración de quimioterapia intratecal. Sin embargo, la indicación terapéutica, la pauta utilizada y los fármacos y dosis a utilizar en la terapia intratecal no es una práctica homogénea entre países y/o grupos de trabajo o, incluso, entre distintos hospitales. En España, según el estudio QUIT, se utiliza mayoritariamente la administración conjunta de metotrexato, citarabina e hidrocortisona, conocido como quimioterapia triple intratecal (TIT)2-3.
A esta práctica heterogénea, hay que añadirle el hecho de que existen pocos estudios que evalúen la tolerancia de la administración de quimioterapia intratecal; además, otros aspectos que según diversos autores pueden afectar a la toxicidad, tales como el volumen, pH y osmolaridad de la mezcla, así como aspectos relacionados con la técnica de administración, no suelen indicarse en los estudios existentes y podrían afectar los resultados4,5.
Por todo ello, se elaboró un protocolo intrahospitalario donde se estandarizaba la forma de preparación y se indicaban recomendaciones para la administración de la TIT.
El objetivo del presente estudio es evaluar la toxicidad asociada a la administración de quimioterapia triple intratecal estandarizada e identificar factores de riesgo asociados a la misma.
Métodos
Se realizó un estudio observacional y prospectivo de todas las administraciones de TIT estandarizada administradas a pacientes onco-hematológicos adultos (edad ≥ 18 años) durante 18 meses (Enero 2013 - Junio 2014). Se realizó el seguimiento de los pacientes hasta el 31 de Julio de 2014.
Quimioterapia triple intratecal
Las dosis de metotrexato, citarabina e hidrocortisona se extrajeron de los protocolos PETHEMA (Programa para el Estudio y Tratamiento de las Hemopatias Malignas) siendo éstas 12 mg, 30 mg y 20 mg, respectivamente. El volumen final de la mezcla fue de 8 mL. Las preparaciones se ajustaron a valores de pH y osmolaridad similares a los del líquido cefalorraquídeo (LCR), utilizando como disolvente cloruro sódico 0,9% (osmolaridad aproximada 300 mOsm/L) y ajustando el pH entre 7-7,5 con bicarbonato sódico6,7.
La preparaciones eran estériles, apirógenas y libres de conservantes.
Administración de la TIT
Se establecieron recomendaciones con el objetivo de mejorar la tolerancia: (1) extraer un volumen de LCR similar al volumen de TIT a administrar; (2) realizar la PL con el paciente en decúbito lateral o sedestación durante la administración; (3) usar anestésicos locales previos a la administración (4) mantener al paciente 2 horas en reposo en decúbito supino tras la administración.
Variables estudiadas y análisis estadístico
Se registraron los eventos adversos (EA) aparecidos tras la administración de la quimioterapia TIT, así como diferentes variables del paciente y de la administración que podían influir en la toxicidad. Los efectos adversos se definieron y evaluaron según la clasificación CTCAE v4.08 y se estudió su causalidad mediante el Algoritmo de Naranjo9.
Se analizó la relación de las variables con la presencia o ausencia de toxicidad mediante el test de Chi-cuadrado (variables cualitativas o categóricas) o t-Student o U-Mann-Whitney (variables cuantitativas). Se realizó un análisis de regresión logística con la aparición de toxicidad como variable dependiente, y las variables en las que se había observado relación con la aparición de toxicidad como covariables. Las variables con p < 0,15 en el análisis univariante se incluyeron en el modelo de regresión multivariante. Se consideró significativo un valor de p < 0,05.
Resultados
Se registraron 56 administraciones de TIT estandarizada, en 20 pacientes, con una media de edad de 47,7 ± 13,8 años (Tabla 1).
Tabla 1 Características clínicas y demográficas de los pacientes incluidos
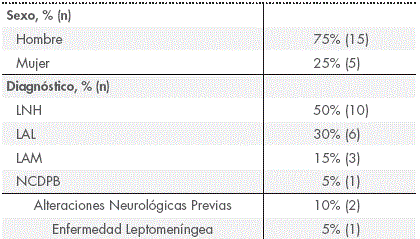
*Abreviaturas: LAL: Leucemia Aguda Linfoblástica; LAM: Leucemia Aguda Mieloide; LNH: Linfoma no Hodking; NCDPB: Neoplasia Células Dendríticas Plasmocitoides Blásticas.
El 94,6% de las administraciones se realizaron como profilaxis de la infiltración del SNC y solo 3 procedimientos se realizaron como tratamiento, todos en el mismo paciente. La mediana de TIT administradas previamente a la TIT registrada fue de 2 (Rango intercuartílico (RIQ) = 0,25-7). La mediana del intervalo de tiempo entre administraciones fue de 28 días (RIQ = 20,5-51 días).
No se había administrado radioterapia craneoespinal previa en ninguno de los pacientes, pero sí se había administrado previamente irradiación corporal total (ICT) en 2 procedimientos (1 paciente) y se administró ICT concomitante en 10 administraciones (17,9%) (5 pacientes). En el 76,8% de las administraciones el paciente estaba recibiendo concomitantemente quimioterapia y en el 75% algún antineoplásico potencialmente neurotóxico.
Todos los procedimientos se realizaron mediante PL, durante el procedimiento el paciente permaneció en decúbito lateral en el 62,5% de las administraciones y tras el procedimiento en el 94,6% permaneció en decúbito supino. Se utilizaron anestésicos locales previos a la administración en el 19,6% de las administraciones. El tiempo de reposo post-punción se registró en 24 administraciones (42,8%) siendo la mediana de 1 hora (RIQ = 1-2h) y el tiempo máximo de reposo de 4 horas. Aparecieron complicaciones durante el procedimiento en sólo 2 casos, ambas fueron leves y no necesitaron tratamiento.
El volumen de TIT administrado fue de 8 mL en todos los procedimientos y la diferencia media entre el volumen de fármaco administrado y de LCR extraído fue de 2,7 ± 2,2 mL (Rango = 1-6,75 mL).
En el 87,5% de los procedimientos el paciente estaba ingresado y el resto de administraciones se realizaron en régimen ambulatorio. El tiempo de observación hospitalaria fue de 13 ± 11 días en los pacientes ingresados y 2,8 ± 0,7 horas en los pacientes ambulatorios.
En el 39,3% de las administraciones (22) se registró algún EA, afectando al 70% de los pacientes incluidos en el estudio. El 95,5% de las administraciones donde se detectó algún EA tuvo lugar en pacientes ingresados. En el 22,7% de las administraciones donde apareció algún EA el paciente estaba recibiendo concomitantemente ICT, en el 86,4% quimioterapia y en el 68,2% algún fármaco potencialmente neurotóxico.
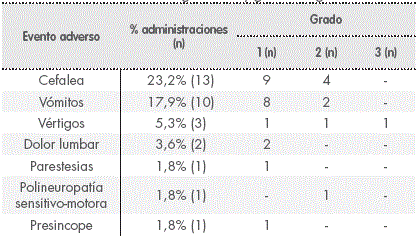
En 8 procedimientos apareció más de un EA (2 EA en 7 procedimientos y 3 EA en 1), siendo el número total de EA registrados de 31 divididos en 7 eventos clínicos (Tabla 2). El 96,7% tuvieron una gravedad leve-moderada, sólo un evento adverso fue de grado 3. Se precisó tratamiento sintomático en el 77,4% de los casos.
La mediana de tiempo de inicio de los eventos desde la administración de la terapia TIT fue de 20 horas (RIQ = 4-48h). La mediana de duración de los EA fue de 48 horas (RIQ = 5-144h).
Aplicando el Algoritmo de Naranjo se obtuvo una relación de causalidad entre la TIT y el EA probable en el 6,5% de los EA, posible en el 77,4% y dudosa en el 16,1%.
Al comparar las variables recogidas durante el estudio entre las administraciones de TIT donde se detectó o no toxicidad, se observaron diferencias estadísticamente significativas en (mediana (Rango Intercuartílico)): edad del paciente (43(31,5-53,7) vs. 52,5(41,2-59,2) años, p = 0,019), intervalo de días entre administraciones (20(4-32) vs. 31 (22-74), p = 0,010), tiempo de observación hospitalaria (360(90-600) vs. 84(3-462) horas, p = 0,042) y en la diferencia entre volumen de LCR extraído y de fármaco administrado (3,2(2,7 -5) vs. 3(0-3,6) ml, p = 0,036). No se observaron diferencias estadísticamente significativas en: aparición de complicaciones durante el procedimiento, régimen de ingreso hospitalario, indicación de la TIT (profilaxis o tratamiento), irradiación SNC previa o concomitante, quimioterapia concomitante, fármacos neurotóxicos concomitantes o número de TIT previas. Los resultados del análisis de regresión logística para las variables que se asociaron con toxicidad se muestran en la Tabla 3.
Discusión
La administración de quimioterapia TIT, en las condiciones protocolizadas descritas, se ha mostrado como un procedimiento relativamente seguro, con un único episodio de toxicidad grado 3; el resto de los eventos adversos registrados fueron de gravedad leve-moderada, siendo todos de aparición aguda o subaguda y autolimitados, requiriendo sólo tratamiento sintomático. Cabe destacar que en el 86,4% de las administraciones donde apareció algún EA el paciente estaba recibiendo concomitantemente quimioterapia o radioterapia y en el 68,2% algún fármaco neurotóxico, lo que complica considerablemente diferenciar si estos EA eran debidos al tratamiento TIT o al tratamiento sistémico de la neoplasia maligna hematológica. Además, la mayoría de los EA registrados podrían ser debidos a las complicaciones asociadas al propio procedimiento de administración, ya que se han descrito como complicaciones de la PL: cefalea post-punción, lumbalgia, irritación de raíces nerviosas, hemorragia subdural, entre otras10. Debido a esta complejidad para el establecimiento de la relación de causalidad entre los EA y la TIT, al utilizar el Algoritmo de Naranjo, se consideró la relación posible en la mayoría de los casos y en ninguno definida.
Existen pocos estudios publicados que describan la toxicidad debida a la quimioterapia TIT en adultos11-16; además, estos estudios presentan una gran variabilidad metodológica, lo que dificulta extremadamente la comparación directa de los resultados del presente estudio con los comunicados por otros autores. Hitchins y col.11 de forma prospectiva y Kim y col.12 retrospectivamente, centran sus estudios en pacientes con carcinomatosis meníngea por tumores sólidos; ninguno de los dos describe la aparición de neurotoxicidad grave. En los estudios de Huguet y col.13, Thomas y col.14 y Storring y col.15 se utiliza quimioterapia TIT como parte del protocolo de tratamiento de LAL en adultos; sólo el estudio de Storring y col. describe la aparición de cefalea y náuseas grado 1-2 como consecuencia de la profilaxis del SNC, aunque sin dar datos de incidencia15.
Pardo y col.16 analizaron retrospectivamente la toxicidad asociada a la administración intratecal de diversos fármacos (TIT, metotrexato, citarabina, trastuzumab y citarabina liposomal) en un total de 627 procedimientos; se registró algún EA en el 9,4% de los mismos. Excluyendo la administración de citarabina liposomal, asociada a mayor toxicidad, solo en el 8% de los 537 procedimientos restantes (80% TIT) se registró algún EA, pero, a diferencia de nuestro estudio, el 40,9% de estos fueron considerados graves. El efecto adverso mayoritario registrado por Pardo, al igual que en nuestro estudio, fue la cefalea, atribuida posiblemente, según el Algoritmo de Naranjo, a la quimioterapia intratecal. Sin embargo, este autor no recoge la emesis como EA con posible relación con la administración IT, lo que puede contribuir a la diferencia en los resultados.
Ninguno de los estudios citados describe las condiciones de realización del procedimiento, el volumen de mezcla IT administrado y si se extrajo un volumen similar, la forma de preparación de la mezcla y las condiciones finales de la misma. Tampoco suelen indicarse el uso de premedicación, la posición durante la punción o el tiempo de reposo post-punción, aspectos que sí se han recogido en este estudio, como información adicional. De ellos solo destacar que el tiempo de reposo fue inferior al recomendado.
La buena tolerancia de los pacientes a la quimioterapia TIT en nuestro estudio parece sugerir que las condiciones de preparación y administración de la mezcla TIT son adecuadas para conseguir un buen perfil de seguridad.
En población pediátrica, con igual metodología, se ha observado una menor frecuencia de aparición de toxicidad (16,7% de los procedimientos), aunque con un perfil similar, siendo la mayoría de los EA detectados grado 1-2 y destacando como más frecuentes la aparición de vómitos, cefalea y dolor lumbar17.
En cuanto a la relación de la toxicidad con las variables a estudio, sólo se observó en el análisis multivariante una relación con la edad del paciente y la diferencia de volumen extraído y administrado.
La edad se comportó como un factor protector de la aparición de toxicidad, siendo 0,95 el riesgo de un paciente de una determinada edad de sufrir un EA comparado con el de un paciente que tiene un año menos. Aunque está descrito el mayor riesgo de toxicidad por quimioterapia sistémica en pacientes de mayor edad, especialmente de neurotoxicidad con dosis altas de citarabina, no existen datos en la literatura que asocien la edad en los pacientes adultos con la aparición o no de toxicidad por quimioterapia IT. La relación observada entre la menor edad y la toxicidad podría no ser debida propiamente o exclusivamente a la edad, sino a que en los pacientes más jóvenes se suelen utilizar regímenes de quimioterapia más intensivos, pudiendo influir la quimioterapia sistémica en la aparición de la toxicidad descrita. Además, el riesgo de emesis es mayor en pacientes jóvenes y este efecto adverso se incluyó en nuestro estudio por su posible asociación al tratamiento IT.
La mayor diferencia de LCR extraído y volumen administrado se comportó como un factor de riesgo de desarrollo de toxicidad. La aparición de cefalea, náuseas, vómitos y obnubilación, por aumento de la presión intracraneal al administrar un volumen de fármaco mayor del LCR que se extrae, está descrito en la literatura4,16. Sin embargo, a pesar de los resultados obtenidos, no es probable que se produjese un aumento de la presión intracraneal por aumento del volumen en un rango de 1 a 6,75 mL, teniendo en cuenta que el volumen de LCR en una persona adulta es de 125 a 150 mL. Luego el mecanismo subyacente para esta toxicidad debe estar influido por otros factores, como la velocidad de administración de ese volumen adicional15.
En cuanto a las limitaciones, destacar que el tiempo de seguimiento de los pacientes, puede haber sido insuficiente para detectar la aparición de algunas reacciones adversas a largo plazo relacionadas con la quimioterapia IT. El 12,5% de administraciones en régimen ambulatorio puede haber ocasionado una pérdida de información, con la consiguiente infraestimación de la frecuencia de aparición de toxicidad, especialmente en síntomas leves. Además, la elevada complejidad de los pacientes de la muestra y la dificultad de diferenciación, en ocasiones, entre la toxicidad debida al fármaco o al propio procedimiento ha complicado el establecimiento de la relación causal de la toxicidad con la quimioterapia IT.
La administración de la quimioterapia triple intratecal en las condiciones protocolizadas ha mostrado un buen perfil de seguridad. Los eventos adversos más frecuentes fueron la aparición de cefalea y vómitos de intensidad leve-moderada. Se identificaron como factores de riesgo para la aparición de toxicidad la menor edad del paciente y la mayor diferencia entre el volumen de LCR extraído y de fármaco administrado.
Aportación a la literatura científica
Según nuestro conocimiento, este estudio es el primer estudio prospectivo focalizado en evaluar la toxicidad de la administración de quimioterapia intratecal en condiciones protocolizadas de uso en pacientes onco-hematológicos adultos. En este estudio se describe la utilización de mezclas estandarizadas de metotrexato, citarabina e hi drocortisona en suero fisiológico, con ajuste de pH y osmolaridad al rango fisiológico del líquido cefalorraquídeo. Esta descripción de la mezcla estandarizada junto con la de las condiciones protocolizadas de administración puede ser de gran utilidad para los diferentes profesionales, ya que aunque la administración de quimioterapia intratecal está ampliamente extendida, existe muy poca información al respecto en la literatura sobre estos aspectos.
Es importante destacar que este estudio evalúa resultados reales en salud, describe el protocolo de uso de quimioterapia intratecal con el que se obtiene un buen perfil de toxicidad. También es importante destacar, el estudio de factores predictores de toxicidad que puede ayudar en la predicción del riesgo de toxicidad según los diferentes grupos de población.
Bibliography
Nagpal S, Recht L. Treatment and prophylaxis of hematologic malignancy in the central nervous system. Curr Treat Options Neurol. 2011;13(4):400-12. [ Links ]
Sancho JM, Morgades M, Arranz R, Fernandez-Abellan P, Deben G, Alonso N, et al. Practice of central nervous system prophylaxis and treatment in acute leukemias in Spain. Prospective registry study. Med Clin. (Barc) 2008;131(11):401-5. [ Links ]
Sancho JM, Morgades M, Alonso N, Deben G, Fernandez de SA, Vazquez L, et al. Prospective study on the practice of central nervous system prophylaxis and treatment in non-Hodgkin’s lymphoma in Spain. Med Clin. (Barc) 2008;131(12):441-6. [ Links ]
Gil LG, Clemente BS, Oliveras AM, Cabanas Poy MJ, Hidalgo AE. Dosage of drugs for cerebrospinal administration. Farm Hosp. 2005;29(3):185-90. [ Links ]
Cradock JC, Kleinman LM, Rahman A. Evaluation of some pharmaceutical aspects of intrathecal methotrexate sodium, cytarabine and hydrocortisone sodium succinate. Am J Hosp Pharm. 1978;35:402-6. [ Links ]
Olmos-Jiménez R, Espuny-Miró A, Díaz-Carrasco MS, Fernández-Varón E, Valderrey-Pulido M, Cárceles-Rodríguez C. Stability of four standardized preparations of methotrexate, cytarabine, and hydrocortisone for intrathecal use. J Oncol Pharm Pract. 2016;22:659-65. [ Links ]
Olmos-Jiménez R, Espuny-Miró A, Cárceles-Rodríguez C, Díaz-Carrasco MS. Practical aspects of the use of intrathecal chemoterapy. Farm Hosp. 2017;41(1):105-29. [ Links ]
Common Terminology Criteria for Adverse Events (CTCAE). Version 4.0. National Cancer Institute 2013 (cited 2016 Sep 11); Available from: URL: http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_8.5x11.pdf [ Links ]
Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981;30:239-45. [ Links ]
Sempere AP, Berenguer-Ruiz L, Lezcano-Rodas M, Mira-Berenguer F, Waez M. Lumbar puncture: its indications, contraindications, complications and technique. Rev Neurol. 2007;45(7):433-6. [ Links ]
Hitchins RN, Bell DR, Woods RL, Levi JA. A prospective randomized trial of singleagent versus combination chemotherapy in meningeal carcinomatosis. J Clin Oncol. 1987;5(10):1655-62. [ Links ]
Kim DY, Lee KW, Yun T, Park SR, Jung JY, Kim DW, et al. Comparison of intrathecal chemotherapy for leptomeningeal carcinomatosis of a solid tumor: methotrexate alone versus methotrexate in combination with cytosine arabinoside and hydrocortisone. Jpn J Clin Oncol. 2003;33(12):608-12. [ Links ]
Huguet F, Leguay T, Raffoux E, Thomas X, Beldjord K, Delabesse E, et al. Pediatricinspired therapy in adults with Philadelphia chromosome-negative acute lymphoblastic leukemia: the GRAALL-2003 study. J Clin Oncol. 2009;27(6):911-8. [ Links ]
Thomas X, Boiron JM, Huguet F, Dombret H, Bradstock K, Vey N, et al. Outcome of treatment in adults with acute lymphoblastic leukemia: analysis of the LALA-94 trial. J Clin Oncol. 2004;22(20):4075-86. [ Links ]
Storring JM, Minden MD, Kao S, Gupta V, Schuh AC, Schimmer AD, et al. Treatment of adults with BCR-ABL negative acute lymphoblastic leukaemia with a modified paediatric regimen. Br J Haematol. 2009;146(1):76-85. [ Links ]
Pardo-Moreno J, Fernández C, Arroyo R, Ruiz-Ocaña C, Concepción A, Cuadrado ML. Safety of intra-cerebrospinal fluid chemotherapy in onco-haematological patientes: a restrospective analysis of 627 interventions. J Neurooncol. 2015;125:351-8. [ Links ]
Olmos-Jiménez R, Díaz-Carrasco MS, Galera-Miñarro A, Pascual-Gazquez JF, Espuny-Miró A. Evaluation of standardized triple intrathecal therapy toxicity in oncohematological pediatric patients. Int J Clin Pharm. (2016). DOI:10.1007/s11096-016-0408-0 [ Links ]
Recibido: 25 de Enero de 2017; Aprobado: 02 de Mayo de 2017











 texto em
texto em