My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.41 n.6 Toledo Nov./Dec. 2017
https://dx.doi.org/10.7399/fh.10834
Originales
Hidrogel oftálmico de cisteamina para el tratamiento de la cistinosis ocular
1Pharmacy Service, Xerencia Xestión Integrada Santiago de Compostela (SERGAS). Spain.
2Clinical Pharmacology Group, Instituto de Investigación Sanitaria, Santiago de Compostela (IDIS-ISCIII). Spain.
3Pharmacology, Pharmacy and Pharmaceutical Technology Department, Faculty of Pharmacy, University of Santiago of Compostela (USC). Spain.
4Ophthalmology Service, Pharmacy Service, Xerencia Santiago de Compostela (SERGAS). Spain.
Introducción
La cistinosis es una enfermedad rara de herencia autosómica recesiva que se clasifica dentro de los desórdenes del almacenamiento o depósito lisosomal1. Es un trastorno metabólico que se caracteriza por la acumulación del aminoácido cistina en los lisosomas debido a un defecto en el transporte de cistina desde el interior del lisosoma hacia el exterior2,3. Dado que la cistina es poco soluble en agua, se produce su cristalización intralisosomal produciendo daño en diferentes tejidos y órganos, entre ellos la córnea. Las manifestaciones oculares de la enfermedad se deben a la acumulación de cristales de cistina en la superficie ocular, siendo estos ya descritos por Burki en los años cuarenta4. Estos cristales pueden ser observados con una lámpara de hendidura y constituyen un signo patognomónico de la cistinosis. Su formación comienza en la infancia y se empiezan a apreciar mediante la lámpara de hendidura a los 16 meses de edad. Inicialmente los pacientes están asintomáticos, pero debido a que se produce una acumulación progresiva de los cristales corneales con el tiempo, aproximadamente a la edad de 10 años se observan evidentes cristales de cistina corneales que ocasionan los síntomas oculares5.
El tratamiento específico de la cistinosis es la cisteamina, también llamada mercaptamina o 2-aminoetanotiol, un aminotiol con fórmula química HSCH2CH2NH26. La cisteamina fue introducida como opción terapéutica para la cistinosis en 1976 y es a día de hoy el único tratamiento disponible7. Aunque la cisteamina no produce la curación de la cistinosis, ha revolucionado el manejo y la prognosis de los pacientes. Se ha visto que retrasa el progreso de la enfermedad y puede reducir la cantidad de cistina intracelular en más del 90%. El tratamiento con cisteamina debe empezarse tan pronto como se realiza el diagnóstico y es una terapia de por vida. Los pacientes con poca adherencia al tratamiento o que lo empiezan tardíamente no obtienen unos resultados tan beneficiosos8.
La cisteamina oral se administra en forma de cisteamina bitartrato, pero esta no alcanza la córnea debido a la falta de vascularización corneal, por lo que es necesaria la aplicación tópica ocular, cuya seguridad y efectividad ya se demostró en los años 809-11. Actualmente, existen dos formulaciones oftálmicas disponibles de cisteamina clorhidrato. Por un lado, el Cystaran ® (Sigma Tau Pharmaceuticals Inc.), medicamento aprobado por la FDA y el que se debe instilar entre 6-12 veces al día12 ; y por otro lado el Cystadrops® (Orphan Europe, Paris, France), el cual tiene mayor viscosidad y prolonga más el tiempo de permanencia ocular13,14. Esta última formulación, a pesar de encontrarse en fase III de ensayo clínico, la EMEA ha permitido recientemente su comercialización para facilitar su acceso como medicamento huérfano15.
El acceso a medicamentos extranjeros y/o huérfanos, puede en ocasiones retardase en el tiempo debido a las tramitaciones y aprobaciones requeridas necesarias para su utilización. Por otro lado, el precio de los mismos, en ocasiones desorbitado, puede dificultar el acceso a los mismos16. Por ello, con el fin de facilitar el tratamiento de la cistinosis ocular, la elaboración de colirios de cisteamina como fórmula magistral es habitual en los Servicios de Farmacia Hospitalaria.
Estas formulaciones presentan principalmente dos problemas, el primero, que la instilación del colirio de cisteamina para conseguir una reducción de los cristales corneales, debe realizarse cada hora mientras que el paciente esté despierto. Para evitar este problema, y así optimizar la formulación y evitar incómodas posologías, nuestro grupo ha desarrollado y caracterizado en trabajos previos, un hidrogel bioadhesivo de cisteamina de alta permanencia ocular, potencialmente formulable en Servicios de Farmacia Hospitalaria17,18. El segundo problema de las formulaciones con cisteamina, es determinar la estabilidad de las misma, debido a que el análisis de compuestos con grupos tiol siempre ha resultado difícil, la elevada susceptibilidad que presentan estos compuestos para oxidarse y a la falta de un cromóforo estructural necesario para su detección19,20. Además, el bajo peso molecular de la cisteamina (PM = 77,15 g/mol) dificulta su detección directa mediante detectores de masas. Por ello, los métodos desarrollados para determinar este tipo de compuestos suelen derivatizar previamente la molécula de cisteamina para poder ser posteriormente cuantificada mediante masas21.
El objetivo del presente trabajo es determinar la estabilidad de un hidrogel bioadhesivo oftálmico de cisteamina bajo diferentes condiciones de conservación.
Métodos
Elaboración del hidrogel oftálmico de cisteamina al 0,55%
La elaboración del hidrogel se realiza en dos etapas. Inicialmente se disuelve una cantidad suficiente de cisteamina (BioXtra, Sigma-Aldrich) en BSS® (Balanced Salt Solution Alcon®) para poder alcanzar una concentración del 0,55%, incorporándola progresivamente durante 5 minutos en agitación magnética. A continuación, se añade la cantidad de ácido hialurónico (Acofarma®) suficiente para lograr una concentración final del 0,4%, manteniendo la agitación magnética.
Para finalizar, el hidrogel se filtra con vacío, empleando un filtro de membrana de 0,22 micras (Stericup® Merck Millipore ExpressTM Plus 0,22 μm) y se envasa en frascos de vidrio topacio clase I de 15 mL de capacidad, en los que se dosifican 10 mL de hidrogel por envase. El volumen restante se rellena con nitrógeno gaseoso, y se cierran los envases. Todo el proceso es realizado en condiciones asépticas y en campana de flujo laminar horizontal.
Condiciones de conservación y variables estudiadas
Se han estudiado las formulaciones con y sin conservante, añadiéndole para ello EDTA al 0,01% a la mitad de los lotes en el momento de la disolución de la cisteamina. Por otra parte, ambas formulaciones han sido almacenadas durante 30 días, bajo dos condiciones de temperatura (22 ºC (ambiente) y 4 ºC (nevera)). Así, las formulaciones estudiadas se denominarán a partir de ahora como HA (Hidrogel a temperatura ambiente sin EDTA), HAE (Hidrogel a temperatura ambiente con EDTA), HN (Hidrogel en nevera sin EDTA), HNE (Hidrogel en nevera con EDTA).
Los parámetros físicos y químicos evaluados, han sido la osmolalidad, el pH y la concentración de cisteamina. Los ensayos descriptivos se han basado en la medición de la transparencia y los ensayos microbiológicos en la realización de pruebas de esterilidad.
Antes de la realización de las diferentes medidas, todas las muestras fueron atemperadas durante un tiempo mínimo de 30 minutos para evitar variaciones en la determinación debidas a la temperatura. Todos los ensayos han sido realizados por triplicado y se han llevado a cabo los días 0, 7, 14, y 30 post-elaboración de los hidrogeles.
Ensayos descriptivos
El método utilizado para medir la transparencia ha consistido en la determinación de la transmitancia de las formulaciones en el intervalo de longitud de onda de la luz visible (380 nm-780 nm) utilizando para ello un espectrofotómetro UV-VIS (Espectrofotómetro de red de diodos Hewlett Packard 8452). Para ello, se realizó un blanco con agua destilada y las diferentes formulaciones se introdujeron en una cubeta de cuarzo para medir la transmitancia, obteniéndose una gráfica que representa el porcentaje de luz transmitida en función de las longitudes de onda.
Ensayos físico-químicos
Determinación de Osmolalidad y pH: La osmolalidad se midió utilizando un osmómetro Vapor Pressure Osmometer (VAPRO 5520). Para ello, 10 μL de cada formulación se depositaron en un disco de papel de filtro Whatman sobre la cámara. La determinación del pH se llevó a cabo con un pHmetro Crison micropH2001®.
Cuantificación de la cantidad de cisteamina: Para la determinación de la cisteamina en las muestras se prepara previamente una disolución saturada del reactivo de Ellman (5,5’-dithiobis-(2-nitrobenzoic acid) o DTNB) como derivatizador22 (Figura 1). Para ello 29,6 mg del polvo fueron disueltos en 10 mL de NaOH acuoso al 0,018 M. Posteriormente, la disolución fue filtrada a través de un filtro de 0,45 μm.
Para la cuantificación de la cisteamina, inicialmente se realiza una dilución 1:1000 de la formulación. De esta muestra diluida se recogen 50 µL y se le adicionan 100 µL de reactivo de Ellman y 100 µL de agua purificada. La disolución resultante se analiza mediante un método de Cromatografía Líquida de Ultra Alta Presión empleando un detector de masas en tándem (UPLC-MS/MS). Para ello se utilizó un sistema Acquity UPLC® H-Class (Waters®) conectado a un detector de masas en tándem Waters® Xevo TQD. Los datos fueron recogidos empleando el software Masslynx v4.1 y procesados a través del software cromatográfico TargetLynxTM Application Manager. La separación cromatográfica se realizó a 40 °C utilizando la columna Acquity BEH C18 (2,1 x 50 mm, 1,7 µm de tamaño de partícula, Waters®). Los solventes de la fase móvil fueron una disolución de ácido fórmico al 0,1% agua MilliQ® (Fase A) y acetonitrilo (Fase B). Se utilizó un gradiente con una velocidad de flujo constante a 0,4 mL/min. El gradiente se inició con 100% de fase A que cambió a una composición 40% A- 60% B a los 2,20 minutos de forma lineal para a continuación mantener la composición hasta los 2,60 minutos y volver a las condiciones iniciales a los 3 minutos. El muestreador automático se ajustó a 10 °C y se inyectaron 10 µL de cada muestra. El tiempo de ejecución total, incluyendo el equilibrado del sistema cromatográfico antes de la inyección de la muestra, fue de 3 minutos. La obtención de los datos de espectrometría de masas se llevó a cabo mediante el modo de monitorización de reacción múltiple (MRM) a través de la ionización de las muestras mediante electrospray positivo. Para la cuantificación, se utilizaron las transiciones del ion precursor de m/z 313 y el fragmento de 196.85 empleando un flujo de gas de desolvatación de 1,100 L/h, gas del cono 80 L/h y voltaje capilar de 3,2 kV. La temperatura de desolvatación y la temperatura de la fuente fueron de 600 °C y 146 °C, respectivamente.
Ensayos microbiológicos
Cada uno de los hidrogeles, se han analizado a los tiempos previamente indicados, con el fin de establecer la estabilidad microbiológica. Para ello, 1 ml de cada uno de los hidrogeles se añaden en placas de agar sangre, agar sabouraud y medio tioglicolato liquido. Estas muestras se cultivan a 37 ºC durante un periodo de 48h, 15 días y 10 días respectivamente. Al finalizar de cada período de incubación se observan y se determina si ha existido crecimiento microbiológico.
Márgenes de variación permitidos y análisis estadístico
Se ha establecido los márgenes fijados según lo indicado en el Pharmaceutical Codex23, estableciéndose la caducidad de la formulación cuando la concentración de principio activo se ha reducido en un 10% con respecto a la concentración inicial. Por otra parte, los cambios en pH y osmolalidad, se consideran no aceptables si sus valores exceden los criterios de aceptación para su administración por vía oftálmica. La estabilidad microbiológica se considera adecuada siempre y cuando no se detecten crecimiento microbiano en las muestras cultivadas. Por último, con respecto a las características descriptivas del producto, no se considerará aceptable, si la transparencia no es plena.
El análisis estadístico utilizado para comparar los resultados de las diferentes condiciones de conservación estudiada ha sido el análisis de la varianza multifactorial, realizado con el GraphPad Prism® v.5.0b.
Resultados
Ensayos descriptivos y fisicoquímicos
La transparencia de todas las formulaciones ha sido total, no observandose disminución de la misma durante todo el periodo estudiado. En la Figura 2, se puede observar como en el rango visible, no se observa ninguna señal, signo de la transparencia de la muestra.
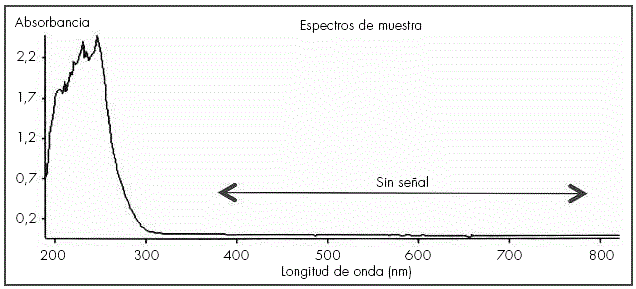
Figura 2 Gráfica obtenida en la determinación de la transparencia de una de las formulaciones. Se observa que en el rango de luz visible (380-780 nm) la absorbancia es despreciable.
En la Figura 3 se representa la variación de la osmolalidad de hidrogel de cisteamina bajo las cuatro condiciones de conservación a lo largo del tiempo. Los valores de osmolalidad en todas las formulaciones se mantienen comprendidos entre el 90% y el 100% de los valores iniciales durante todo el periodo de estudio. No se han observado diferencias estadísticamente significativas entre las formulaciones bajo las diferentes condiciones estudiadas, si bien, debe indicarse el valor ligeramente superior de las que contenían EDTA en su composición (427±8,96 mOsm/Kg vs 410±9,48 mOsm/Kg).
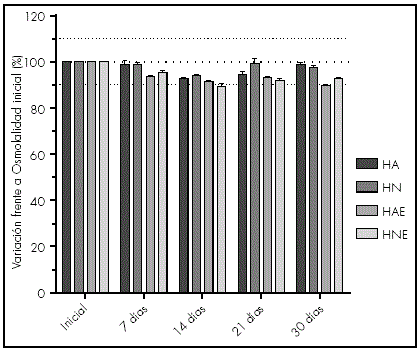
Figura 3 Percentage change in osmolality (mOsm/Kg) (mean and standard deviation) of cysteamine hydrogel over 30 days under the four different storage conditions. HA, room temperature without EDTA; HAE, room temperature with EDTA; HN, refrigerated without EDTA; HNE, refrigerated with EDTA.
Por otro lado, tal y como se puede observar en la Figura 4, ni la adición de EDTA al hidrogel ni las condiciones termicas de almacenamiento, han influido en los valores de pH del hidrogel a lo largo del estudio. Así, no se han observado diferencias estadísticamente significativas entre el pH inicial y final en ninguna de las condiciones ensayadas, pese a existir una ligera disminución del pH en las formulaciones con EDTA (6,29 vs 6,44).

Figura 4 Change in pH (mean and standard deviation) of cysteamine hydrogel over 30 days under the four different storage conditions. HA, room temperature without EDTA; HAE, room temperature with EDTA; HN, refrigerated without EDTA; HNE, refrigerated with EDTA.
Concentración de cisteamina
En las condiciones metodológicas desarrolladas se obtiene un pico cromatográfico estrecho, simétrico y bien definido, con un tiempo de elución de 0,33 minutos. En la Figura 5, se puede observar un ejemplo de cromatograma de la cisteamina derivatizada obtenido mediante la técnica de UPLC MS/MS.
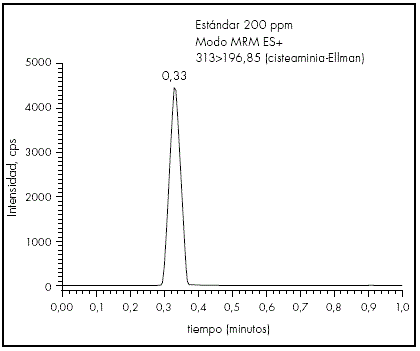
Figura 5 Example of chromatogram obtained for cysteamine derivatized with Ellman´s reagent, using the UPLC MS/MS method.
El método de determinación de UPLC MS/MS desarrollado posee una gran especificidad ya que une la eficacia de la separación cromatográfica y la gran selectividad del detector de masas en tándem, para seleccionar la estructura química que se desea determinar. Con ello conseguimos aislar la señal del producto derivatizado entre la cisteamina y el reactivo de Ellman y separarla de posibles compuestos que se puedan formar durante la degradación de la cisteamina.
En la Figura 6 se puede observar la variación de la concentración de cisteamina a lo largo del tiempo, bajo las cuatro condiciones de conservación. Al representar los valores de concentración de cisteamina a lo largo del tiempo, podemos observar que durante el período estudiado en ningún caso se produce una disminución de la misma por debajo del 90%. Por otra parte, se debe señalar que se ha observado una gran variabilidad entre los valores de concentración obtenidos a los diferentes tiempos durante el almacenamiento, obteniéndose en algunos muestreos, porcentajes superiores al 100% de la concentración inicial. La variabilidad es debida a la dificultad de tomar muestras volumétricas reproducibles de los hidrogeles mediante aspiración, causada por su elevada viscosidad.
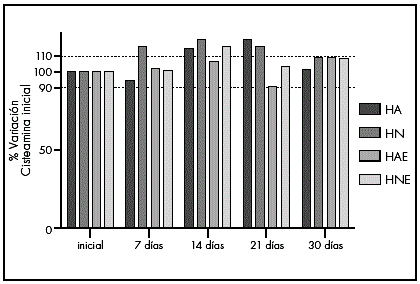
Figura 6 Representación de la variación en porcentaje de la concentración de cisteamina a lo largo del tiempo.
Estabilidad microbiológica
Se ha observado una adecuada conservación de las muestras en todas las condiciones ensayadas, no observándose crecimiento microbiano en ninguno de los hidrogeles durante el tiempo de almacenamiento.
Discusión
Las formulaciones magistrales oftálmicas de hidrocloruro de cisteamina presentan el problema principal que para conseguir una reducción de los cristales corneales deben realizarse instilaciones horarias con posologías de difícil cumplimiento. El hidrogel que nos ocupa, ha mostrado en estudios preclínicos una biopermanencia similar al Cystadrops ®(18. Por otra parte, en estudios de biopermanencia cuantitativa guiada por PET, se ha mostrado que el hidrogel de cisteamina con hialurónico presenta una vida media de 60 minutos; muy superior a los 18 minutos presentados por el colirio de cisteamina habitualmente formulado en los Servicios de Farmacia. Además, la cantidad de cisteamina que llega al estroma tras la administración de este hidrogel, es superior a la mostrada por el colirio en solución, existiendo diferencias estadísticamente significativas entre ambos para los valores de permeación transcorneal. De modo que, con la formulación de este hidrogel se consigue una liberación controlada de la cisteamina a lo largo del tiempo, y se muestra como una alternativa factible para ser formulado desde los Servicios de Farmacia para pacientes con cistinosis ocular17. En el material suplementario, se muestran dos metódicas para su elaboración.
Los estudios de estabilidad tienen gran repercusión en la organización de los Servicios de Farmacia, suponen un importante esfuerzo técnico y económico, y cada vez son más frecuentes para garantizar la calidad de los medicamentos elaborados24. En el presente trabajo, se presenta la estabilidad del hidrogel de ácido hialurónico con cisteamina, observándose que las propiedades del mismo permanecen inalteradas durante todo el periodo estudiado y en todas las condiciones de conservación. Otros autores, han indicado que la cisteamina se oxida a su dímero cistamina a temperatura ambiente, la cual no es efectiva en la eliminación de los cristales corneales de cistina25, por ello en la elaboración del hidrogel hemos empleado nitrógeno para eliminar el oxígeno presente en el ambiente, antes del cierre del envase.
La elección el ácido etilendiaminotetraacético, EDTA (Ethylene Diamine Tetraacetic Acid) como conservante, se ha basado en publicaciones previas, donde otros autores han probado que es el más idóneo para ser usado en las formulaciones con cisteamina. La concentración elegida para su adición al colirio fue la menor posible para minimizar el componente tóxico que pudiese tener a nivel de epitelio corneal20,26-28. La adición de otros conservantes como cloruro de benzalconio, se ha descartado, tras una valoración beneficio-riesgo desfavorable por parte de los oftalmólogos. Se tuvo en cuenta su potencial toxicidad epitelial, de mayor riesgo en uso crónico, como sería el caso del hidrogel analizado29.
Según la farmacopea de los Estados Unidos (USP), la estabilidad de una formulación magistral se define como la extensión o el tiempo durante el cual un producto mantiene dentro de unos límites específicos y a través del periodo de almacenamiento y uso las mismas propiedades y características que poseía en el momento de su fabricación30. Por tanto, el objetivo de los estudios de estabilidad es obtener una información que permita hacer propuestas sobre la caducidad del medicamento y recomendar las condiciones de almacenamiento, determinando como varía la calidad de un medicamento dependiendo del tiempo y bajo la influencia de una serie de factores establecidos. El pH y la osmolalidad de los hidrogeles a lo largo del estudio, permanece practicamente inalterada, sin apreciarse diferencias estadísticamente significativas (α<0,001) entre los valores iniciales y finales en todas las condiciones de conservacion estudiadas. La adición de EDTA a la formulación incrementa ligeramente la osmolalidad y disminuye el pH, sin afectar a la estabilidad de la cisteamina. La transparencia es del 100% en todas la medidas realizadas. Por tanto puede concluirse que el hidrogel de hialurónico con cisteamina mantiene sus propiedades durante 30 días tras su elaboración. Por otro lado, debido a que la adición de EDTA no ha supuesto mejoras en términos de estabilidad, y como la adición de cloruro de benzalconio como preservante no se ha contemplado, se recomienda la conservación del hidrogel en nevera por razones microbiológicas y como método alternativo si no se produce el sellado de los viales con nitrógeno previo al cierre31.
Las propiedades previamente descritas, junto con el actual estudio de estabilidad, hace que el uso del hidrogel de cisteamina pueda proporcionar importantes mejoras terapéuticas en pacientes con cistinosis ocular. Por otro lado, su formulación, puede representar una herramienta de eficiencia frente a otras alternativas no comercializadas en España, pero disponibles para su importación (37.728 euros/año/paciente vs 1.080 euros/año/paciente, coste estimado de la formulación del hidrogel de cisteamina).
Tras la realización de un sondeo mediante a través de la lista de correo de la Sociedad Española de Farmacia Hospitalaria (SEFH), estimamos que en España hay actualmente 39 pacientes a tratamiento con cisteamina tópica ocular, por lo que el uso del medicamento adquirido a través de Medicamentos Extranjeros, podría suponer un coste de 1.471.392 euros/ año. La utilización del hidrogel de cisteamina supone un mejor acceso de los pacientes al tratamiento y un ahorro importante al Sistema Nacional de Salud.
Aportación a la literatura científica
La elaboración de colirios de cisteamina como fórmula magistral es habitual en los Servicios de Farmacia Hospitalaria. Estas formulaciones presentan principalmente dos problemas, el primero, la baja permanencia de estas formulaciones a nivel ocular, y el segundo la falta de estudios sobre su estabilidad. Con el presente trabajo se presenta el primer estudio de estabilidad de un hidrogel de cisteamina de alta permanencia ocular, potencialmente formulable desde los Servicios de Farmacia Hospitalaria, pudiendo suponer por tanto un gran avance en el tratamiento de la cistinosis ocular.
Bibliography
Gahl WA, Thoene JG, Schneider JA. Cystinosis. N Engl J Med. 2002;347(2):111-21. doi:10.1056/NEJMra020552 [ Links ]
Linkage of the gene for cystinosis to markers on the short arm of chromosome 17. The Cystinosis Collaborative Research Group. Nat Genet. 1995;10(2):246-8. doi:10.1038/ng0695-246 [ Links ]
Town M, Jean G, Cherqui S, Attard M, Forestier L, Whitmore SA, et al. A novel gene encoding an integral membrane protein is mutated in nephropathic cystinosis. Nat Genet. 1998;18(4):319-24. doi:10.1038/ng0498-319 [ Links ]
Burki E. Ueber die Cystinkrankheit im Kleinkindesalter unter besonderer Berücksichtigung des Augenbefundes (About the Cystinosis in infancy with special reference to eye findings). Ophthalmologica. 1941;101:331-42. [ Links ]
Gahl WA, Kuehl EM, Iwata F, Lindblad A, Kaiser-Kupfer MI. Corneal crystals in nephropathic cystinosis: natural history and treatment with cysteamine eyedrops. Mol Genet Metab. 2000;71(1-2):100-20. doi:10.1006/mgme.2000.3062 [ Links ]
Pubchem. Cysteamine (C2H7NS). (Accessed June 22, 2017) Disponible en: https://pubchem.ncbi.nlm.nih.gov/compound/2-Aminoethanethiol [ Links ]
Thoene JG, Oshima RG, Crawhall JC, Olson DL, Schneider JA. Cystinosis. Intracellular cystine depletion by aminothiols in vitro and in vivo. J Clin Invest. 1976;58(1):180-9. doi:10.1172/JCI108448 [ Links ]
Brodin-Sartorius A, Tête M-J, Niaudet P, Antignac C, Guest G, Ottolenghi C, et al. Cysteamine therapy delays the progression of nephropathic cystinosis in late adolescents and adults. Kidney Int. 2012;81(2):179-89. doi:10.1038/ki.2011.277 [ Links ]
Kaiser-Kupfer MI, Caruso RC, Minkler DS, Gahl WA. Long-term ocular manifestations in nephropathic cystinosis. Arch Ophthalmol.1986;104(5):706-11. doi:10.1001/archopht.1986.01050170096030 [ Links ]
Cysteamine Eye Drops to Treat Corneal Crystals in Cystinosis. Clinical Trial. Clinicaltrials. gov (A service of the U.S. National Institutes of Health). (Accessed May 6, 2016) Disponible en: https://clinicaltrials.gov [ Links ]
Kaiser-Kupfer MI, Gazzo MA, Datiles MB, Caruso RC, Kuehl EM, Gahl WA. A randomized placebo-controlled trial of cysteamine eye drops in nephropathic cystinosis. Arch Ophthalmol. 1990;108(5):689-93. doi:10.1001/archopht.1990.01070070075038 [ Links ]
Cystaran®. Prescribing information. (Accessed May 3, 2016) Disponible en: www.sigmatau.com [ Links ]
Cystadrops® 0,55% eye drops solution. Summary of product characteristics. November 2015. (Accessed September 24, 2017) Disponible en: https://www.medicines.org.uk/emc/medicine/34065 [ Links ]
Cystadrops® 0,55% collyre en solutions. Protocole d’utilisation therapeutique et de recueil d’informations. Autorisation temporaire d’utilisation dite de cohorte. (Accessed June 2016) Disponible en: http://ansm.sante.fr/var/ansm_site/storage/original/application/f0f8036949f10b1ce8dd7a7a0ab48927.pdf [ Links ]
Cysteamine Hydrochloride for nephropathic Cystinosis, open-label Phase III pivotal study (CYSTADROPS CHOC study). Clinical Trials Register. (Accessed June 18, 2016) Disponible en: www.clinicaltrialsregister.eu [ Links ]
Velásquez G. El acceso global a los medicamentos en el contexto internacional actual. Biomédica. 2011;31(2):162-3. [ Links ]
Luaces-Rodríguez A, Díaz-Tomé V, González-Barcia M, Silva-Rodríguez J, Herranz M, Gil-Martínez M, et al. Cysteamine polysaccharide hydrogels: study of extended ocular delivery and biopermanence time by PET imaging. Int J Pharm. 2017;528(1-2):714-22. doi:10.1016/j.ijpharm.2017.06.060 [ Links ]
Fernández Ferreiro A, Luaces-Rodriguez A, González Barcia M, Otero Espinar FJ, Lamas MJ. Evaluación de la biopermanencia ocular in vivo de tres formulaciones oftálmicas de cisteamina clorhidrato. Farm Hosp. 2016;Supl1:79. [ Links ]
Guan X, Hoffman B, Dwivedi C, Matthees DP. A simultaneous liquid chromatography/mass spectrometric assay of glutathione, cysteine, homocysteine and their disulfides in biological samples. J Pharm Biomed Anal. 2003;31(2):251-61. [ Links ]
Lawal B. Development of a cysteamine in situ gelling system for the treatment of corneal crystals in cystinosis. (Published July 2008. Accessed February 3,2016). Disponible en: https://cystinosis.org/images/research/updates/CRN_Research_UpdateB.pdf [ Links ]
Qi B-L, Liu P, Wang Q-Y, Cai W-J, Yuan B-F, Feng Y-Q. Derivatization for liquid chromatography-mass spectrometry. TrAC Trends Anal Chem. 2014;59:121-32. doi:10.1016/j.trac.2014.03.013 [ Links ]
Ellman GL. Tissue sulfhydryl groups. Arch Biochem Biophys. 1959;82(1):70-7. [ Links ]
Royal Pharmaceutical Society of Great Britain Dept of Pharmaceutical. The Pharmaceutical Codex: Principles and Practice of Pharmaceutics. Twelfth Edition. London: Pharmaceutical Press; 1994. [ Links ]
Barrueco N, Escobar Rodríguez I, García Díaz B, Gil Alegre ME, López Lunar E, Ventura Valares MG. Estabilidad de medicamentos en la práctica clínica: de la seguridad a la eficiencia. Farm Hosp. 2013;37(3):175-7. doi:10.7399/FH.2013.37.3.587 [ Links ]
Iwata F, Kuehl EM, Reed GF, McCain LM, Gahl WA, Kaiser-Kupfer MI. A randomized clinical trial of topical cysteamine disulfide (cystamine) versus free thiol (cysteamine) in the treatment of corneal cystine crystals in cystinosis. Mol Genet Metab. 1998;64(4):237-42. doi:10.1006/mgme.1998.2725 [ Links ]
Herreros JMA. Preparación de medicamentos y formulación magistral para oftalmología. Ediciones Díaz de Santos; 2003. [ Links ]
Fernández MA, Atienza JM, del Vayo CÁ. Formulación en farmacia pediátrica. Madrid. A. Madrid Vicente editores; 2011. [ Links ]
Asociación de Formulistas de Andalucia. (Accessed May 28, 2016) Disponible en: http://www.formulistasdeandalucia.es/noticia.php?id=264 [ Links ]
Rosin LM, Bell NP. Preservative toxicity in glaucoma medication: clinical evaluation of benzalkonium chloride-free 0.5% timolol eye drops. Clin Ophthalmol Auckl NZ. 2013;7:2131-5. doi:10.2147/OPTH.S41358 [ Links ]
Convention USP. Farmacopea de los Estados Unidos de América, USP 37, 2014: Formulario nacional, NF 32. United States Pharmacopeia; 2013. [ Links ]
Practical Pharmaceutics. An International Guideline for the Preparation, Care and Use of Medicinal Products. Yvonne Bouwman-Boer, V’lain Fenton-May, Paul Le Brun, editors. Springer 2015. (Accessed June 22, 2017). Disponible en: http://www.springer.com/gp/book/9783319158136> [ Links ]
Recibido: 23 de Junio de 2017; Aprobado: 08 de Agosto de 2017











 text in
text in 



