Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.42 no.3 Toledo may./jun. 2018
https://dx.doi.org/10.7399/fh.10954
Articles
Determinación de fitoesteroles en emulsiones lipídicas para nutrición parenteral
1Servicio de Farmacia, Hospital Universitari de Bellvitge, L’Hospitalet de Llobregat. Spain.
2Grupo de Farmacoterapia, Farmacogenética y Tecnología Farmacéutica, Instituto de Investigación Biomédica de Bellvitge (IDIBELL), L’Hospitalet de Llobregat. Spain.
3Departamento de Farmacia y Tecnología Farmacéutica, y Fisicoquímica, Facultad de Farmacia y Ciencias de la Alimentación, Universidad de Barcelona, Barcelona. Spain.
Introducción
Actualmente, el uso de emulsiones lipídicas (EL) es una práctica habitual y rutinaria en nutrición parenteral (NP). La incorporación de lípidos en NP implicó un claro avance ya que su elevada eficiencia energética permitió reducir las altas cargas de glucosa utilizadas inicialmente y los problemas asociados que ello comportaba1.
En España, las EL empezaron a utilizarse de manera rutinaria en NP a partir de los años ochenta y desde entonces han existido múltiples presentaciones, inicialmente todas con patrón de soja. Actualmente en el mercado existen cinco patrones de EL obtenidos a partir de soja, oliva, triglicéridos de cadena media (TCM) y aceite de pescado en diferentes concentraciones y combinaciones.
Si bien las EL se utilizaron inicialmente como sustrato energético, con la aparición de nuevos patrones se ha postulado su uso como farmaco-nutriente, principalmente por el efecto antiinflamatorio del aceite de pescado2,3 y por un menor efecto de lipoperoxidación del aceite de oliva4.
La aparición de alteraciones hepáticas asociadas a la administración de NP es una de las complicaciones más relevantes en este tipo de terapia. Esta tiene un componente multifactorial5,6,7 y entre los diferentes factores asociados está claramente establecida la cantidad y/o el tipo de lípidos8,9 por lo que en la práctica clínica es relativamente habitual la reducción de la dosis de lípidos o incluso su eliminación temporal10,11. Desde hace años, se han relacionado también estas complicaciones con las EL de origen vegetal, hipótesis que ha sido atribuida a la presencia de fitoesteroles a partir de los estudios de Clayton en población pediátrica12 y que nuestro grupo confirmó posteriormente en pacientes adultos13. El contenido de fitoesteroles presentes en las EL no está declarado, por lo que su presencia no se incluye en ficha técnica y, por tanto, tampoco en el etiquetado. Dado que todas las emulsiones comercializadas actualmente en España contienen en mayor o menor grado lípidos de origen vegetal, todas contienen fitoesteroles y su utilización implica una administración errática de su contenido.
Los fitoesteroles son sustancias de origen vegetal, consideradas como equivalentes de colesterol, debido a una estructura esterol similar y con funciones análogas en la regulación de la membrana celular. Recientemente, su importancia clínica se ha incrementado debido a sus efectos beneficiosos en la reducción del colesterol, cuando se administra per vía oral14,15,16. En el ámbito de la NP, por su potencial efecto hepatotóxico, su determinación en las EL ayudaría a establecer un mejor abordaje de las complicaciones hepáticas y su prevención.
Para la determinación cualitativa y cuantitativa de fitoesteroles existen diversos métodos analíticos de cromatografía de gases (GC) y de cromatografía líquida de alta resolución (HPLC), especialmente para análisis de alimentos y extractos de plantas. La determinación simultánea se describe con GC, mientras que los métodos de HPLC disponibles permiten identificar únicamente unos pocos fitoesteroles y requieren condiciones especiales17.
En este contexto, una vez desarrollado un método analítico simple por HPLC para la determinación de fitoesteroles para uso de rutina en análisis de EL parenterales, nuestro objetivo en este estudio ha sido determinar si la presencia de fitoesteroles en las EL registradas en el mercado farmacéutico español varía en función del patrón, marca y lote.
Métodos
En el estudio prospectivo para determinar las dosis de exposición diaria a fitoesteroles de los pacientes tratados con NP se analizaron las EL intravenosas disponibles en el mercado español con distinta composición (Tabla 1).
Tabla 1. Emulsiones lipídicas intravenosas con la composición declarada por el fabricante
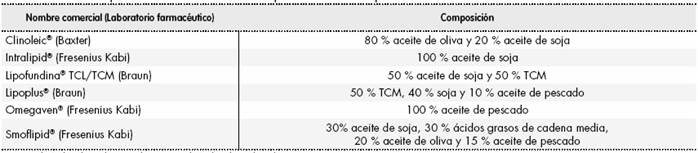
TCM: triglicéridos de cadena media; TCL: triglicéridos de cadena larga.
Para una mejor aproximación a la práctica clínica en nuestro ámbito establecemos distintos escenarios en función del tipo de EL y el lote utilizado. Para ello se estudiaron tres-cuatro lotes de cada uno de los cinco preparados comerciales con patrón vegetal existentes en el mercado farmacéutico español. Los lotes correspondieron a partidas no consecutivas.
Se incluyó en el estudio la EL con patrón exclusivo de aceite de pescado, Omegaven®, que por no estar registrado en el mercado farmacéutico español, procedimos a su importación.
Para la cuantificación de los fitoesteroles se desarrolló un método analítico de HPLC, adecuado para el uso rutinario a partir del establecimiento de un protocolo para la preparación de la muestra de tal manera que nos permitió separar fitoesteroles de la matriz de una manera simple y eficaz pensado para que en corto tiempo se obtuvieran muestras de fitoesteroles con alto porcentaje de extracción y buena repetibilidad. La cromatografía líquida se llevó a cabo en cromatógrafo Dionex Ultimate 300018.
Las diferencias entre las concentraciones de fitoesteroles para cada uno de los cinco preparados de EL registradas en el mercado español y las diferencias entre los diferentes lotes de cada EL se estudiaron mediante análisis de varianza de una sola vía (ANOVA) utilizando la prueba de comparación múltiple post hoc de Scheffe. Se complementó con la aproximación no paramétrica de Kruskal-Wallis.
Los datos se analizaron con el programa IBM SPSS 22.0; se definió la significación estadística para una p < 0,05 con contraste bilateral.
Resultados
El método analítico propuesto nos permitió una preparación de muestra simplificada y un único análisis, que separa con éxito ocho fitoesteroles, colesterol y escualeno. La validación demostró que el método es adecuado para el análisis de rutina.
En el estudio entre distintas marcas comerciales de EL (Tabla 2), la marca Omegaven®, EL con patrón exclusivo de aceite de pescado, no contenía fitoesteroles, lo que concuerda con los resultados previamente publicados3,5 y se excluyó del estudio estadístico. De todas las marcas utilizadas, Intralipid ®, EL de 100 % de aceite de soja, es la que contenía la concentración más alta de fitoesteroles (422,4 ± 130,5 µg/mL) y confirmó que el alto contenido de fitoesteroles proviene de aceite de soja. El resto de marcas de EL presentaron un contenido variable de 120 y 210 µg/mL, dependiendo del porcentaje del aceite de soja y con diferencias estadísticamente significativas entre ellas (F = 42,97; p = 0,00). El contenido de fitoesteroles tendía a correlacionarse con un mayor contenido de lípidos vegetales, especialmente con patrón soja.
Tabla 2. Diferencias entre marcas comerciales en el contenido total de fitoesteroles

F = 42,976 y sig 0,000. Diferencia estadísticamente significativa con análisis de la varianza ANOVA de un factor y la aproximación no paramétrica de Kruskal-Wallis (se excluye Omegaven® en análisis estadístico). *Análisis post hoc Scheffé. 1, Clinoleic®; 2, Intralipid®; 3, Lipofundina® TCL/TCM; 4, Lipoplus®; 5, Smoflipid®.
En la segunda parte del estudio que abordaba el contenido de fitoesteroles en distintos lotes no consecutivos de las EL comercializadas (Tabla 3) se constataron diferencias estadísticamente significativas también entre distintos lotes. Clinoleic® (F = 23,59; p = 0,000); Intralipid (F = 978,25; p = 0,000); Lipofundina® TCL/TCM (F = 5,43; p < 0,045); Lipoplus® (F = 123,53; p = 0,000); y Smoflipid® (16,78; p = 0,000). Excepto en el caso de la Lipofundina® TCL/TCM, las diferencias entre lotes fueron marcadas.
Tabla 3. Diferencias entre lotes en el contenido total de fitoesteroles
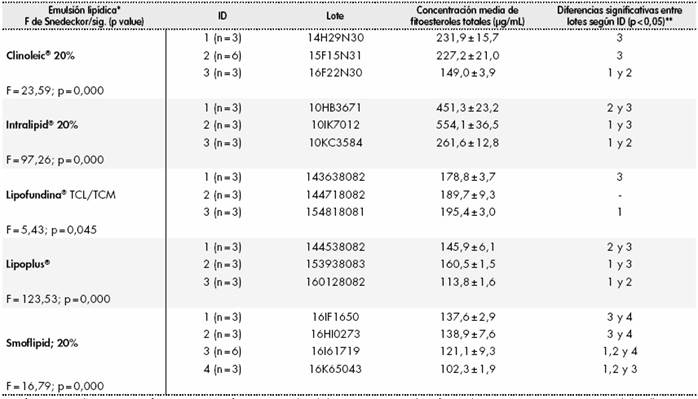
* Diferencias estadísticamente significativas con p significativa con análisis de la varianza ANOVA de un factor y la aproximación no paramétrica Kruskal-Wallis.
** Análisis pos thoc Scheffé. 1, Clinoleic®; 2, Intralipid®; 3, Lipofundina® TCL/TCM; 4, Lipoplus®; 5, Smoflipid.
Discusión
Se ha desarrollado un método de HPLC para simplificar y economizar la determinación de los fitoesteroles en EL18. En la validación del método desarrollado se ha demostrado selectividad, linealidad, precisión, exactitud y robustez lo que permite su uso en rutina18. El procedimiento de tratamiento de la muestra de diferentes EL comercialmente disponibles es una versión adaptada de las ya publicadas19 considerando la propiedades de la muestra y los requisitos del método analítico. El conocimiento, con este método, del contenido de fitoesteroles de todas las EL registradas en el mercado farmacéutico español nos facilita relacionar el impacto de su contenido en la variada práctica clínica de nuestro entorno.
En un reciente estudio observacional de utilización de EL en 22 hospitales catalanes se explicitó la diferencias en el número de presentaciones utilizadas y las diferencias de criterio en su utilización. Estos criterios estaban fijados básicamente en función de políticas de gestión económica y en algunos casos en función del nivel de estrés de los pacientes candidatos20.
Nuestro estudio, aparte de los criterios fijados, introduce un nuevo criterio en la elección de EL en función de su contenido de fitoesteroles con el fin de prevenir o corregir las alteraciones de los parámetros de función hepática, que frecuentemente presentan los pacientes con NP.
Existen pocos trabajos en los que se estudian series diferentes de EL para evaluar su impacto sobre la función hepática y el contenido de fitoesteroles. En el estudio experimental de Meisel et al.21 con cinco EL se demostró alteración de la función hepática en función del patrón lipídico administrado. El aceite de pescado previno la esteatosis hepática en el modelo murino. En el estudio de Forchielli en 201022 se constataron diferencias estadísticamente significativas en el contenido de fitoesteroles entre diferentes preparados comerciales. En el ámbito clínico, Savini et al.23 relacionaron el contenido de fitoestoles administrados a recién nacidos prematuros no complicados que recibieron NP de rutina y las concentraciones plasmáticas de fitosteroles. En estos dos últimos estudios con diferentes tipos de EL el contenido de fitoesteroles variaba entre 50 y 400 µg/mL, rango que se confirma también en nuestra serie.
En Estados Unidos, con la intención de poder conocer el contenido de fistoesteroles de la EL con fines clínicos, la Sociedad Americana de Nutrición Parenteral y Enteral (ASPEN) editó en 2014 un documento de posicionamiento actualizado24 que recopilaba diferentes estudios25,26,27 que informaban sobre la concentración de fitoesteroles en EL. La ASPEN consultó con los fabricantes involucrados para validar la exactitud de la información del documento.
La determinación de fitoesteroles en las EL permitiría cuantificar la cantidad administrada y, por tanto, controlar uno de los factores relevantes descritos que inciden en la aparición de alteraciones hepáticas asociada a NP. La administración de EL con bajo contenido de fitoesteroles o bien la administración de emulsiones no vegetales, como las de aceite de pescado, podrían ser una alternativa. Los buenos resultados obtenidos con la sustitución de las EL vegetales por EL de aceite de pescado28,29 sugieren que la supresión de fitoesteroles podría estar relacionada con la mejoría de parámetros de la función hepática, aunque son necesarios estudios aleatorizados para determinar si la ausencia de fitoesteroles se ve también favorecida por otras propiedades o componentes de las EL de aceite de pescado.
En nuestro estudio por primera vez se determina la presencia de fitoesteroles en todas las emulsiones registradas en el mercado farmacéutico español y, a diferencia de los trabajos citados, corrobora la hipótesis planteada de gran variabilidad tanto en función de la marca como del lote con las consiguientes implicaciones clínicas. Los resultados obtenidos resaltan la importancia de incluir la concentración de fitoesteroles totales en la ficha técnica de cada preparado liberado al mercado con la finalidad de una mejor y segura utilización en la práctica clínica.
Bibliography
Wretlind A. Development of fat emulsions. J Parenter Enteral Nutr. 1981;5(3):230-5. [ Links ]
Manzanares W, Dhaliwal R, Jurewitsch B, Stapleton RD, Jeejeebhoy KN, Heyland DK. Alternative lipid emulsions in the critically ill: a systematic review of the evidence. Intensive Care Med. 2013;39(10):1683-94. [ Links ]
Han YY, Lai SL, Ko WJ, Chou CH, Lai HS. Effects of fish oil on inflammatory modulation in surgical intensive care unit patients. Nutr Clin Pract. 2012;27(1):91-8. [ Links ]
Manzanares W, Langlois PL. Fish oil containing lipid emulsions in critically ill patients: Critical analysis and future perspectives. Med Intensiva. 2016;40(1):39-45. [ Links ]
Piper SN, Schade Beschmann RB, Maleck WH, Boldt J, Röhm KD. Hepatocellular integrity after parenteral nutrition: comparison of a fish-oil-containing lipid emulsion with an olive-soybean oil-based lipid emulsion. Eur J Anaesthesiol. 2009;26:1076-82. [ Links ]
Tillman EM. Review and clinical update on parenteral nutrition-associated liver disease. Nutr Clin Pract. 2013;28:30-9. [ Links ]
Carter BA, Shulman RJ. Mechanisms of disease: update on the molecular etiology and fundamentals of parenteral nutrition associated cholestasis. Nat Clin Pract Gastroenterol Hepatol. 2007;4:277-87. [ Links ]
Moreno JM. Complicaciones hepáticas asociadas al uso de nutrición parenteral. Nutr Hosp. 2008;23(Supl. 2):25- 33. [ Links ]
Lloyd DA, Gabe SM. Managing liver dysfunction in parenteral nutrition. Proc Nutr Soc. 2007;66(4):530-8. [ Links ]
Btaiche IF, Khalidi N. Metabolic complications of parenteral nutrition in adults, part 2. Am J Health Syst Pharm. 2004;61(19):2050-7. [ Links ]
Vafa H, Ballarin A, Arvanitakis M, Verrecken S, Dutat F, Lagasse C, et al. Lessons from a 20 year experience of Home Parenteral Nutrition in adult patient. Acta Gastroenterol Belg. 2010;73(4):451-6. [ Links ]
Clayton PT, Bowron A, Mills KA, Massoud A, Casteels M, Milla PJ. Phytosterolemia in children with parenteral nutrition-associated cholestatic liver disease. Gastroenterology. 1993;105:1806-13. [ Links ]
Llop J, Virgili M, Moreno JM, García-Peris P, Serrano T, Forga M, et al. Phytosterolemia in parenteral nutrition patients: Implications for liver disease development. Nutrition. 2008;24(11-12):1145-52. [ Links ]
Fernandes OP, Cabral JM. Phytosterols: Applications and recovery methods. Bioresour. Technol. 2007;98(12):2335-50. [ Links ]
Jones PJ, MacDougall DE, Ntanios C, Vanstone CA. Dietary phytosterols as cholesterol-lowering agents in humans. Can. J. Physiol. Pharmacol. 1997;75(3): 217-27. [ Links ]
de Jong A, Plat J, Mensink RP. Metabolic effects of plant sterols and stanols (Review). J. Nutr. Biochem. 2003;14(7):362-9. [ Links ]
Lagarda MJ, García-Llatas G, Farré R. Analysis of phytosterols in foods. J Pharm Biomed Anal. 2006;41(5):1486- 96. [ Links ]
Novak A, Gutiérrez M, Doménech L, Suñé JM, Miñarro M, García E, et al. Development and validation of a simple high-performance liquid chromatography analytical method for simultaneous determination of phytosterols, cholesterol and squalene in parenteral lipid emulsions. Biomed Chromatogr. (pendiente de publicación, aceptado agosto 2017). [ Links ]
Xu Z, Harvey KA, Pavlina T, Dutot G, Hise M, Zaloga GP, et al. Steroidal compounds in commercial parenteral lipid emulsions. Nutrients. 2012;4(8):904-21. [ Links ]
Llop JM, Leiva E, Novak A, Sanmartí N, Jódar R, Suñé JM, et al. Selección de emulsiones lipídicas en nutrición parenteral: parámetros bioquímicos y metabólicos. Nutr Hosp. 2017;34:767-75. [ Links ]
Meisel JA, Le HD, De Meijer VE, Nose V, Gura KM, Mulkern RV, et al. Comparison of 5 intravenous lipid emulsions and their effects on hepatic steatosis in a murine model. J Pediat Surg. 2011;46(4): 666-73. [ Links ]
Forchielli ML, Bersani G, Tala S, Grossi G, Puggioli C, Masi M. The spectrum of plant and animal sterols in different oil-derived intravenous emulsions. Lipids. 2010;45(1): 63-71. [ Links ]
Savini S, D’Ascenzo R, Biagetti C, Serpentini G, Pompilio A, Bartoli A, et al. The effect of 5 intravenous lipid emulsions on plasma phytosterols in preterm infants receiving parenteral nutrition: A randomized clinical trial. Am J Clin Nutr. 2013;98(2):312-8. [ Links ]
Vanek VW, Seidner DL, Allen P, Bistrian B, Collier S, Gura K, et al. Update to ASPEN Position Paper: Clinical Role for Alternative Intravenous Fat Emulsions. Nutr Clin Pract. 2014;29(6):841. [ Links ]
Vanek VW, Seidner DL, Allen P. ASPEN position paper: clinical role for alternative intravenous fat emulsions. Nutr Clin Pract. 2012;27:150-92. [ Links ]
Xu Z, Harvey KA, Pavlina T. Steroidal compounds in commercial parenteral lipid emulsions Nutrients. 2012;4:904- 21. [ Links ]
Harvey K, Xu Z, Walker C. Parenteral lipid emulsions in Guinea pigs differentially influence plasma and tissue levels of fatty acids, squalene, cholesterol, and phytosterols. Lipids. 2014;49:777-93. [ Links ]
Fallon EM, Le HD, Puder M. Prevention of parenteral nutrition-associated liver disease: role of omega-3 fish oil. Curr Opin Organ Transplant. 2010;15:334-40. [ Links ]
Llop JM, Badía MB, Leiva E, Ramón JM. Parenteral fish oil and liver function test in hospitalized adult patientes receiving parenteral nutrition: A propensity scorematched analysis. Clinical Nutrition. 2017;36(4):1082-8. [ Links ]
Recibido: 11 de Diciembre de 2017; Aprobado: 01 de Febrero de 2018











 texto en
texto en 


