My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.43 n.3 Toledo May./Jun. 2019 Epub Oct 14, 2019
https://dx.doi.org/10.7399/fh.11167
ORIGINALES
Efectividad y análisis farmacoeconómico del tratamiento del asma grave con omalizumab en la práctica clínica
1Servicio de Neumología, Hospital Universitario Doctor Peset, Valencia. España.
2Servicio de Neumología, Hospital San Joan, Alicante. España.
3Servicio de Neumología, Hospital General de Alicante, Alicante. España.
4Servicio de Neumología, Hospital Arnau de Vilanova, Valencia. España.
5Servicio de Neumología. Hospital de La Ribera, Valencia. España.
Objetivo
Evaluar el gasto sociosanitario tras la incorporación de omalizumab al tratamiento estándar en el control del asma grave, así como analizar su efectividad, en condiciones de práctica clínica.
Método
Estudio observacional, retrospectivo y multicéntrico realizado en 12 servicios de neumología de la Comunidad Valenciana. Se analizaron datos de 186 pacientes. Se compararon resultados del año previo y los cinco años posteriores a la incorporación de omalizumab. La efectividad se calculó a partir del incremento de tres puntos en el Asthma Control Test y la reducción del número de exacerbaciones anuales. La utilidad se calculó mediante el número de años de vida ajustados por calidad. En la evaluación económica se incluyeron costes directos e indirectos. Los resultados se expresaron en términos de relación coste-efectividad incremental y relación coste-utilidad incremental.
Resultados
Se detectaron mejoras significativas en la función pulmonar, el control del asma, la calidad de vida y el número de años de vida ajustados por calidad, entre el año anterior y el posterior al inicio de omalizumab. Teniendo en cuenta los costes directos e indirectos, la relación coste-efectividad incremental por exacerbación evitada fue de 1.789,28 € (intervalo de confianza 95%: 1.019,13-3.038,12) y de 4.569,38 € (intervalo de confianza 95%: 3.442,86-6.075,05) por incremento de tres puntos en el Asthma Control Test. La relación coste-utilidad incremental por número de años de vida ajustados por calidad ganada fue de 50.239,98 € (intervalo de confianza 95%: 37.209,88-68.923,84).
Conclusiones
La introducción de omalizumab en el tratamiento del asma grave es efectiva en condiciones de práctica clínica. Disminuye los costes directos e indirectos y proporciona mejoras significativas en el estado de salud de los pacientes.
PALABRAS CLAVE: Análisis coste-beneficio; Asma; Calidad de vida; Costes en salud; Omalizumab
Introducción
Los pacientes con asma grave persistente constituyen sólo un 5-10% de la población de asmáticos. Sin embargo, la mayor morbilidad global y afectación de la calidad de vida y los mayores costes provienen de estos pacientes1. La problemática del asma grave refractaria al tratamiento o de tratamiento difícil ha sido abordada en las guías de práctica clínica (Global Initiative for Treatment of Asthma (GINA) y Guía Española para el Manejo del Asma (GEMA))2,3, pero continúa existiendo un porcentaje notable de pacientes mal controlados, infratratados y con seguimiento inadecuado, lo que indica un cumplimiento deficiente de las guías y recomendaciones de expertos4. Todo ello conforma la realidad actual del asma como un problema de salud pública a nivel mundial, con una magnitud y prevalencia crecientes2,3.
Omalizumab es un anticuerpo monoclonal anti-IgE que previene y reduce la liberación de mediadores proinflamatorios, indicado como modalidad terapéutica adicional en pacientes con asma alérgica grave persistente refractaria al tratamiento habitual. En la última década se ha demostrado que omalizumab es eficaz y bien tolerado en el tratamiento del asma moderada a grave, tanto en ensayos clínicos controlados como en estudios de la “vida real”, especialmente en la reducción de las tasas de exacerbación y el uso de corticosteroides inhalados5 6-7. A diferencia de la sólida evidencia existente sobre la eficacia y perfil de seguridad de omalizumab en el tratamiento del asma, la información relativa al coste-efectividad del uso del fármaco es limitada y los resultados de revisiones sistemáticas y metaanálisis poco concluyentes8,9.
En España, únicamente se han publicado dos estudios de coste-efectividad del tratamiento de asma grave con omalizumab10,11. Dichos estudios se efectuaron en muestras reducidas de pacientes, 47 tratados en el Servicio de Neumología del Hospital Universitario Virgen de la Victoria de Málaga10y 86 en el Servicio de Neumología del Hospital Clínic de Barcelona11. En ambos trabajos, el tratamiento con omalizumab fue coste -efectivo en términos de reducción del coste-efectividad incremental (RCEI) por exacerbaciones prevenidas y aumento de 3 puntos en el Asthma Control Test (ACT). Con el fin de confirmar estos hallazgos en una muestra más extensa de pacientes, se diseñó un estudio en 12 servicios de neumología de la Comunidad Valenciana. El objetivo del mismo fue evaluar la efectividad del tratamiento con omalizumab en pacientes con asma grave, su impacto en la calidad de vida y el beneficio obtenido en términos de reducción de costes directos e indirectos en condiciones habituales de práctica clínica.
Métodos
Diseño del estudio
Estudio observacional, retrospectivo y multicéntrico realizado en condiciones de práctica clínica habitual en 12 servicios de neumología de la Comunidad Valenciana. Se realizó una revisión retrospectiva de historias clínicas en los centros participantes desde el año 2006 (inicio de la comercialización de omalizumab en España) hasta abril de 2014. El estudio incluyó a todos los pacientes atendidos en las consultas externas de neumología de los centros participantes que cumplieron con los siguientes criterios de elegibilidad: 18 años o más, diagnosticados de asma grave2,3(escalones 5-6 de GEMA y 5 de GINA), y en tratamiento con omalizumab como terapia añadida al tratamiento estándar durante al menos un año en el momento de su inclusión.
Se recogieron datos clínicos, de tratamiento, del uso de recursos sanitarios y del absentismo laboral de los pacientes correspondientes al año previo a la adición de omalizumab (periodo preomalizumab) y de los años posteriores al inicio de dicho tratamiento (periodos postomalizumab). Si bien todos los pacientes incluidos en el estudio disponían de datos referidos al primer año de tratamiento con omalizumab por ser criterio de elegibilidad, para el resto de los periodos postomalizumab (años 2-5) la disponibilidad de éstos fue menor.
Se realizó una evaluación de la efectividad del tratamiento y del uso de recursos y calidad de vida por cada año de tratamiento con omalizumab, se escogieron periodos de un año para evitar cualquier potencial sesgo estacional.
El estudio cumplió con los principios de la Declaración de Helsinki y las normas de Buenas Prácticas Clínicas y fue aprobado por el Comité Ético de Investigación Clínica del Hospital Universitario Doctor Peset.
Medida de efectividad, recursos y calidad de vida
Los indicadores de efectividad utilizados para comparar los periodos preomalizumab y postomalizumab fueron: el número de exacerbaciones debidas a asma, la puntuación del ACT12y la evaluación del estado clínico del asma por parte del médico (escala Global Evaluation of Treatment Effectiveness (GETE))13. La exacerbación se definió como el aumento de la sintomatología que requirió tratamiento de recuperación con corticoides sistémicos. El total de exacerbaciones se calculó como el sumatorio de los ciclos de prednisona, número de visitas a urgencias e ingresos hospitalarios debidos a asma.
Los recursos contabilizados en la evaluación de costes directos fueron: a) número de visitas no programadas debidas a exacerbaciones del asma (hospitalarias y en atención primaria (AP)); b) número de visitas a urgencias motivadas por exacerbaciones del asma (hospitalarias y en AP); c) número de hospitalizaciones debidas a exacerbaciones del asma; d) días de ingreso hospitalario, y e) dosis, pauta y duración de los tratamientos.
El impacto de omalizumab en la calidad de vida de los pacientes se evaluó mediante los cuestionarios Asthma
Quality of Life Questionnaire (MiniAQLQ) y el European Quality of Life-5 dimensions (EQ-5D-3L).
Cálculo de los costes directos e indirectos
El impacto económico por la adición de omalizumab al tratamiento del asma grave se realizó considerando los costes directos (uso de recursos sanitarios y farmacológicos) y los indirectos (impacto de la enfermedad en la productividad laboral)14. El coste total del tratamiento farmacológico para cada paciente se estimó a partir de la dosis, la pauta, la duración de cada tratamiento y el coste unitario asociado. Se utilizaron los costes unitarios de los tratamientos publicados en la web del Consejo General de Colegios Oficiales de Farmacéuticos, aplicando la deducción del Real Decreto-Ley 8/2010 (RDL 8/2010) sobre el precio de venta al público sin IVA para los tratamientos de dispensación ambulatoria y la correspondiente deducción del RDL 8/2010 sobre el precio de venta del laboratorio para los medicamentos de dispensación hospitalaria. El coste de omalizumab se calculó aplicando la deducción del RDL del 7,5% sobre el precio de venta del laboratorio. Dado que la administración de omalizumab se realiza en el centro hospitalario, a cada administración de omalizumab se le añadió el coste de una visita de enfermería mensual, para aquellos pacientes que recibieron una dosis al mes, y de dos visitas de enfermería mensuales cuando la administración fue quincenal. Los costes anuales del uso de recursos se calcularon multiplicando las unidades naturales de los recursos utilizados al cabo de un año por el coste unitario asociado. Los precios unitarios de los recursos se obtuvieron de la base de datos eSalud15. La aproximación a los costes indirectos se realizó en base al método del capital humano, considerando que el salario refleja la productividad del trabajador14. Se consideraron los días que el paciente no pudo ir a trabajar debido al asma (absentismo) y se multiplicaron por el coste salarial diario específico por sexo y edad. Los costes salariales procedieron de los últimos datos publicados por el Instituto Nacional de Estadística, obtenidos a partir de la Encuesta de Estructura Anual Salarial 2013. Todos los costes se expresaron en euros del año 2015.
Análisis del coste-efectividad
Para comparar el impacto de omalizumab en términos de costes y resultados clínicos se realizó un análisis de coste-efectividad. Se calculó la ratio coste-efectividad incremental (RCEI) comparando los costes y la efectividad de los periodos preomalizumab y postomalizumab en términos de exacerbación debida al asma evitada e incremento de 3 puntos en el ACT.
Análisis del coste-utilidad
Para medir los eventuales beneficios en salud del tratamiento en años de vida ajustados por calidad (AVAC) se realizó un análisis de coste-utilidad. Se calculó la ratio coste-utilidad incremental (RCUI) en términos de incremento de AVAC.
Análisis estadístico
En el análisis descriptivo se calcularon frecuencias y porcentajes en el caso de las variables categóricas, y la media y desviación estándar o la mediana más el rango intercuartílico para las variables cuantitativas.
El análisis estadístico principal se basó en una comparación de los resultados clínicos y del uso de recursos entre los periodos preomalizumab y postomalizumab, en el que cada año se comparó con el año inmediatamente anterior. Se realizaron análisis descriptivos bivariantes de todas las variables del estudio y contrastes bivariantes paramétricos o no paramétricos, en función de la aplicabilidad (comparaciones de medias (prueba t, suma de rangos de Wilcoxon), tablas de contingencia (prueba χ2, prueba exacta de Fisher, prueba de McNemar) y correlaciones (Pearson, tau de Kendall, rho de Spearman)). Siempre que fue posible, las pruebas estadísticas empleadas tuvieron en cuenta las observaciones pareadas (con datos preomalizumab y postomalizumab para todos los pacientes), ganando así potencia estadística. Se estableció un nivel de significación del 5% en todos los análisis. Los resultados de las estimaciones de los RCEI/RCUI se acompañaron del intervalo de confianza del 95% (IC 95%), que se obtuvo mediante la técnica bootstrap. Se utilizó el paquete estadístico R versión 3.1.2.
Resultados
En el estudio se incluyeron 186 pacientes elegibles. El 62,4% fueron varones y la edad media fue de 50,5 años (IC 95%: 48,2-52,7). El 8,1% de los pacientes eran fumadores activos y el 15,1% exfumadores. La mediana del tiempo desde que se diagnosticó el asma hasta que se inició el tratamiento con omalizumab fue de 15 años (rango intercuartílico 6-24). Las principales comorbilidades fueron rinitis, poliposis nasal y la alergia respiratoria, que fueron presentadas por el 60%, 30,5% y 59,2% de los pacientes, respectivamente.
Efectividad
La adición de omalizumab al tratamiento estándar durante el primer año de tratamiento originó un cambio de puntuación en el ACT de 12,75 puntos (IC 95%: 11,96-13,54) en el periodo preomalizumab a 19,35 puntos (IC 95%: 18,48-20,22) en el periodo post-omalizumab (p < 0,001); el porcentaje de pacientes mal controlados disminuyó de 72,38% a 18,33% (p < 0,001), según puntuación del ACT. El tratamiento con omalizumab produjo un descenso estadísticamente significativo en el número de exacerbaciones anuales (7,52 (IC 95%: 6,45-8,59) versus 2,28 (IC 95%: 1,71-2,85); p < 0,001). Según la escala GETE, un 71,9% de los pacientes tuvieron una respuesta mejor o mucho mejor con omalizumab. Se observó un aumento estadísticamente significativo (p < 0,001) de los parámetros espirométricos capacidad vital forzada (FVC) (80,96% (IC 95%: 78,16-83,75) versus 87,68% (IC 95%: 84,95-90,41)), volumen espiratorio máximo en el primer segundo (FEV1) postbroncodilatador (67,29% (IC 95%: 64,15 -70,42) versus 75,23% (IC 95%: 72,30-78,16)) y FEV1/FVC (64,42% (IC 95%: 62,35-66,50) versus 67,10% (IC 95%: 65,01-69,20)). Resultados similares a los del primer año con omalizumab se obtuvieron en los siguientes cuatro años (Tabla 1 ). Por otro lado, según la percepción del paciente, tras el primer año de tratamiento con omalizumab, la evolución del asma fue mejor o mucho mejor (83,9%), y el porcentaje de pacientes con control pobre o malo de la rinitis disminuyó del 35,48% al 2,15% (p < 0,001).
Tabla 1. Variables clínicas, efectividad y uso de recursos en los periodos preomalizumab y postomalizumab
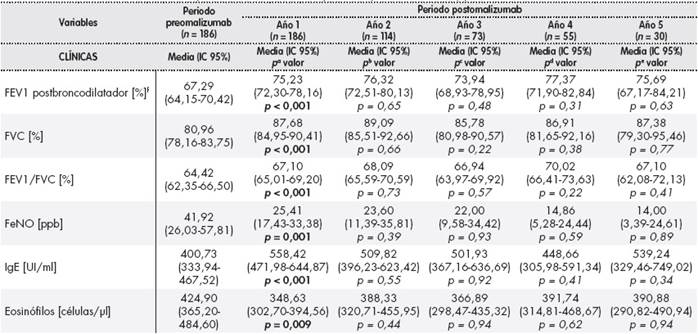
Tabla 1(cont.). Variables clínicas, efectividad y uso de recursos en los periodos preomalizumab y postomalizumab
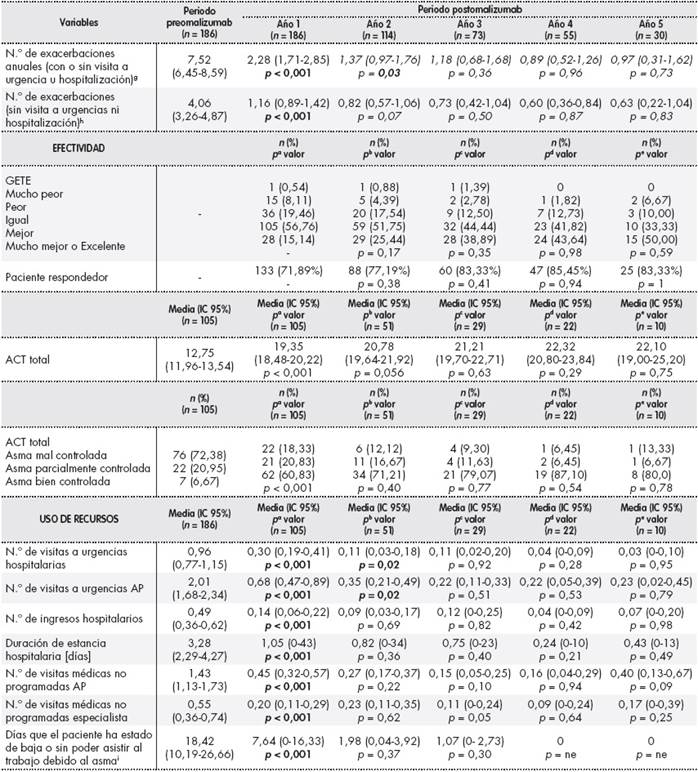
aDiferencia entre año preomalizumab y año 1 postomalizumab;bdiferencia entre año 1 postomalizumab y año 2 postomalizumab;cdiferencia entre año 2 postomalizumab y año 3 postomalizumab;ddiferencia entre año 3 postomalizumab y año 4 postomalizumab;ediferencia entre año 4 postomalizumab y año 5 postomalizumab;fporcentaje respecto al FEV1 teórico;gaumento de síntomas con o sin hospitalización que requieren tratamiento con corticoides sistémicos;haumento de síntomas que requieren tratamiento con corticoides sistémicos sin hospitalización;in = 90 pacientes en periodo preomalizumab y n = 88, 49, 29, 25 y 11 pacientes en los años 1, 2, 3, 4 y 5 respectivamente.
ACT: Asthma Control Test; AP: atención primaria; FeNO: fracción espiratoria óxido nítrico; FEV1: volumen espiratorio máximo en el primer segundo; FVC: capacidad vital forzada; GETE: Global Evaluation of Treatment Effectiveness; IC: intervalo de confianza; IgE: inmunoglobulina E; ne: no evaluable; ppb: partes por billón; UI: unidad internacional.
Test estadísticos: prueba χ2para variables categóricas y prueba pareada U de Mann-Whitney para variables cuantitativas y prueba pareada no paramétrica U de Mann-Whitney.
Al año de iniciar el tratamiento con omalizumab, 13 pacientes (6,95%) habían discontinuado el tratamiento. De éstos, ocho pacientes suspendieron el tratamiento por decisión propia, tres por falta de respuesta y dos por efectos adversos (un paciente debido a náuseas y vómitos y otro debido a prurito).
Uso de recursos
La adición de omalizumab originó reducciones significativas en el número de pacientes con prescripción médica de corticoides inhalados a dosis altas, anticolinérgicos, teofilina y corticoides orales. También se observó una reducción significativa de la dosis media de corticoides inhalados administrados a dosis altas (1.006,4 versus 752,1 μg/día; p = 0,004), agonistas ß2-adrenérgicos de acción larga (LABA) (96,1 versus 58,7 μg/ día; p < 0,000), antileucotrienos (7,7 versus 6,9 mg/día; p = 0,008), anticolinérgicos (72,4 versus 6,4 μg/día; p < 0,000), teofilina (70,1 versus 43,6 mg/día; p < 0,000) y corticoides orales (1,7 versus 0,8 mg/día; p = 0,001). La dosis media de omalizumab por paciente administrada durante el primer año fue de 419,8 ± 259,86 mg/mes.
El tratamiento con omalizumab ocasionó una disminución estadísticamente significativa del número de ingresos hospitalarios (0,49 (IC 95%: 0,36-0,62) versus 0,14 (IC 95%: 0,06-0,22); p < 0,001), así como del número de visitas médicas no programadas y a urgencias (tanto a AP como hospitalarias). La duración media de las estancias hospitalarias disminuyó de 3,28 días (IC 95%: 2,29-4,27) a 1,05 días (IC 95%: 0,35-1,75) (p < 0,001). Esta disminución en el uso de recursos se mantuvo prácticamente constante en los siguientes cuatro años, a excepción del número de visitas a urgencias entre el primer y segundo año (Tabla 1 ).
Calidad de vida
Tras el primer año de tratamiento se observó un incremento clínico y estadísticamente significativo en la calidad de vida de los pacientes tratados con omalizumab, evaluada mediante las cuatro dimensiones y la puntuación global del cuestionario MiniAQLQ (3,26 puntos (IC 95%: 2,88-3,63) versus 4,92 puntos (IC 95%: 4,42-5,43); p < 0,001). Asimismo, se observaron mejoras estadísticamente significativas en las cuatro dimensiones del cuestionario European Quality of Life-5 Dimensions (EQ-5D) y en su escala visual analógica (47,96 puntos (IC 95%: 43-52) versus 70,33 puntos (IC 95%: 64-75); p < 0,001). El tratamiento con omalizumab también produjo un incremento significativo de los AVAC durante el primer año de tratamiento, de 0,61 (IC 95%: 0,54-0,68) a 0,81 (IC 95%: 0,74-0,88) (p < 0,001) (Tabla 2).
Tabla 2. Resultados del cuestionario EQ-5D y AVAC en los periodos preomalizumab y primer año postomalizumab

AVAC: Años de vida ajustados por calidad; EQ-5D: European Quality of Life-5 Dimensions.
Test estadísticos: prueba χ2para variables categóricas y prueba pareada U de Mann-Whitney para variables cuantitativas.
Costes
Se observó un descenso estadísticamente significativo del coste anual medio de recursos utilizados entre el periodo preomalizumab y postomalizumab (1.768,08 € (IC 95%: 1.410,00-2.256,12) versus 822,31 € (IC 95%: 609,44-1.240,50); p = 0,001). Disminuyó el coste anual de exacerbaciones, de visitas a urgencias, de ingresos hospitalarios y de visitas médicas no programadas.
El coste farmacológico anual derivado del uso de corticoides inhalados, LABA, antileucotrienos, anticolinérgicos, teofilina y corticoides orales se redujo significativamente durante el periodo postomalizumab. El coste medio de omalizumab por paciente/año fue de 11.472,14 € (IC 95%: 10.513,52-12.536,62). En el periodo postomalizumab también disminuyó la media de costes indirectos por paciente de 714,95 € (IC 95%: 459,28-1.160,46) a 398,42 € (IC 95%: 155,12-958,43) (p < 0,001). En relación con los costes directos e indirectos, se detectaron reducciones, sin ser estadísticamente significativas en los siguientes cuatro años después del primer año de tratamiento con omalizumab (Tabla 3 ).
Tabla 3. Costes directos e indirectos anuales por paciente en los periodos preomalizumab y postomalizumab
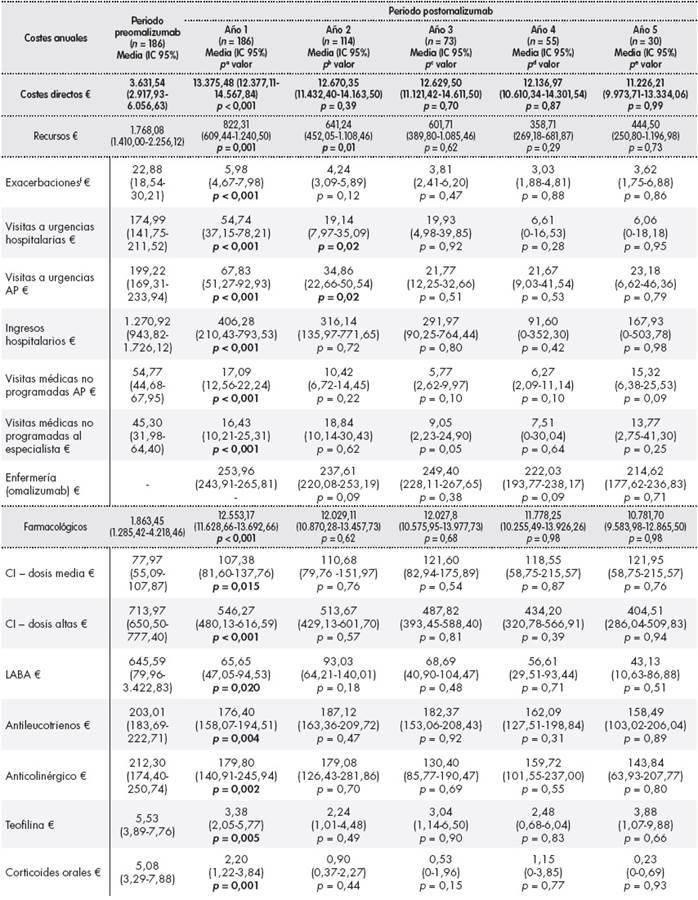
Tabla 3 (cont.). Costes directos e indirectos anuales por paciente en los periodos preomalizumab y postomalizumab
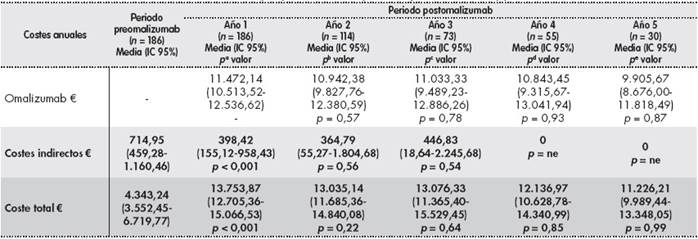
aDiferencia entre año preomalizumab y año 1 postomalizumab;bdiferencia entre año 1 postomalizumab y año 2 postomalizumab;cdiferencia entre año 2 postomalizumab y año 3 postomalizumab;ddiferencia entre año 3 postomalizumab y año 4 postomalizumab;ediferencia entre año 4 postomalizumab y año 5 postomalizumab;fsin visita ni hospitalización.
AP: atención primaria; CI: corticoides inhalados; IC: intervalo de confianza; LABA: agonistas χ2-adrenérgicos de acción larga; ne: no evaluable.
Test estadísticos: prueba no paramétrica U de Mann-Whitney.
Análisis de la relación coste-efectividad y coste-utilidad
La RCEI por costes directos fue de 1.858,84 € (IC 95%: 1.084,72-3.137,62) por exacerbación evitada y de 4.737,42 € (IC 95%: 3.590,60-6.208,86) por incremento de 3 puntos del ACT; la RCUI por AVAC fue de 53.755,34 € (IC 95%: 40.663,14-72.497,39). Incluyendo los costes indirectos, la RCEI fue de 1.789,28 € (IC 95%: 1.019,13-3.038,12) por exacerbación evitada y de 4.569,38 € (IC 95%: 3.442,86-6.075,05) por incremento de 3 puntos del ACT; la RCUI por AVAC fue de 50.239,98 € (IC 95%: 37.209,88-68.923,84) (Tabla 4).
Discusión
La eficacia y perfil de seguridad favorable de omalizumab como tratamiento adicional a los corticoides inhalados y LABA en pacientes con asma grave no controlada han sido extensamente documentados en la literatura16 17 18-19. En el presente estudio, tras un periodo de 12 meses de tratamiento con omalizumab, se observó un incremento medio de 6,6 puntos en el ACT (51,8% de los pacientes) y una reducción media de 5,2 exacerbaciones anuales (69,7% de los pacientes) en comparación con los datos obtenidos durante el año previo al uso de omalizumab. Estos resultados coinciden con datos de ensayos clínicos y estudios observacionales que han demostrado que el tratamiento con omalizumab se asocia a una reducción relativa del número de exacerbaciones del 25% al 75%13,16 17-18,20y a un incremento de la puntuación del ACT en un 41,9-60% de los pacientes13,18,21. Por otra parte, los resultados favorables obtenidos en la mejoría de la calidad de vida también son consistentes con resultados de estudios previos18,22. Concretamente, observamos mejorías en las puntuaciones de los cuestionarios MiniAQLQ (incremento de 1,66 puntos, 50,9% de los pacientes) y cuatro dimensiones del EQ-5D, así como un incremento significativo de 0,20 AVAC (32,8% de los pacientes) durante el primer año de tratamiento.
La mayoría de los estudios que evalúan el impacto farmacoeconómico y en el uso de recursos de omalizumab han sido realizados con muestras pequeñas de pacientes10,11,23o han basado sus resultados en datos de eficacia obtenidos en ensayos clínicos24,25. En este aspecto, este es el primer estudio de evaluación farmacoeconómico multicéntrico y con un número considerable de pacientes realizado en condiciones de práctica clínica en España. Los resultados relevantes incluyen una RCEI de 1.789,28 € por exacerbación evitada y de 4.569,38 € por incremento de 3 puntos del ACT. En estudios previos en nuestro ámbito se había descrito una RCEI que oscilaba entre 462 € y 1.131 € por exacerbación evitada y de 4.124,79 € por incremento de 3 puntos en el ACT10,11. En varios estudios se ha observado un coste entre 23.880 € y 56.091 € por cada AVAC ganado10,24,26, lo que concuerda con los resultados de 50.239,98 € obtenidos en este trabajo.
Se ha descrito que el 22% de los costes asociados al asma grave no controlada puede atribuirse a costes indirectos27. En este sentido, los resultados de este estudio también muestran una disminución de los costes indirectos (316,53 €), así como de los costes directos derivados de las exacerbaciones, visitas e ingresos hospitalarios (945 €). Este estudio constituye el primero en analizar el impacto farmacoeconómico de omalizumab a medio plazo. Tras el primer año de tratamiento, la evolución clínica, el uso de recursos y los costes se mantuvieron prácticamente constantes en los siguientes cuatro años, lo que podría interpretarse como efectividad clínica sostenida de omalizumab y eficiencia a medio plazo.
Algunas de las limitaciones del estudio son la falta de registros clínicos más allá del primer año de tratamiento con omalizumab, así como el número reducido de pacientes (n = 46) en que se basó el análisis de coste-utilidad por la falta de datos retrospectivos sobre calidad de vida. Previamente, Levy et al.10describieron una RCUI de 26.864,89 € por AVAC ganado, considerando sólo los costes directos. Sin embargo, en nuestro estudio hemos evaluado el coste por AVAC ganado con omalizumab teniendo en cuenta los costes indirectos, cuya aproximación se realizó en base al método del capital humano, considerando que el salario refleja la productividad del trabajador14, y los costes salariales procedentes de los últimos datos publicados por el Instituto Nacional de Estadística. Cabe destacar que la validez externa del estudio podría estar limitada a los sistemas de salud de otros países con características organizativas diferentes, así como a las realizadas en otras comunidades autónomas nacionales.
En resumen, los resultados obtenidos en este estudio indican que los pacientes tratados con omalizumab, además de experimentar una mejoría clínica sostenida e incrementar el número de AVAC, requerían una menor atención sanitaria, consumían menos recursos sanitarios y presentaban un menor coste por pérdida de productividad. Estos resultados son clínicamente relevantes y deben tenerse en cuenta en la práctica diaria a la hora de elegir un tratamiento eficaz y costo-eficiente para pacientes con asma grave.
Agradecimientos
Los autores quieren agradecer al equipo de GOC Networking por su soporte y colaboración en el desarrollo de este estudio.
Anexo 1
Grupo de trabajo del estudio Impacto Farmacoeconómico del Uso de Omalizumab:
Frederik Tatay. Servicio de Neumología, Hospital de Vinaroz, Castellón. España.
Pablo Catalán. Servicio de Neumología, Hospital de Requena, Valencia. España.
Patricia García-Sidro. Servicio de Neumología, Hospital de la Plana, Castellón. España.
Concha Pellicer. Servicio de Neumología, Hospital de Gandía, Valencia. España
María José Bueso. Servicio de Neumología, Hospital General de Castellón, Castellón. España.
Amparo LLoris. Servicio de Neumología, Hospital de Sagunto, Valencia. España.
Laura Romero. Servicio de Neumología, Hospital General de Castellón, Castellón. España.
Cristina Miralles. Servicio de Neumología, Hospital de Gandía, Valencia. España.
Paola Ordóñez. Servicio de Neumología, Hospital de Gandía, Valencia. España.
José Vicente Giménez Soler. Servicio de Neumología, Hospital de la Plana, Castellón. España.
Pedro Landete. Servicio de Neumología, Hospital Sant Joan, Alicante. España.
Javier Berraondo. Servicio de Neumología, Hospital General, Valencia. España.
REFERENCIAS
Cisneros Serrano C, Melero Moreno C, Almonacid Sanchez C, Perpina Tordera M, Picado Valles C, Martinez Moragon E, et al. Guidelines for severe uncontrolled asthma. Arch Bronconeumol. 2015;51(5):235-46. [ Links ]
Global Initiative of Asthma. 2018 GINA Report, Global Strategy for Asthma Management and Prevention (Internet). Wisconsin; 2018 (accessed 24/7/2018). Available at: https://ginasthma.org/2018-gina-report-global-strategy-for-asthmamanagement-and-prevention/ [ Links ]
Guía Española para el Manejo del Asma (GEMA 4.2) [Internet]. Madrid: Ed Luzan. (accessed 17/5/2018). Available at: http://www.gemasma.com [ Links ]
López-Vina A, Giner J, Molina J, Palicio J, Plaza J, Quintano JA, et al. Multidisciplinary Consensus on the Nonadherence to Clinical Management of Inhaled Therapy in Spanish asthma patients. Clin Ther. 2017;39(8):1730-45. [ Links ]
Lin CH, Cheng SL. A review of omalizumab for the management of severe asthma. Drug Des Devel Ther. 2016;10:2369-78. [ Links ]
Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev. 2014;1(1):CD003559. [ Links ]
Corren J, Kavati A, Ortiz B, Vegesna A, Colby JA, Ruiz K, et al. Patient-reported outcomes in moderate-to-severe allergic asthmatics treated with omalizumab: a systematic literature review of randomized controlled trials. Curr Med Res Opin. 2018;34(1):65-80. [ Links ]
Lai T, Wang S, Xu Z, Zhang C, Zhao Y, Hu Y, et al. Long-term efficacy and safety of omalizumab in patients with persistent uncontrolled allergic asthma: a systematic review and meta-analysis. Sci Rep. 2015;5:8191. [ Links ]
Norman G, Faria R, Paton F, Llewellyn A, Fox D, Palmer S, et al. Omalizumab for the treatment of severe persistent allergic asthma: a systematic review and economic evaluation. Health Technol Assess. 2013;17(52):1-342. [ Links ]
Levy AN, García A Ruiz AJ, García-Agua Soler N, Sanjuán MV. Cost-effectiveness of omalizumab in severe persistent asthma in Spain: a real-life perspective. J Asthma. 2015;52(2):205-10. [ Links ]
Vennera MC, Valero A, Uría E, Forné C, Picado C. Cost-Effectiveness Analysis of Omalizumab for the Treatment of Severe Persistent Asthma in Real Clinical Practice in Spain. Clin Drug Investig. 2016;36(7):567-78. [ Links ]
Schatz M, Kosinski M, Yarlas AS, Hanlon J, Watson ME, Jhingran P. The minimally important difference of the Asthma Control Test. J Allergy Clin Immunol. 2009;124(4):719-23 e1. [ Links ]
Vennera MC, Pérez de Llano L, Bardagi S, Ausin P, Sanjuas C, González H, et al. Omalizumab therapy in severe asthma: experience from the Spanish registry--some new approaches. J Asthma. 2012;49(4):416-22. [ Links ]
Gisbert R. Economía y salud: economía, gestión económica y evaluación económica en el ámbito sanitario. Madrid: Elsevier; 2002. [ Links ]
Gisbert R, Brosa M. Base de datos de costes sanitarios eSalud (internet database). Oblikue Consulting, S. L.; 2012 (accessed 10/9/2015). Available at: http://www.oblikue.com/bddcostes [ Links ]
Hanania NA, Alpan O, Hamilos DL, Condemi JJ, Reyes-Rivera I, Zhu J, et al. Omalizumab in severe allergic asthma inadequately controlled with standard therapy: a randomized trial. Ann Intern Med. 2011;154(9):573-82. [ Links ]
Bardelas J, Figliomeni M, Kianifard F, Meng X. A 26-week, randomized, double-blind, placebo-controlled, multicenter study to evaluate the effect of omalizumab on asthma control in patients with persistent allergic asthma. J Asthma. 2012;49(2):144-52. [ Links ]
Barnes N, Menzies-Gow A, Mansur AH, Spencer D, Percival F, Radwan A, et al. Effectiveness of omalizumab in severe allergic asthma: a retrospective UK realworld study. J Asthma. 2013;50(5):529-36. [ Links ]
Cazzola M, Camiciottoli G, Bonavia M, Gulotta C, Ravazzi A, Alessandrini A, et al. Italian real-life experience of omalizumab. Respir Med. 2010;104(10):1410-6. [ Links ]
Schumann C, Kropf C, Wibmer T, Rudiger S, Stoiber KM, Thielen A, et al. Omalizumab in patients with severe asthma: the XCLUSIVE study. Clin Respir J. 2012;6(4):215-27. [ Links ]
De Llano LP, Vennera MC, Álvarez FJ, Medina JF, Borderías L, Pellicer C, et al. Effects of omalizumab in non-atopic asthma: results from a Spanish multicenter registry. J Asthma. 2013;50(3):296-301. [ Links ]
Vieira T, de Oliveira JF, da Graca Castel-Branco M. Short and long-term quality of life and asthma control with omalizumab therapy in a real life setting in Portugal. Allergol Immunopathol (Madr). 2014;42(1):3-10. [ Links ]
Padulles Zamora N, Comas Sugranes D, Mendez Cabaleiro N, Figueras Suriol A, Jodar Masanes R. Retrospective analysis of omalizumab in patients with severe allergic asthma. Farm Hosp. 2013;37(5):399-405. [ Links ]
Dewilde S, Turk F, Tambour M, Sandstrom T. The economic value of anti-IgE in severe persistent, IgE-mediated (allergic) asthma patients: adaptation of INNOVATE to Sweden. Curr Med Res Opin. 2006;22(9):1765-76. [ Links ]
Campbell JD, Spackman DE, Sullivan SD. The costs and consequences of omalizumab in uncontrolled asthma from a USA payer perspective. Allergy. 2010;65(9):1141-8. [ Links ]
Dal Negro RW, Tognella S, Pradelli L. A 36-month study on the cost/utility of add-on omalizumab in persistent difficult-to-treat atopic asthma in Italy. J Asthma. 2012;49(8):843-8. [ Links ]
Doz M, Chouaid C, Com-Ruelle L, Calvo E, Brosa M, Robert J, et al. The association between asthma control, health care costs, and quality of life in France and Spain. BMC Pulm Med. 2013;13:15. [ Links ]
How to cite this paper:Martínez-Moragón E, Climent M, Chiner E, Fernández-Aracil C, Sánchez-Toril F, Lluch-Tortajada I; on behalf the Pharmacoeconomic Impact of the Use of Omalizumab study working group. Effectiveness and pharmacoeconomic analysis of the treatment of severe asthma with omalizumab in clinical practice. Farm Hosp. 2019;43(3):101-109.
Aportación a la literatura científica:
Recibido: 12 de Noviembre de 2018; Aprobado: 04 de Enero de 2019











 text in
text in 



