My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.43 n.5 Toledo Sep./Oct. 2019 Epub Oct 14, 2019
https://dx.doi.org/10.7399/fh.11226
ORIGINALES BREVES
Caracterización fisicoquímica de micafungina y anidulafungina para su administración mediante nebulización
1Servicio de Farmacia, Hospital Universitario Vall d’Hebron, Barcelona, España.
Objetivo
Determinar experimentalmente si micafungina y anidulafungina poseen propiedades fisicoquímicas adecuadas para su nebulización.
Método
Se determinó el pH, la osmolalidad, la viscosidad, la densidad y el contenido en cloruros mediante pH-metría, osmometría, viscosimetría, densitometría y potenciometría, respectivamente, en dos muestras de diferente concentración, 5 y 10 mg/ml, de cada equinocandina.
Resultados
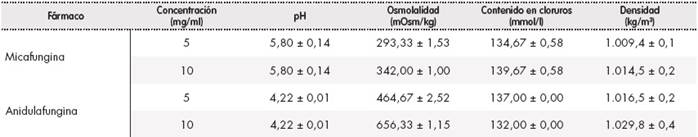
Para la solución de micafungina 5 mg/ml los resultados obtenidos fueron: pH 5,80 (0,14), osmolalidad 293,33 (1,53) mOsm/kg, contenido en cloruros 134,67 (0,58) mmol/l y densidad 1.009,4 (0,1) kg/m3; y para la solución de 10 mg/ml: osmolalidad 342,00 (1,00) mOsm/kg, contenido en cloruros 139,67 (0,58) mmol/l y densidad 1.014,5 (0,2) kg/m3. Para la solución de anidulafungina 5 mg/ml los resultados obtenidos fueron: pH 4,22 (0,01), osmolalidad 464,67 (2,52) mOsm/kg, contenido en cloruros 137,00 (0,00) mmol/l y densidad 1.016,5 (0,2) kg/m3; y para la solución de 10 mg/ml: osmolalidad 656,33 (1,15) mOsm/kg, contenido en cloruros 132,00 (0,00) mmol/l y densidad 1.029,8 (0,4) kg/m3.
Conclusiones
Los valores de pH, osmolalidad, contenido en cloruros y densidad resultaron adecuados para una correcta tolerabilidad mediante nebulización.
PALABRAS CLAVE: Micafungina; Anidulafungina; Antifúngico; Nebulizado; Scedosporium; Scopulariopsis
Introducción
En los pacientes críticos o inmunodeprimidos como los pacientes trasplantados pulmonares, las infecciones fúngicas sistémicas y a nivel pulmonar pueden conllevar graves consecuencias clínicas1 2 3-4.
Entre las posibles infecciones fúngicas que afectan a estos pacientes cabe destacar la infección por especies del género Aspergillus spp. En el postrasplante pulmonar inmediato estas infecciones afectan, principalmente, a las vías respiratorias e incluyen traqueobronquitis ulcerativa e infecciones anastomóticas. Las guías actuales recomiendan un triazol como tratamiento de primera línea y sugieren la posibilidad de asociar un antifúngico nebulizado como tratamiento adyuvante5. Esta asociación resultaría beneficiosa ya que frecuentemente en este tipo de pacientes no se alcanzan concentraciones de fármaco adecuadas a nivel pulmonar con la administración parenteral, pues la penetración tisular en el pulmón es baja y gran parte de ellos son sometidos a ventilación mecánica, la cual produce una alteración de los parámetros farmacocinéticos del principio activo6.
Además de Aspergillus spp., existe una tendencia creciente de infecciones causadas por especies de hongos cuya respuesta al tratamiento con antifúngicos convencionales es muy limitada, como Scedosporium spp. o Scopulariopsis spp., entre otros. En el caso de infecciones diseminadas por Scedosporium spp. se recomienda voriconazol en monoterapia o en combinación con una equinocandina intravenosa y/o terbinafina7,8. En cambio, en el caso de Scopulariopsis spp. se desconoce el antifúngico óptimo.
En aquellas situaciones en las que la respuesta clínica a los antifúngicos de elección no resulta eficaz o se producen efectos adversos y el foco de la infección se localiza en el tracto respiratorio, la administración de fármacos antifúngicos puede plantearse por vía nebulizada.
Actualmente, la bibliografía sobre la nebulización de antiinfecciosos es limitada y la mayoría de ellos no tienen autorizada dicha vía de administración. Existe bibliografía publicada sobre la nebulización de anfotericina B convencional y liposomal, pentamidina, nistatina, posaconazol, voriconazol, itraconazol, caspofungina y micafungina1,3,4,7,9 10 11-12. Los estudios publicados sobre la nebulización de micafungina tuvieron como único objetivo la caracterización de las partículas de fármaco liberadas mediante diferentes nebulizadores9,10.
La administración de fármacos antiinfecciosos mediante nebulización en combinación con la terapia intravenosa puede constituir una alternativa en aquellos casos en los que exista una escasa difusión a través de las membranas biológicas y se requiera una elevada concentración de fármaco en el tracto respiratorio para facilitar el control del foco de la infección6.
Además, la nebulización de fármacos permite alcanzar altas concentraciones a nivel local con una mínima exposición sistémica, lo que generalmente se traduce en una mayor eficacia y un menor número de efectos adversos sistémicos1,4,6,7,9 10 11-12. Por tanto, también podría emplearse la vía nebulizada en monoterapia cuando se requiera únicamente acción local o el paciente presente efectos adversos por vía intravenosa2.
La literatura especializada sugiere que para conseguir una nebulización óptima se deben tener en cuenta las propiedades fisicoquímicas de la solución de principio activo, el sistema de nebulización empleado y las condiciones físicas y clínicas del paciente1,4.
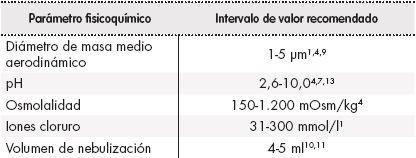
Las propiedades fisicoquímicas como el pH, la osmolalidad, la concentración de iones cloruros, la densidad y el tamaño de partícula del fármaco influyen en la eficacia y la tolerabilidad de la nebulización (Tabla 1). Además, la presencia de los excipientes edetato sódico, cloruro de benzalconio, fenoles y sulfitos puede provocar una mala tolerabilidad4,11.
Los estudios realizados hasta el momento demuestran que valores extremos de pH y osmolalidad, así como la ausencia de cloruros en los preparados para nebulización, pueden producir tos y/o broncoconstricción4,11,13.
El volumen de fármaco a administrar debe ser adecuado para garantizar una viscosidad correcta. La disolución del fármaco en volúmenes pequeños conllevaría una viscosidad elevada que dificultaría la nebulización y podría producir obstrucción o daño del nebulizador, mientras que la disolución en volúmenes mayores provocaría una viscosidad reducida que aumentaría el tiempo de nebulización6,11.
El tamaño de las partículas, expresado como diámetro de masa medio aerodinámico (DMMA), debe encontrase en el intervalo 1-5 µm, ya que permite una entrada adecuada al lugar de acción. Las partículas con DMMA superior a 5 µm quedan depositadas en las vías respiratorias superiores, mientras que aquellas con DMMA inferior a 1 µm pueden ser expulsadas durante la exhalación1,4.
La dosis que se administra mediante nebulización de los antiinfecciosos que no disponen de autorización por vía nebulizada se establece de forma empírica en los casos en los que no se han llevado a cabo estudios farmacocinéticos previos.
El objetivo de este estudio se centra en valorar experimentalmente si los antifúngicos micafungina y anidulafungina podrían presentar una tolerabilidad adecuada por vía nebulizada, dado que su ficha técnica sólo contempla la vía intravenosa.
Métodos
Para llevar a cabo las determinaciones analíticas se partió de las presentaciones comerciales Mycamine® (micafungina) y Ecalta® (anidulafungina) 100 mg polvo concentrado para solución para perfusión, y se prepararon a partir de ellas dos concentraciones diferentes de cada equinocandina, 5 mg/ml y 10 mg/ml, utilizando cloruro sódico al 0,9% como diluyente.
Para cada una de las muestras se realizaron las determinaciones de osmolalidad y contenido en cloruros por triplicado en el Servicio de Bioquímica del hospital. La osmolalidad se determinó mediante el osmómetro automatizado A2O de Advanced Instruments INC®, que emplea la técnica de disminución del punto de congelación. La determinación del contenido en cloruros se realizó mediante potenciometría con el equipo AU5800 de Beckmann Coulter®.
La medición del pH se realizó en el Servicio de Farmacia mediante el pH-metro Testo 206®, también por triplicado, únicamente con la concentración de 5 mg/ml, al tratarse de una variable independiente de la concentración.
Las determinaciones de viscosidad y densidad se realizaron en el Servicio de Desarrollo del Medicamento de la Facultad de Farmacia y Ciencias de la Alimentación de la Universidad asociada al hospital mediante el viscosímetro Brookfield CAP 2000® y el densitómetro Anton Paar®, respectivamente, y por triplicado para cada una de las concentraciones de ambas equinocandinas.
Resultados
Los resultados obtenidos, expresados como media ± desviación estándar, para las muestras de micafungina 5 mg/ml y 10 mg/ml y anidulafungina 5 mg/ml y 10 mg/ml se muestran en la Tabla 2.
No fue posible determinar la viscosidad de las muestras por tratarse de soluciones acuosas con una viscosidad muy similar a la del agua.
Discusión
Los valores de pH y osmolalidad obtenidos en las muestras de micafungina y anidulafungina a las concentraciones estudiadas, así como el contenido en cloruros, se encuentran dentro de los intervalos aceptados para una correcta tolerabilidad por vía nebulizada1,4,7,13. Los valores de densidad obtenidos son similares al valor de densidad del agua (1.000 kg/m3), por lo que la formación de aerosoles en el nebulizador resultaría adecuada1. Por tanto, las características fisicoquímicas estudiadas indican que su administración mediante nebulización podría resultar adecuada. La reconstitución de micafungina y anidulafungina se realizó empleando cloruro sódico al 0,9%, ya que según ficha técnica ambos eran estables y, de esta forma, se aportaban iones cloruro a la disolución.
Además, la ficha técnica indica que las presentaciones empleadas no contienen ningún excipiente (edetato sódico, cloruro de benzalconio, fenoles y sulfitos) relacionado con la producción de tos y/o broncoconstricción.
Se trata del primer estudio reportado que determina las propiedades fisicoquímicas: pH, osmolalidad, contenido en cloruros y densidad de micafungina para su nebulización. Además, es el primer estudio realizado de caracterización fisicoquímica de anidulafungina para administrar nebulizada. Los valores de densidad y contenido en cloruros obtenidos para ambas equinocandinas son similares a los resultados publicados en el estudio de Wong-Beringer et al. de caracterización de la caspofungina, mientras que la diferencia en los valores de pH y osmolalidad es mayor, pero se encuentran dentro de los intervalos recomendados1.
Las concentraciones estudiadas permitirían la administración de volúmenes adecuados para la nebulización de una dosis de 50 mg, dosis empleada en los estudios de Shi et al. y Alexander et al.9,10. En estos estudios, en los que se caracterizó la liberación de una disolución de micafungina a una concentración de 10 mg/ml, se obtuvieron DMMA dentro de los valores establecidos, por lo que una proporción significativa del fármaco alcanzaría vías respiratorias profundas. Estos resultados refuerzan la posibilidad de utilizar micafungina por vía nebulizada.
A diferencia de la anfotericina B desoxicolato o liposomal, actualmente no se han publicado estudios que evalúen la eficacia, la seguridad y la tolerabilidad de micafungina y anidulafungina nebulizadas. Un ejemplo es el estudio de Monforte et al., que demostró una distribución local a nivel pulmonar de anfotericina B liposomal y una adecuada tolerabilidad tras una administración de 25 mg14. Asimismo, se observó que se mantienen niveles de fármaco adecuados durante al menos 14 días tras la administración14.
En cuanto a las limitaciones del estudio, habría que destacar que sólo serían resultados válidos para las marcas comerciales empleadas. Además, sería necesario determinar otros factores físicos como el tamaño de la partícula, así como el tipo de nebulizador y las características físicas y clínicas del paciente para asegurar una difusión eficaz del fármaco a nivel pulmonar.
Las soluciones de micafungina y anidulafungina descritas en este trabajo serían aptas para su nebulización, pudiéndose emplear en casos de infecciones fúngicas respiratorias complejas producidas por especies sensibles. Se podrían administrar junto con terapia intravenosa para intensificar el tratamiento o bien en monoterapia cuando la vía intravenosa no resulte posible o adecuada.
Cómo citar este trabajo:Gómez-Ganda L, Terradas-Campanario S, Campany-Herrero D. Caracterización fisicoquímica de micafungina y anidulafungina para su administración mediante nebulización. Farm Hosp. 2019;43(5):163-5.
Presentación en Congresos:Presentación en formato póster en el 63º Congreso Nacional de la Sociedad Española de Farmacia Hospitalaria (SEFH). Palma de Mallorca, 8 a 10 de noviembre de 2018.
Aportación a la literatura científicaEs el primer estudio en caracterizar fisicoquímicamente micafungina y anidulafungina para su nebulización. Su nebulización permitiría tratar infecciones respiratorias producidas por microorganismos sensibles.
REFERENCIAS
Wong-Beringer A, Lambros MP, Beringer PM, Johnson DL. Suitability of caspofungin for aerosol delivery: physicochemical profiling and nebulizer choice. Chest. 2005;128(5):3711-6. DOI: 10.1378/chest.128.5.3711 [ Links ]
Holle J, Leichsenring M, Meissner PE. Nebulized voriconazole in infections with Scedosporium apiospermum--case report and review of the literature. J Cyst Fibros. 2014;13(4):400-2. DOI: 10.1016/j.jcf.2013.10.014 [ Links ]
McConville JT, Overhoff KA, Sinswat P, Vaughn JM, Frei BL, Burgess DS, et al. Targeted high lung concentrations of itraconazole using nebulized dispersions in a murine model. Pharm Res. 2006;23(5): 901-11. DOI: 10.1007/s11095-006-9904-6 [ Links ]
Le J, Ashley ED, Neuhauser MM, Brown J, Gentry C, Klepser ME, et al. Consensus summary of aerosolized antimicrobial agents: application of guideline criteria. Insights from the Society of Infectious Diseases Pharmacists. Pharmacotherapy. 2010;30(6):562-84. DOI: 10.1592/phco.30.6.562 [ Links ]
Husain S, Sole A, Alexander BD, Aslam S, Avery R, Benden C, et al. The 2015 International Society for Heart and Lung Transplantation Guidelines for the management of fungal infections in mechanical circulatory support and cardiothoracic organ transplant recipients: Executive summary. J Heart Lung Transplant. 2016;35(3):261-82. [ Links ]
Ehrmann S, Chastre J, Diot P, Lu Q. Nebulized antibiotics in mechanically ventilated patients: a challenge for translational research from technology to clinical care. Ann Intensive Care. 2017;7(1):78. DOI: 10.1186/s13613-017-0301-6 [ Links ]
Solé A, García-Robles AA, Jordá C, Cases Viedma E, Mancheno N, Poveda-Andrés JL, et al. Salvage therapy with topical posaconazole in lung transplant recipients with invasive Scedosporium infection. Am J Transplant. 2018;18(2):504-9. DOI: 10.1111/ajt.14580 [ Links ]
Mensa J, Gatell JM, García-Sánchez JE, Letang E, López-Suñé E, Marco F. Guía terapéutica antimicrobiana. 28ª ed. Barcelona: Antares; 2018. [ Links ]
Shi S, Ashley ES, Alexander BD, Hickey AJ. Initial characterization of micafungin pulmonary delivery via two different nebulizers and multivariate data analysis of aerosol mass distribution profiles. AAPS PharmSciTech. 2009;10(1):129-37. DOI: 10.1208/s12249-009-9185-6 [ Links ]
Alexander BD, Winkler TP, Shi S, Ashley ES, Hickey AJ. Nebulizer delivery of micafungin aerosols. Pharmacotherapy. 2011;31(1):52-7. DOI: 10.1592/phco.31.1.52 [ Links ]
Clemente Bautista S, Fernández Polo A, Gil Luján G, Cabañas Poy MJ, Oliveras Arenas M, Hidalgo Albert E. Anti-infectives administration by inhalation. Farm Hosp. 2007;31(2):73-136. DOI: 10.1016/S1130-6343(07)75722-7 [ Links ]
Vaughn JM, Wiederhold NP, McConville JT, Coalson JJ, Talbert RL, Burgess DS, et al. Murine airway histology and intracellular uptake of inhaled amorphous itraconazole. Int J Pharm. 2007;338(1-2):219-24. DOI: 10.1016/j.ijpharm.2007.02.014 [ Links ]
Lowry RH, Wood AM, Higenbottam TW. Effects of pH and osmolarity on aerosolinduced cough in normal volunteers. Clin Sci (Lond). 1988;74(4):373-6. [ Links ]
Monforte V, Ussetti P, López R, Gavalda J, Bravo C, de Pablo A, et al. Nebulized liposomal amphotericin B prophylaxis for Aspergillus infection in lung transplantation: pharmacokinetics and safety. J Heart Lung Transplant. 2009;28(2):170-5. DOI: 10.1016/j.healun.2008.11.004 [ Links ]
Recibido: 13 de Febrero de 2019; Aprobado: 03 de Mayo de 2019











 text in
text in