Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.44 no.3 Toledo Mai./Jun. 2020 Epub 19-Out-2020
https://dx.doi.org/10.7399/fh.11319
Originales
Estudio piloto de monitorización terapéutica de nivolumab en la práctica clínica habitual
1Plataforma de Oncología, Hospital Quironsalud Torrevieja, Torrevieja (Alicante). Spain.
Objetivo:
Una revisión de la literatura sobre nivolumab permite verificar la existencia de diversos aspectos sin resolver sobre su intervalo de dosificación. El objetivo del presente estudio ha sido explorar las posibilidades de personalización del tratamiento con nivolumab mediante la monitorización terapéutica de sus concentraciones séricas para mejorar su efectividad y eficiencia.
Método:
Estudio observacional, prospectivo, realizado entre mayo de 2017 y junio de 2019 en pacientes tratados con nivolumab que estaban diagnosticados de diferentes tumores. Se obtuvieron muestras de sangre en la práctica clínica habitual, una vez alcanzado el estado de equilibrio de nivolumab. Las concentraciones séricas de nivolumab fueron determinadas mediante ELISA cuantitativo. La pauta posológica habitual de 3 mg/kg cada dos semanas tuvo que ser modificada en algunos pacientes debido a diferentes circunstancias, y las concentraciones séricas resultantes se compararon con las correspondientes a los pacientes en los que no se modificó y con datos publicados.
Resultados:
Se analizaron muestras de 19 pacientes que recibieron inicialmente 3 mg/kg de nivolumab cada dos semanas. Se analizó un total de 39 muestras, entre los ciclos 6 y 27. La pauta habitual se modificó, una vez alcanzado el estado de equilibrio, en 12/19 (60%) pacientes, en los que se amplió el intervalo a 3, 4, 5, 6 o 7 semanas. No se encontraron diferencias estadísticamente significativas al comparar la administración cada dos semanas y cada cuatro semanas. Cuando los intervalos fueron de seis o siete semanas, la concentración sérica media mostró una diferencia estadísticamente significativa en comparación con la administración cada dos semanas.
Conclusiones:
La información recogida parece confirmar la necesidad de explorar nuevos escenarios para personalizar la dosificación de nivolumab. Se necesitan estudios adicionales en series de mayor tamaño para confirmar esta información, correlacionarla con los resultados clíni cos y definir mejor el papel de la monitorización terapéutica, no solo por motivos económicos, sino también para mejorar la calidad de vida de los pacientes y facilitar la administración clínica del tratamiento.
PALABRAS CLAVE: Inmunoterapia; Nivolumab; Farmacocinética; Anticuerpos monoclonales; Monitorización terapéutica; Medicina personalizada
Introducción
El eje receptor de muerte programada 1/ligando del receptor de muerte programada 1 (PD-1/PD-L1) es la vía de control inmunitario más conocida. En los últimos años se han desarrollado varios anticuerpos monoclonales (AcM) dirigidos a bloquearla, potenciando así el papel del sistema inmunitario como agente terapéutico contra distintos tipos de tumores. Nivolumab, pembrolizumab y cemiplimab (inhibidores de PD-1), y atezolizumab, durvalumab y avelumab (inhibidores de PD-L1) han recibido la aprobación de las agencias reguladoras tras los resultados positivos de distintos ensayos clínicos, realizados en tumores primarios tradicionalmente considerados respondedores y no respondedores a la inmunoterapia, así como en casos de metástasis y adyuvancia1. La posibilidad de combinar estos fármacos con otros agentes antitumorales, así como las nuevas indicaciones que están siendo evaluadas por los ensayos clínicos actualmente en ejecución, hacen vislumbrar un horizonte esperanzador en este área terapéutica.
En el tratamiento del cáncer, la inmunoterapia actúa primero a través del sistema inmunitario, produciendo respuestas en ocasiones distintas de las observadas tras la quimioterapia o radioterapia2,3. Los AcM que bloquean el control inmunitario actúan sobre las células tumorales, haciéndolas sensibles a la actividad de las células efectoras del sistema inmunitario. Nivolumab es un AcM humano de tipo IgG4 que se une con alta afinidad y especificidad al receptor PD-1, bloqueando su interacción con sus ligandos naturales PD-L1 y PD-L2. La región constante de la cadena pesada de nivolumab es una IgG4 humana en cuya región bisagra se ha introducido una mutación (S228P)4. Esta mutación fue diseñada específicamente para impedir el intercambio de la porción Fab entre moléculas IgG4 endógenas y así preservar la baja afinidad frente a receptores Fc activadores característica de los anticuerpos IgG4 de tipo natural, así como un bajo nivel de actividad citolítica mediada por el complemento5.
Un estudio farmacocinético (PK) poblacional ya caracterizó el perfil PK de nivolumab en casos de cáncer de pulmón no microcítico (CPNM), carcinoma de células renales y melanoma6. Dicha caracterización se basó en un modelo lineal bicompartimental con infusión intravenosa de orden cero y eliminación de primer orden. Se desarrolló un completo modelo de covariables con el fin de evaluar los efectos de las covariables sobre los parámetros PK. El primer modelo incluyó los efectos del estado funcional inicial, el peso corporal, la tasa estimada de filtración glomerular, el sexo y la raza sobre el aclaramiento (CL) de nivolumab; y los efectos del peso corporal inicial y el sexo sobre el volumen del compartimento central. El peso corporal, el estado funcional y el nivel de albúmina sérica fueron los parámetros que más significativamente afectaron al CL y a la exposición al nivolumab, aunque es posible que el efecto del nivel de albúmina sobre el CL esté al menos en parte relacionado con el estado funcional de los pacientes6. Tras su administración intravenosa, nivolumab es objeto de una eliminación bifásica que consta de una fase rápida de distribución con una semivida terminal t1/2 (α) de 32,5 horas, y una fase de eliminación lenta con una t1/2 (β) de 25 días, una vez alcanzado el estado de equilibrio6. En el modelo final, el CL de nivolumab se reduce con el tiempo, con una reducción media máxima de los valores iniciales cercana al 25%. La raza (china, asiática, no-china, no-asiática) no demostró ejercer ningún efecto significativo sobre el CL6-8, mientras que los análisis con respecto al tipo del tumor no arrojaron resultados concluyentes8.
Recientemente las agencias reguladoras han autorizado pautas de dosis fija, independientes del peso corporal. Algunos investigadores han descubierto que las concentraciones plasmáticas medias de nivolumab durante el estado de equilibrio al administrar dosis fijas de 240 mg cada dos semanas o de 480 mg cada cuatro semanas son muy similares a las observadas al administrar la dosis de 3 mg/kg cada dos semanas utilizada en los estudios que dieron lugar a la aprobación del fármaco1-3. Estas concentraciones se alcanzaron en general al administrar la sexta dosis (12 semanas)1,6,9. La larga semivida de nivolumab, así como su mecanismo de acción, sugieren que podrían explorarse pautas de dosificación diferentes de las actualmente autorizadas. Un factor que refuerza el argumento anterior es la ausencia de una correlación demostrada y sistemática entre exposición y respuesta o toxicidad a dosis clínicamente testadas. Sin embargo, en este caso los datos disponibles no son uniformes, especialmente en lo relativo a la relación entre exposición y respuesta8,10. Las variaciones tanto en materia de exposición como de respuesta individual podrían permitir una mayor optimización del tratamiento en pacientes individuales y ayudar a reducir los elevados costes asociados con el uso de nivolumab11. La monitorización terapéutica y los biomarcadores farmacodinámicos pueden ayudar a individualizar y optimizar la dosificación de nivolumab.
El objetivo del presente trabajo fue el explorar las posibilidades de personalizar el tratamiento con nivolumab mediante monitorización terapéutica, con el fin de mejorar su efectividad y eficiencia.
Métodos
Estudio observacional prospectivo, llevado a cabo entre mayo de 2017 y junio de 2019 en pacientes con distintos tipos de tumores tratados con nivolumab.
Los pacientes recibieron inicialmente la dosis habitual de nivolumab de 3 mg/kg cada dos semanas. En algunos pacientes, una vez administradas las primeras seis dosis (y alcanzado el estado de equilibrio de nivolumab) se modificó la pauta habitual debido a distintas circunstancias, siendo las concentraciones registradas en estos pacientes comparadas con las observadas en los pacientes tratados con la pauta habitual. Considerando que la media geométrica (MG) de las concentraciones valle de nivolumab en estado de equilibrio (Cmin,ss) con esta pauta habitual fue de 57 µg/ml (según lo descrito en el dosier presentado ante la Food and Drug Administration para solicitar su aprobación)9, se adoptó la decisión de utilizar dicha concentración como nivel objetivo de referencia en el presente trabajo.
Se tomaron muestras de sangre por punción venosa en hospital de día antes de la siguiente administración del fármaco. La sangre fue procesada y analizada. Las muestras plasmáticas se obtuvieron centrifugando la sangre extraída durante 10 minutos a 3.000 rpm. Seguidamente fueron almacenadas a -80 ºC. Para la determinación, se utilizó un ELISA cuantitativo capaz de detectar ≥ 0,3 µg/ml de nivolumab libre en plasma (Shikari® Q-Nivo, Matriks Biotek, Ankara, Turquía), siguiendo las instrucciones del fabricante. Los resultados se leyeron con el lector ELISA 679ELX800 (BioTek Instruments, Inc. Winooski, WT, EE. UU.) utilizando un filtro de 450 nm y otro de referencia de 650 nm, dentro de los 30 minutos transcurridos desde la adición de la solución bloqueante.
Los resultados se expresan como la MG y el coeficiente de variación (CV) porcentual de los valores totales obtenidos en cada grupo de determinaciones, según el intervalo de administración. Se llevaron a cabo el análisis de varianza y la prueba de homogeneidad de varianzas de Levene utilizando el programa estadístico SPSS 20.0 para Windows software (IBM, Armonk, NY, EE. UU.). El umbral de significación estadística se fijó en una p < 0,05 y las comparaciones a posteriori se realizaron con las pruebas de Scheffé o de Dunnett.
El diseño del estudio recibió la aprobación del Comité de Ética de la Investigación del Hospital Quironsalud Torrevieja (referencia 1/2019). Todos los pacientes incluidos firmaron el pertinente formulario de consentimiento informado.
Resultados
Durante el transcurso del estudio se analizó el perfil PK de nivolumab en 19 pacientes con tumores sólidos tratados con 3 mg/kg cada dos semanas. La mayoría de los pacientes estudiados estaban diagnosticados de CPNM, aunque también había pacientes con otros diagnósticos, como se muestra en la Tabla 1.
Se analizaron un total de 39 muestras de sangre obtenidas entre los ciclos sexto y vigesimoséptimo de nivolumab (media por paciente ± desviación estándar: 2,05 ± 1,54). La pauta habitual de 3 mg/kg cada dos semanas se amplió en 12/19 (60%) pacientes a intervalos de 3, 4, 5, 6 ó 7 semanas, una vez alcanzado el estado de equilibrio. Esta modificación obedeció a diversas circunstancias: en cuatro casos a problemas de toxicidad (uno por fiebre, astenia, bronquitis y boca seca; uno por colitis; uno por nefritis y uno por astenia, trombocitopenia, anemia y estreñimiento) y en ocho a toxicidad financiera.
Las concentraciones plasmáticas de nivolumab tras alcanzarse el estado de equilibrio (en el sexto ciclo o más adelante), expresadas como MG (CV porcentual), fueron de 62,3 (10,3) μg/ml tras administración cada dos semanas (n = 13); 49,2 (13,3) μg/ml tras administración cada cuatro semanas (n = 12); y 36,2 (18,6) μg/ml tras administración cada cinco semanas (n = 5). No se detectaron diferencias estadísticamente significativas entre la administración de la dosis cada dos y cada cuatro semanas (p = 0,861). Los pacientes que recibían tratamiento a intervalos de tres y cinco semanas fueron excluidos del análisis debido a la escasa cantidad de muestras evaluadas. En los casos en que el tratamiento se administraba cada seis o siete semanas, la concentración plasmática media fue de 23,8 (19,8) μg/ml (n = 7), mostrando una diferencia estadísticamente significativa con respecto a la administración cada dos semanas (p = 0,047) (Tabla 2 y Figura 1).
Tabla 2. Cmin.ss (μg/ml) de nivolumab administrado a 3 mg/kg, en funcion del intervalo de dosificacion empleado

% CV: coeficiente de variacion; *: diferencias estadisticamente significativas versus 2 semanas (p < 0,05); MG: media geometrica; NS,#: sin diferencias estadísticamente significativas versus 2 semanas (p > 0,05).
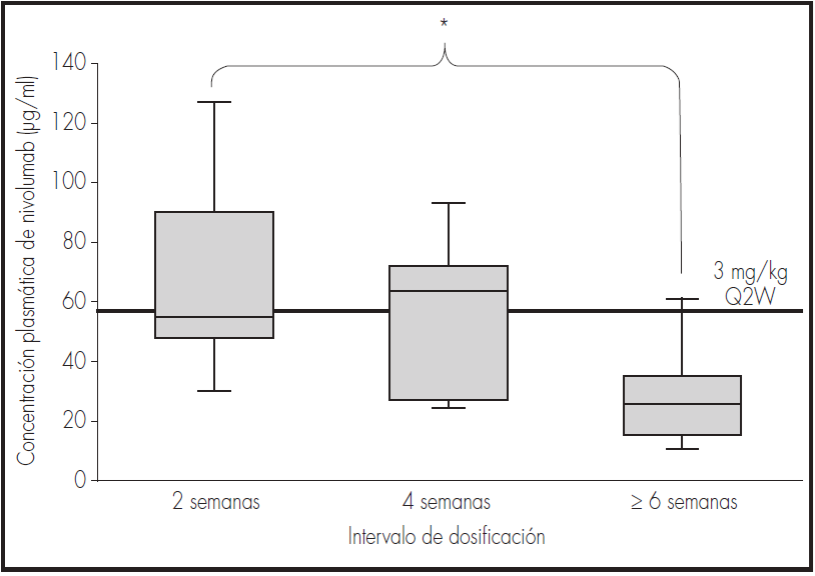
Figura 1. Cmin.ss (μg/ml) de nivolumab 3 mg/kg en funcion del intervalo de dosificacion. Los recuadros representan las medias y rangos intercuartílicos para los diferentes grupos. *: diferencias estadísticamente significativas alcanzadas versus dos semanas (p < 0,05); línea (dentro de cada recuadro): concentración media de nivolumab; línea continua "3 mg/kg Q2W": concentración sérica de nivolumab tras administración de 3 mg/kg cada dos semanas (57 μg/ml), utilizada como nivel objetivo en el presente trabajo.
Discusión
El desarrollo farmacológico en oncología ha estado tradicionalmente vinculado a la determinación de la dosis máxima tolerada (DMT), entendiéndose que existía una relación directa entre dosis y respuesta en aquellos fármacos de índice terapéutico estrecho que actúan directamente sobre las células malignas y que podrían ser responsables de toxicidades severas al acceder a tejidos sanos debido a su relativa carencia de selectividad. Sin embargo, un abordaje basado en la DMT no siempre produce resultados clínicos superiores, especialmente en el caso de las nuevas terapias dirigidas, ya que su eficacia es a menudo uniforme a dosis farmacológicamente activas por debajo de la DMT12.
Los fármacos nivolumab y pembrolizumab se conocen como AcM inhibidores del punto de control inmunitario. Su uso está avalado por una gran cantidad de datos procedentes de la experiencia clínica y preclínica. Tras un exhaustivo análisis comparativo, Fessas et al.4 llegaron a la conclusión de que ambos fármacos podrían usarse de forma indistinta y que las diferencias observadas en los resultados de los ensayos clínicos no tenían nada que ver con las características de los fármacos en sí. Los resultados combinados de nivolumab y pembrolizumab indican que las estrategias seguidas inicialmente por las compañías que los desarrollaron dieron lugar a una serie de predicciones traslacionales muy acertadas y que los análisis de concentración plasmática obtenidos a partir de casi 2.000 pacientes tratados demostraron propiedades PK similares para ambos fármacos5, avalando el uso de los datos obtenidos para uno de ellos como argumento para mejorar el uso del otro. Las fichas técnicas de ambos productos definen sus pautas de dosificación, pero la literatura refiere muchas cuestiones aún sin resolver en materia de dosificación.
En los casos en que no se ha determinado la DMT, o en los que se ha observado un fenómeno de saturación en los parámetros PK y farmacodinámicos (PD), la dosis recomendada debe basarse en el perfil PK/ PD, optándose posiblemente por una dosis fija13. Las características PD de nivolumab y pembrolizumab han sido delimitadas con bastante precisión. Para ambos, se han propuesto pautas de dosis fija, independientes del peso corporal, que han sido aceptadas por las agencias reguladoras. Al evaluar las posibilidades de mejorar las condiciones de uso, tanto para los pacientes como para los proveedores de cobertura sanitaria, se observó que una dosis fija facilitaba el manejo a nivel de la farmacia, reducía el tiempo de preparación, optimizaba el uso de los viales permitiendo un mejor aprovechamiento del fármaco y acortaba la permanencia del paciente en el hospital, mejorando su calidad de vida1,14
No obstante, y reconociendo los incuestionables beneficios de la dosis fija, quedan aún varias cuestiones por resolver. Por ejemplo, en el caso de pembrolizumab, se propuso una dosis fija de 200 mg cada tres semanas cuando se había demostrado que una dosis fija de 154 mg cada tres semanas proporcionaba una exposición (AUC) en estado de equilibrio casi idéntica a la de 2 mg/kg cada tres semanas. La adopción de la dosis de 154 mg supondría una reducción de más del 20% en la cantidad de fármaco utilizada sin afectar las tasas de respuesta14.
En este trabajo se presentan datos preliminares de los niveles plasmáticos de nivolumab en pacientes en quienes la pauta de dosificación convencional de 3 mg/kg cada dos semanas fue modificada debido a distintas circunstancias. No se observaron cambios estadísticamente significativos en la Cmin,ss cuando nivolumab se administró cada cuatro semanas, una vez alcanzado el estado de equilibrio. Las concentraciones plasmáticas medias obtenidas durante este intervalo (49,2 (13,3) μg/ml para un intervalo de administración de cuatro semanas) fueron similares a las descritas por Long et al., que compararon la exposición farmacocinética de nivolumab para la pauta de 480 mg cada cuatro semanas en 3.817 pacientes con múltiples tipos de tumor, con la exposición del fármaco para las pautas de 3 mg/kg cada dos semanas y de 240 mg cada dos semanas3, y a las analizadas por otras series recientemente publicadas1,2,15, como se muestra en la Tabla 3. La mayoría de los pacientes incluidos habían sido diagnosticados de CPNM y la CV observada se mantuvo a niveles más bajos que los descritos en estudios precedentes en el mismo contexto, probablemente debido al tamaño reducido de la muestra.
Tabla 3. Concentracion minima de nivolumab en estado de equilibrio (Cmin.ss) en distintos estudios con diferentes pautas posologicas
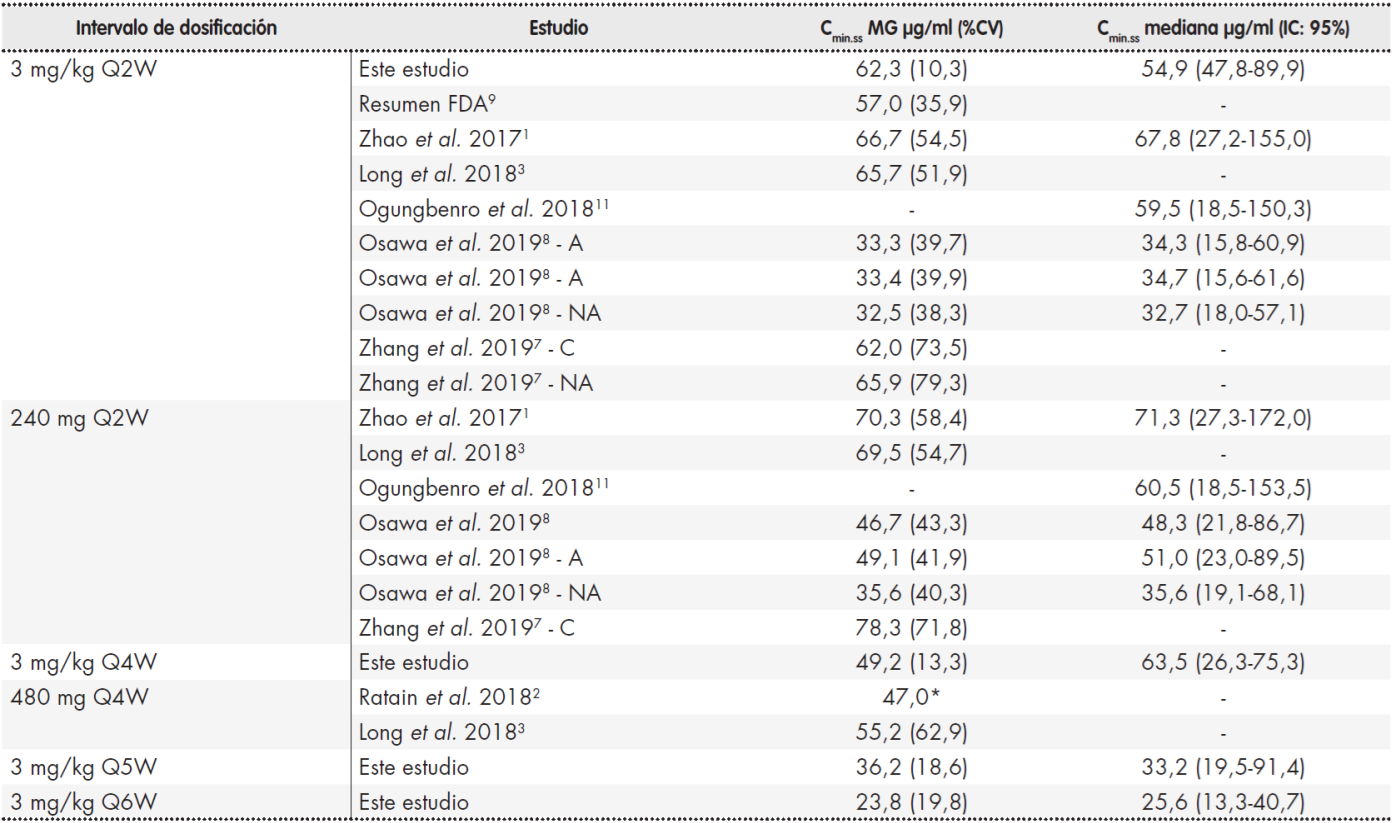
*: estimacion, no se calculo el % CV; %CV: coeficiente de variacion; A: poblacion asiatica; C: poblacion china; IC: intervalo de confianza; MG: media geometrica; NA: poblacion no asiatica.
La determinación de la DMT se ha considerado ventajosa para fármacos asociados con una gran variabilidad interindividual en materia de exposición farmacodinámica, pero con baja variabilidad intraindividual, fuerte relación exposición-respuesta, estrecha ventana terapéutica y un ensayo bioanalítico validado16. Sin embargo, la DMT podría también representar una herramienta útil para individualizar la pauta de dosificación y optimizar el tratamiento para fármacos con una ventana terapéutica amplia y coste elevado.
Diversos estudios han descrito una estrecha relación entre los perfiles PK/DK de los AcM utilizados para el tratamiento de tumores sólidos y hematológicos, lo que supone que la determinación de la DMT pudiera ser beneficiosa para estos AcM en la práctica clínica cotidiana. Según el dosier técnico presentado ante la Agencia Europea del Medicamento para tramitar su aprobación, nivolumab posee una amplia variabilidad PK, con un 50% de aclaramiento sistémico17.
Los estudios publicados sugieren que nivolumab cuenta con un perfil de seguridad aceptable incluso en poblaciones no candidatas según los criterios habituales de inclusión en los ensayos clínicos. La excepción la constituye su uso en receptores de trasplantes de órganos sólidos18 y trasplantes alogénicos de progenitores hematopoyéticos19. En situaciones como las de pacientes trasplantados, o ante los problemas clínicos que plantean los tratamientos combinados, o los pacientes que presentan variables no consideradas en los ensayos clínicos pero ampliamente difundidas en el "mundo real", y considerando el coste de los fármacos inmunomoduladores y el hecho de que no siempre están cubiertos por los sistemas sanitarios nacionales o por las aseguradoras, la DMT podría convertirse en una herramienta esencial13,20. Además de las ventajas de su uso en casos "problemáticos", la incorporación de la DMT de nivolumab a la práctica clínica cotidiana podría ayudar a mantener una concentración plasmática terapéutica con dosis más bajas o menos frecuentes, aportando un beneficio económico sin reducir la eficacia clínica.
El incremento de los costes sanitarios supone una carga evidente para los sistemas de salud de todo el mundo, que tienen el deber de ofrecer tratamientos y cuidados asistenciales de forma eficiente y sostenible11. En un artículo reciente, Ratain y Goldstein refieren que "los inhibidores del punto de control inmunitario han revolucionado el tratamiento de muchas enfermedades malignas, pero existe un creciente número de dudas acerca del coste que supone la prescripción de estos agentes"2. Otros autores también se han referido a la "toxicidad financiera" surgida en este context21. Desde el punto de vista clínico, ¿deberían los AcM inmunomoduladores considerarse terapias dirigidas, para lo cual es necesario mantener una presión de selección permanente (por ejemplo, mediante la activación del sistema inmunitario) a través de un tratamiento continuado? o ¿deberían ser considerados vacunas de las que una primera dosis de carga y alguna dosis de refuerzo posterior podrían ser suficientes para producir una respuesta inmunitaria duradera? No existe aún una respuesta unívoca a estas cuestiones. Al analizar los patrones de respuesta a los AcM anti-PD-1, pueden distinguirse cuatro grupos de pacientes (aunque algunos pacientes podrían clasificarse en más de un grupo). El primer grupo está formado por pacientes que responden rápidamente al fármaco y mantienen una respuesta completa; alrededor del 90% de ellos conservan la respuesta completa tras interrumpir el tratamiento (por problemas de toxicidad o por decisión clínica o personal). Los pacientes del segundo grupo tienen una enfermedad estable de larga duración o muestran una respuesta parcial, requiriendo la administración continuada del agente activo para mantener la respuesta. En el tercer grupo se incluyen los pacientes que muestran progresión del tumor, lo que hace que se cambie de tratamiento, como sucede en cualquier tratamiento oncológico. Por último, el cuarto grupo lo componen pacientes que experimentan una aceleración de la progresión de su enfermedad como consecuencia del tratamiento.
En cuanto al primer grupo, Khushalani et al.22 recomiendan la interrupción de la administración de anti-PD-1 en pacientes con respuesta completa que han recibido al menos seis meses de tratamiento. En el segundo grupo, los resultados preliminares del ensayo CheckMate-153 en CPNM, que evalúa la duración del tratamiento con nivolumab en pacientes con respuesta parcial o enfermedad estable, sugieren que podría ser perjudicial interrumpir la administración de nivolumab tras un año de tratamiento debido a una tasa de supervivencia libre de enfermedad a un año significativamente más baja (40% versus 65%, hazard ratio 0,42; intervalo de confianza del 95%, 0,25-0,71) y a una tendencia no estadísticamente significativa hacia una supervivencia global a un año más baja (81% versus 88%) en comparación con mantener el tratamiento hasta que la enfermedad vuelva a progresar23.
En lo relativo al cuarto grupo, es evidente la necesidad de descubrir factores predictivos que permitan evitar un tratamiento claramente perjudicial y contrario a los intereses del paciente24.
Las implicaciones farmacoeconómicas de una pauta limitada, aunque efectiva, de un inhibidor del receptor PD-1 en casos de melanoma y otros tumores son de gran calado y van mucho más allá del posible ahorro de costes y de una administración más sencilla. En una enfermedad en la que la cura se ha convertido en una realidad para un gran número de pacientes con enfermedad avanzada, la posibilidad de que los pacientes puedan retomar sus actividades laborales debe tenerse en consideración22.
El reducido tamaño de la muestra, la falta de análisis de correlaciones clínicas (eficacia y toxicidad) y el hecho de que se trate de un análisis observacional no aleatorizado constituyen las principales limitaciones de este estudio. Antes de establecer un cambio de paradigma, es preciso confirmar los datos obtenidos con estudios que incluyan series de pacientes más numerosas y que correlacionen sus hallazgos con resultados clínicos. Los nuevos estudios deberán asimismo centrarse en la optimización de la dosificación de AcM inhibidores de las vías inmunitarias y definir el papel de la DMT y los biomarcadores en el tratamiento, no solo por motivos financieros, sino por cuestiones relativas a la calidad de vida y el manejo clínico de los pacientes.
En cualquier caso, este estudio sí confirma las sospechas anteriores sobre la posibilidad de mejorar la dosificación de nivolumab mediante la exploración de nuevos escenarios y la personalización del tratamiento.
REFERENCIAS
1. Zhao X, Suryawanshi S, Hruska M, Feng Y, Wang X, Shen J, et al. Assessment of nivolumab benefit-risk profile of a 240-mg flat dose relative to a 3-mg/kg dosing regimen in patients with advanced tumors. Ann Oncol. 2017;28(8):2002-8. [ Links ]
2. Ratain MJ, Goldstein DA. Time is money: Optimizing the scheduling of nivolumab. J Clin Oncol. 2018;36(31):3074-6. DOI: 10.1200/JCO.18.00045 [ Links ]
3. Long GV, Tykodi SS, Schneider JG, Garbe C, Gravis G, Rashford M, et al. Assessment of nivolumab exposure and clinical safety of 480 mg every 4 weeks flat-dosing schedule in patients with cancer. Ann Oncol. 2018;29(11):2208-13. [ Links ]
4. Fessas P, Lee H, Ikemizu S, Janowitz T. A molecular and preclinical comparison of the PD-1-targeted T-cell checkpoint inhibitors nivolumab and pembrolizumab. Semin Oncol. 2017;44(2):136-40. [ Links ]
5. Garrido MJ, Berraondo P, Trocóniz IF. Commentary on pharmacometrics for immunotherapy. CPT Pharmacometrics Syst Pharmacol. 2017;6(1):8-10. [ Links ]
6. Bajaj G, Wang X, Agrawal S, Gupta M, Roy A, Feng Y. Model-based population pharmacokinetic analysis of nivolumab in patients with solid tumors. CPT Pharmacometrics Syst Pharmacol. 2017;6(1):58-66. [ Links ]
7. Zhang J, Cai J, Bello A, Roy A, Sheng J. Model-based population pharmacokinetic analysis of nivolumab in Chinese patients with previously treated advanced solid tumors, including non-small cell lung cancer. J Clin Pharmacol. 2019;59(10):1415-24. [ Links ]
8. Osawa M, Hasegawa M, Bello A, Roy A, Hruska M. Population pharmacokinetics analysis of nivolumab in Asian and non-Asian patients with gastric and gastroesophageal junction cancers. Cancer Chemother Pharmacol. 2019;83(4):705-15. [ Links ]
9. Food and Drug Administration. Center for Drug Evaluation and Research. Clinical Pharmacology BLA Review. Opdivo (nivolumab) 2014 (accessed 01/22/2020). Available at: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2014/ 125554Orig1s000ClinPharmR.pdf [ Links ]
10. Hukmans D, Basak E, van Dijk T, Mercieca D, Schreurs M, Wijkhuijs A, et al. A prospective cohort study on the pharmacokinetics of nivolumab in metastatic nonsmall cell lung cancer, melanoma, and renal cell cancer patients. J Immunother Cancer. 2019(1);7:192. [ Links ]
11. Ogungbenro K, Patel A, Duncombe R, Nuttall R, Clark J, Lorigan P. Dose rationalization of pembrolizumab and nivolumab using pharmacokinetic modeling and simulation and cost analysis. Clin Pharmacol Ther. 2018;103(4):582-90. [ Links ]
12. De Greef R, Elassaiss-Schaap J, Chatterjee M, Turner DC, Ahamadi M, Forman M, et al. Pembrolizumab: role of modeling and simulation in bringing a novel immunotherapy to patients with melanoma. CPT Pharmacometrics Syst Pharmacol. 2017;6(1):5-7. [ Links ]
13. Postel-Vinay S, Aspeslagh S, Lanoy E, Robert C, Soria JC, Marabelle A. Challenges of phase 1 clinical trials evaluating immune checkpoint-targeted antibodies. Ann Oncol. 2016;27(2):214-24. [ Links ]
14. Freshwater T, Kondic A, Ahamadi M, Li CH, de Greef R, de Alwis D, et al. Evalua tion of dosing strategy for pembrolizumab for oncology indications. J Immunother Cancer. 2017;5:43. [ Links ]
15. Basak EA, Koolen SLW, Hurkmans DP, Schreurs MWJ, Bins S, Oomen-de Hoop E, et al. Correlation between nivolumab exposure and treatment outcomes in non- small-cell lung cancer. Eur J Cancer. 2019;109:12-20. [ Links ]
16. Centanni M, Moes D, Trocóniz I, Ciccolini J, van Hasselt J. Clinical pharmacokinetics and pharmacodynamics of immune checkpoint inhibitors. Clin Pharmacokinet. 2019;58(7):835-57. [ Links ]
17. Puszkiel A, Noé G, Boudou-Rouquette P, Cossec CL, Arrondeau J, Giraud JS, et al. Development and validation of an ELISA method for the quantification of nivolumab in plasma from non-small-cell lung cancer patients. J Pharm Biomed Anal. 2017;139:30-6. [ Links ]
18. Gormley NJ, Pazdur R. Immunotherapy combinations in multiple myeloma- known unknowns. N Engl J Med. 2018(19);379:1791-5. [ Links ]
19. Balar AV, Weber JS. PD-1 and PD-L1 antibodies in cancer: current status and future directions. Cancer Immunol Immunother. 2017;66(5):551-64. [ Links ]
20. Johnson DB, Sullivan RJ, Menzies AM. Immune checkpoint inhibitors in challenging populations. Cancer. 2017;123(11):1904-11. [ Links ]
21. Renner A, Burotto M, Rojas C. Immune checkpoint inhibitor dosing: can we go lower without compromising clinical efficacy? J Glob Oncol 2019 Jul;5:1-5. DOI: 10.1200/JGO.19.00142. [ Links ]
22. Khushalani NI. Duration of anti-programmed death-1 therapy in advanced melanoma: how much of a good thing is enough? J Clin Oncol. 2018;36(17): 1649-53. [ Links ]
23. Salati M, Baldessari C, Cerbelli B, Botticelli A. Nivolumab in pretreated non-small cell lung cancer: continuing the immunolution. Transl Lung Cancer Res. 2018;7(Suppl 2):S91-4. [ Links ]
24. Kato S, Goodman A, Walavalkar V, Barkauskas DA, Sharabi A, Kurzrock R. Hyper- progressors after immunotherapy: analysis of genomic alterations associated with accelerated growth rate. Clin Cancer Res. 2017;23(15):4242-50. [ Links ]
Financiación: El proyecto se ha financiado en parte mediante contribución de la Fundación TEDECA (www.fundaciontedeca.org)
Aportación a la literatura científica:
Nivolumab es uno de los agentes de mayor relevancia en la oncología actual. Aunque su ficha técnica contiene pautas de dosificación bien definidas, una revisión de la literatura desvela la existencia de muchas cuestiones aún sin resolver en materia de posología.
En este trabajo, las concentraciones plasmáticas de nivolumab en pacientes tratados con una pauta de dosificación estándar (3 mg/kg cada dos semanas) no mostraron diferencias estadísticamente significativas con respecto a las concentraciones en pacientes que recibían la dosis cada cuatro semanas. Al tratarse de datos preliminares, se requiere la realización de estudios a mayor escala para confirmar los resultados obtenidos.
Recibido: 11 de Septiembre de 2019; Aprobado: 29 de Enero de 2020











 texto em
texto em