Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.44 no.5 Toledo sep./oct. 2020 Epub 26-Jul-2021
https://dx.doi.org/10.7399/fh.11390
REVISIÓN
Farmacología clínica de cannabidiol en epilepsias refractarias
1Precision Medicine, Hospital de Pediatría JP Garrahan, Buenos Aires. Argentina.
2National Scientific and Technical Research Council, Buenos Aires. Argentina.
3Pharmaceutical Science Department, School of Chemistry, Universidad de La República, Montevideo. Uruguay.
4Unit of Clinical Pharmacokinetics, Pharmacy, Hospital de Pediatría JP Garrahan, Buenos Aires. Argentina.
Introducción
Cannabis sativa ha sido una herramienta importante en el arsenal terapéutico de los herbolarios y la farmacopea médica durante siglos, pero solo desde principios de la década de 1990 la ciencia ha proporcionado una mejor comprensión de sus usos terapéuticos1,2. En el transcurso de los años se observa un incremento notable en el estudio de los mecanismos de acción de los cannabinoides (CB) principalmente en modelos preclínicos. Sin embargo, existen escasos reportes de casos clínicos que hayan sido adecuadamente monitorizados y aún menos estudios clínicos de eficacia, efectividad o seguridad3. Todo esto hace que el equipo de salud, incluyendo especialmente al farmacéutico clínico, deba cumplir un rol fundamental en la utilización adecuada de estas preparaciones que contienen CB tales como cannabidiol (CBD) y tetrahidrocannabinol (∆9-THC)4. En este marco, es posible estimar que en los próximos años la expansión de usos de CB será notablemente pronunciada, situación que demanda que el profesional de la salud cuente con la formación requerida en relación con la farmacología de los CB para la correcta toma de decisions4.
Respecto al CBD, la condición fisiopatológica para la cual se prescribe con mayor frecuencia es la epilepsia refractaria o resistente a otros tratamientos farmacológicos, existiendo diversos estudios clínicos que abordan la efectividad y seguridad de este tratamiento, principalmente desarrollados en niños5-10. Sin embargo, los datos referentes a los eventos adversos asociados a su uso son todavía incipientes, situación que incluso puede derivar en la discontinuación de un tratamiento farmacológicamente efectivo. Por ello, es fundamental contar con dicho conocimiento para un manejo clínico correcto del tratamiento del paciente4. Asimismo, el CBD, en su uso clínico de rutina, normalmente es administrado en situaciones en las que los pacientes también reciben otros fármacos y alimentos que puede generar interacciones, a partir de lo que podría surgir tanto falta de eficacia como toxicidad de los CB o de los fármacos administrados concomitantemente3.
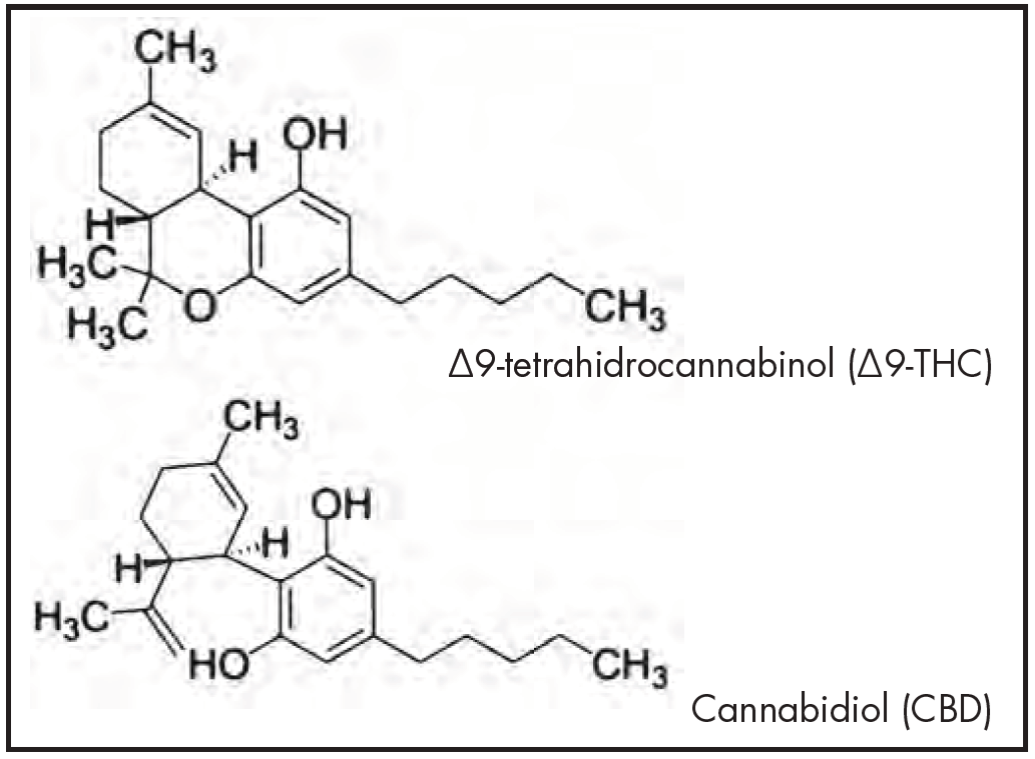
En cuanto a la farmacología, C. sativa contiene más de 500 componentes representados por flavonas, terpenos y CB, habiéndose identificado también carbohidratos, ácidos grasos y sus ésteres, amidas, aminas y fitosteroles11. Al menos 100 compuestos CB son farmacológicamente activos3,12,13. El CBD y el ∆9-THC son, tanto desde lo cuantitativo como desde el punto de vista de las actividades farmacológicas demostradas, los principales CB de C. sativa (Figura 1). Los ácidos CB, presentes como metabolitos primarios en las plantas de C. sativa, aunque pueden poseer algunas actividades farmacológicas, no producen efecto psicotrópico significativo. El ácido cannabidiólico (CBDA) y el ácido tetrahidrocannabinol (THCA) son los precursores naturales del CBD y de ∆9-THC, los que se transforman por exposición a los rayos ultravioleta, al calor o almacenamiento prolongado2,13. En la comprensión de la farmacología de los CB fue de gran importancia el descubrimiento de los CB endógenos o endocannabinoides como la anandamida, los receptores CB y las enzimas reguladoras, lo que se conoce en conjunto actualmente como sistema endocannabinoide14. Este sistema ejerce funciones homeostáticas reguladoras en el cerebro, la piel, el tracto digestivo, el hígado, el sistema cardiovascular, la función genito-
urinaria e incluso la ósea.
Los receptores de membrana celular acoplados a proteína G, hoy conocidos como CB1 y CB2, difieren en su distribución y participación biológica. Los receptores CB1 predominan en el sistema nervioso central y periférico, con una expresión menos pronunciada en otros tejidos (bazo, amígdalas, tracto gastrointestinal, útero, próstata, glándulas suprarrenales), mientras que los receptores CB2 se encuentran predominantemente en el sistema inmune con menor representación en los sistemas nerviosos central y periférico y en el tracto gastrointestinal13-15. Las funciones de estos receptores también difieren entre sí: mientras los CB1 están implicados en la regulación central de la ingesta de alimentos, la respuesta a la novedad y al estrés, el comportamiento adictivo, la regulación de la actividad hepática y gastrointestinal, el olfato y la actividad cardiovascular, los CB2 estarían involucrados en la regulación inmune, neurodegeneración y en menor medida, en la participación en el procesamiento de recompensas y del comportamiento adictivo16. El receptor CB1 cerebral es a través del cual el THC ejerce sus principales efectos psicoactivos1.
Es evidente que no todas las acciones de los CB están mediadas por receptores CB1 y CB2, participando asimismo los receptores 18 y 55 acoplados a proteína G (GPR18 y GPR55), el receptor de potencial transitorio vanilloide subtipo 1 (TRPV1) y los receptores activados por proliferadores de peroxisomas alfa y gamma (PPARα y PPARγ)13,15,17-19. Es decir, el CBD es una sustancia no psicoactiva que está involucrada en la modulación de diferentes receptores por fuera del sistema endocannabinoide y estas interacciones ponen en evidencia sus propiedades antiepilépticas, antiinflamatorias, analgésicas y ansiolíticas19-22.
En particular, en el tratamiento de la epilepsia el mecanismo de acción del CBD aún no se comprende con claridad. El CBD, que es el compuesto que parece resultar más activo para tratar esta condición, se une a más de 65 objetivos moleculares y en la mayoría de los estudios experimentales requiere de una concentración que no se alcanzaría en el cerebro humano22. Además, no debe descartarse que exista algún aporte antiepiléptico por parte del THC mediado por la activación de receptores CB1(19.23). Dentro de los principales objetivos moleculares del CBD se incluyen los canales de calcio voltaje-dependientes. Estos canales están involucrados en la regulación de la excitabilidad neuronal y su interacción con CBD causa su bloqueo, lo cual podría explicar la acción antiepiléptica24. La acción agonista de CBD con el TRPV1 determina una desensibilización de estos canales con la consiguiente normalización de calcio intracellular24. En cuanto a los receptores de serotonina, los subtipos 5-HT1A y 5-HT2A podrían representar un objetivo terapéutico válido del CBD19,24. Otros receptores relacionados con la actividad de CBD en epilepsia incluyen los canales iónicos activados por glicina, el GPR55, el receptor para el ácido γ-aminobutírico tipo A (GABAA), la modulación de la adenosina, la proteína del canal selectivo de aniones dependiente de voltaje (VDAC1) y la liberación del factor de necrosis tumoral alfa (TNFα)21,25-27. Adicionalmente, el CBD parece generar acciones anticonvulsivas a través del bloqueo de los receptores opioides µ y δ24. El CBD también parece tener un efecto antiinflamatorio en el sistema nervioso al disminuir las funciones proinflamatorias y la señalización en los astrocitos para prevenir el aumento de las citocinas inflamatorias (IL-6) en los modelos animales de epilepsia. Sin embargo, el papel que juega la inflamación neural en el inicio y el mantenimiento de
las convulsiones continúa bajo investigación19. Asimismo, otros CB como el cannabicromeno y los homólogos de propilo de ∆9-THC y CBD (respectivamente, ∆9-tetrahidrocannabivarina y cannabidivarina) también demostraron actividad en el sistema nervioso central pero su farmacología molecular y los mecanismos de acción son menos conocidos20.
El CBD puede modular algunos de los efectos del ∆9-THC, ya que reduce la psicoactividad del ∆9-THC, mejorando su tolerabilidad y ampliando así su ventana terapéutica. Incluso, el CBD podría contrarrestar algunas de las acciones psicoactivas de la activación de CB1 en el cerebro, posiblemente mediante la mejora indirecta de la actividad de los receptores de adenosina A1. Esto puede explicar en parte por qué los usuarios de preparaciones de cannabis que contienen una alta relación de cantidad de CBD respecto de ∆9-THC tienen menos probabilidades de desarrollar síntomas psicóticos que aquellos que consumen preparaciones en los que esta relación es baja. Estos y otros mecanismos de acción del CBD pueden contribuir al efecto llamado "séquito" entre el CBD y el THC y la capacidad del CBD para reducir los efectos secundarios psicoactivos del THC16,20. Asimismo, el CBD puede complementar los efectos antiespasmódicos del ∆9-THC20.
La terapéutica con CBD involucra la administración frecuente y continua del fármaco durante un tratamiento crónico. La farmacocinética de CBD es altamente variable respecto de la vía de administración que se utilice, el tipo de producto y los fármacos concomitantes administrados, las condiciones patológicas del paciente e incluso la administración de comidas y bebidas, entre otros factores. Es por ello, que en este trabajo sólo se contempla la farmacocinética y farmacodinamia de CBD contenido en productos aprobados por autoridades sanitarias. Esta situación permite suponer que al ser elaborados bajo procedimientos de buenas prácticas de producción, ser conocida y reproducible la composición del producto, se asegura que la variabilidad en la farmacocinética o la seguridad y eficacia no dependa de las características farmacotécnicas del producto.
Además, es importante notar que la farmacocinética de CBD varía según la especie animal. Es por ello que debe tenerse en cuenta este factor cuando se realizan los estudios, para no extrapolar directamente al humano y obtener conclusiones erróneas28.
Así entonces, el presente trabajo desarrolla una revisión del estado actual de la farmacología del CBD, con especial énfasis en la farmacocinética, interacciones y eventos adversos asociados a su uso en epilepsias refractarias, brindando herramientas fundamentales para la atención clínica.
Métodos
Para realizar la presente revisión se analizaron estudios preclínicos y de cohortes de pacientes adultos y pediátricos, habiéndose revisado las bases de datos PubMed y LILACS a diciembre de 2019. Se utilizaron los siguientes términos MeSH: "cannabidiol", "pharmacokinetics", "bioavailability", "adverse drug events", "drug interactions" y términos libres en español. Asimismo, se consideraron los siguientes filtros disponibles en PubMed, aplicados de manera secuencial, aditiva y alternativa: "Other animals", "Humans", "Clinical trials", "Adults: +19 years" y "Child: birth-18 years". A los fines de analizar parámetros farmacocinéticos y farmacodinámicos de CBD y su relación, se consideraron sólo aquellos que fuesen estudios originales realizados in vitro, en modelos animales y población humana pediátrica o adulta, según corresponda para cada variable analizada, y siempre que estuviese disponible el manuscrito en su formato de texto completo.
Resultados
Se encontraron un total de 2.783 artículos acerca de CBD, de los cuales 61 cumplían con los criterios de selección ampliados. Finalmente, 31 artículos fueron trabajos originales in vitro, en humanos o en animales y se incluyeron en la presente revisión.
Farmacocinética
En cuanto a la absorción del CBD, ésta es rápida y se alcanzan concentraciones plasmáticas luego de 0,5 a 6 horas tras su administración en adultos y niños29-34. En un estudio en voluntarios adultos se analizó el comportamiento de CBD tras dosis únicas y ascendentes entre 1.500 y 6.000 mg, alcanzándose la concentración máxima en plasma (Cmáx) entre 3 a 5 horas (Tmáx) de su administración independientemente de la dosis30. Asimismo, se constató que CBD responde a una cinética no lineal a partir de la dosis de 4.500 mg (aproximadamente 64 mg/kg/día, considerando 70 kg de peso promedio del adulto), ya que tanto el Cmáx como el área bajo la curva definida por la concentración en función del tiempo (ABC) mostraron aumentos menores que los proporcionales al aumento de dosis. Como no se registraron diferencias en la semivida de eliminación con las distintas dosis de CBD, los resultados de este trabajo sugieren que la causa de este comportamiento es la disminución de la biodisponibilidad con dosis crecientes de CBD30. En niños se observó un incremento lineal en la exposición sistémica de CBD entre las dosis de 10 y 40 mg/kg/día7.
Frente a la administración repetida de 750 mg o 1.500 mg de CBD cada 12 horas se alcanzó el estado estacionario luego de 2 a 4 días, observándose el Tmáx del CBD y de los metabolitos cercano a 3 horas, independientemente de la dosis. En esta cohorte de voluntarios evaluados a dosis múltiples de 750 y 1.500 mg se observó la acumulación de CBD entre dos y tres veces y al duplicar la dosis de CBD se incrementó la exposición sistémica al doble, lo cual se corresponde con farmacocinética lineal en el rango de dosis evaluado30. Otro dato interesante de este estudio fue que la exposición sistémica de CBD administrado por la noche fue entre dos y seis veces mayor que el valor registrado luego de la toma por la mañana (obtenida tras la administración de CBD en ayuno de 8 a 12 horas), posiblemente debido a un efecto postprandial y de cronofarmacocinética. Si bien no existe un estudio acerca de la biodisponibilidad oral de CBD, se estima que ésta es baja (6-10%) debido al efecto de primer paso mediado principalmente por la enzima CYP3A4, la subfamilia P450 más abundante expresada en el intestino delgado que funciona como barrera frente a los xenobióticos35-37. Además, la alta hidrofobicidad del CBD, y por lo tanto baja solubilidad en los fluidos gastrointestinales, justifica la baja biodisponibilidad oral de CBD37.
Estudios incipientes ponen en evidencia la influencia de los alimentos en la biodisponibilidad de CBD. Así, el trabajo publicado por Zgair et al. muestra el aumento en la biodisponibilidad oral de CBD en modelos animales al administrar junto a una comida rica en lípidos probablemente por favorecer la absorción de CBD mediada por el transporte linfático intestinal35. En adultos sanos, distintos estudios mostraron que la administración de una dosis de 300, 750 o 1.500 mg de CBD junto con la ingesta de una comida hipercalórica rica en grasas resultó en un incremento de cuatro veces la exposición sistémica al fármaco respecto de su administración en ayunas30,32,33. Algunos autores incluso reportan que la variabilidad en las concentraciones plasmáticas de CBD fue menor luego de la administración con comidas30. Ademas, la administración de 750 mg de CBD junto con una comida baja en calorías o bien con leche derivó asimismo en el incremento de la biodisponibilidad del CB entre tres y cuatro veces dada la reducción en el volumen de distribución aparente (Vd/F) y el clearance aparente (Cl/F) pero no así de la semivida de eliminación (t1/2)33. Por todo lo antedicho, se infiere que la administración de CBD junto con la ingesta de alimentos implica un aumento en su biodisponibilidad. Una explicación plausible implica que la comida rica en grasas incrementa el tiempo de tránsito gastrointestinal y estimula la secreción de ácidos biliares que emulsionan las grasas o los compuestos hidrofóbicos, favoreciendo la disolución y absorción de CBD. No obstante, sería sumamente interesante estudiar si este incremento en la biodisponibilidad se relaciona con una mejora en el control del desarrollo de convulsiones sin alterar la frecuencia de aparición de eventos adversos.
No es de descartar el rol que pueden tener las bombas de eflujo como son los transportadores dependientes de ATP en la biodisponibilidad y disposición de fármacos39.
Como el CBD es poco soluble en agua y está sujeto a un extenso metabolismo de primer paso en el tracto gastrointestinal, una vía alternativa para incrementar la velocidad de absorción y mejorar la biodisponibilidad es la administración sublingual40,41. Esta vía de administración pasa por alto el metabolismo de primer paso, de modo que el principio activo pasa directamente al torrente sanguíneo. Igualmente puede conducir a una biodisponibilidad disminuida dada la existencia de una glándula salival debajo de la lengua que se estimula por las formulaciones sublinguales, lo que resulta difícil para los pacientes evitar tragar y por ende podría conducir a una biodisponibilidad disminuida similar a la ingesta oral42.
En cuanto a la distribución, tanto el CBD como sus metabolitos se unen fuertemente a proteínas plasmáticas (> 95%) y están principalmente unidos a lipoproteínas de baja densidad, con hasta un 10% de presencia en los glóbulos rojos y solo un 2-3% como fármaco libre20,43-47. Dada su naturaleza lipofílica, se distribuye ampliamente en el organismo, en primera instancia en órganos de alta irrigación sanguínea, luego en tejidos menos vascularizados y finalmente en la grasa corporal, siendo este último un lugar de almacenamiento a largo plazo. Esta preferencia por los tejidos grasos aumenta la posibilidad de acumulación formando depósitos tras la administración crónica, especialmente en los pacientes con alta adiposidad. Los CB atraviesan la placenta y se excretan por la leche materna durante la lactancia. En estudios en animales gestantes, las concentraciones plasmáticas de CB en el feto fueron un 10% de las maternas48,49.
En adultos sanos que recibieron una dosis entre 1.500 y 6.000 mg de CBD el Vd/F resulta en valores altos comprendidos entre 1.111-1.909 l, lo que constata el elevado volumen de distribución del fármaco30. Si bien no existe información acerca de las concentraciones de CBD en los distintos tejidos humanos, luego de su administración oral en ratas se observó que la concentración en el cerebro de los animales fue el 30% de aquella alcanzada en sangre, mostrando una distribución homogénea en las distintas regiones cerebrales50,51.
A partir de estudios realizados en modelos in vitro de hígado humano se propone que los procesos enzimáticos responsables del metabolismo del CBD involucran la oxidación mediada por las isoenzimas de la familia de citocromos P450 (CYP) CYP2C19, CYP3A4 y en menor medida CYP1A1, CYP1A2, CYP2C9, CYP2D6 y CYP3A5, así como la actividad de glucuroniltransferasa de la uridinadifostato glucuronidasa (UGT) UGT1A7, UGT1A9 y UGT2B752,53. Estas reacciones involucran la oxidación de la molécula hacia la formación de 7-OH-CBD y modificaciones ulteriores que resultan en la formación de más de 100 metabolitos identificados en distintos organismos54. La enzima CYP2C19 media la formación del metabolito farmacológicamente activo 7-OH-CBD. Este es, a su vez, transformado por el CYP3A4 al compuesto inactivo pero mayoritario en sangre de humanos, el 7-COOH-CBD30-33,52-54. Además, el CBD se metaboliza en menor medida a 6-OH-CBD a través de las enzimas CYP2C19 y CYP3A, al igual que a otros metabolitos inactivos a través de las enzimas CYP1A y CYP354-58. Es importante señalar que si bien los metabolitos mayoritarios son el 6-OH, 7-OH y 7-COOH-CBD, el perfil de metabolitos difiere entre especies animales y, por lo tanto, la extrapolación al humano de los resultados obtenidos en animales debe realizarse con cautela. La eliminación del CBD intacto, el glucurónido de CBD y los metabolitos solos o conjugados se produce principalmente por vía fecal, siendo la vía renal de menor importancia57. Hace más de tres décadas, en un estudio realizado en voluntarios adultos sanos que recibieron una inyección endovenosa de 20 mg de CBD deuterado se determinó que el clearance de CBD fue de 960-1.560 ml/min y la semivida de eliminación de 24 horas58,59. El 16% del total eliminado se recolectó en orina y correspondió a CBD como molécula intacta, y en menor proporción a los conjugados de CBD. En las heces se encontró el 33% de los productos eliminados principalmente como CBD inalterado y en menor proporción, los metabolitos mono y dihidroxilados, los derivados carboxílicos y los conjugados glucurónidos59.
Tras la administración oral de CBD, en distintos trabajos realizados en adultos se referenciaron valores de Cl/F entre 6 y 20 l/h/kg independientemente de la dosis, lo que sugiere una importante eliminación del fármaco30-33. En niños, hasta el momento de la presente revisión, sólo existe un estudio luego de la ingesta de aceite de CBD, habiéndose referenciado valores de Cl/F de 24 a 38 l/h/kg para todos los pacientes, ya reciban CBD o CBD con clobazam7. Es importante señalar que en adultos con alteración hepática severa el Cl/F fue sólo de 0,3 l/h/kg, tal como se discute en el apartado siguiente60.
Para fármacos como el CBD que muestran una distribución a nivel del tejido adiposo amplia, lo que resulta en una disminución multiexponencial en la concentración plasmática, la t1/2 comúnmente calculada puede resultar engañosa, ya que el equilibrio entre las concentraciones en plasma y tejido adiposo se alcanza lentamente. Este hecho explica los valores disímiles de t1/2 de CBD referenciados en la literatura tanto en adultos como en niños luego de dosis única o múltiples que oscilan entre 14 y 60 horas7,30-33.
Farmacocinética en la disfunción hepática
Como se mencionó, el metabolismo de CBD es principalmente hepático, por lo que es de suponer que alteraciones en la funcionalidad de este órgano afecten a la farmacocinética del CBD. Recientemente se referenció el efecto de la disfunción hepática en la farmacocinética de CBD en adultos con función hepática normal o con alteraciones leves, medianas y severas60. La exposición sistémica a CBD se incrementó entre dos y cinco veces cuanto mayor fue la severidad de la disfunción hepática. Asimismo, se incrementó la t1/2 y disminuyó consecuentemente el Cl/F en los pacientes con mayor compromiso hepático. En cuanto a los metabolitos, la exposición sistémica a 6-OH y 7-OH-CBD se incrementó a mayor disfunción hepática. Por el contrario, la exposición sistémica a 7-COOH-CBD disminuyó en pacientes con compromiso hepático severo, dada probablemente la reducción en la capacidad metabólica. A propósito de estos resultados, la ficha técnica de Epidiolex®, medicamento que contiene como principio activo CBD, recomienda el ajuste de dosis en pacientes con disfunción hepática moderada y severa43. Estos resultados denotan la necesidad de realizar la monitorización cercana de los pacientes con disfunción hepática.
Farmacocinética en pediatría
Tras la administracion de una dosis de 1,25 mg/kg/día de CBD en pacientes pediátricos con epilepsias refractarias, la Cmáx fue aproximadamente 30 ng/ml y el Tmáx de 2,5 horas5. En ese mismo estudio, la administración de dosis repetidas de 5, 10 o 20 mg/kg/día resultó en una Cmáx media de CBD de 130 ng/ml, 242 ng/ml y 380 ng/ml, respectivamente, lo cual demuestra el incremento lineal en la exposición sistémica a CBD respecto de la dosis en el rango de estudio. No obstante, los autores reportaron una variabilidad en el ABC de entre 20 y 120%. El metabolito mayoritario fue el 7-COOH-CBD, con una exposición entre 12 y 17 veces mayor respecto de aquella de CBD, mientras que la exposición sistémica a 6-OH-CBD fue menor al 6%. El cociente entre la exposición de 6-OH-CBD y CBD se mantuvo constante en el tiempo de tratamiento para los tres niveles de dosis pero no así para aquel entre el ABC de 7-COOH-CBD y de CBD, lo que muestra la importancia de la vía metabólica del CBD hacia 7-COOH-CBD y la acumulación de este metabolito.
En otro estudio de farmacocinética en pediatría7 tras la administración durante 10 días de una formulación farmacéutica sintética de CBD diferente a la del estudio anteriormente discutido y a dosis de 10, 20 y 40 mg/kg/día bid, se observó un incremento proporcional en la exposición del CB respecto de la dosis administrada. Los valores medios de Cmáx reportados para cada dosis fueron 120 ng/ml, 220 ng/ml y 427 ng/ml, respectivamente, lo que apoya la suposición de linealidad en la farmacocinética de CBD. Sin embargo, estos valores de Cmáx son prácticamente el doble de lo reportado en el estudio pediátrico publicado por Devinsky et al.5, lo cual puede atribuirse al número de muestras obtenido para caracterizar el perfil cinético y a la diferencia entre las formulaciones de CBD estudiadas. Además, los autores reportan una t1/2 de CBD entre 20 y 30 horas, independientemente de la dosis, apo-
yando la hipótesis de cinética lineal. Es importante señalar que los autores reportaron una alta variabilidad interindividual en la farmacocinética del CBD y, en particular, menores concentraciones de CBD en los niños menores de dos años respecto de los otros grupos de pacientes pediátricos. Estos resultados nos llevan a enfatizar la necesidad de caracterizar la farmacocinética del CBD para cada producto comercializado y a la monitorización de CBD para adecuar la dosis según los requerimientos individuales y del grupo etario.
Interacciones farmacológicas
Las interacciones entre fármacos pueden ser aditivas, sinérgicas o antagónicas, lo que puede llevar a una respuesta terapéutica alterada (fallo terapéutico o toxicidad). Las interacciones farmacocinéticas se presentan principalmente por ser el CBD un fármaco que se metaboliza ampliamente por las enzimas del CYP450 y, por ende, la administración concomitante de fármacos inductores o inhibidores de las isoenzimas que participan de la biotransformación de CBD modificarán su exposición sistémica. Es importante enfatizar que pueden existir distintos tipos y grados de interacción entre los fármacos administrados conjuntamente y los productos que contienen CBD comercializados en el mercado, más aún cuando en múltiples casos éstos no corresponden a medicamentos aprobados por la autoridad sanitaria y su composición y pureza son desconocidas. Así, si la concentración de CBD en el producto es más baja o alta que la referenciada en su información, puede no manifestarse la interacción o, por el contrario, ser notablemente mayor a la registrada para productos con CBD de grado farmacéutico. Por ello, aquí solo se abordan las interacciones evidenciadas en estudios que utilizaron productos farmacéuticos de CBD.
En voluntarios adultos se evaluaron las interacciones entre Sativex® (composición: CBD y THC en proporción 1:1) y rifampicina, ketoconazol u omeprazol. La administración de dosis repetidas de rifampicina, conocido inductor de CYP3A4 y CYP2C19, resultó en la reducción al 50% en la exposición sistémica de CBD (y de THC) y el incremento del Cl/F, mientras que la administración concomitante con ketoconazol (inhibidor de CYP3A4) derivó en un incremento del 100% en la exposición sistémica de CBD. Los inhibidores moderados del CYP2C19 como el omeprazol no mostraron efecto en la farmacocinética de CBD61,62.
La actividad inhibitoria in vitro de CBD sobre el CYP2C19 se traslada a la clínica de pacientes con encefalopatías epilépticas dada la frecuente administración conjunta de CBD y clobazam (CLB). La biotransformación del CLB involucra la desmetilación del compuesto resultando en el metabolito activo N-desmetil-clobazam (N-CLB), reacción catalizada por las enzimas CYP3A4, CYP2C19 y CYP2B6. Posteriormente, N-CLB se hidroxila al metabolito inactivo 4´-OH-N-CLB a través del CYP2C1963. Es por ello que la administración conjunta de CLB con CBD, inhibidor del CYP2C19 y CYP3A4, lleva a la inhibición del metabolismo del N-CLB, su acumulación y el desarrollo de eventos adversos como somnolencia64-67.
En pacientes pediátricos con epilepsias, el tratamiento conjunto con CBD y CLB no derivó en la alteración de la exposición sistémica a CLB pero sí en la elevación en 500% de la concentración de N-CLB luego de 21 días del tratamiento conjunto. Asimismo, el cociente entre las concentraciones de N-CLB y CLB aumentaron hasta un 660% respecto del primer día de tratamiento con CBD, lo que denota la inhibición metabólica de N-CLB y la consecuente acumulación de este metabolite66. En concordancia, el estudio publicado por Geffrey et al. en pacientes pediátricos que recibieron CBD (escalando la dosis desde 5 mg/kg hasta 25 mg/kg/dia) y CLB, se referenció un incremento del 500% en los niveles de N-CLB por el tratamiento conjunto con CBD, los cuales se correspondieron con el desarrollo de somnolencia que pudo resolverse al disminuir la dosis de CLB67. No obstante, las concentraciones de CBD también pueden modificarse, habiéndose referenciado un incremento al doble en la exposición a CBD en pacientes que recibieron 40 mg/kg/día de CBD conjuntamente con CLB7. En estos pacientes pediátricos las concentraciones de CLB y N-CLB fueron el doble de aquellas observadas en los pacientes que recibieron dosis menores de CBD. Por último, en pacientes adultos y niños con epilepsias que recibieron CBD (dosis incial de 5 mg/kg/día e incrementos hasta un máximo de 50 mg/kg/dia)66 se observó el incremento en los niveles plasmáticos de N-CLB, topiramato y zonisamida con el aumento de la dosis de CBD posiblemente por la competencia por el metabolismo mediado por el CYP2C9, CYP2C19 y CYP3A4.
El único estudio realizado en voluntarios sanos adultos diseñado para cuantificar la interacción entre clobazam, estiripentol o valproato y CBD y los metabolitos de CBD mostró un incremento notable en la exposición del N-CLB sin alteración de la farmacocinética de estiripentol, valproato o del metabolito del valproato en la administración conjunta con CBD64. Por su parte, la administración repetida de clobazam produjo un incremento de la exposición de 7-OH-CBD pero no de CBD o de 7-COOH-CBD, y el estiripentol derivó en una disminución leve pero significativa de la exposición de 7-OH-CBD y 7-COOH-CBD. Nuevamente, el valproato no alteró la farmacocinética del CBD.
Existen interacciones que sufren otros fármacos por la administración de CBD dado su efecto inhibidor sobre la actividad de CYP2C19 y CYP3A4, y en menor medida sobre CYP1A1, CYP1A2, CYP1B1, CYP2A6, CYP2B6, CYP3A5, CYP2D6 y CYP2C9 y en las enzimas de glucuronidación UGT1A9, UGT2B753,55,57,68,69. Por esto, se recomienda el ajuste de dosis de fármacos sujetos a metabolismo por estas enzimas como el ácido valproico. Por su parte, fenobarbital, carbamazepina y fenitoína son inductores enzimáticos, lo que podría llevar a una disminución de los niveles de CBD según datos obtenidos in vitro53. Además, el CBD puede causar un aumento en los niveles de los antiepilépticos por inhibición enzimática o alterar la actividad de glicoproteína P (Pgp).
Algunos estudios in vitro y en animales han demostrado que el CBD interactúa de alguna manera con transportadores dependientes de ATP: proteína resistente al cáncer de mama (Bcrp) y Pgp. Por lo tanto, la modulación de estos transportadores de eflujo por el CBD puede impactar también en la absorción y disposición de otros medicamentos administrados conjuntamente. Según algunos estudios preclínicos, el CBD inhibe la Pgp y Bcrp, y de esta manera puede causar cambios farmacocinéticos en otros fármacos que son sustratos de estos transportadores70-73. A pesar de que los inhibidores son a menudo sustratos, los estudios in vitro con células MDCK (Madin-Darby Canine Kidney) o los estudios in vivo en modelos murinos muestran que el CBD no es un sustrato de Pgp sino que actúa provocando una regulación negativa en la expresión de Pgp74,75. Si esto es así, y debido a que en la epilepsia refractaria se habla de una sobreexpresión de estos transportadores, el uso concomitante de CBD y fármacos antiepilépticos que son sustratos de estos transportadores como la fenitoína, sería beneficioso, ya que conduciría a una mayor concentración de estos fármacos antiepilépticos en el sitio de acción.
En conclusión, se refuerza el concepto de monitorización terapéutica de los fármacos antiepilépticos, incluido el CBD, ya que las interacciones fármaco-fármaco pueden conducir a efectos adversos (toxicidad o fracaso terapéutico).
Eventos adversos asociados a cannabidiol
Distintos estudios realizados en pacientes pediátricos con síndrome de Dravet y convulsiones resistentes que recibieron entre 5 y 20 mg/kg/día de CBD en dos dosis junto a otros fármacos antiepilépticos referenciaron que al menos el 90% de los pacientes manifestaron eventos adversos (EA)5,6. Los EA más frecuentes fueron somnolencia, diarrea, disminución del apetito, fatiga, vómitos, fiebre, letargia, convulsiones, infecciones del tracto respiratorio superior y resultados anormales en las pruebas de función hepatica5,6,7,34. El 84% fue de gravedad leve o moderada en el grupo de CBD y relacionados con su administración. Dentro de los EA graves se incluyeron fiebre, convulsiones, tromboflebitis, apnea y erupción cutánea6,7. Si bien algunos estudios referencian que los EA se desarrollaron sin relación con la dosis, otros sí establecen la existencia de dicha relación dosis-EA, incluyendo la disminución del apetito, la incidencia de diarrea, el aumento de peso, la somnolencia e hiperactividad psicomotora como dependientes de la dosis de CBD5,7. En pacientes para quienes la pérdida de peso fue clínicamente significativa, la reducción de la dosis o la interrupción de CBD generalmente condujeron a la estabilización y aumento de peso8. Es importante señalar que el 80% de los pacientes que desarrolló somnolencia recibían conjuntamente CLB. La reducción de la dosis de CLB permitió resolver los EA en la mayoría de los pacientes. Otro dato significativo es que aquellos pacientes en terapia con ácido valproico mostraron un marcado incremento de los niveles de enzimas hepaticas5,6,34. En algunos casos, estos valores elevados regresaron al valor inicial luego de disminuir la dosis de valproato o finalizar el tratamiento con CBD5,6,8.
En otro estudio retrospectivo, en 70 pacientes pediátricos, adolescents y adultos jóvenes con epilepsia refractaria, se evaluaron los EA tras recibir una solución oleosa de CBD a dosis inicial de CBD de 1-3 mg/kg/día y aumentos hasta 16 mg/kg/día administrados en dos dosis. Los cinco fármacos antiepilépticos concomitantes más usados fueron ácido valproico, clobazam, vigabatrina, lamotrigina y fenobarbital, seguidos por levetiracetam, topiramato, rufinamida, oxcarbazepina y otros. Se informaron EA en cinco niños. Un paciente tuvo motilidad reducida a una dosis de 20 mg/kg/día, pero lo resolvió al reducir la dosis a 10 mg/kg/día. Un paciente obeso mórbido, que recibía altas dosis de CBD (1.000 mg/día), tuvo enuresis nocturna, resolviéndose luego de disminuir la dosis a 800 mg/día. La eosinofilia de un paciente motivó la suspensión del tratamiento con CBD, aunque su asociación con el CBD no fue clara. El dolor estomacal desarrollado en un paciente se asoció con enzimas hepáticas ligeramente elevadas, que normalizaron al reducirse la dosis de CBD9.
En base a lo descrito, se enumeran los eventos adversos frecuentes y aquellos graves en la Tabla 1.
Discusión
La utilización creciente de CBD en el tratamiento de las epilepsias refractarias ha despertado el interés no sólo de la comunidad científica y clínica, sino de la población en general, quienes se involucran en el uso y acciones de este fármaco. Por ello, es extremadamente importante que el equipo de salud, y en especial el farmacéutico clínico, se encuentre informado acerca de los usos aprobados por las agencias regulatorias, los mecanismos de acción, la farmacocinética, la efectividad y la seguridad del tratamiento. Esto permite la optimización de la terapéutica de CBD como parte del tratamiento con múltiples fármacos antiepilépticos, lo cual puede traer, consecuentemente, la aparición de EA asociados al tratamiento conjunto o desarrollado en el marco de interacciones farmacológicas. Asimismo, el conocimiento de los EA a CBD y su adecuado manejo clínico es de suma importancia para optimizar el tratamiento, evitando su discontinuación o disminuyendo la calidad de vida del paciente con epilepsias refractarias. Así, los datos aportados en el presente trabajo tienen una implicación directa en el trabajo del equipo de salud para el manejo del paciente con epilepsias refractarias en tratamiento con CBD.
Los estudios originales discutidos en el presente trabajo proveen información acerca de la farmacocinética de CBD obtenida en modelos preclínicos, así como en distintas poblaciones etarias humanas sanas o con diferentes estados fisiopatológicos.
Se referencia una rápida absorción de CBD, observándose un Tmáx entre 0,5 y 4 horas, que puede extenderse hasta las 6 horas de la administración del CB5,7,30,32,33. La cantidad de fármaco en la circulación sistémica se incrementa cuatro veces ante la ingesta conjunta de comidas ricas en grasas respecto de la condición de ayuno30,32,33. Las alteraciones en la biodisponibilidad de CBD según el tipo de alimento ingerido son fundamentales y refuerzan la necesidad del equipo de salud de comunicar claramente al paciente las precauciones a seguir en cuanto a la ingesta de CBD en ayunas o con alimentos y de mantener la misma pauta a lo largo del tratamiento. Por otro lado, consideramos que es necesario continuar las investigaciones en este ámbito para evaluar si el incremento en la biodisponibilidad de CBD por administración conjunta de comidas ricas en grasas se asocia (o no) con la mayor frecuencia de EA asociados al CBD o cambios en la efectividad.
La administración continua de CBD resulta en la acumulación del fármaco, y dosis crecientes del mismo hasta una dosis máxima de 3.000 mg/día en adultos (aproximadamente 40 mg/kg/día considerando un peso promedio de 70 kg) y de 40 mg/kg en niños, son proporcionales a la exposición sistémica correspondiente a un comportamiento de farmacocinética lineal5,7,30.
Dosis superiores mostraron la falta de linealidad en la cinética, posiblemente debida a la disminución de la absorción de este fármaco lipofílico.
En cuanto a la eliminación, es principalmente metabólica y los valores de semivida de eliminación luego de la ingesta oral de CBD se encuentran dentro del intervalo de 14 a 60 horas7,30,32,33. Esta gran variación puede ser atribuida a la demora en el equilibrio entre las concentraciones de CBD en plasma y en tejidos periféricos, principalmente adiposo, por lo que los tiempos de toma de muestra del estudio farmacocinético deben ser lo suficientemente prolongados, lo cual no ocurre en todos los estudios referenciados. También es necesario incrementar los estudios en relación con las posibles modificaciones farmacocinéticas por la administración de dosis multiples de CBD respecto de la dosis única. En los casos de alteraciones hepáticas severas, es recomendable el ajuste de dosis dada la disminución en el aclaramiento del fármaco60.
Los pacientes con epilepsias refractarias se encuentran polimedicados, situación que deriva en el potencial desarrollo de diversas interacciones medicamentosas. Asimismo, el CBD es un sustrato e inhibidor de diversas enzimas de la familia de los citocromos P450, por lo que es esperable que se manifiesten diversas interacciones farmacológicas53-58. Hasta el momento, la interacción de CBD con CLB es la que presenta mayor evidencia científica in vitro e in vivo64,65,67. Esta interacción farmacocinética deriva en el incremento de los niveles del metabolito de CLB. Los EA descritos más frecuentes asociados al uso de CBD fueron de gravedad leve o moderada e incluyeron somnolencia, principalmente por el uso conjunto de CLB, y alteraciones gastrointestinales. Asimismo, se referencian anormalidades en la función hepática concomitante al uso de ácido valproico y en baja proporción EA graves5,6,8,9. Dentro de las limitaciones del presente trabajo se debe señalar que nos hemos abocado a la farmacocinética y farmacodinamia de CBD referenciada en relación con el tratamiento de epilepsias refractarias y, por lo tanto, puede existir bibliografía adicional excluida del presente trabajo. Asimismo, una limitación del trabajo es la falta de análisis estadístico de los datos discutidos de manera cualitativa, siendo los mismos limitados dados los escasos reportes en literatura hallados hasta el momento.
Por todo lo comentado, la presente revisión brinda una actualización en el conocimiento de la farmacocinética y farmacodinamia de CBD para reforzar el trabajo del farmacéutico clínico en el abordaje del paciente con epilepsias refractarias en tratamiento con CBD.
Bibliography
Pain S. A potted history. Nature. 2015;525(7570):S10-1. DOI: 10.1038/525S10a [ Links ]
Russo EB, Marcu J. Cannabis pharmacology: The usual suspects and a few promising leads. Adv Pharmacol. 2017;80:67-134. DOI: 10.1016/bs.apha.2017.03.004 [ Links ]
Perucca E. Cannabinoids in the treatment of epilepsy: Hard evidence at last? J Epilepsy Res. 2017;7(2):61-76. DOI: 10.14581/jer.17012 [ Links ]
Caceres Guido P, Riva N, Calle G, Dell’Orso M, Gatto M, Sberna N, et al. Medicinal cannabis in Latin America: History, current state of regulation, and the role of the pharmacist in a new clinical experience with cannabidiol oil. J Am Pharm Assoc. 2020;60(1):212-5. DOI: 10.1016/j.japh.2019.09.012 [ Links ]
Devinsky O, Patel AD, Thiele EA, Wong MH, Appleton R, Harden CL, et al. Randomized, dose-ranging safety trial of cannabidiol in Dravet syndrome. Neurology. 2018; 90(14): e1204-e1211. DOI: 10.1212/WNL.0000000000005254. [ Links ]
Devinsky O, Cross JH, Laux L, Marsh E, Miller I, Nabbout R, et al. Trial of cannabidiol for drug-resistant seizures in the Dravet syndrome. N Engl J Med. 2017;376(7):2011-20. DOI: 10.1056/NEJMoa1611618 [ Links ]
Wheless JW, Dlugos D, Miller I, Oh DA, Parikh N, Phillips S, et al. Pharmacokinetics and tolerability of multiple doses of pharmaceutical-grade synthetic cannabidiol in pediatric patients with treatment-resistant epilepsy. CNS Drugs. 2019;33(6):593-604. DOI: 10.1007/s40263-019-00624-4 [ Links ]
Sands TT, Rahdari S, Oldham MS, Caminha Nunes E, Tilton N, Cilio MR. Long-term safety, tolerability, and efficacy of cannabidiol in children with refractory epilepsy: Results from an expanded access program in the US. CNS Drugs. 2019;33(1):47-60. DOI: 10.1007/s40263-018-0589-2 [ Links ]
Neubauer D, Perkovic Benedik M, Osredkar D. Cannabidiol for treatment of refractory childhood epilepsies: Experience from a single tertiary epilepsy center in Slovenia. Epilepsy Behav. 2018;81:79-85. DOI: 10.1016/j.yebeh.2018.02.009 [ Links ]
Silvestro S, Mammana S, Cavalli E, Bramanti P, Mazzon E. Use of cannabidiol in the treatment of epilepsy: Efficacy and security in clinical trials. Molecules. 2019;24(8):1459. DOI: 10.3390/molecules24081459 [ Links ]
Pellati F, Brighenti V, Sperlea J, Marchetti L, Bertelli D, Benvenuti S. New methods for the comprehensive analysis of bioactive compounds in Cannabis sativa L. (hemp). Molecules. 2018;23(10). DOI: 10.3390/molecules23102639 [ Links ]
Lafaye G, Karila L, Blecha L, Benyamina A. Cannabis, cannabinoids, and health. Dialogues Clin Neurosci. 2017;19(3):309-16. [ Links ]
Bow EW, Rimoldi JM. The structure-function relationships of classical cannabinoids: CB1/CB2 modulation. Perspect Medicin Chem. 2016;8:17-39. DOI: 10.4137/PMC.S32171 [ Links ]
Zhang X. Handbook of cannabis by Roger Pertwee. Oxford, UK: Oxford University Press, 2014. Br J Psychol. 2015;106(3):547-8. DOI: 10.1111/bjop.12138 [ Links ]
Fernandez-Ruiz J. Farmacos cannabinoides para las enfermedades neurologicas: .que hay detras? Rev Neurol. 2012;54(10):613-28. DOI: 10.33588/rn.5410.2011689 [ Links ]
Szaflarski JP, Bebin EM. Cannabis, cannabidiol, and epilepsy-from receptors to clinical response. Epilepsy Behav. 2014;41:277-82. DOI: 10.1016/j.yebeh.2014.08.135 [ Links ]
Dunn SL, Wilkinson JM, Crawford A, Bunning RAD, Le Maitre CL. Expression of cannabinoid receptors in human osteoarthritic cartilage: Implications for future therapies. Cannabis Cannabinoid Res. 2016;1(1):3-15. DOI: 10.1089/can.2015.0001 [ Links ]
Moran BM, McKillop AM, O’Harte FP. Development of novel ligands for peptide GPCRs. Curr Opin Pharmacol. 2016;31:57-62. DOI: 10.1016/j.coph.2016.08.009 [ Links ]
Gaston TE, Szaflarski JP. Cannabis for the treatment of epilepsy: An update. Curr Neurol Neurosci Rep. 2018;18(11):73. DOI: 10.1007/s11910-018-0882-y [ Links ]
Devinsky O, Cilio MR, Cross H, Fernandez-Ruiz J, French J, Hill C, et al. Cannabidiol: pharmacology and potential therapeutic role in epilepsy and other neuropsychiatric disorders. Epilepsia. 2014;55(6):791-802. DOI: 10.1111/epi.12631 [ Links ]
Morales P, Reggio PH, Jagerovic N. An overview on medicinal chemistry of synthetic and natural derivatives of cannabidiol. Front Pharmacol. 2017;8:422. DOI: 10.3389/fphar.2017.00422 [ Links ]
Ali S, Scheffer IE, Sadleir LG. Efficacy of cannabinoids in paediatric epilepsy. Dev Med Child Neurol. 2019;61(1):13-8. DOI: 10.1111/dmcn.14087 [ Links ]
Rosenberg EC, Patra PH, Whalley BJ. Therapeutic effects of cannabinoids in animal models of seizures, epilepsy, epileptogenesis, and epilepsy-related neuroprotection. Epilepsy Behav. 2017;70(Pt B):319-27. DOI: 10.1016/j.yebeh.2016.11.006 [ Links ]
Reddy DS, Golub VM. The pharmacological basis of cannabis therapy for epilepsy. J Pharmacol Exp Ther. 2016;357(1):45-55. DOI: 10.1124/jpet.115.230151 [ Links ]
Chemin J, Monteil A, Perez-Reyes E, Nargeot J, Lory P. Direct inhibition of T-type calcium channels by the endogenous cannabinoid anandamide. EMBO J. 2001; 20(24):7033-40. DOI: 10.1093/emboj/20.24.7033 [ Links ]
Sylantyev S, Jensen TP, Ross RA, Rusakov DA. Cannabinoid-and lysophosphatidylinositol-sensitive receptor GPR55 boosts neurotransmitter release at central synapses. Proc Natl Acad Sci USA. 2013;110(13):5193-8. DOI: 10.1073/pnas.1211204110 [ Links ]
Ibeas Bih C, Chen T, Nunn AV, Bazelot M, Dallas M, Whalley BJ. Molecular targets of cannabidiol in neurological disorders. Neurotherapeutics. 2015;12(4):699-730. DOI: 10.1007/s13311-015-0377-3 [ Links ]
Deiana S, Watanabe A, Yamasaki Y, Amada N, Arthur M, Fleming S, et al. Plasma and brain pharmacokinetic profile of cannabidiol (CBD), cannabidivarine (CBDV), Delta(9)-tetrahydrocannabivarin (THCV) and cannabigerol (CBG) in rats and mice following oral and intraperitoneal administration and CBD action on obsessive-compulsive behaviour. Psychopharmacology (Berl). 2012;219(3):859-73. DOI: 10.1007/s00213-011-2415-0 [ Links ]
Millar SA, Stone NL, Yates AS, O’Sullivan SE. A systematic review on the pharmacokinetics of cannabidiol in humans. Front Pharmacol. 2018;9:1365. DOI: 10.3389/fphar.2018.01365 [ Links ]
Taylor L, Gidal B, Blakey G, Tayo B, Morrison G. A phase I, randomized, doubleblind, placebo-controlled, single ascending dose, multiple dose, and food effect trial of the safety, tolerability and pharmacokinetics of highly purified cannabidiol in healthy subjects. CNS Drugs. 2018;32(11):1053-67. DOI: 10.1007/s40263-018-0578-5 [ Links ]
Bialer M, Johannessen SI, Levy RH, Perucca E, Tomson T, White HS. Progress report on new antiepileptic drugs: A summary of the Twelfth Eilat Conference (EILAT XII). Epilepsy Res. 2015;111:85-141. DOI: 10.1016/j.eplepsyres.2015.01.001 [ Links ]
Birnbaum AK, Karanam A, Marino SE, Barkley CM, Remmel RP, Roslawski M, et al. Food effect on pharmacokinetics of cannabidiol oral capsules in adult patients with refractory epilepsy. Epilepsia. 2019;60(8):1586-92. DOI: 10.1111/epi.16093 [ Links ]
Crockett J, Critchley D, Tayo B, Berwaerts J, Morrison G. A phase 1, randomized, pharmacokinetic trial ofthe effect of different meal compositions, whole milk, and alcohol on cannabidiol exposure and safety in healthy subjects. Epilepsia. 2020;61(2):267-77. DOI: 10.1111/epi.16419 [ Links ]
Huntsman RJ, Tang-Wai R, Alcorn J, Vong S, Acton B, Corley S. Dosage related efficacy and tolerability of cannabidiol in children with treatment-resistant epileptic encephalopathy: Preliminary results of the CARE-E Study. Front Neurol. 2019;10:716. DOI: 10.3389/fneur.2019.00716 [ Links ]
Thummel KE. Gut instincts: CYP3A4 and intestinal drug metabolism. J Clin Invest. 2007;117(11):3173-6. DOI: 10.1172/JCI34007 [ Links ]
Paine MF, Hart HL, Ludington SS, Haining RL, Rettie AE, Zeldin DC. The human intestinal cytochrome P450 "pie". Drug Metab Dispos. 2006;34(5):880-6. DOI: 10.1124/dmd.105.008672 [ Links ]
Grotenhermen F. Pharmacokinetics and pharmacodynamics of cannabinoids. Clin Pharmacokinet. 2003;42(4):327-60. DOI: 10.2165/00003088-200342040-00003 [ Links ]
Zgair A, Wong JC, Lee JB, Mistry J, Sivak O, Wasan KM, et al. Dietary fats and pharmaceutical lipid excipients increase systemic exposure to orally administered cannabis and cannabis-based medicines. Am J Transl Res. 2016;8(8):3448-59. [ Links ]
Fromm MF. Importance of P-glycoprotein for drug disposition in humans. Eur J Clin Invest. 2003;33(Suppl 2):6-9. DOI: 10.1046/j.1365-2362.33.s2.4.x [ Links ]
Cherniakov I, Izgelov D, Barasch D, Davidson E, Domb AJ, Hoffman A. Piperinepro-nanolipospheres as a novel oral delivery system of cannabinoids: Pharmacokinetic evaluation in healthy volunteers in comparison to buccal spray administration. J Control Release. 2017;266:1-7. DOI: 10.1016/j.jconrel.2017.09.011 [ Links ]
Atsmon J, Cherniakov I, Izgelov D, Hoffman A, Domb AJ, Deutsch L, et al. PTL401, a new formulation based on pro-nano dispersion technology, improves oral cannabinoids bioavailability in healthy volunteers. J Pharm Sci. 2018;107(5):1423-9. DOI: 10.1016/j.xphs.2017.12.020 [ Links ]
Dev A, Mundke MS, Pawar PK, Mohanty S. Critical aspects in sublingual route of drug delivery. Pharm Biol Eval. 2016;3(1):42-9. [ Links ]
EpidiolexR (cannabidiol) oral solution, CV. Initial U.S. Approval: 2018. Available at: https://www.epidiolex.com/sites/default/files/EPIDIOLEX_Full_Prescribing_Information.pdf [ Links ]
Hunt CA, Jones RT. Tolerance and disposition of tetrahydrocannabinol in man. J Pharmacol Exp Ther. 1980;215(1):35-44. [ Links ]
Wahlqvist M, Nilsson IM, Sandberg F, Agurell S. Binding of delta-1-tetrahydrocannabinol to human plasma proteins. Biochem Pharmacol. 1970;19(9):2579-84. DOI: 10.1016/0006-2952(70)90007-9 [ Links ]
Klausner HA, Wilcox HG, Dingell JV. The use of zonal ultracentrifugation in the investigation of the binding of delta9-tetrahydrocannabinol by plasma lipoproteins. Drug Metab Dispos. 1975;3(4):314-9. [ Links ]
Widman M, Agurell S, Ehrnebo M, Jones G. Binding of (+)-and (minus)-delta-1-tetrahydrocannabinols and (minus)-7-hydroxy-delta-1-tetrahydrocannabinol to blood cells and plasma proteins in man. J Pharm Pharmacol. 1974;26(11):914-6. DOI: 10.1111/j.2042-7158.1974.tb09207.x [ Links ]
What you should know about using cannabis, including CBD, when pregnant or breastfeeding? The Food and Drug Administration (FDA); 2019. Available at: fda.gov/consumers/consumer-updates/what-you-shouldknow-about-using-cannabis-including-cbd-when-pregnant-or-breastfeeding [ Links ]
US National Library of Medicine. Drugs and Lactation Database (LactMed) (base de datos en Internet). Bethesda (MD): 2006, p. CASRN: 8063-14-7. Available at: https://www.ncbi.nlm.nih.gov/books/NBK501587/. [ Links ]
Alozie SO, Martin BR, Harris LS, Dewey WL. 3H-delta 9-Tetrahydrocannabinol, 3H-cannabinol and 3H-cannabidiol: penetration and regional distribution in rat brain. Pharmacol Biochem Behav. 1980;12(2):217-21. DOI: 10.1016/0091-3057(80)90359-7 [ Links ]
Siemens AJ, Walczak D, Buckley FE. Characterization of blood disappearance and tissue distribution of (3H)cannabidiol. Biochem Pharmacol. 1980;29(3):462-4. DOI: 10.1016/0006-2952(80)90532-8 [ Links ]
Stout SM, Cimino NM. Exogenous cannabinoids as substrates, inhibitors, and inducers of human drug metabolizing enzymes: a systematic review. Drug Metab Rev. 2014;46(1):86-95. DOI: 10.3109/03602532.2013.849268 [ Links ]
Jiang R, Yamaori S, Takeda S, Yamamoto I, Watanabe K. Identification of cytochrome P450 enzymes responsible for metabolism of cannabidiol by human liver microsomes. Life Sci. 2011;89(5-6):165-70. DOI: 10.1016/j.lfs.2011.05.018 [ Links ]
Harvey DJ. Metabolism and pharmacokinetics of the cannabinoids. En: Watson RR, (ed.). Biochemistry and Physiology of Substance Abuse. Boca Raton (FL): CRC Press; 1991. p. 279-365. [ Links ]
Yamaori S, Okamoto Y, Yamamoto I, Watanabe K. Cannabidiol, a major phytocannabinoid, as a potent atypical inhibitor for CYP2D6. Drug Metab Dispos. 2011;39(11):2049-56. DOI: 10.1124/dmd.111.041384 [ Links ]
Brown NK, Harvey DJ. In vitro metabolism of cannabichromene in seven common laboratory animals. Drug Metab Dispos. 1990;18(6):1065-70. [ Links ]
Huestis MA. Pharmacokinetics and metabolism of the plant cannabinoids, Δ9-tetrahydrocannibinol, cannabidiol and cannabinol. En: Pertwee RG (ed.) Cannabinoids. Handbook of Experimental Pharmacology, vol 168. Springer: Berlin, Heidelberg; 2005. DOI: https://doi.org/10.1007/3-540-26573-2_23 [ Links ]
Ujvary I, Hanus L. Human metabolites of cannabidiol: A review on their formation, biological activity, and relevance in therapy. Cannabis Cannabinoid Res. 2016;1(1):90-101. DOI: 10.1089/can.2015.0012 [ Links ]
Ohlsson A, Lindgren JE, Andersson S, Agurell S, Gillespie H, Hollister LE. Singledose kinetics of deuterium-labelled cannabidiol in man after smoking and intravenous administration. Biomed Environ Mass Spectrom. 1986;13(2):77-83. DOI: 10.1002/bms.1200130206 [ Links ]
Taylor L, Crockett J, Tayo B, Morrison G. A phase 1, open-label, parallel-group, single-dose trial of the pharmacokinetics and safety of cannabidiol (CBD) in subjects with mild to severe hepatic impairment. J Clin Pharmacol. 2019;59(8):1110-9. DOI: 10.1002/jcph.1412 [ Links ]
Stott C, White L, Wright S, Wilbraham D, Guy G. A Phase I, open-label, randomized, crossover study in three parallel groups to evaluate the effect of rifampicin, ketoconazole, and omeprazole on the pharmacokinetics of THC/CBD oromucosal spray in healthy volunteers. SpringerPlus. 2013;2(1):236. DOI: 10.1186/2193-1801-2-236 [ Links ]
Jiang R, Yamaori S, Okamoto Y, Yamamoto I, Watanabe K. Cannabidiol is a potent inhibitor of the catalytic activity of cytochrome P450 2C19. Drug Metab Pharmacokinet. 2013;28(4):332-8. DOI: https://doi.org/10.2133/dmpk.DMPK-12-RG-129 [ Links ]
Huddart R, Leeder JS, Altman RB, Klein TE. PharmGKB summary: clobazam pathway, pharmacokinetics. Pharmacogenet Genomics. 2018;28(4):110-5. DOI: 10.1097/FPC.0000000000000327 [ Links ]
Morrison G, Crockett J, Blakey G, Sommerville K. A phase 1, open-label, pharmacokinetic trial to investigate possible drug-drug interactions between clobazam, stiripentol, or valproate and cannabidiol in healthy subjects. Clin Pharmacol Drug Dev. 2019;8(8):1009-31. DOI: 10.1002/cpdd.665 [ Links ]
Anderson LL, Absalom NL, Abelev SV, Low IK, Doohan PT, Martin LJ, et al. Coadministered cannabidiol and clobazam: preclinical evidence for both pharmacodynamic and pharmacoinetic interactions. Epilepsia. 2019;60(11):2224-34. DOI: 10.1111/epi.16355 [ Links ]
Gaston TE, Bebin EM, Cutter GR, Liu Y, Szaflarski JP, UAB CBD Program. Interactions between cannabidiol and commonly used antiepileptic drugs. Epilepsia. 2017;58(9):1586-92. DOI: 10.1111/epi.13852 [ Links ]
Geffrey AL, Pollack SF, Bruno PL, Thiele EA. Drug-drug interaction between clobazam and cannabidiol in children with refractory epilepsy. Epilepsia. 2015;56(8):1246-51. DOI: 10.1111/epi.13060 [ Links ]
Zendulka O, Dovrtelova G, Noskova K, Turjap M, Šulcova A, Hanuš L, et al. Cannabinoids and cytochrome P450 interactions. Curr Drug Metab. 2016;17(3):206-26. DOI: 10.2174/1389200217666151210142051 [ Links ]
Arellano AL, Papaseit E, Romaguera A, Torrens M, Farre M. Neuropsychiatric and general interactions of natural and synthetic cannabinoids with drugs of abuse and medicines. CNS Neurol Disord Drug Targets. 2017;16(5):554-66. DOI: 10.2174/1871527316666170413104516 [ Links ]
Holland M, Lau D, Allen J, Arnold J. The multidrug transporter ABCG2 (BCRP) is inhibited by plant-derived cannabinoids. Br J Pharmacol. 2007;152(5):815-24. DOI: 10.1038/sj.bjp.0707467 [ Links ]
Holland M, Panetta J, Hoskins J, Bebawy M, Roufogalis BD, Allen JD, et al. The effects of cannabinoids on P-glycoprotein transport and expression in multidrug resistant cells. Biochem Pharmacol. 2006;71(8):1146-54. DOI: 10.1016/j.bcp.2005.12.033 [ Links ]
Feinshtein V, Erez O, Ben-Zvi Z, Eshkoli T, Sheizaf B, Sheiner E, et al. Cannabidiol enhances xenobiotic permeability through the human placental barrier by direct inhibition of breast cancer resistance protein: An ex vivo study. Am J Obstet Gynecol. 2013;209(6):e1-573.e15. DOI: 10.1016/j.ajog.2013.08.005 [ Links ]
Zhu HJ, Wang JS, Markowitz JS, Donovan JL, Gibson BB, Gefroh HA, et al. Characterization of P-glycoprotein inhibition by major cannabinoids from marijuana. J Pharmacol Exp Ther. 2006;317(2):850-7. DOI: 10.1124/jpet.105.098541 [ Links ]
Feinshtein V, Erez O, Ben-Zvi Z, Erez N, Eshkoli T, Sheizaf B, et al. Cannabidiol changes P-gp and BCRP expression in trophoblast cell lines. Peer J. 2013;1:e153. DOI: 10.7717/peerj.153 [ Links ]
Brzozowska N, Li K, Wang X, Booth J, Stuart J, McGregor IS, et al. ABC transporters P-gp and Bcrp do not limit the brain uptake of the novel antipsychotic and anticonvulsant drug cannabidiol in mice. Peer J. 2016;4:e2081. DOI: 10.7717/peerj.2081 [ Links ]
Recibido: 17 de Diciembre de 2019; Aprobado: 23 de Marzo de 2020











 texto en
texto en