Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.44 no.6 Toledo nov./dic. 2020 Epub 27-Dic-2021
https://dx.doi.org/10.7399/fh.11451
ORIGINALES
Coste-efectividad de los medicamentos en situaciones especiales en un hospital
1Servicio de Farmacia, Hospital Universitario Son Llàtzer, Palma de Mallorca. Spain.
Introducción
La entrada en vigor en España del Real Decreto 1015/2009 (RD) por el que se regula la disponibilidad de medicamentos en situaciones especiales1 supuso dos grandes aportaciones: redefinir los usos de determinados medicamentos y modificar el procedimiento necesario para su adquisición.
Así, respecto a la primera, se definieron claramente tres situaciones especiales:
El acceso de medicamentos en investigación para pacientes fuera de un ensayo clínico y sin alternativas terapéuticas autorizadas (uso compasivo de medicamentos en investigación).
El uso de medicamentos en condiciones diferentes a las autorizadas (off-label).
El uso de medicamentos aprobados en otros países, distintos a España, generalmente por motivos de mercado (medicamentos extranjeros).
Con respecto a la segunda aportación, que hace referencia a los procedimientos que regulan la disponibilidad de estos medicamentos, se eliminó la necesidad de autorización individual de cada caso por parte de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), trasladándose esta responsabilidad a los centros sanitarios.
Otra situación particular es aquella que se genera con los medicamentos no incluidos en la Guía Farmacoterapéutica (GFT) del hospital, fármacos que sí tienen la aprobación de la AEMPS para una indicación determinada, pero que en el momento de su solicitud no están incluidos en la GFT para su prescripción a pacientes atendidos en un centro hospitalario o en una comunidad autónoma.
La necesidad de cumplir con los requisitos del nuevo RD1, de justificar convenientemente la necesidad del uso del medicamento en situaciones especiales y no incluidos en GFT y de informar al paciente de los beneficios y riesgos potenciales para obtener su consentimiento informado ha impulsado el trabajo desarrollado en el seno de las Comisiones Fármaco-Terapéuticas (CFyT)2-5; en relación con nuestro centro, esta actividad queda reflejada en el Real Decreto 86/2015, por el que se crea y regula la composición, organización y funcionamiento de la Comisión de Farmacoterapéutica de las Islas Baleares6. Igualmente, se hace necesario el seguimiento y la monitorización de medicamentos en situaciones especiales y medicamentos no incluidos en GFT, pues como concluyen en el trabajo de Blanco-Reina et al.(7) o en el documento consenso del grupo francés de evaluación de medicamentos8, el gran volumen de prescripciones fuera de indicación conlleva la necesidad de un seguimiento de la efectividad y costes. Si bien, son pocos los estudios publicados en los que se hayan evaluado los resultados obtenidos del empleo de estos medicamentos en términos de efectividad, seguridad y coste asociado9-13.
El objetivo principal de este trabajo es analizar la respuesta clínica conseguida con el empleo de estos medicamentos, así como el coste de los mismos. Se propuso como objetivo secundario describir el empleo y tipo de los medicamentos solicitados por servicio médico.
Métodos
Estudio retrospectivo realizado en un hospital de segundo nivel con un área de salud que atiende a 265.000 habitantes. Se incluyeron en este análisis medicamentos compasivos, off-label y medicamentos no incluidos en GFT del hospital, solicitados en el periodo comprendido entre enero y diciembre de 2018. Se excluyeron del análisis las solicitudes de medicamentos extranjeros, ya que, pese a que se catalogan como medicamentos en situaciones especiales, en nuestro hospital no se tramitan vía CFyT. El periodo de seguimiento de cada solicitud se estableció en función del objetivo esperado con dicho tratamiento.
Con el fin de cumplir con los RD mencionados1,6, en el caso de nuestro hospital se diseñó un procedimiento normalizado de trabajo (PNT), presentado y aprobado por la CFyT, a través del cual dicha comisión asume la responsabilidad de evaluar el uso interno de los medicamentos off-label,
de uso compasivo y medicamentos no incluidos en GFT. El PNT consta de las siguientes etapas:
Generación de solicitud: el clínico responsable realiza una solicitud informática por paciente del nuevo tratamiento. En dicho informe se registra: medicamento solicitado, posología, indicación, objetivo esperado por el clínico del tratamiento en su paciente, bibliografía que justifique su empleo, informe clínico del paciente y su consentimiento informado.
Evaluación de la solicitud: el servicio de farmacia (SF) recibe, a través del buzón de peticiones de medicamentos en situaciones especiales, cada solicitud realizada por el clínico, y elabora un informe técnico que incluye el análisis de la evidencia disponible del fármaco para la indicación solicitada, alternativas con indicación aprobada, existencia de alternativas con indicación no aprobada pero con mayor peso de evidencia científica, análisis del impacto económico y propuesta de autorización/denegación. Este informe se somete a la revisión y evaluación por parte de los vocales de la CFyT.
Resolución de la solicitud: se estipula una reunión mensual para debatir cada solicitud en la que se presenta el informe técnico elaborado por el farmacéutico y el caso clínico por el médico solicitante. La CFyT emite una resolución final, que en caso de autorización ha de ser corroborada por la Dirección Médica.
Para examinar la respuesta clínica de cada tratamiento se desarrolló, por el SF, una base de datos Access 2007® donde se registra cada solicitud. Las variables recogidas fueron: servicio médico, fármaco, indicación, tipo de solicitud, objetivo de tratamiento, respuesta al tratamiento (en función de si alcanzó o no el objetivo propuesto por el clínico) y coste. Los datos se obtuvieron de la historia clínica electrónica y del sistema integral de gestión del medicamento del SF.
Se consideró respuesta clínica al tratamiento y, por tanto, éxito terapéutico, cuando con el tratamiento se alcanzó el objetivo propuesto por el clínico en la solicitud del medicamento; mientras que fracaso terapéutico se consideró cuando no se alcanzaba ese resultado en el tiempo consensuado en la reunión de la CFyT.
Para el análisis de los datos se utilizó el software SPSS v.23. Las variables del estudio se tabularon de forma descriptiva, expresando las variables continuas como media; para las variables categóricas se estimaron los porcentajes globales y frecuencias. Para el cálculo del coste se consideró la duración del tratamiento hasta la consecución de la respuesta clínica o, en su defecto, se tuvo en cuenta el número de dosis administradas hasta su interrupción. Para dicho análisis se aplicó el coste de adquisición del hospital (PVL - descuentos + IVA).
Todos los datos fueron recogidos por un investigador y se contó con una doble revisión externa, por parte de la CFyT y del farmacéutico responsable del servicio médico que realizó la solicitud.
Resultados
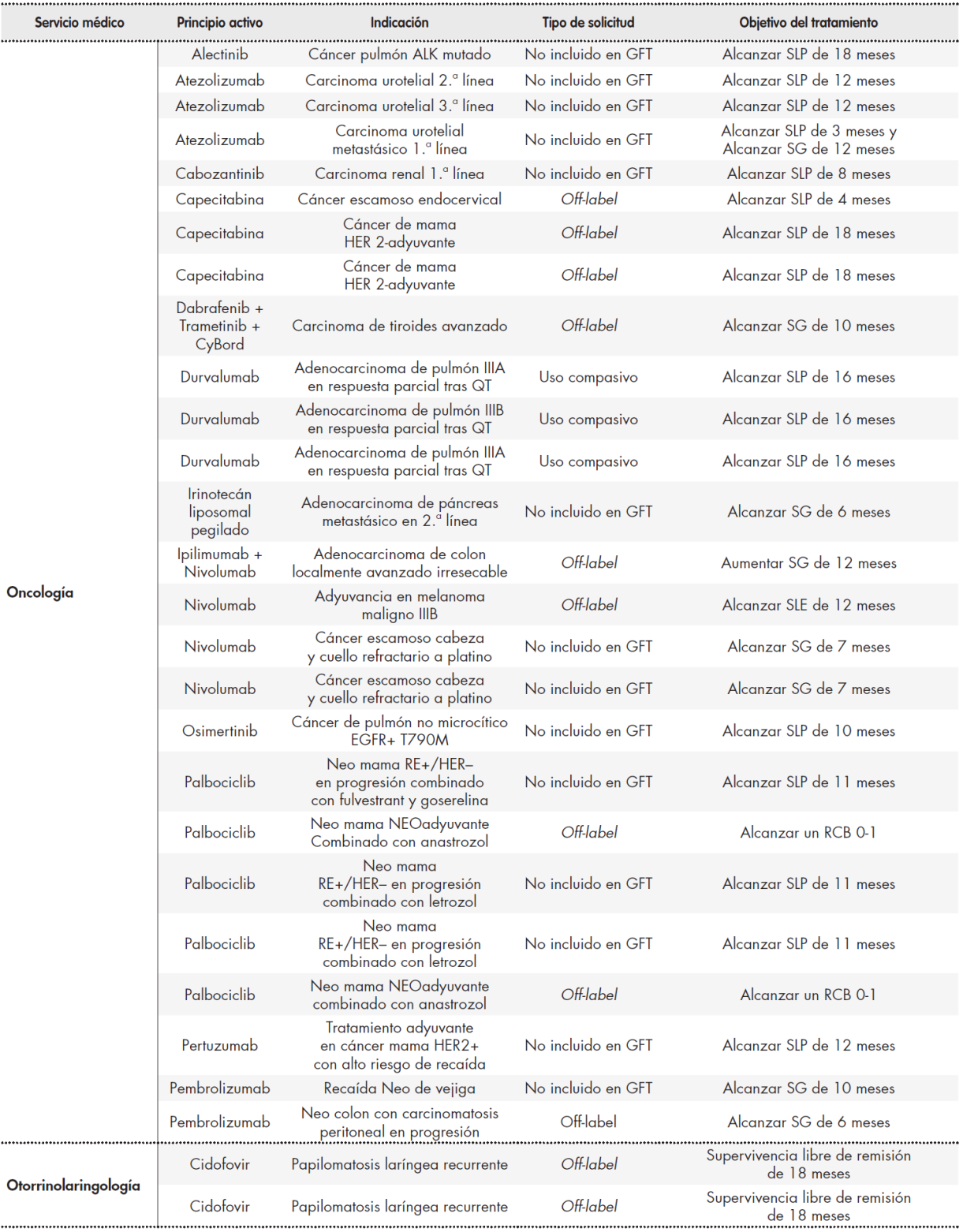
Se analizaron un total de 70 solicitudes, que fueron las aceptadas por la CFyT durante el periodo de estudio. En la Tabla 1 Tabla 1 cont Tabla 1 cont se recogen estas solicitudes clasificadas por servicio médico prescriptor. Los servicios médicos que realizaron mayor número de solicitudes fueron oncología médica con 26 peticiones, seguido de hematología con 11 y dermatología con 10; 67% del total de solicitudes. Respecto al tipo de solicitud, el 69% fueron peticiones off-label, el 20% medicamentos no incluidos en GFT del hospital y el 11% peticiones como uso compasivo.
Tabla 1 (cont.). Registro de solicitudes clasificadas por servicio medico
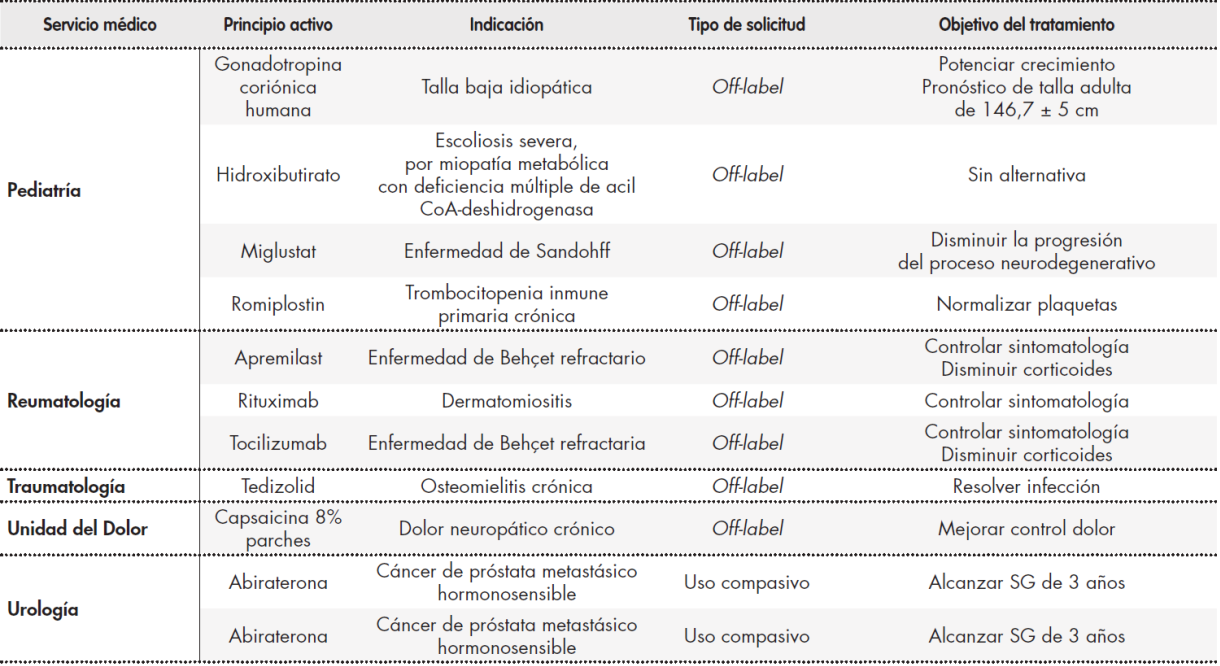
GFT: guía farmacoterapéutica; LDCGB: linfoma no Hodgkin de células grandes B refractario; QT: quimioterapia; RCB: residual cancer burden; SCR-2: síndrome cardio-renal-2;
SG: supervivencia global; SLE: supervivencia libre de enfermedad; SLP: supervivencia libre de progresión; TASPE: trasplante autólogo de sangre periférica.
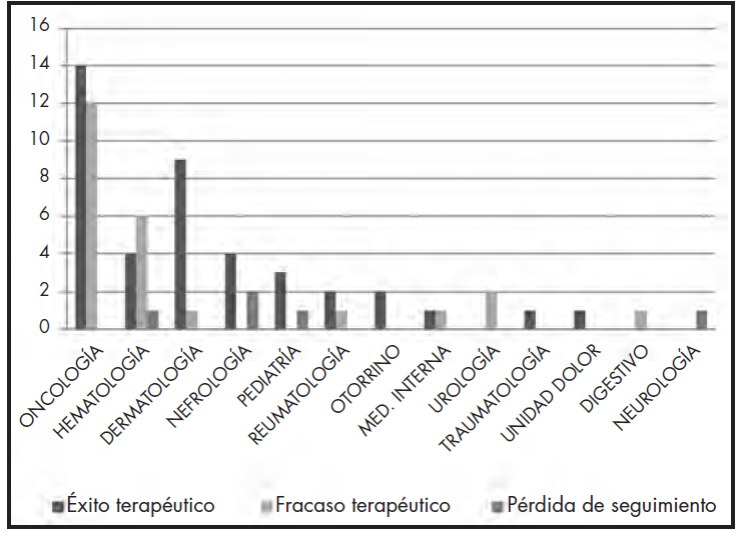
Se alcanzó la respuesta clínica en el 59% (41 solicitudes) de los tratamientos solicitados, considerados, por tanto, éxito terapéutico. En el 34% (24 solicitudes) no lograron los objetivos esperados por el clínico, por lo que se consideraron como fracasos terapéuticos. Un 7% no pudo ser analizado por pérdida de seguimiento (tres muertes por causa no relacionada con la enfermedad ni con el tratamiento recibido, un caso en el que el paciente se trasladó a otra comunidad autónoma, lo que imposibilitó realizar seguimiento, y un caso en el que el paciente declinó iniciar tratamiento tras aprobación por la CFT). En la Figura 1 se representan los resultados clínicos desglosados por servicio.
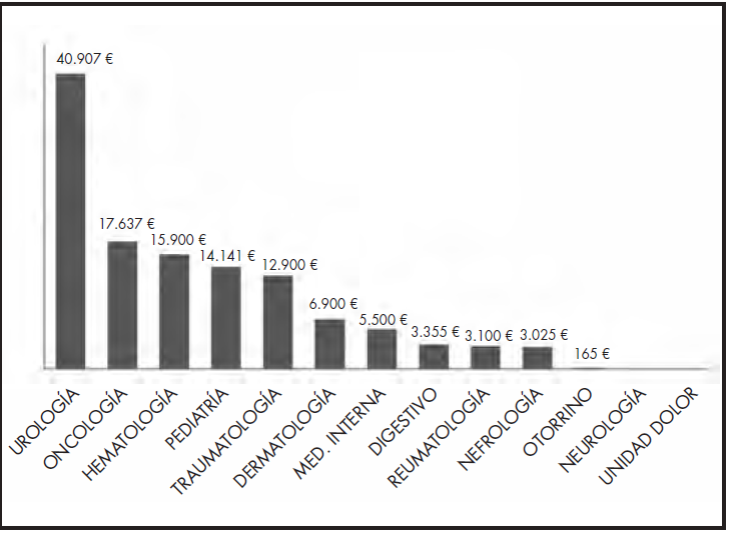
El coste del tratamiento de las 70 solicitudes de medicamentos especiales y los no incluidos en GFT supuso un total de 1.140.240 €. Referente al coste de los tratamientos que pudieron ser analizados, la suma fue de 821.631 € y se distribuyó en 521.250 € para los considerados éxitos terapéuticos (63% de este presupuesto) y 300.381 € para los fracasos (37% de este presupuesto). La media de coste por solicitud de tratamiento fue de 16.288 €. En este cálculo se ha excluido el coste de uno de los tratamientos solicitados por el servicio de hematología, inotuzumab + rituximab (259.764 €), con objeto de no desvirtuar los resultados. En la Figura 2 se representa el coste por solicitud por servicio médico.
De las 41 solicitudes en las que se alcanzó éxito terapéutico, 30 corresponden a una solicitud tipo off-label, 4 a medicamentos no incluidos en GFT del hospital y 7 a usos compasivos. Se puede observar que el 75% de los medicamentos fueron fármacos citostáticos y biológicos.
Discusión
Este trabajo refleja una importante actividad de evaluación de medicamentos en situaciones especiales y medicamentos no incluidos en GFT, donde en un año la CFyT del hospital analizó un total de 70 solicitudes, lo que equivaldría a casi 6 solicitudes al mes.
La prescripción fuera de ficha técnica, así como de uso compasivo de medicamentos y fármacos no incluidos en la GFT de los hospitales, permite al paciente beneficiarse de un tratamiento potencialmente eficaz. En contrapartida, en caso de prescripciones fuera de ficha técnica y usos compasivos, le coloca en una situación de riesgo al privarle de las garantías de seguridad, competencia de las agencias reguladoras, al no estar analizado el beneficio-riesgo de dicha terapia en esa patología. Por otro lado, el sistema sanitario tendrá que hacer frente a una inversión que se destina a tratamientos con evidencia limitada en cuanto al beneficio clínico generado(14-16(. Estos hechos hacen que el RD1, en su artículo 23.1, permita este procedimiento con carácter excepcional y limitándolo a aquellas situaciones que carezcan de alternativas terapéuticas.
A pesar de todo ello, son muchos los autores que recogen que este tipo de prescripción es práctica común y generalizada17,18., siendo el campo de la oncología y la pediatría los que por diferentes necesidades más tienen que recurrir a ella15,16,19.
Existen diversas situaciones que pueden justificar la necesidad de este tipo de prescripciones: la demora en la publicación de los resultados de la investigación clínica y la posterior autorización de una nueva indicación por las agencias reguladoras, la exclusión en los ensayos clínicos de determinados grupos de pacientes por limitaciones éticas, el desinterés del fabricante en registrar la indicación, la dilación en el tiempo entre la aprobación por la AEMPS y la Comisión Farmacoterapéutica que permita la disponibilidad del fármaco(19.20.21).
Por otro lado, la aparición de nuevos fármacos eficaces, pero con alto coste económico, obliga a recoger y analizar toda la información disponible para decidir cuanto antes si tienen o no alto valor terapéutico; el seguimiento y la creación de registros de resultados obtenidos en vida real puede contribuir a un mejor uso de los medicamentos. En nuestro trabajo, del total de solicitudes, encontramos un 59% de tratamientos solicitados considerados como éxitos terapéuticos; con un 7% de pérdidas de seguimiento.
Al querer comparar nuestros resultados con la bibliografía publicada encontramos la limitación de la baja tasa de publicaciones que evalúen los resultados en salud obtenidos del empleo de medicamentos en situaciones especiales y no incluidos en la GFT.
El estudio multicéntrico de Danés et al.9, que incluía la evaluación de 232 medicamentos en situaciones especiales para 102 indicaciones diferentes, obtiene cifras de éxito terapéutico similares al nuestro (respuesta completa en el 31,4% de los casos, respuesta parcial en el 36,3% y estabilización en el 4,9%). Sin embargo, existe una disparidad en patologías tratadas y fármacos empleados entre el trabajo de Danés et al. y nuestro estudio que imposibilita una comparación de resultados.
Centrándonos en los servicios médicos de oncología y hematología, que fueron los que mayor número de solicitudes realizaron, obtenemos un 49% de éxito terapéutico, 18 de 37 solicitudes. Comparamos nuestros resultados con los del estudio descriptivo, observacional, retrospectivo llevado por Arroyo Álvarez et al.13, donde analizan un total de 154 fármacos antineoplásicos empleados en situaciones especiales entre 2005-2015 y observan una tasa de respuesta subjetiva del 32,5% y objetiva del 10,7% de respuesta clínica. Esta diferencia en tasa de respuesta se puede justificar, tal y como concluyen Arroyo Álvarez et al. en su estudio, al empleo de fármacos para el tratamiento mayoritario de tumores metastásicos; en nuestro estudio esta circunstancia no se produce en demasía.
Respecto al servicio médico de dermatología, tercer servicio médico con mayor número de solicitudes, encontramos que, en nuestro estudio 9 de las 10 solicitudes fueron consideradas como éxito terapéutico, resultado superior al obtenido por Natalie Ong et al.12, que al evaluar el resultado clínico de sus 25 solicitudes off-label de dermatología obtienen un 70% de respuesta clínica. Esta diferencia se podría justificar a que en el estudio de Natalie Ong et al., un 20% de los pacientes tuvo que discontinuar el tratamiento por la aparición de eventos adversos.
Otro aspecto, nada desdeñable, es el impacto económico en el presupuesto motivado por el empleo de estos medicamentos y la sostenibilidad del sistema sanitario. El coste real de los tratamientos durante el análisis supuso más un millón de euros. Comparamos el coste medio por solicitud de nuestro estudio con los del estudio de Vicente Arocas Casañ et al.22; este evalúa el impacto económico de 834 solicitudes de medicamentos en condiciones especiales, y obtiene un coste por solicitud/año de 8.554 €. En nuestro estudio, el coste medio por solicitud fue de 16.288 €, supone casi el doble de dinero que el obtenido por Arocas Casañ et al., seguramente porque muchos de nuestros tratamientos exceden el año de duración, mientras que Arocas Casañ et al. calculan el coste medio anual.
Si comparamos ahora los medicamentos empleados por dermatología con el estudio previamente mencionado de Natalie Ong et al.12, el coste por solicitud/año en dicho estudio fue de 2.755 €, en nuestro estudio la cifra asciende a 4.348 €. Esta diferencia se puede justificar por dos razones; la primera, de nuevo, porque en nuestro estudio el cálculo del coste fue hasta obtener éxito terapéutico y no por año de tratamiento, y la segunda, porque en el estudio de Natalie Ong et al. emplea en 20 de 25 solicitudes revisadas, talidomida, micofenolato de mofetilo y ciclosporina, fármacos con menor coste que los utilizados en nuestro estudio.
En relación con el beneficio-coste de estas terapias, al detallar exclusivamente el coste destinado a los tratamientos que pudieron ser evaluados, observamos que el 63% del presupuesto fue destinado para tratamientos que finalmente fueron exitosos. Tal y como concluyen N. Ong et al.12, es probable que los costes de los medicamentos se hayan compensado mediante la reducción de los ingresos (menor morbilidad con una mejor calidad de vida) y los tratamientos alternativos.
En nuestro hospital se observa cómo la mitad de las solicitudes fueron realizadas por los servicios de hematología y oncología y supusieron más del 75% del presupuesto destinado a medicamentos especiales y no incluidos en GFT. Esto se puede justificar por el auge de la investigación en esta área y la rápida difusión de resultados que conllevan el empleo de estos fármacos antes de que las agencias reguladoras aprueben su autorización19.
Es de destacar el bajo número de solicitudes realizado por el servicio médico de pediatría a la CFyT, únicamente 4 solicitudes de 70, cuando la bibliografía resalta una tasa de prescripción de fármacos fuera de indicación que supera el 50% en esta población23,24. Esta gran disparidad puede ser debida a que nuestro centro no es centro materno-infantil; aunque también podría ser debido a una posible infranotificación a la CFyT de nuestro hospital.
Como limitaciones del estudio encontramos que los resultados no pueden generalizarse y es compleja la extrapolación de los mismos, pues incluyen un grupo heterogéneo de patologías y fármacos, con pocos casos en cada grupo. Sin embargo, sí podría considerarse un buen reflejo de lo que ocurre en nuestro hospital y nos permite conocer los resultados en vida real con el empleo de estos fármacos y con ello aportar evidencia a la comunidad científica.
Con este proyecto se buscaba desarrollar un modelo de gestión de medicamentos especiales y medicamentos no incluidos en GFT del hospital adecuado a la vez que se cumplían el RD 1015/2009 y el RD 86/2015. De esta forma, la metodología de evaluación y de seguimiento propuesto por la CFyT, que integra un equipo multidisciplinar, asegura que en la toma de decisiones se preserven los aspectos éticos y garantiza que el acceso al tratamiento se base en la mejor evidencia y relación coste-efectividad para el paciente. El seguimiento prospectivo del paciente en el curso del tratamiento permite reevaluarlo en caso de que no se esté consiguiendo el objetivo expresado por el clínico en la solicitud. Además, posibilita medir la atención que aporte valor, entendiendo como valor el beneficio clínico. En conclusión, más de la mitad de los tratamientos en situaciones especiales y medicamentos no incluidos en GFT del hospital consiguen su objetivo terapéutico, si bien el impacto económico de su empleo es elevado.
Aportación a la literatura científica
La prescripción de fármacos en situaciones especiales, fuera de ficha técnica o uso compasivo, es una práctica habitual y generalizada que permite al paciente beneficiarse de un tratamiento potencialmente eficaz, pero a su vez conlleva un cierto riesgo, pues se está empleando en condiciones en las que se carece de suficiente evidencia que garantice un balance beneficio-riesgo positivo. Este hecho hace que se deba justificar convenientemente su utilización y que se requiera del consentimiento informado del paciente; asimismo, expertos en la evaluación de medicamentos recomiendan encarecidamente realizar un seguimiento y monitorización. A pesar de ello, existe una limitada publicación de artículos que evalúen los resultados en salud obtenidos del empleo de estos medicamentos.
En este estudio se analiza un modelo de gestión de medicamentos especiales y medicamentos no incluidos en Guía Farmacoterapéutica del hospital solicitados a la Comisión de Farmacia y Terapéutica, que incluye la evaluación y el seguimiento de las solicitudes, que posibilita que cada tratamiento se base en la mejor evidencia y relación costeefectividad asegurando un beneficio tanto para el paciente como para el sistema sanitario. El seguimiento y la creación de registros de resultados obtenidos en vida real, con el análisis apropiado de resultados, pueden contribuir a establecer estrategias de mejora con el fin de mejorar el uso racional y razonable de los medicamentos.
Bibliography
Real Decreto 1015/2009, de 19 de julio de 2009, por el que se regula la disponibilidad de medicamentos en situaciones especiales. Boletín Oficial del Estado, n.º 174 (20 de julio de 2009). [ Links ]
Avendaño Solá C. Uso compasivo de medicamentos: un cambio necesario en España. Med Clin (Barc). 2009;133:425-6. DOI: 10.1016/j.medcli.2009.07.003 [ Links ]
Delgado O, Puigventos F, Clopés A. Posicionamiento del farmacéutico de hospital ante la utilización de medicamentos en condiciones diferentes a las autorizadas. Farm Hosp. 2009;33:237-9. [ Links ]
Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica. Boletín Oficial del Estado, n.º 274 (15 de noviembre de 2002). [ Links ]
Pérez-Moreno MA, Villalba-Moreno AM, Santos-Ramos B, Marín-Gil R, Varela-Aguilar JM, Torello-Iserte J, et al. Off-label approval of drug use in a tertiary hospital. Rev Calid Asist. 2013;28(1):12-8. DOI: 10.1016/j.cali.2012.05.005 [ Links ]
Real Decreto 86/2015, de 23 de octubre, por el que se crea la Comisión Farmacoterapéutica del Servicio de Salud de las Illes Balears y se regula su composición, organización y funcionamiento. Boletín Oficial de las Islas Baleares, n.º 155 (25 de octubre de 2015). [ Links ]
Blanco-Reina E, Muñoz-García A, Cárdenas-Aranzana MJ, Ocaña-Riola R, Prado-Llergo JR. Assessment of off-label prescribing: profile, evidence and evolution. Farm Hosp. 2017;41(4):458-69. DOI: 10.7399/fh.2017.41.4.10562 [ Links ]
Benoît Mourlat B. Les assises du medicament. Rapport de synthèse des Assises du médicament. Groupe 3. France : Ministère des Solidarités et de la Santé (Internet); 2011 Available at: https://solidarites-sante.gouv.fr/IMG/pdf/VOLUME_V_groupe_3-1.pdf [ Links ]
Danés I, Agustí A, Vallano A, Alerany C, Martínez J, Bosch JA, et al. Outcomes of off-label drug uses in hospitals: a multicentric prospective study. Eur J Clin Pharmacol. 2014;70(11):1385-93. DOI: 10.1007/s00228-014-1746-2 [ Links ]
Chay J, Donovan P, Cummins S, Kubler P, Pillans P. Experience with low dose rituximab in off-label indications at two tertiary hospitals. Int Med J. 2013;43:871-82. DOI: 10.1111/imj.12207 [ Links ]
Kesselheim A, Myers J, Solomon D, Winkelmayer W, Levin R, Avorn J. The Prevalence and Cost of Unapproved Uses of Top-Selling Orphan Drugs. PLoS ONE. 2012;7(2):e31894. DOI: 10.1371/journal.pone.0031894 [ Links ]
Ong N, McMeniman E, Pillans P, Soyer H. A clinical audit of high-cost and off-label drug use in dermatology. Australas J Dermatol. 2015;58(1):30-4. DOI: 10.1111/ajd.12392 [ Links ]
Arroyo Álvarez C, Rodríguez Pérez L, Rodríguez Mateos ME, Martínez Bautista MJ, Benítez Rodríguez E, Baena-Cañada JM. Off-label antineoplastic drugs. An effectiveness and safety study. Farm Hosp. 2017;41(3):382-90. DOI: 10.7399/fh.2017.41.3.10745 [ Links ]
Bellis JR, Kirkham JJ, Thiesen S, Conroy EJ, Bracken LE, Mannix HL, et al. Adverse drug reactions and off-label and unlicensed medicines in children: a nested casecontrol study of inpatients in a pediatric hospital. BMC Med. 2013;11:238. DOI: 10.1186/1741-7015-11-238 [ Links ]
Falabregues A, Daul M, Pourroy B, Gauthier-Villano L, Pisano P, Rathelot P, et al. Pertinence des prescriptions «hors AMM/RTU» des molécules onéreuses dans un hôpital universitaire. Therapies. 2015;70(5):385-402. [ Links ]
Smieliauskas F, Sharma H, Hurley C, de Souza J, Shih Y. State insurance mandates and off-label use of chemotherapy. Health Economics. 2017;27(1):e55-70. DOI: 10.1002/hec.3537 [ Links ]
Largent EA, Miller FG, Pearson SD. Going off-label without venturing off-course. Evidence and ethical off-label prescribing. Arch Intern Med. 2009;169:1745-7. DOI: 10.1001/archinternmed.2009.314 [ Links ]
Walton SM, Schumock GT, Lee KV, Alexander GC, Meltzer D, Stafford RS. Prioritizing future research on off-label prescribing: results of a quantitative evaluation. Pharmacotherapy. 2008;28:1443-52. DOI: 10.1592/phco.28.12.1443 [ Links ]
Saiyed M, Ong P, Chew L. Off-label drug use in oncology: a systematic review of literature. J Clin Pharm Ther. 2017;42(3):251-8. DOI: 10.1111/jcpt.12507 [ Links ]
Orloff JJ, Stanski D. Innovative approaches to clinical development and trial design. Ann Ist Super Sanità. 2011;47:8-13. DOI: 10.4415/ANN_11_01_03 [ Links ]
Kwinta P. Off-label drugs use in children-clinical perspective. Przegl Lek. 2011;68:1-3. [ Links ]
Arocas Casañ V, Mateo Carmona J, García Molina O, Fernández de Palencia Espinosa MA, Blázquez Álvarez MJ, de la Rubia Nieto MA, et al. Off-label prescription of drugs at hospital. Farm Hosp. 2016;40(2):63-78. DOI: 10.7399/fh.2016.40.2.9268 [ Links ]
García-López I, Fuentes-Ríos J, Manrique-Rodríguez S, Fernández-Llamazares C. Utilización de medicamentos en condiciones off-label y unlicensed: resultados de un estudio piloto realizado en una unidad de cuidados intensivos pediátricos. An Pediatr (Barc). 2017;86 (1):28-36. DOI: 10.1016/j.anpedi.2016.01.026 [ Links ]
Allen HC, Garbe MC, Lees J, Aziz N, Chaaban H, Miller JL, et al. Off-Label Medication use in Children, More Common than We Think: A Systematic Review of the Literature. J Okla State Med Assoc. 2018;111(8):776-83. [ Links ]
Recibido: 10 de Abril de 2020; Aprobado: 29 de Mayo de 2020











 texto en
texto en