Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.44 no.6 Toledo nov./dic. 2020 Epub 27-Dic-2021
https://dx.doi.org/10.7399/fh.11525
ORIGINALES
Coste de eltrombopag y rituximab por paciente respondedor al tratamiento de la trombocitopenia inmune primaria en España
1Hematology Department, Hospital Universitario de Salamanca-IBSAL, Salamanca. Spain.
2JParrondoHEALTH. Coslada, Madrid. Spain.
3Hematology Department, IML, IdISSC; Hospital Clínico San Carlos. Medical School, Department of Medicine, Complutense University (UCM), Madrid, Spain.
Introducción
La trombocitopenia inmune primaria (PTI) es una enfermedad autoinmune adquirida que se caracteriza por un recuento plaquetario inferior a 100 x 109 plaquetas/litro causado por la destrucción y producción inadecuada de plaquetas1,2. El diagnóstico se realiza por exclusión de otras enfermedades asociadas con la trombocitopenia. La incidencia anual de PTI es de 3-4/100.000 en adultos, y superior a esa cifra en pacientes ancianos3. La enfermedad se considera de diagnóstico reciente cuando su evolución es inferior a los 3 meses a partir del diagnóstico; persistente si los síntomas se mantienen de 3 a 12 meses; y crónica cuando se prolonga más allá de los 12 meses1. A pesar de que un tercio de los pacientes afectados son asintomáticos, y de que los casos con un recuento plaquetario superior a 50 x 109 plaquetas/litro no requieren tratamiento, es una enfermedad muy duradera que puede ser mortal debido al sangrado provocado por la trombocitopenia. Además, la PTI tiene un impacto negativo sobre la calidad de vida y supone un importante lastre económico para los sistemas sanitarios1,2.
Las guías clínicas clásicas recomendaban la administración de corticoides como tratamiento de primera línea para la PTI en adultos, seguida de una esplenectomía como tratamiento de segunda línea. Asimismo, aconsejaban el uso del anticuerpo monoclonal quimérico anti-CD20 o un agonista del receptor de la trombopoyetina (AR-TPO) en casos de fracaso o contraindicación de los tratamientos considerados como de primera línea2,4.
La esplenectomía consigue una tasa de respuesta del 60% al cabo de 5 años5. No obstante, este tratamiento produce importantes eventos adversos derivados principalmente del procedimiento quirúrgico, estando asimismo asociado a riesgo de infección, trombosis y cancer6. En cambio, el rituximab y los AR-TPO causan escasa toxicidad y evitan la realización de una esplenectomía. La primera de estas opciones suele dar lugar a una respuesta duradera tras un breve tratamiento, con alrededor de un 60% de respuesta inicial y un tercio de los pacientes en remisión al cabo de un año7. La segunda requiere tratamiento a largo plazo, pero ofrece tasas de respuesta muy elevadas (75-95%) y menos efectos secundarios que el rituximab, con la posibilidad de interrumpir el tratamiento si se han alcanzado los objetivos terapéuticos7-12. Estos beneficios han hecho que unos tratamientos anteriormente considerados de tercera línea gocen actualmente de un uso muy extendido13. De hecho, aunque los corticoides siguen constituyendo el tratamiento de primera línea para pacientes con PTI, según las últimas recomendaciones, puesto que no existen en la actualidad estudios aleatorizados que comparen directamente la esplenectomía, el rituximab y los AR-TPO, las tres opciones terapéuticas pueden utilizarse como tratamientos de segunda línea7.
Los AR-TPO, tanto eltrombopag como romiplostim, estimulan la producción de plaquetas, incrementando el recuento plaquetario(9,14(. A diferencia del romiplostim, que se administra por vía subcutánea, el eltrombopag es de administración oral y no requiere la asistencia de personal de Enfermería15.
El objetivo de este trabajo es ofrecer datos sobre el coste por paciente respondedor del uso del AR-TPO de administración oral eltrombopag y de rituximab en el tratamiento de PTI crónica para que los profesionales del sistema público de salud español puedan tomar sus decisiones clínicas en función de las implicaciones económicas de cada uno de estos tratamientos.
Métodos
Modelo
Hemos desarrollado un modelo de coste-consecuencia para comparar el coste directo del uso de eltrombopag y rituximab para el tratamiento de la PTI en el sistema sanitario público español. Tal y como se hiciera en un estudio similar en el que se comparó romiplostim con rituximab16, sólo se consideraron los costes directos hospitalarios producidos por el tratamiento con eltrombopag y rituximab. Los sangrados de grado 1 (petequiales), habitualmente tratados por los mismos pacientes o en los centros de atención primaria, no fueron considerados en el análisis.
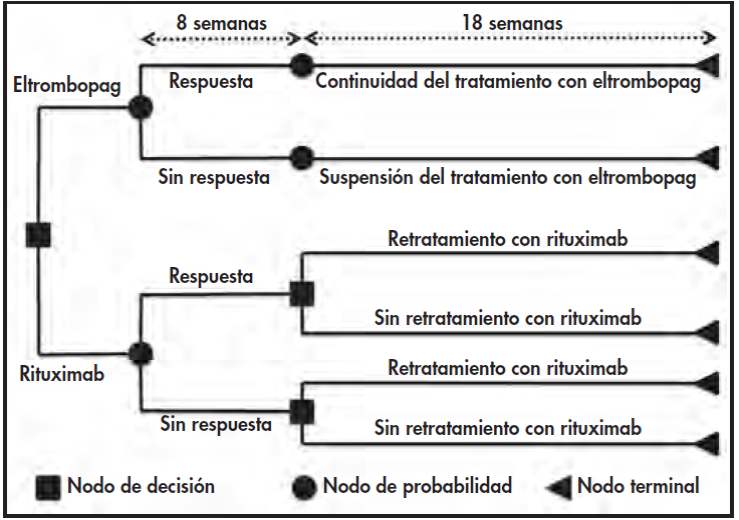
En línea con el estudio realizado anteriormente que había evaluado el coste por respuesta de romiplostim y rituximab, se estableció un horizonte de 26 semanas (medio año)16. Como puede observarse en la Figura 1, se consideraron dos periodos. El primero comprendió 8 semanas durante las cuales se trató a todos los pacientes evaluando la respuesta de cada uno. El segundo fue un periodo de 18 semanas, durante las que: a) sólo se siguió tratando a pacientes con respuesta a eltrombopag; y b) los pacientes que recibían rituximab fueron tratados según los criterios descritos previamente17. Este protocolo se diseñó de conformidad con el estudio antes mencionado, llevado a cabo en España16, con la finalidad de facilitar la toma de decisiones.
Puesto que el horizonte temporal era inferior a un año se decidió no aplicar descuento alguno en relación con costes o efectos.
De este modo, para calcular el coste final por paciente respondedor a ambas alternativas terapéuticas, el modelo toma en cuenta los costes a lo largo de las 26 semanas derivados del tratamiento (los fármacos en sí, más su administración), los costes de seguimiento y los costes producidos por los sangrados.
Población estudiada
Considerando que eltrombopag está indicado en pacientes de más de un año de edad con PTI crónica resistente a otros tratamientos15 y que, aunque rituximab no cuenta con indicación aprobada para esta enfermedad, se suele restringir a los adultos por las reservas que suscita el efecto de rituximab en el sistema inmune infantile7,18, decidimos limitar nuestro análisis a pacientes adultos con PTI crónica resistente al tratamiento.
Para determinar la eficacia de estos tratamientos, llevamos a cabo una revisión de los artículos sobre PTI crónica publicados en inglés y español entre 2000 y 2017. Dicha revisión nos permitió identificar un artículo referido a un grupo de pacientes españoles tratados con eltrombopag19. Al no encontrar ningún artículo de características similares para rituximab (realizado en pacientes españoles con PTI resistente a tratamiento), decidimos utilizar los datos de la revisión sistemática de Arnold DM et al.20.
Para estimar la dosis de rituximab requerida fue necesario calcular la superficie corporal de los pacientes, para lo que utilizamos la fórmula de Dubois y Dubois21. Altura y peso fueron determinados en base a microdatos procedentes de los resultados para España de la Encuesta Europea de Salud de 2014 (las características fundamentales de la población incluida en el análisis se muestran en la Tabla Suplementaria 1)22.
Estimación de la respuesta
Puesto que no fue posible encontrar ningún estudio o ensayo clínico de fase III español que investigara la respuesta a rituximab, los datos en relación con los efectos de este fármaco fueron extraídos de la revisión sistemática mencionada/20). Además, utilizamos un modelo retrospectivo francés para evaluar la necesidad de retratamiento y su efectividad17.
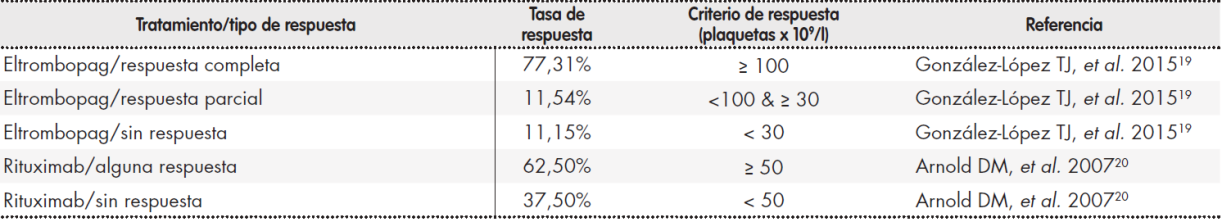
La Tabla Suplementaria 2 muestra las tasas de respuesta obtenidas según tratamiento, así como las fuentes de los datos y los criterios utilizados para evaluar dicha respuesta. El número de retratamientos y su tasa de respuesta se muestran en la Tabla Suplementaria 3.
Como se muestra en la Tabla Suplementaria 2, los criterios para evaluar la respuesta no fueron los mismos en todos los casos. Mientras que en el estudio de eltrombopag se utilizan dos categorías de respuesta: respuesta completa (definida como un recuento plaquetario ≥ 100 x 109/l) y alguna respuesta (recuento plaquetario ≥ 30 y < 100), el estudio de rituximab utiliza una única categoría de respuesta según la cual se considera respondedor a todo paciente con un recuento plaquetario ≥ 50 x 109/l). A pesar de lo anterior, pudo determinarse que la eficacia de eltrombopag es superior a la de rituximab, puesto que su tasa de respuesta completa es del 77,3% frente a un 62,5% para rituximab.
Estimación del riesgo de sangrado
Puesto que los sangrados petequiales no requieren atención hospitalaria (se tratan en atención primaria), el modelo sólo considera sangrados de grado 2, 3 y 4 según la Escala de Sangrado de la Organización Mundial de la Salud (OMS)23 (véase la Tabla Suplementaria 4).
Tabla suplementaria 4. Tipo de sangrado según la escala de la Organización Mundial de la Salud

Adaptación de Fogarty et al. 201223.
Se determinó la existencia de una relación entre un recuento plaquetario bajo y un mayor riesgo de sangrado. De esta forma, los pacientes sin respuesta al tratamiento tendrán un recuento más bajo y un mayor riesgo de sangrado que los pacientes respondedores. Para simular el riesgo de sangrado se utilizaron los datos del ensayo RAISE12, presuponiendo que los pacientes no respondedores se comportan de la misma forma que los del brazo placebo en relación con el riesgo de sangrado, mientras que los pacientes respondedores presentan una reducción del riesgo similar a la observada en el brazo de tratamiento del ensayo.
Esta presuposición parece ser válida considerando la eficacia demostrada por eltrombopag y la duración del ensayo RAISE, que fue equivalente a la del modelo (6 meses). Las intensidades de sangrado utilizadas en el modelo vienen reflejadas en la Tabla Suplementaria 5. Los sangrados de grado 4 son potencialmente letales, con una tasa de mortalidad del 40%.
Tabla suplementaria 5. Tipo de sangrado según respuesta

Un 80% de los pacientes que sobreviven a dichos sangrados requieren rehabilitación24.
Recursos y costes
Para la estimación de costes, calculamos la media de los precios oficiales establecidos por las distintas comunidades autónomas españolas (Tabla Suplementaria 6). Los precios han sido actualizados a euros de 2018 (€2018).
Como ambas alternativas de tratamiento eran con fármacos utilizados en el entorno hospitalario, se utilizaron los precios mayoristas, excluyendo de este modo los costes adicionales relacionados con los canales de distribución y la venta en farmacia.
La Tabla Suplementaria 7 muestra los precios mayoristas (PM) de los distintos fármacos, tal y como aparecen en la base de datos farmacológica en línea del Consejo General de Colegios Oficiales de Farmacéuticos (BotPlusWeb Portalfarma), consultada el 1 de junio de 2018 (https:// botplusweb.portalfarma.com).
Tabla suplementaria 7. Costes incluidos en el modelo
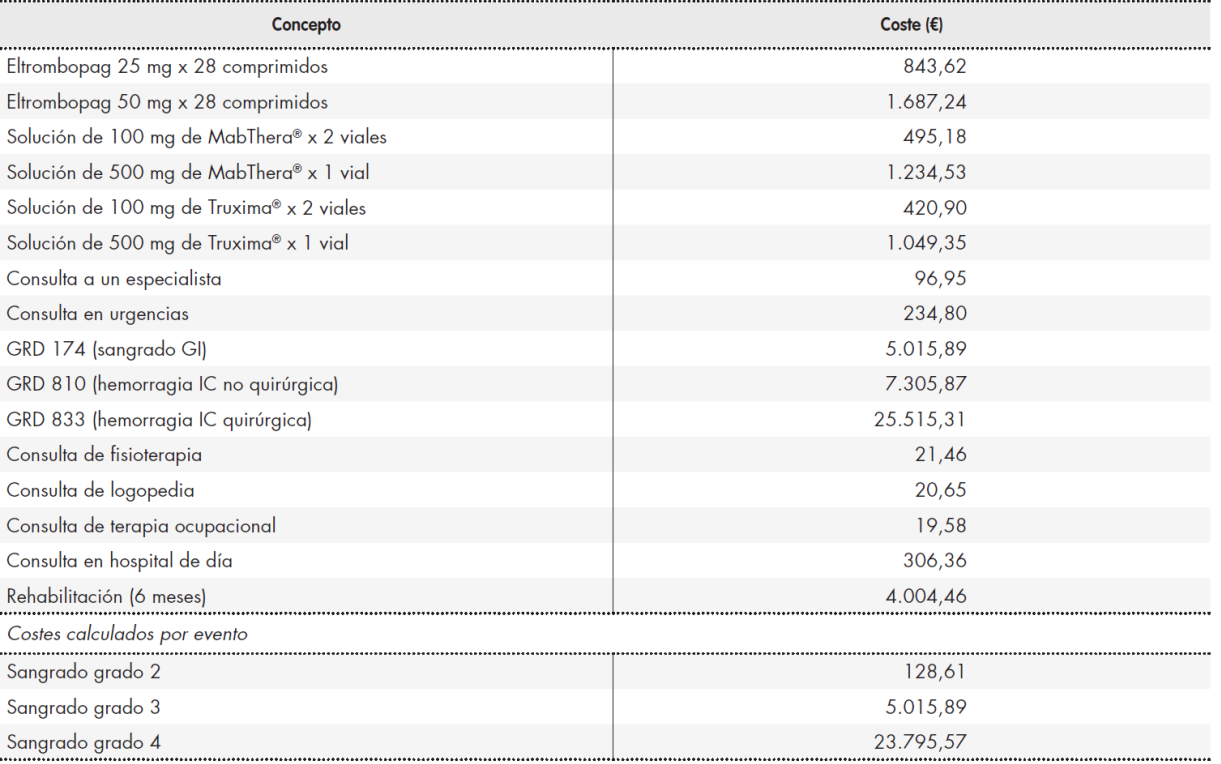
GI: gastrointestinal; GRD: grupo relacionado por el diagnóstico; IC: intracraneal
Para calcular el coste farmacológico, consideramos el coste por mg de cada fármaco y lo multiplicamos por las dosis descritas en los ensayos. Cada tratamiento con rituximab consta de cuatro ciclos de 375 mg por metro cuadrado de superficie corporal20, lo que supone una dosis diaria de 25 mg para el 17,13% de los pacientes, de 50 mg para el 40,89% y de 75 mg para el 41,98%12. En el caso de rituximab, debe añadirse un coste extra relativo a la administración del fármaco, ya que ésta debe ser realizada en el hospital. Hemos asumido una carga económica equivalente al coste diario de estancia hospitalaria.
La Tabla Suplementaria 7 también incluye costes no farmacológicos. La respuesta a eltrombopag se comprueba semanalmente durante las primeras 8 semanas y una vez al mes desde entonces. Las comprobaciones de la respuesta a rituximab se realizan semanalmente durante las primeras 4 semanas y de forma mensual a partir de este momento. Según el cálculo realizado, el coste de tratar un sangrado de grado 2 equivale al 60% del coste de una consulta con un especialista, más el 30% del coste de una visita a urgencias. Para los sangrados de grado 3, planteamos un coste equivalente al del grupo relacionado por el diagnóstico (GRD) 174 de la OMS (hemorragia gastrointestinal); y para los sangrados de grado 4 un coste equivalente al 20% del coste del GRD 810 de la OMS (hemorragia intracraneal susceptible de tratamiento médico), más 80% del coste del GRD 833 (hemorragia intracraneal tributaria de tratamiento quirúrgico) añadiendo, en su caso, el coste de la rehabilitación. La duración de la rehabilitación tras hemorragias de grado 4 se estimó en 6 meses, con una visita mensual al especialista en fisioterapia, cinco sesiones de fisioterapia y de logopedia por semana y tres sesiones semanales de terapia ocupacional25.
Análisis de sensibilidad
Para analizar el efecto de las distintas variables sobre los resultados del modelo llevamos a cabo 15 análisis de sensibilidad, que se describen en la Tabla Suplementaria 8.
Resultados
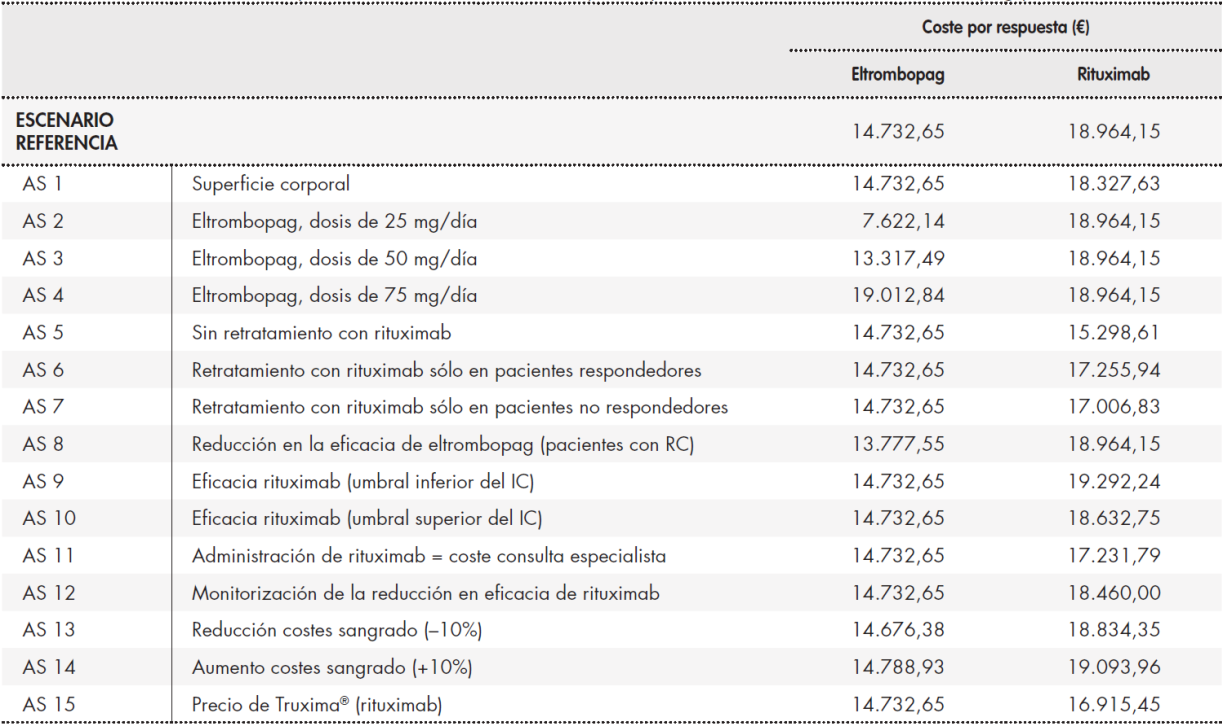
El coste medio por paciente tras 6 meses de tratamiento fue de 13.089,40 € para eltrombopag y de 11.852,60 € para rituximab. El desglose de costes muestra que la mayor tasa de respuesta del primer agente dio lugar a una mayor reducción de los costes por sangrado (811,27 € para rituximab y 499,97 € para eltrombopag). Debido a la menor eficacia de rituximab, el coste medio del tratamiento por paciente fue 29% superior con el anticuerpo monoclonal (14.732,65 € frente a 18.964,15 €).
La Tabla 1, Tabla 2 y Tabla 3 muestran el escenario de referencia y los análisis de sensibilidad. Los análisis de sensibilidad muestran que el coste de eltrombopag es más bajo en todos los casos, salvo en el caso de la administración de una dosis diaria de 75 mg de eltrombopag. En este caso, el coste del tratamiento con eltrombopag fue 5.039,58 € superior al del tratamiento con rituximab. Sin embargo, si se toma en consideración la respuesta obtenida, la diferencia se reduce a sólo 48 € sobre el coste de rituximab.
Tabla 1. Escenario de referencia y análisis de sensibilidad. Coste global del tratamiento con eltrombopag y rituximab
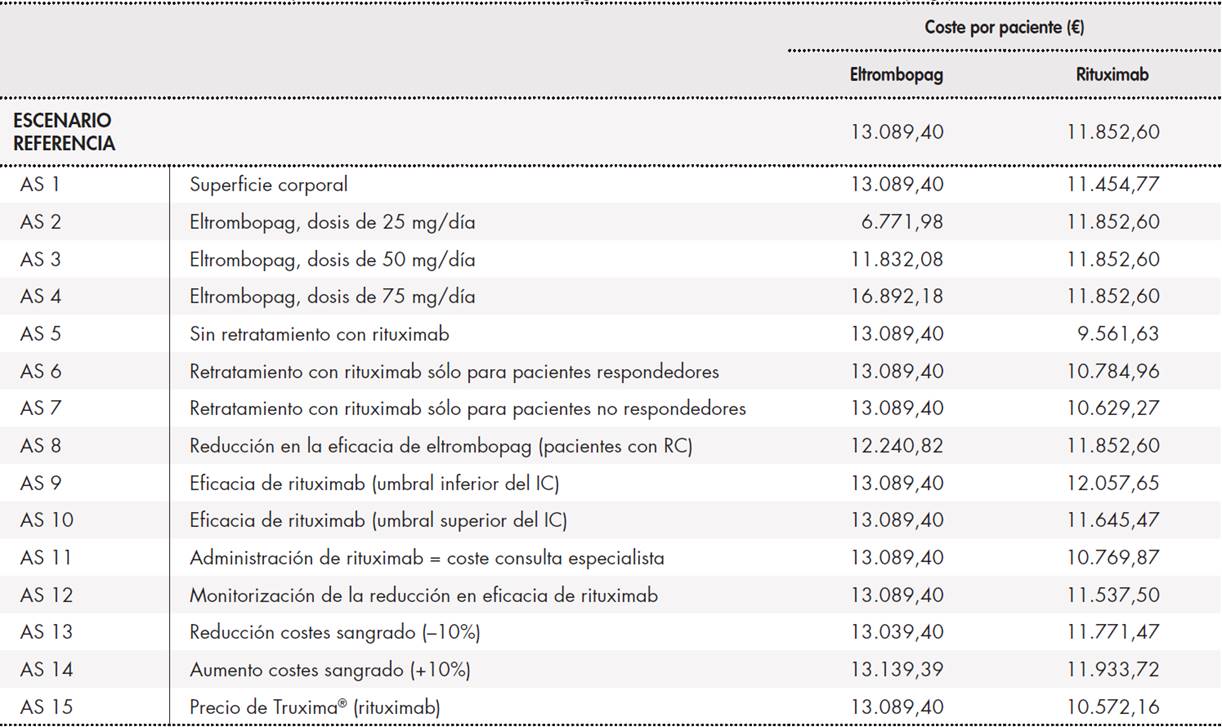
AS: análisis de sensibilidad; IC: intervalo de confianza; RC: respuesta completa.
Tabla 2. Escenario de referencia y análisis de sensibilidad. Detalle de los costes del tratamiento con eltrombopag y rituximab
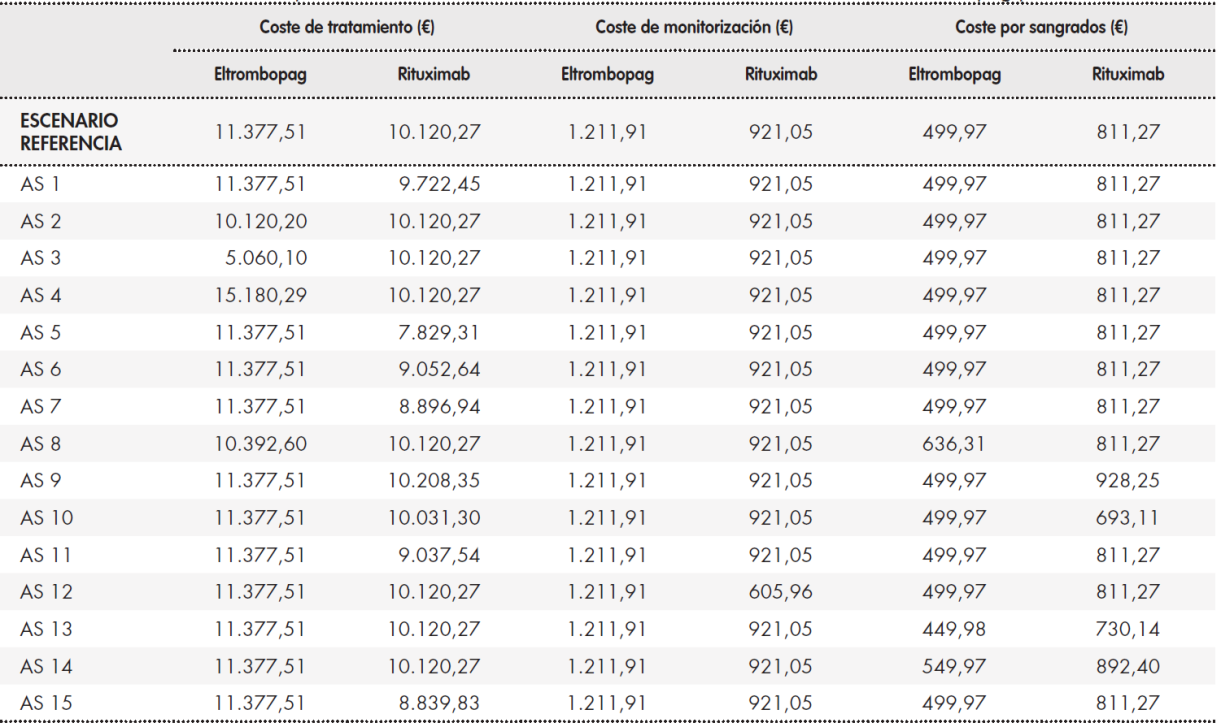
AS: análisis de sensibilidad.
Discusión
La negativa de los pacientes a someterse a cirugía, añadida a los riesgos asociados a cualquier procedimiento quirúrgico y al riesgo de desarrollar infecciones crónicas, eventos tromboembólicos y neoplasias malignas tras una esplenectomía, han incrementado en uso de AR-TPO y rituximab26,27. La última actualización de las guías de la Asociación Hematológica Americana para el tratamiento de la PTI recomienda el uso de rituximab frente a la esplenectomía y coloca a la esplenectomía y a los AR-TPO al mismo nivel7. La decisión entre rituximab y AR-TPO es motivo de debate en pacientes no respondedores a los corticoides o que padecen de PTI persistente7. Por ello, el coste y la efectividad de ambos tratamientos debe evaluarse cuidadosamente para garantizar la idoneidad de las decisiones médicas adoptadas. En este estudio, se seleccionó el AR-TPO eltrombopag en lugar de romiplostim debido a su administración por vía oral y fuera del entorno hospitalario. A diferencia de eltrombopag, romiplostim es un fármaco de administración subcutánea que requiere la intervención de personal de enfermería.
En este estudio queda demostrado que el coste de seis meses de tratamiento con rituximab o con eltrombopag es similar: 11.852,60 € para el primero frente a 13.089,40 € para el segundo. Ambos tratamientos inducen una respuesta favorable en el paciente y se asocian con escasos efectos secundarios. Sin embargo, se ha observado que la respuesta al tratamiento con eltrombopag es mayor que la de rituximab13, lo que hace que el coste de eltrombopag por paciente respondedor sea menor, aunque el coste del tratamiento en sí mismo sea más elevado. El coste medio del tratamiento con eltrombopag por paciente respondedor durante el periodo considerado es de 14.732,65 €, frente a 18.964,15 € para rituximab. Estos resultados están en línea con los de otras evaluaciones económicas llevadas a cabo en España, que han demostrado la favorable relación coste-beneficio de eltrombopag frente a romiplostim, y de romiplostim frente a rituximab16,25. Un reciente metaanálisis, que comparó indirectamente rituximab con los AR-TPO eltrombopag y romiplostim en el tratamiento de la PTI persistente sugiere que los AR-TPO son superiores al anticuerpo monoclonal en lo relativo a la respuesta (recuento plaquetario ≥ 50 × 109/l) y a los sangrados observados que, en el caso de rituximab, fueron significativos y severos28. Por otra parte, aunque el tratamiento con eltrombopag se considera crónico, se han publicado evidencias que sugieren que, en determinados casos, es posible suspender el tratamiento19.
Otra cuestión que es preciso considerar es que, a diferencia de eltrombopag que se administra en el domicilio del paciente por vía oral, la vía de administración de rituximab es intravenosa o subcutánea, siendo precisa la monitorización hospitalaria por si se producen efectos adversos. Así, el tratamiento con eltrombopag reduce la carga asistencial de los hospitales de día, permitiendo centrar los recursos en aquellos pacientes que necesitan acudir al centro para recibir tratamientos como quimioterapia.
Una limitación de este estudio es que el modelo utilizado no toma en consideración los eventos adversos causados por los tratamientos, que podrían ser más graves durante las primeras infusiones del anticuerpo monoclonal que en el caso del AR-TPO.
Teniendo en cuenta que los datos disponibles para rituximab no hacen referencia a los pacientes sometidos a esplenectomía, en nuestro modelo se ha tomado la media española del 22% de pacientes sometidos a esplenectomía, pero sin realizar desglose alguno de estos pacientes. Los estudios clínicos han demostrado que eltrombopag es más efectivo en pacientes no sometidos a esplenectomía12,29,30, por lo que un incremento del número de pacientes sometidos a esplenectomía podría conllevar una reducción de la tasa de respuesta.
Una última limitación tiene que ver con la posibilidad de usar rituximab en una dosis inferior (100 mg). En ausencia de datos de eficacia en relación con esta dosis más baja, esta opción se ha excluido del presente análisis (cabe destacar que el uso de datos que no resultaran suficientemente contrastados supondría en sí mismo una limitación adicional). Por otro lado, el uso de una dosis estándar de rituximab de 375 mg está en línea con lo expuesto en un artículo similar en el que se evaluó rituximab frente a romiplostim16, y que podría permitir una comparación entre ambos fármacos.
En definitiva, el coste del tratamiento con rituximab, incluidos los costes de monitorización y del tratamiento de los sangrados, es más elevado que el de eltrombopag. Esto, añadido a las prolongadas tasas de respuesta y a la baja incidencia de efectos no deseados de eltrombopag, avala la recomendación del tratamiento con este AR-TPO frente a rituximab. Este tipo de análisis debería realizarse de forma habitual en virtud de su utilidad a la hora de establecer políticas sanitarias y adoptar decisiones terapéuticas.
Contribución a la literatura científica
Determinación del coste de respuesta al tratamiento en pacientes con trombocitopenia inmune primaria en el sistema sanitario español.
Los datos obtenidos favorecen el uso de eltrombopag frente a rituximab en pacientes con trombocitopenia inmune primaria en España.
Bibliography
Rodeghiero F, Stasi R, Gernsheimer T, Michel M, Provan D, Arnold DM, et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report from an international working group. Blood. 2009;113(11):2386-93. DOI: 10.1182/blood-2008-07-162503 [ Links ]
Sanz MA, Vicente García V, Fernández A, López MF, Grande C, Jarque I, et al. (Guidelines for diagnosis, treatment and monitoring of primary immune thrombocytopenia). Med Clin (Barc). 2012;138(6):261.e1-17. DOI: 10.1016/j.medcli.2011.11.011 [ Links ]
Schoonen WM, Kucera G, Coalson J, Li L, Rutstein M, Mowat F, et al. Epidemiology of immune thrombocytopenic purpura in the General Practice Research Database. Br J Haematol. 2009;145(2):235-44. DOI: 10.1111/j.1365-2141.2009.07615.x [ Links ]
Rodeghiero F, Ruggeri M. ITP and international guidelines: what do we know, what do we need? Presse Med. 2014;43 (4 Pt 2):e61-7. DOI: 10.1016/j.lpm.2014.02.004 [ Links ]
Kahn MJ, McCrae KR. Splenectomy in immune thrombocytopenic purpura: recent controversies and long-term outcomes. Curr Hematol Rep. 2004:3(5):317-23. [ Links ]
Rubin LG, Schaffner W. Clinical practice. Care of the asplenic patient. N Engl J Med. 2014;371(4):349-56. DOI: 10.1056/NEJMcp1314291 [ Links ]
Neunert CE, Cooper N. Evidence-based management of immune thrombocytopenia: ASH guideline update. Hematology Am Soc Hematol Educ Program. 2018 Nov 30;2018(1):568-75. DOI: 10.1182/asheducation-2018.1.568 [ Links ]
González-Porras JR, Bastida JM. Eltrombopag in immune thrombocytopenia: efficacy review and update on drug safety. Ther Adv Drug Saf. 2018;9(6):263-85. DOI: 10.1177/2042098618769587 [ Links ]
Bussel JB, Cheng G, Saleh MN, Psaila B, Kovaleva L, Meddeb B, et al. Eltrombopag for the treatment of chronic idiopathic thrombocytopenic purpura. N Engl J Med. 2007;357(22):2237-47. DOI: 10.1056/NEJMoa073275 [ Links ]
Grainger JD, Locatelli F, Chotsampancharoen T, Donyush E, Pongtanakul B, Komvilaisak P, et al. Eltrombopag for children with chronic immune thrombocytopenia(PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015;386(10004):1649-58. DOI: 10.1016/S0140-6736(15)61107-2 [ Links ]
Tarantino MD, Bussel JB, Blanchette VS, Despotovic J, Bennett C, Raj A, et al. Romiplostim in children with immune thrombocytopenia: a phase 3, randomised, double-blind, placebo-controlled study. Lancet. 2016;388(10039):45-54. DOI: 10.1016/S0140-6736(16)00279-8 [ Links ]
Cheng G, Saleh MN, Marcher C, Vasey S, Mayer B, Aivado M, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6-month, randomised, phase 3 study. Lancet. 2011;377(9763):393-402. DOI: 10.1016/S0140-6736(10)60959-2 [ Links ]
Bylsma LC, Fryzek JP, Cetin K, Callaghan F, Bezold C, Mehta B, et al. Systematic literature review of treatments used for adult immune thrombocytopenia in the second-line setting. Am J Hematol. 2019;94(1):118-32. DOI: 10.1002/ajh.25301 [ Links ]
Bussel JB, Kuter DJ, George JN, McMillan R, Aledort LM, Conklin GT, et al. AMG 531, a thrombopoiesis-stimulating protein, for chronic ITP. N Engl J Med. 2006;355(16):1672-81. DOI: 10.1056/NEJMoa054626 [ Links ]
European Medicines Agency. Summary of Product Characteristics: Revolade (eltrombopag). (Internet). 2017. Disponible en: https://www.ema.europa.eu/en/documents/product-information/revolade-epar-productinformation_en.pdf [ Links ]
López MF, Mingot ME, Valcárcel D, Vicente García V, Perrin A, Campos Tapias I. Cost-per-responder analysis comparing romiplostim to rituximab in the treatment of adult primary immune thrombocytopenia in Spain. Med Clin (Barc). 2015;144(9):389-96. DOI: 10.1016/j.medcli.2013.11.035 [ Links ]
Brah S, Chiche L, Fanciullino R, Bornet C, Mancini J, Schleinitz N, et al. Efficacy of rituximab in immune thrombocytopenic purpura: a retrospective survey. Ann Hematol. 2012;91(2):279-85. DOI: 10.1007/s00277-011-1283-3 [ Links ]
European Medicines Agency. Summary of Product Characteristics: Mabthera (rituximab) (Internet). 2018. Disponible en: https://www.ema.europa.eu/en/documents/product-information/mabthera-epar-product-information_en.pdf [ Links ]
González-López TJ, Pascual C, Álvarez-Román MT, Fernández-Fuertes F, Sánchez-González B, Caparros I, et al. Successful discontinuation of eltrombopag after complete remission in patients with primary immune thrombocytopenia. Am J Hematol. 2015;90(3):E40-3. DOI: 10.1002/ajh.23900 [ Links ]
Arnold DM, Dentali F, Crowther MA, Meyer RM, Cook RJ, Sigouin C, et al. Systematic review: efficacy and safety of rituximab for adults with idiopathic thrombocytopenic purpura. Ann Intern Med. 2007;146(1):25-33. DOI: 10.7326/0003-4819-146-1-200701020-00006 [ Links ]
Du Bois D, Du Bois EF. A formula to estimate the approximate surface area if height and weight be known. Nutrition. 1989 Sep-Oct;5(5):303-11; discussion 312-3. PMID: 2520314. [ Links ]
Instituto Nacional de Estadística. European Survey of Health in Spain 2014 (Internet). 2015. Disponible en: https://www.ine.es/dyngs/INEbase/en/operacion.htm?c=Estadistica_C&cid=1254736176784&menu=resultados&idp=1254735573175#!tabs-1254736194728 [ Links ]
Fogarty PF, Tarantino MD, Brainsky A, Signorovitch J, Grotzinger KM. Selective validation of the WHO Bleeding Scale in patients with chronic immune thrombocytopenia. Curr Med Res Opin. 2012;28(1):79-87. DOI: 10.1185/03007995.2011.644849 [ Links ]
Cohen YC, Djulbegovic B, Shamai-Lubovitz O, Mozes B. The bleeding risk and natural history of idiopathic thrombocytopenic purpura in patients with persistent low platelet counts. Arch Intern Med. 2000;160(11):1630-8. DOI: 10.1001/archinte.160.11.1630 [ Links ]
Parrondo J, Grande C, Ibáñez J, Palau J, Páramo JA, Villa G. Economic evaluation of Thrombopoietin Receptor Agonists in the treatment of chronic primary immune thrombocytopenia. Farm Hosp. 2013;37(3):182-91. DOI: 10.7399/FH.2013.37.3.526 [ Links ]
Kristinsson SY, Gridley G, Hoover RN, Check D, Landgren O. Long-term risks after splenectomy among 8,149 cancer-free American veterans: a cohort study with up to 27 years follow-up. Haematologica. 2014;99(2):392-8. DOI: 10.3324/haematol.2013.092460 [ Links ]
Anguita E, Candel FJ, González-Del Castillo J, Martín-Sánchez FJ. Splenectomy in ITP: we keep removing a healthy functional organ. Ann Hematol. 2016;95(11):1911-2. DOI: 10.1007/s00277-016-2778-8 [ Links ]
Arai Y, Matsui H, Jo T, Kondo T, Takaori-Kondo A. Comparison of treatments for persistent/chronic immune thrombocytopenia: a systematic review and Network meta-analysis. Platelets. 2019;30(8):946-56. DOI: 10.1080/09537104.2018.1543864 [ Links ]
Mazza P, Minoia C, Melpignano A, Polimeno G, Cascavilla N, Di Renzo N, et al. The use of thrombopoietin-receptor agonists (TPO-RAs) in immune thrombocytopenia (ITP): a “real life” retrospective multicenter experience of the Rete Ematologica Pugliese (REP). Ann Hematol. 2016;95(2):239-44. DOI: 10.1007/s00277-015-2556-z [ Links ]
González-López TJ, Álvarez-Román MT, Pascual C, Sánchez-González B, Fernández-Fuentes F, Jarque I, et al. Eltrombopag safety and efficacy for primary chronic immune thrombocytopenia in clinical practice. Eur J Haematol. 2016;97(3):297-302. DOI: 10.1111/ejh.12725 [ Links ]
Recibido: 06 de Junio de 2020; Aprobado: 26 de Agosto de 2020











 texto en
texto en