Introducción
La artritis reumatoide (AR) es una enfermedad autoinmune sistémica, de carácter inflamatorio y crónico que afecta principalmente a la membrana sinovial conduciendo a la destrucción de las estructuras articulares1,2.
La sintomatología típica consiste en dolor, tumefacción y rigidez articular, junto con la limitación funcional de las articulaciones afectadas2. Además, se manifiesta mediante síntomas generales como fatiga, malestar general, rigidez matutina, debilidad y depresión que, asociados a la posible afectación extraarticular, disminuyen la calidad y esperanza de vida1.
Su prevalencia en España es del 1,07% (intervalo de confianza del 95% [IC95%]: 0,70-1,44) de la población adulta, afectando en un mayor porcentaje a mujeres y edades superiores a los 60 años3,4.
En los últimos años hemos asistido a una auténtica revolución en el tratamiento de la AR. El abordaje terapéutico incluye el uso de fármacos dirigidos al control de los síntomas a corto plazo (antiinflamatorios y corticoides) y el inicio simultáneo de una estrategia de fármacos modificadores de la enfermedad (FAME). Son fármacos de acción lenta dirigidos especialmente contra moléculas con implicación directa en la patogenia de la enfermedad. Se clasifican en tres grupos: FAME convencionales (FAMEc), FAME biológicos (FAMEb) y FAME sintéticos dirigidos5,6.
Actualmente existen fármacos que bloquean citoquinas, que impiden la coestimulación celular, que actúan frente a moléculas de superficie celular y fármacos dirigidos contra enzimas intracelulares Janus Kinasas (JAK) implicadas en la transmisión de las señales celulares imprescindibles para la producción de citoquinas inflamatorias. Estos fármacos son los inhibidores JAK (iJAK), pequeñas moléculas sintéticas que se administran por vía oral2,5-7.
El desarrollo de estos nuevos fármacos ha propiciado la puesta en marcha de estrategias en el tratamiento de los pacientes con AR como el tratamiento precoz, el tratamiento por objetivo y control cercano y el desarrollo de herramientas que permiten una mejor monitorización de la enfermedad en cada momento de la misma5.
Baricitinib (BAR) es un inhibidor reversible y selectivo de la JAK tipo 1 y 2 y tofacitinib (TOF) es un inhibidor selectivo de las JAK tipos 1 y 3. Ambos están indicados, en monoterapia o asociados a metotrexato, en el tratamiento de la AR activa moderada-grave en adultos con respuesta inadecuada o intolerantes a uno o más FAME2,6.
Ambos fármacos han sido sometidos a extensos ensayos clínicos fase III y han demostrado mejoras rápidas en la actividad de la enfermedad, función y resultados percibidos por el paciente2,6,8. Diversos estudios y metaanálisis han evaluado la efectividad y seguridad en práctica clínica real de BAR y TOF en el tratamiento de la AR de pacientes que han fracasado a tratamientos previos comparados con otros FAMEc y FAMEb9-16.
Dado que los iJAK siguen representando una opción de tratamiento de la AR relativamente novedosa, existe la necesidad de utilizar la experiencia obtenida con dichos fármacos en un entorno clínico de vida real para evaluar más a fondo su seguridad y utilidad11.
El objetivo principal de este trabajo consiste en describir la efectividad y seguridad de BAR y TOF en pacientes diagnosticados de AR a tratamiento con estos iJAK en nuestro centro. Como objetivo secundario, analizar si existen diferencias entre ambos fármacos en práctica clínica real.
Métodos
Se realizó un estudio unicéntrico, observacional y retrospectivo. Se incluyeron pacientes diagnosticados de AR que cumplieron los criterios de financiación establecidos por la Comisión Autonómica Central de Farmacia y Terapéutica (CACFT) y que iniciaron tratamiento con BAR y TOF entre enero de 2018 y diciembre de 2019, con un período mínimo de 6 meses de tratamiento.
Los criterios establecidos por la CACFT para la utilización de BAR y TOF son17:
Ante el fallo primario a un antifactor de necrosis tumoral (anti-TNF).
En el caso de pérdida de eficacia al tratamiento previo con FAMEc y/o FAMEb atendiendo a criterios de eficiencia y las características de cada paciente.
Se utilizaron la historia clínica electrónica (IANUS® versión 04.53.0102) y el aplicativo informático de dispensación a pacientes externos (Silicon® versión 10.5.0) como fuentes de datos demográficos, analíticos, farmacoterapéuticos y clínicos.
Las variables recogidas fueron edad y sexo como variables demográficas, factor reumatoide (FR) y anticuerpos anticitrulina (ACCP) como factores de mal pronóstico, tratamiento previo con FAMEc y FAMEb, duración del tratamiento, tratamiento concomitante con corticoides, tratamiento concomitante con FAMEc, número de articulaciones inflamadas (NAI) y dolorosas (NAD), puntuación en la escala visual analógica del dolor (EVA), puntuación en la escala de medida de la actividad de la enfermedad (DAS28), reacciones adversas (RA), suspensión del tratamiento y motivo de suspensión.
Para evaluar la efectividad se utilizó como variable principal la disminución en la escala DAS28 a los 6 y 12 meses de tratamiento. Como variables secundarias se utilizaron la disminución en el NAI y NAD, y la disminución en la puntuación de la escala EVA a los 6 y 12 meses del inicio del tratamiento.
La seguridad se evaluó mediante la detección de RA, a través de las manifestaciones clínicas registradas en la historia clínica.
Las variables cualitativas se presentaron con su frecuencia absoluta y porcentaje. Las variables cuantitativas se expresaron con su mediana y rango. Se realizó el test de normalidad de Shapiro-Wilk para comprobar la distribución normal de las variables dependientes.
Para analizar las diferencias entre los dos iJAK (BAR y TOF) se utilizó la prueba t-student con un nivel de significancia estadística (p < 0,05). El programa estadístico utilizado fue el software R-Commander (versión Rx64 3.6.1). Toda la información fue anonimizada y no contiene datos de carácter personal.
Resultados
Características de los pacientes
Durante el periodo enero de 2018 y diciembre de 2019 iniciaron tratamiento con BAR y TOF 48 pacientes en nuestro centro. Se excluyeron 4 pacientes por no llevar un mínimo de 6 meses en tratamiento.
Se evaluaron un total de 44 pacientes, de los cuales 20 (45,5%) recibieron tratamiento con BAR a dosis de 4 mg/24 h y 24 (54,5%) recibieron TOF a dosis de 5 mg/12 h. El 95,0% de los pacientes con BAR y el 70,8% de los pacientes con TOF realizaron tratamiento en monoterapia.
Las características demográficas, factores de mal pronóstico y tratamiento previo recibido con FAMEc y/o FAMEb se describen en la tabla 1.
Tabla 1. Características de los pacientes, factores de mal pronóstico y tratamientos previos.
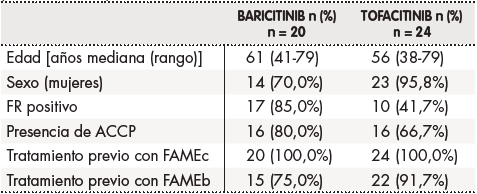
ACCP: anticuerpos anticitrulina; FAMEb: fármacos modificadores de la enfermedad biológicos; FAMEc: fármacos modificadores de la enfermedad convencionales; FR: factor reumatoide; n: número de pacientes.
La mediana (rango) de líneas de tratamiento previo con FAMEb fue de 2 (0-7) para pacientes del grupo BAR y 2 (1-6) para pacientes del grupo TOF. Los FAMEb utilizados fueron etanercept en 23 (47,9%) pacientes, adalimumab en 17 (35,4%) pacientes, abatacept en 15 (31,2%) pacientes, certolizumab en 13 (27,1%) pacientes, infliximab en 13 (27,1%) pacientes, tocilizumab en 13 (27,1%) pacientes, rituximab en 8 (16,7%) pacientes, golimumab en 7 (14,6%) pacientes, ustekinumab en 3 (6,3%) pacientes y secukinumab en 2 (4,2%) pacientes.
Resultados de efectividad
La puntuación en la escala DAS28 se redujo en 2,3 puntos a los 6 meses y 1,7 puntos a los 12 meses en el grupo de pacientes que recibieron tratamiento con BAR comparado con el grupo TOF, en el que la puntuación se redujo en 2 puntos a los 6 meses y 1,9 puntos a los 12 meses. Los resultados no mostraron diferencias estadísticamente significativas (p = 0,074) (Tabla 2).
Tabla 2. Puntuaciones en la escala DAS28.

DAS28: escala de medida de actividad de la enfermedad; t0: inicial; t6: a los 6 meses; t12: a los 12 meses.
El NAI se redujo en 7 tanto a los 6 como a los 12 meses en el grupo BAR y en 4 en el grupo TOF, sin observarse diferencias estadísticamente significativas entre ambos grupos de pacientes (p = 0,42) (Tabla 3).
Tabla 3. Evolución en el número de articulaciones inflamadas y dolorosas.

NAD: número de articulaciones dolorosas; NAI: número de articulaciones inflamadas; t0: inicial; t6: a los 6 meses; t12: a los 12 meses.
El NAD se redujo en 7 tanto a los 6 como a los 12 meses en el grupo BAR y en 6 en el grupo TOF. Los resultados tampoco mostraron diferencias significativas entre ambos fármacos (p = 0,67) (Tabla 3).
La puntuación en la escala EVA se redujo en 7,8 puntos a los 6 meses y 6,8 puntos a los 12 meses en el grupo BAR versus 5 puntos a los 6 meses y 6 puntos a los 12 meses en el grupo TOF. No se observaron diferencias estadísticamente significativas entre ambos grupos de pacientes (p = 0,66) (Tabla 4).
Tabla 4. Puntuaciones en la Escala Visual Analógica del dolor.

EVA: Escala Visual Analógica del dolor; t0: inicial; t6: a los 6 meses; t12: a los 12 meses.
Precisaron tratamiento concomitante con corticoides 8 (40,0%) de los pacientes que recibieron tratamiento con BAR y 15 (62,5%) de los pacientes que recibieron tratamiento con TOF. No se observaron diferencias estadísticamente significativas entre ambos fármacos (p = 0,17).
La mediana (rango) de duración de tratamiento fue de 14 (7-24) meses en los pacientes que recibieron tratamiento con BAR y de 14 (7-27) meses en los pacientes que recibieron tratamiento con TOF.
El 10% (2) de los pacientes en tratamiento con BAR y el 25% (6) de los pacientes con TOF suspendieron el tratamiento por falta de efectividad debido a un fallo secundario.
Resultados de seguridad
En los pacientes que recibieron tratamiento con BAR, 2 (10%) pacientes presentaron RA; 1 (50%) paciente experimentó aumento de colesterol LDL y transaminasas en el control analítico como RA moderada que ocasionó la suspensión del tratamiento, y 1 (50%) paciente sufrió trastornos gastrointestinales de carácter leve.
De los pacientes que recibieron tratamiento con TOF, 3 (12,5%) experimentaron alguna RA: 1 (33,3%) paciente sufrió enfermedad pulmonar intersticial difusa como RA grave que motivó la suspensión del tratamiento. Los otros 2 pacientes experimentaron RA leves: 1 (33,3%) paciente sufrió astenia y 1 (33,3%) paciente padeció alteraciones gastrointestinales.
El 5% (1) de los pacientes que recibieron BAR y el 4,2% (1) de los pacientes que recibieron TOF suspendieron el tratamiento por RA moderadas/graves.
Los resultados en cuanto a seguridad no mostraron diferencias estadísticamente significativas entre ambos grupos de pacientes (p = 0,5).
Discusión
La AR es la forma de poliartritis crónica más prevalente y con mayor impacto sociosanitario en nuestro medio. La AR puede provocar diferentes grados de discapacidad, pérdida de calidad de vida e incluso aumento de la mortalidad1.
Las recomendaciones de tratamiento actuales vigentes en nuestro país, así como el protocolo de tratamiento establecido por la CACFT recomiendan utilizar FAMEc como tratamiento de inicio en cuanto se diagnostique la AR. Cuando el objetivo terapéutico no se ha alcanzado con esta primera estrategia, se pueden utilizar otros FAMEc en terapia secuencial o combinada o añadir un FAMEb en función de las características del paciente y la presencia de factores de mal pronóstico. Después del fracaso a un primer FAMEb, se recomienda que el paciente sea tratado con otro FAMEb o un fármaco sintético dirigido1,17,18.
En nuestro estudio, todos los pacientes recibieron tratamiento con FAMEc y la mayoría (75,0% del grupo TOF y 91,7% del grupo BAR) más de un FAMEb previo, con una mediana de líneas de tratamiento de 2, siendo el más frecuente etanercept. Estos resultados se asemejan a los descritos por Mueller et al.11 en el que un 84,7% de los pacientes del estudio habían recibido al menos un FAMEb previo con una media de líneas de tratamiento de 2,2.
En cuanto a las características demográficas de los pacientes, el grupo TOF era ligeramente más joven y con menos factores de mal pronóstico, pero había un mayor número de mujeres. Estos resultados difieren de los publicados en diversos estudios en los que, aunque la mayoría de los pacientes son mujeres, la población del grupo TOF presenta mayor edad que la población que recibió tratamiento con BAR11-16.
Aunque la puntuación en la escala DAS28 y EVA al inicio del tratamiento era similar entre ambos grupos, el grupo BAR presentaba un mayor NAI y NAD. Estos datos son similares a los descritos por Guidelli et al. para evaluar la eficacia y seguridad de BAR, en el que los pacientes presentaban al inicio de tratamiento una puntuación en la escala DAS28 de 4,67 ± 1,05, NAD 7,6 ± 5,7 y NAI 5,5 ± 4,5 [media ± desviación estándar (DE)]14.
Las dosis recibidas de ambos fármacos fueron las descritas en la ficha técnica. Aunque en el caso del BAR la ficha técnica especifica que una dosis de 2 mg al día puede ser apropiada en pacientes de edad igual o superior a 75 años19; cabe destacar que, en nuestra muestra, todos los pacientes del grupo BAR recibieron una dosis de 4 mg diarios aunque había pacientes de mayor edad. Esta dosis de BAR coincide con la administrada en diversas publicaciones, pero la media de edad de los pacientes no superaba los 75 años13,14,16. A pesar de haber pacientes que recibieron una dosis superior a la recomendada en ficha técnica para su edad, no se observaron RA relacionadas.
Desde la comercialización de los iJAK, diversos estudios en vida real evaluaron la efectividad y seguridad de BAR y TOF con resultados similares a los obtenidos en nuestra población.
Iwamoto et al. realizaron un estudio para evaluar la efectividad y seguridad de TOF en el que se observó una disminución en la puntuación en la escala DAS28 (media ± DE) de 5,04 ± 1,33 a 3,83 ± 1,11 a las 4 semanas, 3,69 ± 1,19 a las 12 semanas y 3,53 ± 1,17 a las 24 semanas12.
Spinelli et al. realizaron un estudio para evaluar la efectividad y seguridad de BAR durante 48 semanas en 59 pacientes diagnosticados de AR en el que los resultados [mediana (rango intercuartílico)] mostraron una reducción del DAS28 de 4,68 (1,5) inicial a 3,41 (1,6), 2,79 (1,52), 2,79 (1,66) y 2,77 (1,55); el NAD de 8 (7) a 4 (5), 2 (4) 1, (5,5) y 1 (4,5) y el NAI de 4 (4) a 1 (3), 0 (2,25), 0 (4) y 0 (1) a las 4, 12, 24 y 48 semanas, respectivamente. Además, también se registró una mejoría significativa de la percepción de la enfermedad del paciente en la escala EVA13. Estos datos son semejantes a los obtenidos en nuestro estudio para DAS28 y EVA. En cuanto al NAI y NAD, nuestra población tenía un mayor NAI inicial, por lo que la reducción fue superior; sin embargo, los resultados obtenidos para el NAD fueron similares.
En cuanto a los resultados obtenidos sobre la suspensión de tratamiento por pérdida de efectividad, en nuestro estudio el 10% de los pacientes en tratamiento con BAR y el 25% de los pacientes con TOF suspendieron el tratamiento por este motivo. Estos resultados son semejantes a los descritos en estudios previos para ambos fármacos13,15. Sin embargo, comparado con el estudio realizado por Fitton et al.16, en el que 14 de 54 pacientes del grupo TOF y 15 de 69 pacientes del grupo BAR suspendieron el tratamiento por ineficacia, fue menor el porcentaje de pacientes del grupo BAR que suspendió el tratamiento por pérdida de eficacia en nuestra población de estudio.
Los glucocorticoides se encuentran entre los fármacos antiinflamatorios e inmunosupresores más usados en la AR. En países de nuestro entorno los pacientes con AR activa usan glucocorticoides de forma concomitante con FAMEc en porcentajes que van desde el 38% al 55%.. En el estudio realizado por Spinelli et al.13, al inicio del tratamiento un 78% de los pacientes estaban tomando corticoides de manera concomitante. Este porcentaje se disminuyó al 34,8% al final del periodo de estudio. En el estudio realizado por Guidelli et al.14 el porcentaje de pacientes que tomaban corticoides de forma concomitante se redujo del 70% al 32% al final del periodo de estudio. Estos resultados son similares a los descritos en nuestro estudio, en el que, además, no se observaron diferencias significativas en cuanto a la necesidad de corticoides durante el tratamiento con ambos fármacos.
La seguridad de BAR y TOF fue extensamente estudiada en los estudios pivotales y los estudios publicados anteriormente comentados, siendo las RA descritas con mayor frecuencia las infecciones seguidas de cefalea, náuseas, hipertensión y diarrea para TOF y aumento de LDL, elevación de enzimas hepáticas y náuseas para BAR1,2,6,11-18,20. Estas RA coinciden con las observadas en nuestra población de estudio para ambos fármacos, pero cabe destacar que, siendo las infecciones una de las RA más habituales en este tipo de tratamientos, no se detectó ningún signo de infección en la población de estudio. Además, sólo un pequeño porcentaje de pacientes suspendió el tratamiento debido a RA graves.
Por otro lado, la Agencia Española de Medicamentos y Productos Sanitarios publicó en 2019 una nota informativa con restricciones de uso de TOF debido al incremento de riesgo de tromboembolismo venoso dosisdependiente en pacientes con al menos un factor de riesgo21. No se observó ningún efecto de este tipo en nuestra población de estudio.
Las principales limitaciones de este estudio incluyen su diseño retrospectivo y observacional, ser un estudio unicéntrico con un bajo número de pacientes, además de los posibles sesgos derivados de la ausencia de datos en las historias clínicas. Sin embargo, se trata de un estudio en práctica clínica habitual que hace que los resultados obtenidos puedan ser extrapolados a otros entornos hospitalarios.
En base a nuestros resultados, BAR y TOF han demostrado ser efectivos y seguros en la disminución en la puntuación de la escala DAS28, el NAI, NAD y en la puntuación de la escala EVA. Además, ambos fármacos resultaron similares en cuanto a su efectividad y seguridad en la práctica clínica habitual del tratamiento de la AR.
Aportación a la literatura científica
La artritis reumatoide es una patología inflamatoria crónica con una elevada prevalencia, que causa una importante discapacidad y disminución de la calidad de vida de los pacientes, y con un importante impacto sociosanitario en nuestro entorno. En los últimos años hemos asistido a una revolución en el tratamiento de esta patología con el desarrollo de fármacos dirigidos contra moléculas con implicación directa en la patología de la enfermedad.
La evaluación de la efectividad y seguridad de estos fármacos en práctica clínica habitual permitirá tener un mayor conocimiento de las diferentes alternativas terapéuticas de esta patología y sus efectos beneficiosos y/o perjudiciales en los pacientes.














