Introducción
La prescripción de medicaciones potencialmente inapropiadas (MPI) es una cuestión especialmente relevante en los pacientes de edad avanzada y/o polimedicados, tanto por su elevada prevalencia1,2, como por sus consecuencias negativas, tales como el incremento de riesgo de morbimortalidad y de costes sanitarios3,4.
Se pueden considerar MPI como aquellas que presentan un balance beneficio-riesgo y/o coste-efectividad desfavorable5, y para su detección se dispone de diversas herramientas. Por un lado, existen métodos implícitos (por ejemplo, Medication Appropriateness Index6), que están basados en juicios clínicos y tienen en cuenta circunstancias específicas del paciente y del tratamiento. Por otro lado, los métodos explícitos consideran escenarios predefinidos de MPI basados en la evidencia y en el consenso de expertos, entre los que cabe destacar por su amplia utilización los criterios Beers, o los criterios STOPP/START (Screening Tool of Older Person’s potentially inappropriate Prescriptions/Screening Tool to Alert doctors to the Right Treatment)7,8. Además, existen también los denominados indicadores de calidad de prescripción (ICP), que son herramientas de gestión desarrolladas por las instituciones sanitarias para detectar fármacos o grupos terapéuticos con alternativas más coste-efectivas9.
No existe un único método ideal para evaluar la adecuación de la prescripción en pacientes pluripatológicos y/o polimedicados (en tratamiento con ≥ 5 fármacos) e hiperpolimedicados (≥ 10 fármacos)10. Por este motivo, Alfaro-Lara et al. consideran interesante el desarrollo de estrategias basadas en la combinación de diferentes métodos11.
La implicación del farmacéutico en la optimización de la farmacoterapia del paciente geriátrico ha mostrado resultados positivos respecto a reducción de MPI y costes de medicamentos12-14, pero con datos menos consistentes sobre resultados en salud15.
Sin embargo, no se han encontrado ensayos clínicos aleatorizados por clúster, para prevenir contaminación entre pacientes del grupo intervención (GI) y grupo control (GC) atendidos por el mismo médico, que evalúen globalmente la efectividad de una revisión sistemática de la medicación conducida por el farmacéutico (RSM-F) basada en la combinación de diferentes herramientas de detección de MPI sobre variables de adecuación, resultados en salud y costes sanitarios, en pacientes mayores polimedicados en el ámbito de atención primaria (AP).
Basándose en la hipótesis de que la RSM-F podría reducir la prevalencia de MPI en pacientes mayores polimedicados en AP, se realizará un ensayo clínico prospectivo, multicéntrico, abierto, controlado y aleatorizado por clústeres, cuyos objetivos serán evaluar la reducción de proporción de pacientes con ≥ 1 MPI y número medio de MPI/paciente (objetivos principales) y la reducción de la morbimortalidad y los costes de medicamentos y recursos asistenciales (objetivos secundarios).
Métodos
Siguiendo recomendaciones de la declaración Standard Protocol Items: Recommendations for Interventional Trials (SPIRIT)16, se plantea la metodología de nuestro estudio.
Ámbito
Este ensayo clínico será realizado en seis centros de salud de AP del Sector Sanitario Tramuntana, con una población de referencia de aproximadamente 128.000 personas, siendo aproximadamente el 15% mayores de 65 años.
Criterios de selección
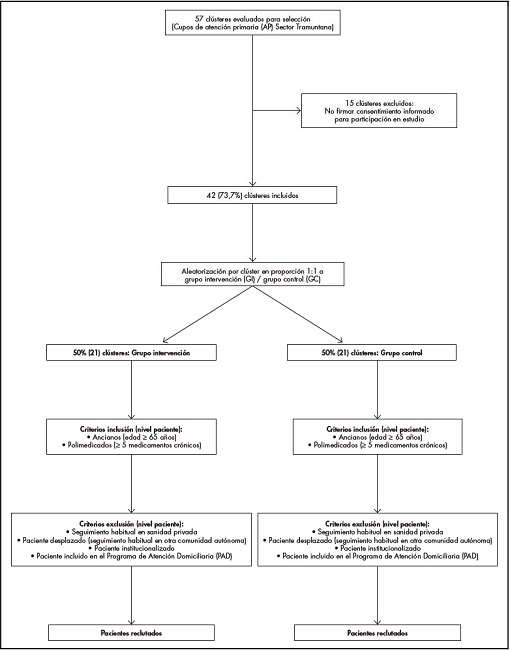
A nivel clúster, serán incluidos los cupos (conjuntos de pacientes atendidos por el mismo médico) de AP cuyo médico responsable firme el consentimiento informado. De estos cupos, se incluirán pacientes de edad ≥ 65 años y en tratamiento con ≥ 5 fármacos crónicos, excluyendo aquellos que cumplan ≥ 1 de los siguientes criterios: atención habitual en la sanidad privada, desplazados, institucionalizados, incluidos en el programa de atención domiciliaria (Figura 1).
Intervención
La intervención se realizará a nivel clúster y consistirá en la RSM-F para detectar MPI y proporcionar recomendaciones al médico prescriptor sobre las estrategias terapéuticas más apropiadas para resolverlas, como se explica más detalladamente a continuación:
-
-Previamente, se recogerán los datos basales necesarios de la historia clínica electrónica (HCE), tanto para GI como para GC:
-Detección de MPI: Tanto para GI como para GC, se llevará a cabo mediante combinación de métodos explícitos e implícitos (criterios STOPP/START8, información procedente de las fichas técnicas de los medicamentos [https://www.cima.aemps.es/cima/publico/home.html], recomendaciones “no hacer” en el paciente crónico complejo17), con ayuda del programa informático CheckTheMeds® (https://www.checkthemeds.com), junto con la aplicación de la batería de ICP del Servicio de Salud de las Islas Baleares.
-Solamente para GI, se comunicará a los médicos prescriptores a través de la HCE y/o verbalmente, si se considera necesario, la estrategia más adecuada para manejar cada MPI, considerando circunstancias particulares del paciente (por ejemplo: sí/no tratamiento previo con la alternativa propuesta, otras comorbilidades y/o otros tratamientos). Dichas estrategias podrán consistir en: suspender el tratamiento, ajustar la posología, sustituir la medicación, añadir un nuevo medicamento; junto con recomendaciones específicas de manejo, como pautas de inicio o retirada gradual en los casos necesarios. En caso de detección de una MPI potencialmente peligrosa en el GC, se informará al médico prescriptor, pero no se emitirán recomendaciones.
Variables
En función de los objetivos del estudio, se evaluarán las siguientes variables a nivel paciente:
Variables independientes:
-Demográficas: edad, sexo.
-Clínicas: Índice de Comorbilidad de Charlson (ICC), proporción de pacientes con ≥ 2 patologías crónicas.
-Farmacoterapéuticas: número de medicaciones crónicas, proporción de pacientes polimedicados e hiperpolimedicados.
Variables primarias: Diferencia en la proporción de pacientes con MPI y número medio de MPI/paciente entre el momento de la intervención y 6 meses después. Se considerará MPI aquella prescripción que cumpla alguno de los siguientes criterios: no indicación basada en la evidencia, posología superior o inferior a la recomendada, duplicidad, contraindicación, interacción, ausencia de fármaco potencialmente beneficioso. También se considerarán MPI, en base a los criterios de calidad de prescripción del Servicio de Salud de las Islas Baleares, aquellos medicamentos comercializados en los 5 años anteriores y que no presentan aportación terapéutica relevante frente a las alternativas disponibles en el mercado (por ejemplo: saxagliptina, silodosina, rosuvastatina), y medicamentos diferentes a los considerados como primera elección en el tratamiento de las patologías más prevalentes en el ámbito ambulatorio (por ejemplo: antiulcerosos-omeprazol, antidiabéticos orales-metformina, estatinas-simvastatina).
Variables secundarias:
-Morbilidad: Diferencia en el número medio de recursos sanitarios frecuentados durante los 12 meses anteriores y posteriores a la intervención, tanto hospitalarios (HOSP) como ambulatorios (AMBU). Se definirá HOSP como la variable compuesta de días de ingreso hospitalario (DIH: estancia ≥ 13 horas en unidad de hospitalización o urgencias para recibir atención especializada18) y visitas al servicio de urgencias hospitalarias (SUH). Se considerará AMBU la variable compuesta de visitas a: servicio de urgencias de atención primaria (SUAP), consultas externas de atención especializada (CAE) y consultas de atención primaria (CAP)19.
-Mortalidad: Proporción de pacientes fallecidos durante los 12 meses posteriores a la intervención, y días de supervivencia durante los 12 meses posteriores a la intervención.
-Coste de medicamentos: Diferencia en el coste medio anual estimado por paciente de los medicamentos implicados en las MPI (CA-MPI) entre el momento de la intervención y 6 meses después (mismo marco temporal que la variable principal), según el precio de facturación reflejado en el nomenclátor autonómico.
-Coste de recursos sanitarios: Diferencia en el coste medio por paciente de los recursos sanitarios (HOSP + AMBU) frecuentados durante los 12 meses anteriores y posteriores a la intervención según las tarifas oficiales publicadas en el Boletín Oficial de las Islas Baleares18.
Marco temporal
A continuación, se detallan las fechas correspondientes a cada proceso del estudio:
-Reclutamiento de clústeres: Abril-mayo 2014.
-Asignación de clústeres: Enero 2015.
-Reclutamiento de pacientes: Enero-mayo 2015.
-Intervención: Enero-mayo 2015.
-Evaluación características basales: Enero-mayo 2015.
-Evaluación de variables principales: Julio-noviembre 2015.
-Evaluación de costes de medicamentos: Julio-noviembre 2015.
-Evaluación de morbimortalidad: Enero-mayo 2016.
-Evaluación de costes de recursos asistenciales: Enero-mayo 2016.
-Análisis y difusión de resultados: Junio 2016-Actualidad.
Tamaño muestral
El tamaño muestral se calculará mediante contraste de proporciones para una diferencia en la proporción de pacientes con MPI del 15% entre GI (80%) y GC (65%) en base a los resultados de un estudio piloto no publicado. Para un poder estadístico del 80%, y asumiendo una tasa de pérdidas alrededor del 10%, el tamaño muestral requerido es 153. Dividiendo el tamaño muestral entre los 21 clústeres incluidos, obtendremos un tamaño medio de 8 pacientes por clúster. Aplicando un coeficiente de correlación intraclúster de 0,0520, el factor de inflación será 1,35, resultando en un tamaño muestral final de 207 pacientes por grupo.
Reclutamiento
-Nivel clúster: Todos los médicos de AP del Sector Sanitario Tramuntana, en representación de sus respectivos cupos, que firmen el consentimiento informado serán reclutados y asignados aleatoriamente a GI o GC por el Instituto de Investigación Sanitaria de las Islas Baleares (IdISBa).
-Nivel paciente: Del listado resultante de la aleatorización, el farmacéutico que realizará la RSM-F seleccionará cada día un clúster del GI y GC en orden consecutivo, y reclutará todos los pacientes citados para el día siguiente que cumplan criterios de selección, hasta completar el tamaño muestral.
Asignación
Para prevenir la contaminación entre pacientes tratados por el mismo médico, IdISBa aleatorizará los clústeres a GI o GC en proporción 1:1 mediante aleatorización balanceada en bloques de cuatro clústeres a través del software “Computer Program for Epidemiologists: WINPEPI (http://www.brixtonhealth.com/pepi4windows.html)”; manteniendo la confidencialidad del resultado de la aleatorización para asegurar su ocultación.
Cegamiento (enmascaramiento)
El cegamiento de los participantes (clústeres) no será posible, debido a la comunicación de estrategias de manejo de las MPI a los médicos asignados al GI.
Recogida y manejo de datos
Los datos serán recogidos por el farmacéutico que realizará la RSM-F en una hoja de cálculo electrónica, la cual estará protegida por encriptación y almacenada en un servidor seguro custodiado por el Departamento de Informática del Hospital Comarcal de Inca.
Análisis estadístico
Variables
Las variables del estudio serán analizadas a nivel paciente por intención de tratar, teniendo en cuenta todos los pacientes reclutados según el grupo al que sean inicialmente aleatorizados.
Respecto a las características basales, se realizará:
-Análisis descriptivo: Se emplearán medidas de frecuencia y porcentaje para variables cualitativas y media ± desviación estándar o mediana (rango intercuartil) para variables cuantitativas según la distribución sea o no normal, respectivamente. La normalidad de distribución de las variables cuantitativas y la homogeneidad de las varianzas serán verificadas mediante las pruebas de Kolmogorov-Smirnov y Levene, respectivamente.
-Análisis comparativo: Para evaluar la homogeneidad entre GI-GC. Se emplearán la prueba chi-cuadrado, o la prueba exacta de Fischer si menos del 25% de las frecuencias esperadas es menor que 5 para variables cualitativas; y T-Student o U-Mann Whitney para variables cuantitativas dependiendo si la distribución es o no paramétrica, respectivamente.
Para las variables primarias y secundarias, se calculará la magnitud del efecto, expresada como diferencia de medias (variables cuantitativas) o diferencia de proporciones (variables cualitativas), aportando los correspondientes intervalos de confianza 95% (IC95) mediante las pruebas estadísticas que se indican a continuación:
Para tener en cuenta el efecto de clúster, se calculará el coeficiente de correlación kappa para las variables primarias.
Se considerará diferencia estadísticamente significativa si p < 0,05. El análisis estadístico se realizará mediante el software Statistical Package for Social Sciences for Windows (SPSS®) v22.0.
Análisis adicionales
No especificado en el protocolo, se evaluará el efecto de la intervención sobre los ingresos hospitalarios en los diferentes subgrupos resultantes de la combinación de los siguientes criterios: sexo (hombres/mujeres), edad (menor/mayor de 85 años), número de medicamentos (5-9/10 o más).
Monitorización
No se considera necesaria la constitución formal de un comité externo de monitorización de datos ni un análisis provisional, porque no se esperan daños asociados a la intervención. Por otro lado, en caso de recurrencia de síntomas asociados a la retirada de medicación inapropiada, ésta puede ser reiniciada en cualquier momento según juicio clínico.
Ética y difusión
Aprobación por comité de ética
El protocolo del estudio fue evaluado y aprobado por el Comité de Investigación de Atención Primaria de Mallorca y por el Comité de Ética de Investigación de las Islas Baleares con número IB2360/14 el 30/06/2014.
Enmiendas al protocolo
Desde su primera versión, el protocolo ha sufrido diversos cambios, los cuales se pueden consultar en el siguiente enlace: https://clinicaltrials.gov/ct2/history/NCT02224833.
Consentimiento informado
El Comité de Ética de Investigación de las Islas Baleares aceptó solicitar el consentimiento informado a los médicos en lugar de a los pacientes, ya que la RSM-F está dirigida al médico, quien finalmente decidirá modificar o no el tratamiento del paciente en base a las recomendaciones proporcionadas por el farmacéutico. Además, el reclutamiento de los pacientes el día anterior a la visita médica sin realizar preselección previa, y la alta dispersión de los centros participantes, hacen imposible la firma del consentimiento informado por el paciente.
Confidencialidad
Para asegurar la confidencialidad de la información, los pacientes serán identificados mediante un código alfanumérico de tres dígitos y una letra.
Acceso a datos
Este estudio es parte de la tesis doctoral del investigador principal. Por este motivo, los datos y materiales no estarán abiertamente disponibles para el público, y solamente pueden ser transferidos a terceras personas bajo autorización de la Universidad de Santiago de Compostela (http://www.usc.es/export9/sites/webinstitucional/gl/centros/cptf/edi/descargas_EDI/CDS_cas_06_10_16.pdf).
Política de difusión
Los resultados de este estudio serán publicados en revistas de revisión por pares, y serán presentados en congresos de geriatría, farmacia clínica y medicina general, así como tesis doctoral del investigador principal. Se seguirán las guías de selección de autores, y no se pretende el uso de escritores profesionales.
Discusión
En base al diseño de nuestro estudio, esperamos obtener reducción estadísticamente significativa en proporción de pacientes con MPI y número medio de MPI por paciente, así como en el coste de medicamentos, en línea con los resultados mostrados por otros autores13,14. Sin embargo, aunque esperamos observar una tendencia a la reducción de la morbimortalidad y de los costes de recursos asistenciales, las diferencias podrían no ser estadísticamente significativas, puesto que el tamaño muestral no se calculó para este fin, sino para demostrar reducción significativa de la proporción de pacientes con MPI.
Entre las fortalezas del estudio podríamos destacar la aleatorización por clústeres, que podría reducir la aparición de sesgos en los resultados al prevenir la contaminación entre pacientes de GI y GC atendidos por el mismo médico; o la aplicabilidad de los resultados tanto a otras áreas como a otros ámbitos con elevada prevalencia de este tipo de pacientes (unidades de hospitalización de medicina interna y/o geriatría; centros sociosanitarios y de cuidados prolongados, etc.) en base a la naturaleza pragmática del estudio y sus criterios de selección poco restrictivos. Además, la combinación de diversas herramientas (incluyendo criterios de eficiencia) permitirá detectar mayor cantidad de MPI y plantear mayor número de escenarios de optimización de prescripción.
Sin embargo, el estudio presenta algunas limitaciones. En primer lugar, su diseño abierto podría provocar la aparición de sesgos, al conocer los médicos su pertenencia al GI al recibir las recomendaciones del farmacéutico, lo cual podría ser minimizado mediante la aleatorización de clústeres por personal ajeno al estudio. Otra limitación podría ser considerar la HCE como única fuente de información y principal vía de comunicación. Este hecho podría provocar infra- o sobredetección de MPI al no tener en cuenta medicamentos no financiados o patologías no registradas en la HCE. Sin embargo, debido a que el diseño aleatorizado asegura grupos equilibrados, esperamos que este hecho afecte de forma similar a ambos grupos sin influir significativamente en el efecto de la intervención. Por otro lado, algunos autores consideran la comunicación directa médicofarmacéutico como el modo más efectivo para aceptar recomendaciones sobre adecuación de la prescripción13. Esto no será posible en nuestro estudio, porque el reclutamiento de pacientes y la RSM-F se realizarán el día anterior a la consulta médica y por la elevada dispersión geográfica de los centros participantes.
En conclusión, nuestro ensayo clínico controlado aleatorizado por clústeres proporcionará evidencia sobre la efectividad de una RSM-F consistente en la detección de MPI mediante combinación de diferentes herramientas (incluyendo criterios de eficiencia) y en la comunicación de las estrategias individualizadas más apropiadas para resolver dichas MPI en pacientes mayores polimedicados, no solamente sobre variables intermedias de adecuación, sino también sobre variables relevantes (morbimortalidad y costes sanitarios).
Aportación a la literatura científica
Nuestro estudio proporcionará evidencia del impacto en salud e impacto económico de la actuación del farmacéutico en la adecuación del tratamiento del paciente geriátrico.
Los resultados podrían ser aplicables no solamente a otras áreas de atención primaria, sino también a otros ámbitos asistenciales con elevada prevalencia de este tipo de pacientes, como, por ejemplo: determinadas unidades de hospitalización (medicina interna, geriatría); centros sociosanitarios y de cuidados prolongados, etc.