Introducción
La enfermedad de Crohn (EC) y la colitis ulcerosa (CU) son dos de los principales tipos de enfermedad intestinal inflamatoria (EII). Aunque aún se desconoce su etiología, los estudios realizados han encontrado altas concentraciones de factor de necrosis tumoral alfa (TNF-α) tanto en pacientes con EC como en aquellos con CU en comparación con el grupo control1. De ello se desprende que la terapia con anti-TNF es efectiva a la hora de inducir y mantener la remisión cínica y la curación de la mucosa (CM).
Adalimumab (ADA) e infliximab (IFX) son fármacos anti-TNF de primera línea utilizados en caso de respuesta inadecuada a tratamiento convencional en pacientes con EII activa de moderada a severa. Aunque en los últimos años se han sumado nuevos fármacos biológicos (ustekinumab, vedolizumab, etc.) o inhibidores de JAK como tofacitinib2 a las opciones farmacológicas dirigidas al tratamiento de la EII, las líneas disponibles tras el fracaso de los agentes anti-TNF son limitadas.
Sin embargo, entre un 10 y un 30% de los pacientes con EII tratados con agentes anti-TNF no responden a la terapia de inducción (ausencia de respuesta primaria), mientras que el 23-46% de los pacientes en remisión pierden respuesta durante el tratamiento (pérdida de respuesta secundaria). El mecanismo más habitualmente implicado en el desarrollo de la pérdida de respuesta es la formación de anticuerpos contra los agentes anti-TNF, que interfieren con la fijación del TNF, aceleran el aclaramiento de los fármacos y se asocian con menores niveles plasmáticos y una duración más corta de la respuesta3. La tasa de pérdida de respuesta a los 12 meses oscila entre el 23% y el 46% en pacientes con EC tratados con IFX o ADA4. Por consiguiente, alrededor del 25% de los pacientes con EC experimenta una pérdida de respuesta a IFX durante el primer año del tratamiento de mantenimiento5. Además, el perfil farmacocinético de los agentes anti-TNF varía enormemente de un paciente a otro en función de múltiples factores como el nivel de albúmina en sangre, el género, el índice de masa corporal (IMC), la presencia de inflamaciones sistémicas y la administración concomitante de agentes inmunosupresores6.
Concentraciones plasmáticas elevadas de estos agentes anti-TNF se han correlacionado con mejores resultados clínicos7. Dado que el gasto sanitario relacionado con la EII se ha atribuido principalmente a los costes farmacológicos8, la monitorización terapéutica de los fármacos administrados podría desempeñar un papel importante a la hora de reducir los costes sanitarios sin menoscabo de la eficacia9. La remisión profunda (RP), definida como remisión según biomarcadores, remisión clínica o CM, se ha convertido en una nueva diana terapéutica en el contexto de la EII10. No obstante, no se ha definido aún un punto de corte óptimo de concentración de IFX y ADA por encima del cual pueda afirmarse que se ha producido una RP.
El objetivo de este estudio fue definir un punto de corte óptimo de concentración valle de IFX y ADA durante la terapia de mantenimiento asociada con RP en pacientes con EII. El objetivo secundario fue evaluar la influencia de variables sociodemográficas, clínicas, farmacológicas y de biomarcador sobre las concentraciones de anti-TNF y sobre la RP.
Métodos
Diseño del estudio, definiciones y población estudiada
Se trata de un restudio retrospectivo observacional unicéntrico que incluyó pacientes con EC y CU tratados con IFX o ADA en el Hospital General Universitario de Castellón entre diciembre de 2013 y diciembre de 2020. Todos los pacientes consecutivos incluidos respondieron al tratamiento de inducción con IFX o ADA, siendo tratados mediante una estrategia de mantenimiento. La dosis de mantenimiento de IFX osciló entre 5 y 10 mg/kg, administrados cada 6 a 8 semanas. La dosis de ADA fue de 40 mg y se administró de forma semanal o quincenal.
La cohorte fue sometida a un examen endoscópico y a monitorización terapéutica farmacocinética. Se realizaron evaluaciones endoscópicas 5 días antes de la medición de las concentraciones valle de IFX y ADA. La evaluación de la actividad clínica de la enfermedad y las determinaciones serológicas se realizaron el día en que se midieron las concentraciones mínimas de IFX y ADA. Se excluyeron aquellos pacientes cuya dosificación no fue estable durante los 3 meses anteriores o los 30 días anteriores a la medición de las concentraciones valle de IFX o de ADA, respectivamente. Los datos analíticos y de tratamiento se obtuvieron a partir de las historias clínicas electrónicas de los pacientes hasta marzo de 2021. El estudio recibió la aprobación del Comité de Ética de la Investigación del Departamento.
Definiciones de remisión profunda
Se definió la DP como una remisión tanto analítica como clínica, que asimismo debía estar acompañada de CM. Para la remisión analítica, la PCR debía ser inferior a < 5 mg/l y la calprotectina fecal (CF) < 100 µg/g. En la EC, se consideró que se había alcanzado la remisión clínica si la puntuación en la escala de Harvey Bradshaw (HB) era < 5; para la CM, el índice endoscópico simple para EC (SES-CD) debía ser < 3. El estudio diagnóstico en pacientes con patología del íleon se realizó con la ayuda de estudios de enterorresonancia magnética. En CU, se requirió una puntuación total en la escala Mayo < 3 y, para la CM, el índice subendoscópico de Mayo debía ser < 2.
Monitorización terapéutica farmacocinética
Las muestras séricas de IFX y ADA fueron recogidas de forma rutinaria y sistemática por el área de farmacocinética del departamento de farmacia. Las muestras se extrajeron justo antes de la siguiente administración de IFX o ADA (concentración valle) en tubos separadores de suero. Tras el centrifugado (1.500 x g durante 10 minutos), el suero se distribuyó en alícuotas en dos tubos Eppendorf de polietileno debidamente identificados y se almacenó a –20 °C hasta su análisis. La monitorización terapéutica farmacocinética se realizó en estado estacionario, durante el tratamiento de mantenimiento, extrayéndose las muestras a partir de la semana 30 tras el comienzo del tratamiento con anti-TNF.
La concentración valle de anti-TNF y de anticuerpos frente a IFX (AAI) y ADA (AAA) se midió mediante un ensayo inmunoabsorbente ligado a enzimas Lisa-Tracker® automatizado y clínicamente validado (Theradiag Laboratories®). Esta técnica mide las concentraciones de inhibidores del TNF-α libre y de anticuerpos antifármaco libres11. El límite más bajo para la detección de concentraciones valle fue de 0,3 μg/ml para anti-TNF y de 10 ng/ml para los anticuerpos antifármaco.
Variables y serología basales
Se registraron las variables basales como el sexo, la edad en el momento del diagnóstico, el diagnóstico, el grado de fistulización perianal, la puntuación en la clasificación de Montreal de CU y EC, y la administración o no de tratamiento biológico previo. La duración de la terapia anti-TNF, el tratamiento biológico previo, el tratamiento concomitante con corticoides e inmunomoduladores, la presencia de hábito tabáquico, el peso, el IMC, los valores de PCR, CF, DR, remisión clínica, CM y las variables bioquímicas (hemoglobina, recuento de leucocitos, neutrófilos, plaquetas, albúmina) se determinaron el día de la extracción de muestras para el control terapéutico farmacocinético.
Análisis estadístico
Las características demográficas se representaron con medianas y rangos intercuartílicos (RIC) para las variables continuas y mediante frecuencias y porcentajes para las variables categóricas. En cuanto a las concentraciones plasmáticas de IFX y ADA, se realizó un análisis de las características operativas del receptor (ROC) utilizando la RP como variable de clasificación para calcular la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo, la razón de probabilidades y el área bajo de la curva ROC (AUROC) con el valor p asociado. Las concentraciones de ADA e IFX de los grupos se compararon mediante la prueba U de Mann-Whitney según la RP. Los niveles de RP se relacionaron con los incrementos en las concentraciones de anti-TNF mediante la prueba de chi cuadrado. Las concentraciones de anti-TNF se clarificaron en cuartiles. La prueba de chi cuadrado y la de Kruskal-Wallis se utilizaron para comparar las variables discretas o continuas entre los grupos de cuartiles. La prueba de chi-cuadrado y la de Mann-Whitney se utilizaron para realizar una evaluación univariante encaminada a determinar las variables categóricas o cuantitativas asociadas con la RP, respectivamente. Se llevó a cabo una regresión logística binaria multivariante, que incluyó las variables del análisis univariante realizado previamente con un valor de p < 0,1, tras aplicar el método regresivo de Wald para identificar las variables independientes asociadas con la RP. Los resultados se expresaron en términos de ratios de probabilidades, con intervalos de confianza del 95%. El valor de p debía ser < 0,05 para que los resultados fueran considerados estadísticamente significativos. El análisis estadístico se llevó a cabo con el programa informático STATA (versión 14,0).
Resultados
Población del estudio
Se incluyeron 120 y 122 pacientes tratados con IFX y ADA, respectivamente. La mayoría de los pacientes mostraron remisión analítica de conformidad con sus niveles de PCR< 5 mg/l (IFX, n = 95, 79,2%) (ADA, n = 80, 65,6%) y CF < 100 μg/g (IFX, n = 80, 66,7%) (ADA, n = 72, 59,0%). La RP se alcanzó en 52 de los 120 (43,3%) pacientes tratados con IFX y en 52 de los 122 (42,6%) tratados con ADA. Las características de la enfermedad y de los pacientes se recogen en la tabla 1.
Tabla 1. Características de los pacientes.

Anti-TNF: antifactor de necrosis tumoral; CF: calprotectina fecal; CM: curación de la mucosa; CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatória intestinal; IMC: índice de masa corporal; MTF: monitorización terapéutica farmacocinética; PRC: proteína C reactiva; RIC: rango intercuartílico; RP: remisión profunda.
†Clasificación de Montreal de la Enfermedad de Crohn. Localización: L1 íleon terminal, L2 colon, L3 ileocólica y L4 tracto digestivo alto. Comportamiento: B1 no estenosante no fistulizante, B2 estenosante, y B3 fistulizante.
‡Clasificación de Montreal de la colitis ulcerosa: E1 proctitis ulcerosa, E2 colitis ulcerosa izquierda y E3 colitis ulcerosa extensa.
Concentraciones de anti-TNF y remisión profunda
Las concentraciones medianas (RIC) de anti-TNF fueron significativamente más altas en pacientes en RP que en los que no la alcanzaron, tanto para los pacientes tratados con IFX (4,4; RIC: 3,3-6,5 versus 2,3; RIC: 1,1-4,2 μg/ml; p < 0,05) como en aquellos tratados con ADA (6,3; RIC: 4,2-8,2 versus 3,9; RIC: 2,4-5,5 μg/ml; P < 0,05). El análisis de la curva ROC identificó umbrales de concentración asociados con RP estadísticamente significativos de 3,1 μg/ml para IFX y de 6,3 μg/ml para ADA (figura 1). Las concentraciones séricas de anti-TNF más elevadas se asociaron con tasas más altas de RP en pacientes tratados tanto con IFX como ADA (figura 2). Los factores asociados con los cuartiles de las concentraciones séricas de anti-TNF se enumeran en la tabla 2. Los factores asociados con una mayor concentración de IFX fueron un mayor IMC, no haber sido operado previamente por EII, concentraciones de PCR < 5 mg/l y CF < 100 μg/g. En pacientes tratados con ADA, los factores asociados con una mayor concentración del fármaco fueron la administración concomitante de inmunomoduladores, bajo IMC, no haber sido operado previamente por EII, y concentraciones de PCR < 5 mg/l y de CF < 100 μg/g.
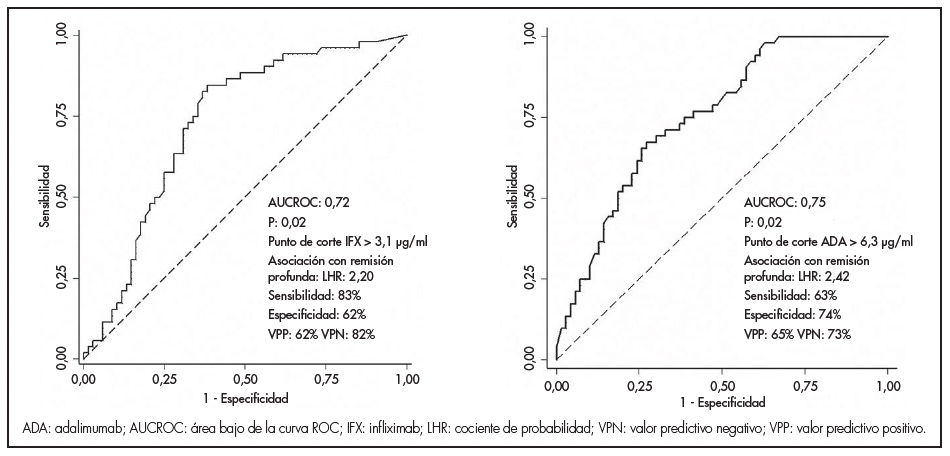
Figura 1. Curva ROC para las concentraciones valle de infliximab y adalimumab en pacientes con enfermedad intestinal inflamatoria (con remisión profunda versus sin remisión profunda).
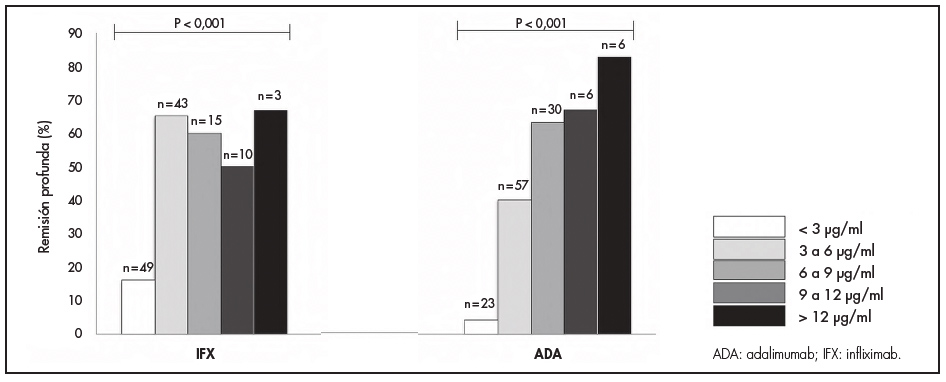
Figura 2. Tasas de remisión profunda por incrementos de concentraciones valle de 3 μg/ml in infliximab y adalimumab. (Los valores p indican la comparación entre distintas concentraciones). Prueba de chi cuadrado (asociación lineal por lineal).
Tabla 2. Resumen de factores que influyen sobre las concentraciones séricas de infliximab y adalimumab.
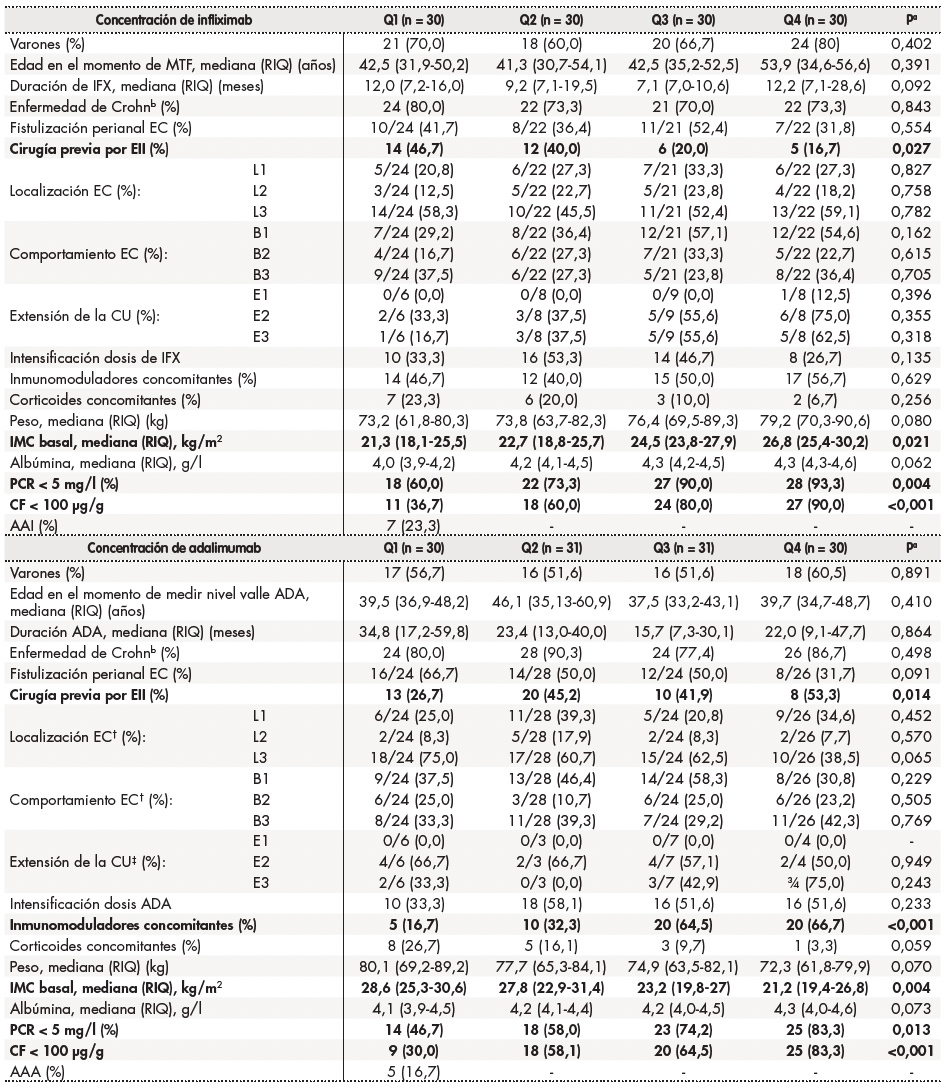
AAA: anticuerpos frente a adalimumab; ATI: anticuerpos frente a infliximab; CU: colitis ulcerosa; IMC: índice de masa corporal; Inmunomoduladores: tiopurina; MTF: monitorización terapéutica farmacocinética; PCR: proteína C reactiva; FC: calprotectina fecal; RIQ: rango intercuartílico.
aSe utilizaron las pruebas de Kruskal-Wallis y de chi cuadrado para comparar las variables continuas y las discretas, respectivamente.
bPorcentaje de EC frente a CU.
†Clasificación de Montreal de la enfermedad de Crohn. Localización: L1 íleon terminal, L2 colon, L3 ileocólica, y L4 tracto digestivo alto. Comportamiento: B1 no estenosante no fistulizante, B2 estenosante, y B3 fistulizante.
‡Clasificación de Montreal de la colitis ulcerosa: E1 proctitis ulcerosa, E2 CU izquierda, y E3 CU extensa.
Anticuerpos anti-TNF y remisión profunda
De todos los pacientes en tratamiento anti-TNF, sólo 7 (6%) de los que recibieron IFX y 5 (4%) de los que recibieron ADA desarrollaron AAI y AAA, respectivamente. Los niveles de anticuerpo oscilaron entre 16 y 1.440 ng/ml para los AAI y entre 12 y 672 ml para los AAA.
Factores asociados con la remisión profunda
El análisis univariante identificó los niveles de CF < 100 μg/g (p = 0,001) y de PCR < 5 mg/l (p = 0,028) y las concentraciones de IFX ≥ 3,1 μg/ml (P < 0,001) como variables asociadas con RP en pacientes tratados con IFX. En los pacientes tratados con ADA, las variables asociadas con DP según el análisis univariante fueron CF < 100 μg/g (p = 0,001), PCR < 5 mg/l (p = 0,002), concentraciones de ADA ≥ 6,3 μg/ml (p < 0,001) y ATA positivo (p = 0,049) (Tabla 3).
Tabla 3. Análisis univariante de las variables basales que influyen sobre la remisión profunda.
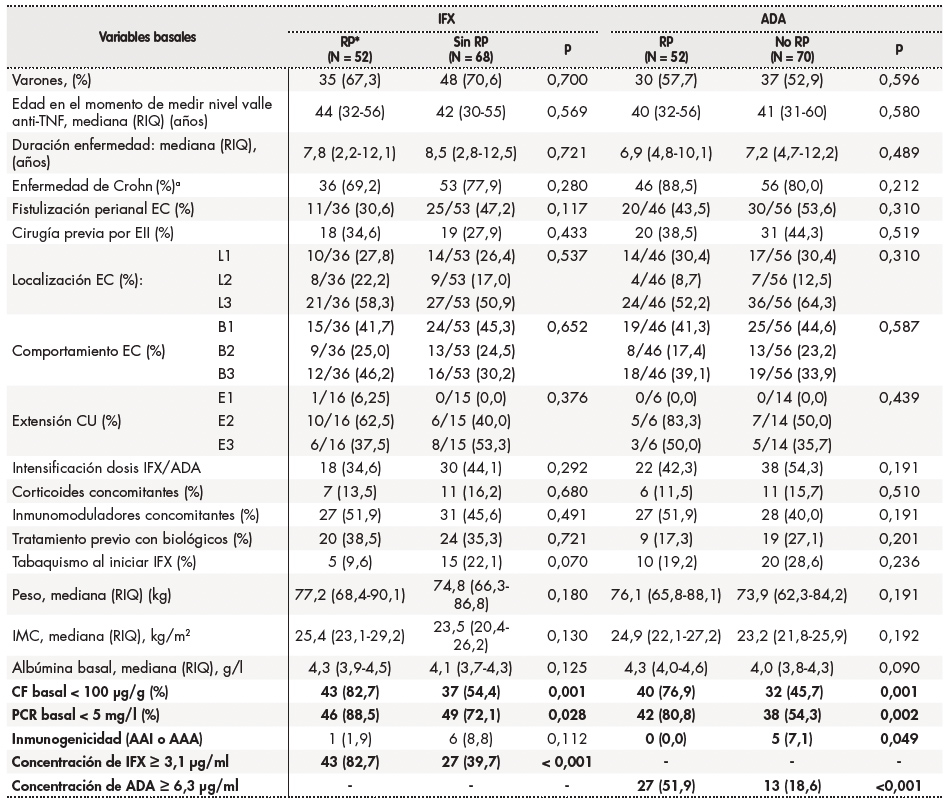
AAA: anticuerpos frente a adalimumab; ATI: anticuerpos frente a infliximab; CU: colitis ulcerosa; IMC: índice de masa corporal; Inmunomoduladores: tiopurina; MTF: monitorización terapéutica farmacocinética; PCR: proteína C reactiva; FC: calprotectina fecal; RIQ: rango intercuartílico.
aPorcentaje de EC versus CU.
*La remisión profunda se definió como una combinación de remisión clínica, normalización de biomarcadores y remisión endoscópica.
Según el análisis de regresión logística binario multivariante, la RP se asoció con valores de CF < 100 μg/g (p = 0,039), PCR < 5 mg/l (p = 0,035), y concentraciones de IFX ≥ 3,1 μg/ml (P = 0,008) en pacientes tratados con IFX, y de CF < 100 μg/g (p = 0,030), PCR < 5 mg/l (p = 0,015) y concentraciones de ADA ≥ 6,3 μg/ml (p = 0,010) en pacientes tratados con ADA (Tabla 4).
Tabla 4. Variables asociadas con la remisión profunda.

AAA: anticuerpos frente a adalimumab; ADA: adalimumab; CF: calprotectina fecal; IC: intervalo de confianza; IFX: infliximab; OR: razón de probabilidades; PCR: proteína C reactiva.
Se realizó un análisis de regresión logística binaria multivariante que incluyó variables procedentes del análisis univariante con un valor de p < 0,1, tras la aplicación del método regresivo de Wald para identificar las variables independientes asociadas con la remisión profunda.
Discusión
El tratamiento individualizado por objetivos (treat-to-target) se ha definido como nueva estrategia terapéutica encaminada a optimizar los resultados clínicos. El estudio demostró que unas concentraciones más elevadas de IFX y ADA durante la terapia de mantenimiento en pacientes con EII se asociaban con mayores tasas de RP.
La monitorización terapéutica de los agentes anti-TNF se ha asociado con normalización de biomarcadores y remisión clínica. En un estudio de 1.487 muestras procedentes de 483 pacientes, una concentración de IFX > 2,9 μg/ml estuvo asociada con un nivel de PCR < 5 mg/l12. Un metanálisis13 de 22 estudios demostró que una concentración valle de IFX más elevada se relaciona con remisión clínica y que un punto de corte de concentración de IFX por encima de 2 μg/ml supone una mayor probabilidad de remisión clínica. De igual modo, mayores concentraciones de ADA se han asociado con mejores resultados clínicos. Un metaanálisis14 que incluye siete estudios observacionales, una revisión sistemática, un metaanálisis y un análisis post hoc de los resultados de un ensayo clínico sugieren que el rango de concentraciones de ADA varía según cada diana, postulando una concentración de 4,8 μg/ml como punto de corte para la remisión clínica.
Los análisis de regresión logística univariantes y multivariantes realizados en este estudio muestran una fuerte correlación entre las concentraciones de IFX y ADA y la RP. Específicamente, se identificó un punto de corte de concentración valle de 3,1 μg/ml para IFX y de 6,3 μg/ml para ADA. El punto de corte para la RP fue inferior al observado en otros estudios15-18, que proponen una ventana terapéutica de 5-10 μg/ml para IFX y de 8-12 μg/ml para ADA para alcanzar la CM. No obstante, las concentraciones valle medidas en estos estudios no se obtuvieron en estado estacionario, lo que podría explicar que propusieran un rango terapéutico más elevado. En este sentido, los puntos de corte descritos en la bibliografía son muy heterogéneos, llegando algunos estudios a proponer valores de 3,4 μg/ml19 para IFX y de 4,9 µg/ml para ADA20. Este estudio incluyó un alto porcentaje de pacientes que habían sido sometidos a intervención quirúrgica a causa de EII, sin que se observaran diferencias en materia de RP a pesar de que presentaran menores concentraciones de anti-TNF. Los anti-TNF han demostrado una alta eficacia en la prevención de recidiva endoscópica de EC21. Sorrentino et al.22 sugirieron que, aunque las dosis más bajas de IFX daban lugar a menores concentraciones del fármaco en plasma, también conseguían mantener la remisión clínica y endoscópica en ente tipo de pacientes. Aunque nuestro estudio identificó un punto de corte específico asociado a la RP, el rango de concentraciones asociado con la RP fue bastante amplio, oscilando entre 0 y 14,4 μg/ml, y entre 2,36 y 15,6 μg/ml para IFX y ADA, respectivamente. De esto se deduce la necesidad de individualizar las concentraciones diana tanto de IFX como de ADA. Un nivel de IFX de hasta 3,1 μg/ml produjo un incremento en la tasa de RP, mientras que concentraciones más altas del fármaco no se asociaron con un incremento mucho mayor de la RP. En el caso de ADA, puesto que niveles altos del fármaco en sangre (>12 μg/ml) consiguen aumentar la RP, es posible que algunos pacientes requieran concentraciones aún más altas para obtener mejores resultados. En este sentido, Plevris et al.23 explican que son necesarias concentraciones más altas de ADA para el cierre de una fístula. Sin embargo, puesto que sólo seis pacientes de este estudio lograron esas concentraciones, no se pudieron extraer conclusiones en ese aspecto.
En línea con la evidencia disponible, se identificaron niveles de PCR < 5 mg/l24 y de CF < 100 μg/g25 como predictores independientes de RP. Además, un alto IMC, la ausencia de operaciones previas por EII, y unas concentraciones de PCR < 5 mg/l y de CF < 100 μg/g en pacientes tratados con IFX, así como la coadministración de inmunomoduladores, un bajo IMC, la ausencia de cirugías previas por EII, y unas concentraciones de PCR < 5 mg/l, y de CF< 100 μg/g en pacientes tratados con ADA, tienen una influencia positiva en la consecución de concentraciones valle más altas. La influencia del IMC estuvo en consonancia con la descrita en un estudio farmacocinético26 de 24 pacientes tratados con IFX. En dicho estudio, un IMC elevado se correlacionó con concentraciones postinfusión más altas. Sin embargo, dichas concentraciones no se correlacionaron con una mayor tasa de respuesta, lo que sugiere que las concentraciones del fármaco en sangre no se correlacionaron con las concentraciones observadas en los tejidos. En el caso de ADA, Sánchez et al. demostraron en un estudio farmacocinético prospectivo que el IMC desempeñaba un papel en el aparente aclaramiento de ADA y era una variable significativa en la farmacocinética del fármaco27.
A diferencia de lo descrito en otros estudios28, la administración de inmunomoduladores en estos pacientes no demostró estar correlacionada con las concentraciones de IFX. No obstante, en un estudio retrospectivo multicéntrico29, la retirada del tratamiento con inmunomoduladores tras al menos 6 meses de administración de IFX no produjo una reducción de las concentraciones valle de IFX en pacientes con EC. En ese sentido, la duración mediana del tratamiento con IFX de los pacientes incluidos en este estudio, que fue de 10,9 meses, podría haber influido en la ausencia de impacto de la coadministración de inmunomoduladores en las concentraciones de IFX. Por contra, la coadministración de inmunomoduladores se asoció con concentraciones más altas de ADA, en consonancia con lo descrito por Matsumoto et al.30 que, tras evaluar la eficacia del tratamiento con ADA con y sin azatioprina en pacientes con EC determinaron, aunque sin hallar diferencias significativas (p = 0,084), que la coadministración de inmunomoduladores aumentaba las concentraciones mínimas de ADA.
La inmunogenicidad fue cuantitativamente más elevada en pacientes tratados con IFX que en aquellos que recibieron ADA. De hecho, sólo 7 (6%) pacientes tratados con IFX y 5 (4%) tratados con ADA desarrollaron anticuerpos frente al fármaco. No obstante, el porcentaje de inmunogenicidad observado en la bibliografía varía, según un análisis reciente, en función del método de inmunoensayo utilizado, entre un 0% y un 79% en pacientes tratados con IFX y entre el 0% y el 87% en aquellos tratados con ADA31. La presencia de anticuerpos AAI y AAA se ha asociado a una pérdida de respuesta clínica32,33. En este estudio, los AAA se relacionaron negativamente con la RP en el análisis univariante, pero no en el multivariante. Además, sólo 1 de los 7 pacientes con EII con AAI y ninguno con AAA estaban en RP.
El uso de un ensayo farmacosensible que sólo detecta concentraciones de inhibidores TNF-α libres y anticuerpos antifármaco libres y es incapaz de medir anticuerpos antifármaco en presencia de inhibidores TNF-α, podría hacer influido en la baja prevalencia de pacientes con inmunogenicidad positiva. Algunos ensayos de tolerancia11 utilizan un tampón ácido que disocia los inmunocomplejos entre los anticuerpos antifármaco y ADA o IFX, permitiendo la determinación de los anticuerpos antifármaco que forman parte de estos inmunocomplejos. La monitorización terapéutica mediante estos kits podría mejorar la detección de la sensibilidad e inmunogenicidad, posibilitando un análisis más riguroso de la influencia de los anticuerpos antifármaco en la RP. Sin embargo, un análisis post hoc del ensayo TAXIT34, en el que se evaluó la relevancia clínica de los AAI utilizando un ensayo de tolerancia farmacológica, determinó que sólo las altas concentraciones de AAI, que normalmente también pueden detectarse en un ensayo de sensibilidad farmacológica, persisten en el tiempo, son clínicamente relevantes y permiten un cambio de tratamiento más eficiente desde el punto de vista del coste.
El principal punto fuerte de este estudio es la evaluación sistemática de la RP, considerada como una nueva diana terapéutica, a través de biomarcadores y escalas endoscópicas. Esto lo diferencia de otros estudios que evalúan el impacto de la monitorización farmacocinética de IFX o ADA utilizando exclusivamente biomarcadores o evaluaciones clínicas o endoscópicas sin normalizar. Además, este estudio ha identificado un punto de corte óptimo de concentración valle de IFX y de ADA.
Este estudio presenta algunas limitaciones que deben ser mencionadas. Al tratarse de un estudio retrospectivo unicéntrico con datos del mundo real es imposible excluir completamente la presencia de factores de confusión. No se realizó una recogida centralizada de los datos de las endoscopias, por lo que la variabilidad interobservador puede haber influido en los resultados. La toma de muestras se realizó en distintos momentos durante el transcurso de la enfermedad, incluyéndose un alto porcentaje de pacientes con pautas intensificadas. Esto pudo haber derivado en una infraestimación de los puntos de corte, ya que aquellas concentraciones que, debido a la mala respuesta requirieron una intensificación del tratamiento, no fueron evaluadas. Además, criterios de evaluación clínicos como la hospitalización o la colectomía no fueron objeto de análisis. El nivel medio de albúmina en sangre, biomarcador clásico del aclaramiento de anti-TNF y de enteropatía, se mantuvo en rangos normales (4 g/l) y no demostró estar relacionado con las concentraciones plasmáticas de los fármacos ni con la RP.
En suma, nuestros hallazgos ponen de manifiesto que las concentraciones valle de IFX y ADA (PCR < 5 mg/l y CF < 100 μg/g) se asocian de manera estadísticamente significativa con la RP durante el tratamiento de mantenimiento. Cabe destacar que se encontró que un punto de corte óptimo de 3,1 para IFX y de 6,3 μg/ml para ADA era capaz de predecir ese resultado.
Aportación a la literatura científica
La remisión profunda, definida como remisión clínica y cicatrización de la mucosa digestiva, ha surgido como nuevo objetivo terapéutico en la enfermedad inflamatoria intestinal. En este sentido, diversos estudios evalúan el impacto de la monitorización farmacocinética de infliximab y adalimumab en el abordaje de la enfermedad inflamatoria intestinal. Sin embargo, la mayoría miden la respuesta a estos antifactores de necrosis tumoral utilizando variables intermedias como biomarcadores analíticos, criterio facultativo no estandarizado o escalas de remisión clínica. En este sentido, en este trabajo se evalúa la asociación de concentraciones séricas de infliximab y adalimumab durante la terapia de mantenimiento mediante el uso de la remisión profunda como objetivo clínico en la enfermedad inflamatoria intestinal.
Este estudio aporta mayor evidencia respecto a la importancia clínica que implican las concentraciones séricas de estos antifactores de necrosis tumoral en la remisión profunda. Se demuestra el valor añadido que supone la monitorización de los antifactores de necrosis tumoral en los servicios de farmacia hospitalaria. Asimismo, avala la importancia de la participación del farmacéutico hospitalario en la toma de decisiones sobres estos fármacos en el manejo de la enfermedad inflamatoria intestinal.














