Introducción
El uso de medicamentos en pacientes pediátricos es una tarea con un grado de dificultad superior que en adultos, pues el desarrollo fisiológico produce grandes cambios en la biodisponibilidad de los fármacos en el organismo1,2; de tal manera que no sólo la dosificación requiere una atención particular, sino también las combinaciones de fármacos que podrían modificar el efecto de la farmacoterapia afectando la efectividad o la seguridad, es decir: la aparición de interacciones fármaco-fármaco (IFF)3,4.
Cuando las IFF se manifiestan clínicamente en el paciente se denominan IFF reales (IFFr). La evidencia clínica de la manifestación de alguna IFFr, independientemente de sus mecanismos, puede consistir en la aparición de reacciones adversas a medicamentos (RAM) o modificación del efecto terapéutico; de otra manera, una IFF es sólo potencial (IFFp)5.
Ciertos factores intrínsecos a los pacientes pediátricos incrementan el riesgo de presentar IFFp, como cambios súbitos en los parámetros de actividad hepática y renal, en la fisiología gástrica, permeabilidad celular, proporción de agua corporal total y grasa, los cuales afectan la farmacocinética de los fármacos. Tales cambios hacen más susceptibles a los neonatos, pues en ellos la tasa de depuración de fármacos está reducida y se prolonga el tiempo de vida media6. Además, otros factores como polifarmacia7-9, especialmente en la adolescencia10,11, estancias hospitalarias prolongadas7,8, diagnósticos como neoplasias, enfermedades autoinmunes, del sistema nervioso central y enfermedades congénitas7-9, atención en cuidados intensivos7, y recibir fármacos antineoplásicos, antiepilépticos, opioides, antibióticos, inmunosupresores, gastrointestinales diuréticos y adrenérgicos8,9,11,12, también se asocian a mayor presencia de IFFp.
En años recientes el estudio de IFF se ha enfocado en pacientes pediátricos8-15, pero la información disponible sigue siendo incipiente y se restringe a IFFp o sus factores de riesgo casi en su totalidad. La prevalencia estimada de IFFp entre pacientes pediátricos que reciben dos o más medicamentos varía ampliamente, desde 1,4%11 hasta 83,5%14. Dicha variabilidad refleja diversidad metodológica y el uso de distintas bases de datos para su identificación que pueden diferir en el valor predictivo, clasificación de relevancia clínica, acceso y facilidad de manejo16.
Adicionalmente, la evidencia sobre IFFr en pacientes pediátricos es escasa. En un estudio en pacientes agudos que requirieron hospitalización se observó una prevalencia considerablemente baja de IFFr de 0,009%17. Sin embargo, dicho estudio no evaluó IFF como objetivo principal, sino problemas relacionados con la medicación, y la IFFr observada no fue descrita detalladamente.
Otra limitación es la ausencia de información sobre pacientes que ingresan en servicios de atención para niños quemados, cuya complejidad en el manejo farmacológico y uso continuo de medicamentos con alto potencial de IFF merece una descripción más específica18, como se ha hecho con pacientes pediátricos en unidades de atención crítica y con diagnósticos de hematooncología7,9. Por lo anterior, es necesario el estudio de las IFF en esos grupos, distinguiendo las particularidades del fenómeno en la práctica médica y sus implicaciones para la seguridad del paciente. De ese modo, el propósito de este estudio piloto es explorar la prevalencia y características de las IFFp e IFFr en dos hospitales pediátricos de la Ciudad de México.
Métodos
Diseño de estudio
Estudio piloto transversal que se realizó en pacientes pediátricos agudos que recibieron atención médica en diversos servicios de hospitalización en un sólo punto del tiempo, entre mayo de 2017 y mayo de 2019. El estudio fue diseñado y dirigido por un farmacéutico.
Población de estudio y ámbito
Los pacientes recibieron atención en el Hospital Infantil de México Federico Gómez o el Hospital Pediátrico Tacubaya, ambos en la Ciudad de México. El primero es un Instituto Nacional de Salud de tercer nivel de atención con 229 camas, una cuarta parte de los egresos anuales son pacientes oncológicos y se realizan actividades de investigación y enseñanza. El segundo es un hospital de segundo nivel de atención con 76 camas, y que presta servicios de hospitalización y terapia intensiva para niños quemados.
Un médico residente de pediatría fue asignado a rotar en distintos servicios de ambos hospitales. En cada servicio seleccionó consecutivamente aquellos pacientes pediátricos hasta con 18 años, que ingresaron en hospitalización y que recibieron concomitantemente dos o más medicamentos durante su estancia.
Variables de estudio
La variable primaria en este estudio fue la prevalencia de IFF que se presentaron como resultado del tratamiento farmacológico recibido en hospitalización. Para explorar este fenómeno nos enfocamos en IFFp e IFFr. Las primeras se definieron como dos o más fármacos que pudieron interactuar y tuvieron el potencial de producir efectos adversos en el paciente; las segundas se definieron como dos o más fármacos que interactuaron y produjeron efectos clínicos medibles, tomando en cuenta el estado individual del paciente5.
Fuente de información clínica
En ambos hospitales los expedientes clínicos se elaboran manualmente en formatos prediseñados en computadora que se imprimen en papel, siguiendo la Norma Oficial Mexicana del expediente clínico. La información farmacoterapéutica y de evolución clínica en hospitalización se extrajo de los expedientes clínicos mediante un formato estructurado que se diseñó para documentar un solo periodo de hospitalización por paciente. Las variables demográficas capturadas fueron: sexo, fecha de nacimiento, peso y talla de cada paciente al ingreso, además se documentaron los diagnósticos de ingreso de acuerdo con la Clasificación Internacional de Enfermedades, 10' edición (CIE-10), la duración de la estancia hospitalaria, los antecedentes de alergia a medicamentos, así como todos los medicamentos recibidos durante la estancia hospitalaria de manera concomitante, incluyendo: dosis ponderal, vía de administración y las fechas de inicio y fin de administración; al final se agruparon de acuerdo con la clasificación anatómica, terapéutica, química.
Clasificación de las interacciones fármaco-fármaco
El perfil farmacoterapéutico de cada paciente fue evaluado por el médico residente de pediatría que recolectó la información. Esta primera evaluación dio origen a una base de datos con información sobre las IFFp identificadas, el número por paciente, la gravedad, el nivel de evidencia y la descripción clínica. Posteriormente, los perfiles farmacoterapéuticos fueron evaluados independientemente por un farmacéutico, quien verificó la evaluación de las IFFp reportada por el médico residente de pediatría. Ambos utilizaron Micromedex®19. La herramienta utilizada fue Micromedex®19 por considerar la amplitud de sus atributos adecuada para el uso profesional y tener un desempeño razonable en la identificación de IFF, tal como ha sido descrito en otros estudios20,21. Además, es una base de datos citada en múltiples estudios de prevalencia de IFF, ya sea como única fuente de consulta o en comparación con otras7-10, y es ampliamente conocida a nivel internacional16. Las IFF fueron clasificadas por su gravedad en las siguientes categorías: “contraindicado”, cuando no se recomendó el uso simultáneo de pares de fármacos; “importante”, si la interacción pudo causar la muerte y/o requirió intervención médica para minimizar o evitar efectos adversos graves; “moderada”, si la interacción pudo agravar la condición del paciente y/o requirió una alteración de la terapia; y “poco importante”, si la interacción pudo tener efectos clínicos limitados y no requirió modificación alguna de la terapia. También se capturó el nivel de evidencia de cada interacción, pudiendo ser excelente, buena o suficiente, de acuerdo con Micromedex®.
Información sobre desenlaces clínicos
Todas las sospechas de RAM fueron documentadas, incluyendo manifestaciones clínicas, temporalidad y consecuencias; así como resultados de laboratorio, valoraciones de interconsulta y cualquier intervención médica implementada como tratamiento a dichos eventos. Se definió una RAM como una respuesta nociva a medicamentos que no es intencional y que ocurre en el rango terapéutico habitual en humanos22. Cuando el médico residente juzgó que la descripción clínica de alguna IFFp se ajustó o se relacionó con la aparición de algún evento adverso (incluyendo RAM o fallo terapéutico), se aplicó la herramienta Drug Interaction Probability Scale (DIPS)23 para determinar la relación causal entre IFFp y la RAM; aquellas probables (5 a 8 puntos) o altamente probables (> 8 puntos) se consideraron IFFr. El resto de las sospechas de RAM no relacionadas con IFFp fueron evaluadas con el algoritmo de Naranjo con fines de documentación y reporte al sistema de farmacovigilancia local. Finalmente, las consecuencias de las IFFr se clasificaron usando las categorías de daño en la escala desarrollada por la National Coordinating Council for Medication Error Reporting and Prevention (NCC MERP)24.
Análisis estadístico
La prevalencia de IFFp o IFFr se definió como la proporción de pacientes con alguna interacción con respecto a la totalidad de los pacientes con dos o más medicamentos incluidos en el estudio y multiplicada por 100.
La edad en días se calculó a través de la fecha de nacimiento y la fecha de ingreso en hospitalización. Para fines descriptivos, dicha variable continua fue transformada en las siguientes categorías: < 29 días, neonatos (incluyendo prematuros); 29 días a 23 meses, lactantes; 24 meses a 71 meses, preescolar; 72 meses a 143 meses, escolar; ≥ 144 meses, adolescentes. Asimismo, se calculó el índice de masa corporal categorizado en desviaciones estándar (DE) del puntaje z (normal –1 ≥ z ≤ +1 DE, desnutrición < –1 DE, sobrepeso +2 ≥ z > +1 DE, y obesidad > +2 DE) usando el software WHO AnthroPlus, excepto para neonatos prematuros. Finalmente, la variable servicios de hospitalización fue agregada en cuatro categorías para su comparación: “cuidados intensivos” (unidades de terapia intensiva neonatal [UCIN] y pediátrica [UTIP]), “unidades de quemados” (unidad de quemados [UQ] básica, de terapia intermedia [UQI] y terapia intensiva [UQTI]), “oncología” y “otros no críticos” (cardiología, pediatría mixta, infectología, gastroenterología y nutrición). Se consideraron servicios críticos UTIP, UCIN, UQI y UQTI. Se consideró polifarmacia entre 5 y 9 medicamentos y polifarmacia excesiva ≥ 10 medicamentos.
Análisis descriptivo
Las variables cualitativas se expresaron como frecuencias relativas y porcentajes, incluyendo el intervalo de confianza al 95% (IC 95%) para los estimadores de prevalencia. Por otro lado, se estudiaron las distribuciones de las variables cuantitativas a través de estimaciones de tendencia central y dispersión. En un análisis bivariado exploratorio, se compararon las variables sexo, grupos de edad, puntaje z del índice de masa corporal, número de medicamentos, días de estancia hospitalaria, número de medicamentos, presencia de RAM y tipo de diagnóstico entre dos grupos: aquellos pacientes con al menos una IFFp y aquellos sin IFFp. Se usó la prueba de chi cuadrado (χ2) o exacta de Fisher según fuera apropiado para variables cualitativas. Por otra parte, se empleó la prueba U de Mann-Whitney en variables cuantitativas sin distribución normal. La asociación entre variables continuas (número de medicamentos, estancia hospitalaria, número de IFFp) se estudió mediante la correlación de Spearman (rS). En todas las pruebas se aceptó una significancia estadística del 95% (α = 0,05) a dos colas. El análisis estadístico se realizó con SPSS versión 25.
Resultados
Se incluyeron 111 pacientes cuyas características se muestran en la tabla 1. Las principales causas de ingreso fueron quemaduras de segundo grado, neumonía bacteriana y neutropenia febril, las cuales representaron el 59,4% de los ingresos. En conjunto, 41 pacientes (36,9%) ingresaron en servicios críticos con diagnósticos de neumonía bacteriana (39,0%), con quemaduras (12,2%) y choque séptico (12,2%). La mediana de estancia hospitalaria fue de 11 días, con un rango entre 1 y 302 días, mientras la mediana de medicamentos concomitantes fue 5, con un rango entre 2 y Sexo, grupo de edad o estado nutricional no aparecen asociados a la presencia de IFFp (Tabla 1).
Tabla 1. Características de los pacientes.
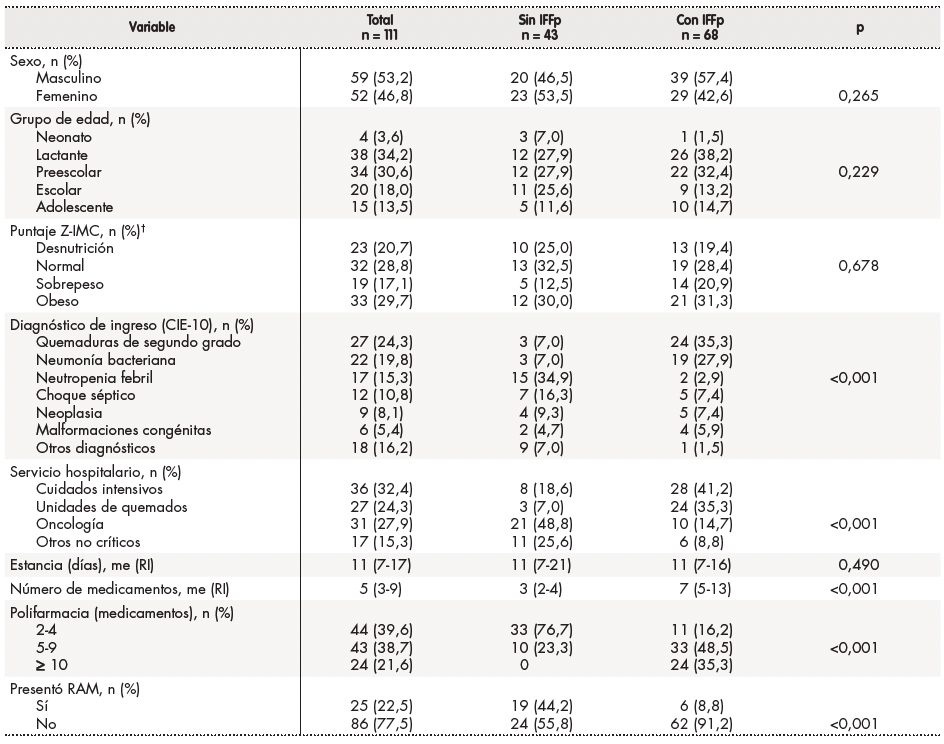
CIE-10: Clasificación Internacional de Enfermedades, 10' edición; IFFp: interacción fármaco-fármaco potencial; IMC: índice de masa corporal; me: mediana; RAM: reacción adversa a medicamentos; RI: rango intercuartílico.
†No se incluyen cuatro pacientes neonatos prematuros por falta de tablas de referencia.
Se identificaron 332 IFFp (142 pares distintos) en 68 pacientes, lo que representó una prevalencia global del 61,3% (IC 95%, 52,2-70,4%). Asimismo, se observaron cinco IFFr en cuatro pacientes, significando una prevalencia del 3,6% (IC 95%, 0,1-7,1%) entre niños que recibieron dos o más medicamentos en hospitalización.
El número de IFFp promedio en este estudio fue 4,8 por paciente. Se observó una asociación positiva entre el número total de IFFp y el número de medicamentos administrados (rS = 0,80; p < 0,001), inclusive a través de los distintos tipos de servicios hospitalarios (Figura 1). La estancia hospitalaria no se correlacionó con el número de IFFp o la polifarmacia. Algunos pacientes en servicios no críticos tuvieron polifarmacia moderada y estancias cortas con poca variación. El 52,9% presentaron fiebre neutropénica o quemaduras menores al 10% de la superficie corporal (SC). Otros pacientes con neoplasias de novo tuvieron estancias muy variables y baja frecuencia de IFFp. En contraste, el 51,2% de los pacientes en servicios críticos como UTIP o UQTI ingresaron por quemaduras entre 20-60% de la SC o neumonías, y presentaron rangos muy variables de estancias hospitalarias, exposición a polifarmacia e IFFp (Figura 2).
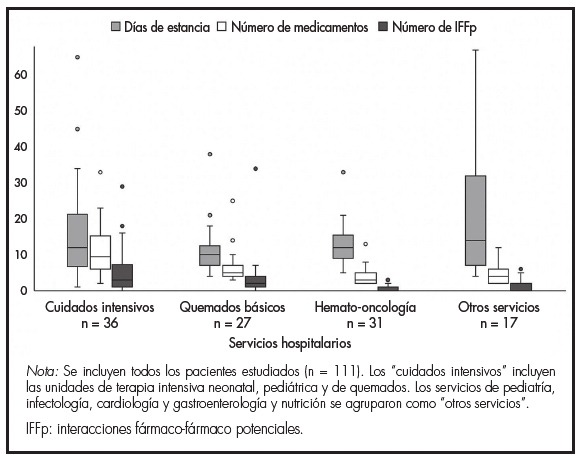
Figura 1. Distribución del número de interacciones fármaco-fármaco potenciales, número de medicamentos y duración de la estancia hospitalaria por servicio de atención.
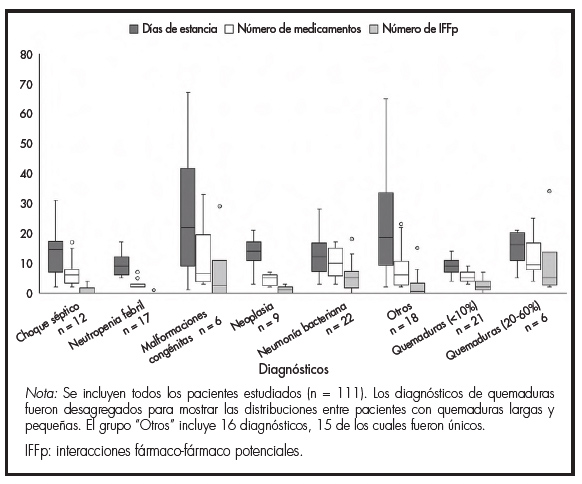
Figura 2. Distribución del número de interacciones fármaco-fármaco potenciales, número de medicamentos y duración de la estancia hospitalaria por diagnóstico de ingreso.
Entre las 332 IFFp, se clasificaron 17 (5,1%) como contraindicadas, 201 (60,5%) importantes, 97 (29,2%) moderadas y 17 (5,1%) poco importantes. El grado de evidencia en 20 (6,0%) se consideró excelente, en 81 (24,4%) buena y en 231 (69,6%) suficiente. Sólo una entre las cinco IFFr observadas prolongó la hospitalización; el resto requirió tratamiento y una monitorización mayor que la habitual (Tabla 2).
Tabla 2. Interacciones fármaco-fármaco con relevancia clínica.

DIPS: Drug Interaction Probability Scale; KCL: cloruro de potasio; UQ-básica: Unidad de quemados básica; UTIP: Unidad de terapia intensiva pediátrica.
†Micromedex®.
‡National Coordinating Council for Medication Error Reporting and Prevention.
Los antibióticos (23,4%) fueron los fármacos más prescritos, seguidos de analgésicos (19,3%), electrolitos (6,5%) y corticosteroides sistémicos (5,6%). Mientras que los principales fármacos involucrados en IFFp fueron analgésicos (22,6%, opioides 18,2%), hipnóticos sedantes (13,3%), antibióticos (13,1%), diuréticos (8,6%), antagonistas del receptor de histamina tipo 2 (6,8%) y corticosteroides sistémicos (5,1%).
Discusión
Este es el primer estudio que estima la prevalencia de IFFp e IFFr entre pacientes pediátricos quemados, oncológicos y de otras especialidades médicas. Se destaca una prevalencia del 61,3% de IFFp entre pacientes con dos o más medicamentos, considerando importantes por su severidad al 60,5%. Así, también se destaca la presencia de IFFr que produjeron un daño temporal y requirieron una intervención médica o prolongaron la hospitalización, alcanzando una prevalencia del 3,6%.
La prevalencia de IFFp observada se encuentra dentro del rango de otros estudios con pacientes pediátricos hospitalizados, que va del 41,7% al 67,1%8-10,12,25. La diversidad de fuentes de información de IFF, procesos de muestreo, especialidades médicas y grupos etarios en el universo de pacientes pediátricos, así como las posibles diferencias en patrones de prescripción entre países, hacen inapropiada cualquier comparación directa entre las estimaciones de prevalencia de IFFp. Por ejemplo: entre los estudios que incluyen pacientes pediátricos oncológicos, la proporción que presenta alguna IFFp varía entre 56,7%9 y 95%26 en pacientes hospitalizados y 83,5%14 en ambulatorios; mientras en este estudio la proporción fue del 32,8%, lo cual podría ser resultado del muestreo no probabilístico, la baja proporción de pacientes oncológicos con polifarmacia y que sólo 3 pacientes con neoplasias ingresaron a servicios críticos.
También este es uno de los escasos estudios que evaluó IFFr. La prevalencia de IFFr reportada anteriormente en pacientes pediátricos que requirieron hospitalización fue del 0,009%17, lo cual es bastante menor que la observada en este trabajo. Esto puede deberse principalmente al sesgo de selección producido por el método de muestreo, sobrerrepresentando a los pacientes que requirieron cuidados críticos, los cuales presentaron mayor polifarmacia para su manejo y estabilización7,27, especialmente los niños con quemaduras18.
Por otro lado, la IFFr entre paracetamol y colestiramina, considerada poco importante en la escala de severidad de Micromedex®, requirió la modificación de la terapia analgésica al manifestarse una reducción objetiva de la efectividad. Un gran estudio con base poblacional señaló que la mayoría de las IFFp observadas involucraron reducciones de efectividad terapéutica13. Aunque esto sugiere que las IFFp consideradas poco importantes no deberían subestimarse en la práctica diaria, se debe tomar en cuenta que las categorías de severidad establecidas por Micromedex® no fueron comparadas con otras bases de datos, lo cual en la práctica habitual puede conducir a subestimación o sobreestimación de la evidencia sobre IFFp.
En este estudio se corroboró una correlación entre el grado de polifarmacia y el número de IFFp como en otros estudios3,5, pero no con la estancia hospitalaria. El tamaño de muestra reducido y la amplísima dispersión en la duración de las estancias hospitalarias por diagnostico impidió tal correlación con las IFFp como en reportes previos7,8. Los diagnósticos con mayor variabilidad en el tiempo de hospitalización y exposición a fármacos fueron las neumonías bacterianas inespecíficas, las neoplasias de novo, los choques sépticos y las malformaciones congénitas. Algunas predominaron más en servicios críticos como neumonías o quemaduras mayores al 20% de la SC. Sin embargo, la subrepresentación y agrupación de varios diagnósticos únicos produjo mayor dispersión entre la exposición a fármacos y la duración de la estancia hospitalaria; ejemplos fueron neuritis óptica, pancreatitis y hemorragia intraventricular, cuya gravedad y complejidad clínica fueron bastante diferentes, por lo cual se diluyó la correlación entre estancia hospitalaria e IFFp.
Otro aspecto relevante al tipo de IFFp es que los agentes analgésicos opioides, antibióticos y neurológicos están entre los tres grupos de fármacos más comúnmente involucrados en IFFp, tanto en este como en otros estudios7,10,11,26,28. Estos grupos farmacológicos son ampliamente usados para el manejo de pacientes en cuidados intensivos7, incluyendo niños con quemaduras grandes (> 20% de la SC) en que los opioides, benzodiazepinas e hipnóticos sedantes se utilizan para el manejo del dolor, así como antibióticos en estados infecciosos complejos18,29.
Dada la naturaleza exploratoria de este estudio piloto, ciertos aspectos metodológicos, como el tamaño de muestra reducido, el proceso no probabilístico para la selección de pacientes, el diseño transversal de análisis, que no permiten eliminar potenciales sesgos de confusión y selección, restringen la validez externa de nuestros resultados. Otra limitación importante fue la falta de comparación de las IFFp con una segunda fuente de información, como en otros estudios9,14,30. Aunque Micromedex® se considera una fuente de información muy completa, fiable y amigable21, el uso de una base de datos de comparación hubiera permitido alcanzar mayor sensibilidad y precisión en la identificación de IFFp21, lo que aportaría mayor solidez a las estimaciones de prevalencia observadas. Por lo anterior, los resultados deben interpretarse con cautela y bajo el contexto de un estudio exploratorio, es decir, los resultados no pretenden establecer un parámetro definitivo, sino servir como punto de partida para otros trabajos. En este trabajo la participación del farmacéutico fue relevante, sin embargo, en México la farmacia hospitalaria se encuentra en desarrollo y con obstáculos para su implementación, lo que implica riesgos para la salud de los pacientes.
En conclusión, la prevalencia de IFFp identificadas con Micromedex® durante la práctica de un médico residente alcanzó al 61,3% de los pacientes pediátricos agudos que recibieron dos o más medicamentos en hospitalización. Sólo el 3,6% de los pacientes en riesgo presentó manifestaciones clínicas por IFFr causando un daño temporal. Sin embargo, hasta el 65,6% de las IFFp identificadas se consideraron importantes o contraindicadas, lo cual sugiere que es necesario un mayor énfasis en la investigación enfocada en la prevención de riesgos para la seguridad del paciente.
Aportación a la literatura científica
Es uno de los escasos estudios sobre interacciones farmacológicas que se manifiestan clínicamente en los pacientes y que ofrece un estimador de prevalencia en pacientes pediátricos en múltiples servicios de hospitalización, incluyendo unidad de quemados. Las observaciones servirán como referencia para estudios futuros e identificar prioridades en la seguridad de los pacientes.














