Introducción
Un biosimilar es un medicamento biológico muy similar a otro fármaco biológico ya aprobado (el fármaco de referencia)1. La finalidad de un programa de desarrollo de biosimilares es demostrar, mediante una estrategia basada en la totalidad de la evidencia, que no existen diferencias clínicas significativas entre un biosimilar y su fármaco de referencia en lo relativo a estructura, función, farmacocinética, farmacodinámica, inmunogenicidad clínica, eficacia y seguridad1. Los biosimilares deben ser aprobados por los organismos reguladores con arreglo a los mismos criterios aplicables a todos los medicamentos biológicos1,2.
Debido a su complejidad y a los procesos utilizados para producirlos, los medicamentos biológicos (biosimilares o fármacos de referencia) están sujetos a cierta variabilidad molecular. Esta variabilidad inherente asociada con el proceso de fabricación de los medicamentos biológicos hace más difícil lograr estructuras moleculares idénticas, incluso entre lotes del mismo producto. La variabilidad, no obstante, está sujeta a estrictos controles por fabricantes y organismos reguladores3. De lo anterior se deduce que los biosimilares no sólo tienen que cumplir con una serie de buenas prácticas de fabricación, sino también con los mismos principios de comparabilidad que los medicamentos de referencia3.
Desde 2006, cuando las autoridades de la Unión Europea aprobaron el primer biosimilar, hasta el 31 de marzo de 2021, se ha autorizado la comercialización de 63 biosimilares1. Los biosimilares se utilizan en distintas especialidades médicas como hematología, oncología, endocrinología, dermatología, reumatología o nefrología.
Sin embargo, varios estudios han mostrado una gran variabilidad en el uso de biosimilares en los distintos países, unas discrepancias que no obedecen a evidencias clínicas4-9. Se han sugerido varias razones para explicar esta variabilidad4-12, incluyendo diferencias en las políticas y prácticas aplicadas por distintos organismos, cuestiones económicas, negativa de las autoridades a aprobar un determinado medicamento, o diferencias en las estrategias de comercialización. De igual modo, se han señalado una serie de factores favorecedores o inhibidores de la aceptación de los biosimilares, como la falta de información o conocimiento de los mismos o los posibles riesgos y beneficios derivados de su administración, que podrían condicionar la aceptación de estos medicamentos por los facultativos4,8,10,11,13-17.
En España, la información sobre el uso de los biosimilares en la práctica clínica y de los factores que influyen en su prescripción es escasa, si no nula. Se ha publicado que, en la actualidad, el conocimiento que poseen los médicos de atención primaria españoles sobre los biosimilares es escaso18, no existiendo aún estudios sobre su uso a nivel hospitalario. Este estudio tiene por objeto evaluar las diferencias en la aceptación de biosimilares y explorar los conocimientos, las actitudes, la práctica, las barreras y facilitadores en torno al uso de biosimilares en España. Para ello, y en línea con la mayor parte de los artículos publicados, hemos diseñado y lanzado una encuesta a escala nacional.
Métodos
Diseño de la encuesta
Entre junio y noviembre de 2020 se realizó una encuesta a escala nacional, no-intervencionista, anónima, autoadministrada y unitaria a un grupo de dermatólogos, reumatólogos, gastroenterólogos y farmacéuticos de hospital. Se eligieron estas tres especialidades médicas porque se ocupan de pacientes con enfermedades crónicas inmunomediadas y utilizan fármacos biológicos similares (actualmente cuatro biosimilares en España). Decidimos no incluir otras especialidades porque su contexto sería diferente. También incluimos a los farmacéuticos de hospital porque desempeñan un papel muy importante en el uso de biosimilares, educando a los pacientes o participando en comités de medicamentos biológicos (que también se ocupan del uso de biosimilares).
Procedimientos de la encuesta
Se creó un comité integrado por un dermatólogo, un reumatólogo, un gastroenterólogo y un farmacéutico de hospital. Los criterios de inclusión del comité fueron los siguientes: 1) estar especializado y tener experiencia demostrada en el uso de biosimilares; 2) tener ≥ 8 años de experiencia clínica y/o ≥ 5 publicaciones; 3) ser miembro de sociedades científicas.
A continuación, se realizó una búsqueda bibliográfica exhaustiva en PubMed para identificar artículos que hicieran referencia a la variabilidad en el uso de biosimilares (frecuencias, tipo de biosimilares, etc.), así como al conocimiento y las percepciones, actitudes, barreras y facilitadores en el uso de biosimilares, sin analizar ningún fármaco concreto. Utilizamos las preguntas clínicas (clinical queries) de PubMed, realizando también búsquedas individuales con descriptores MeSH (como biosimilar pharmaceuticals) y términos de texto libre (como biosimilar o variability) hasta marzo de 2020. Los resultados obtenidos, así como otras cuestiones relacionadas, incluida la metodología de los distintos estudios (la mayor parte de ellos encuestas), fueron objeto de discusión en una reunión del comité en la que se siguió el método del grupo nominal. Para esta reunión, se recurrió a un metodólogo experto para moderar el debate y ayudar en la toma de decisiones. Debido a la falta de estudios sobre el tema en España, el comité acordó recabar datos a partir de profesionales sanitarios españoles. Asimismo, se seleccionaron los puntos principales a analizar y se decidió diseñar una encuesta que se administraría a nivel nacional. Para cada uno de los ítems, se estableció un objetivo y se propusieron una serie de preguntas. Para cada pregunta, el comité buscó la formulación más correcta, utilizando preguntas formuladas en otros artículos o proponiendo preguntas originales. El metodólogo explicó las implicaciones de formular las preguntas de una manera u otra. Algunas de las preguntas finalmente incluidas son idénticas a las de otras encuestas (aunque, en su caso, adaptadas al contexto español), y otras son originales (la encuesta está disponible previa solicitud al autor principal).
Finalmente se generaron dos encuestas estructuradas y cerradas, utilizando la plataforma digital Survey-Monkey, que fueron administradas por un tercero independiente. Una de las encuestas estaba dirigida a personal médico y la otra a farmacéuticos de hospital. Ambas contenían 55 preguntas iguales. Los médicos tenían que responder seis preguntas más específicas y los farmacéuticos hospitalarios dos. Por ejemplo, se preguntó a los médicos acerca de la reacción de los pacientes al proponérseles cambiar su tratamiento biológico de referencia a un biosimilar; a los farmacéuticos hospitalarios se les preguntó por la reacción de los médicos al proponerse este mismo cambio.
Seguidamente, se envió una invitación por correo electrónico para participar en la encuesta, y recordatorios cada 4-6 semanas. La portada de la encuesta contenía información sobre los objetivos de la encuesta, así como una sección donde se solicitaba la participación voluntaria. Se entendía que al leer y responder a la encuesta los participantes daban su consentimiento a participar. Los encuestados podían revisar y cambiar sus respuestas desplazándose hacia arriba o hacia abajo por cada página de la encuesta antes de su envío definitivo. Antes de su lanzamiento, se realizó un pequeño estudio piloto.
Destinatarios de la encuesta
Se seleccionó una muestra de conveniencia de 73 profesionales sanitarios (41 médicos, incluidos dermatólogos, reumatólogos, gastroenterólogos, y 32 farmacéuticos de hospital). Se buscaron profesionales sanitarios de todas las comunidades autónomas que trabajaran en hospitales de distintos niveles de complejidad dentro del Sistema Nacional de Salud (por ejemplo, hospitales generales, hospitales comarcales). No se aplicó ninguna restricción en cuanto a conocimientos previos, experiencia en el uso de biosimilares, participación en comités de biológicos ni ningún otro criterio relacionado con el uso de biosimilares. La selección se realizó mediante un análisis de los hospitales de cada comunidad autónoma, tras el cual el comité responsable del estudio propuso una lista de profesionales (en base a sus contactos personales o preguntando a otros compañeros).
Preguntas de la encuesta
La encuesta se dividió en seis secciones principales, cada una con una serie de preguntas. La primera sección contenía preguntas sociodemográficas y relativas a la práctica diaria como, por ejemplo, la existencia de un comité de biológicos multidisciplinar (es decir con ≥ 2 profesionales sanitarios diferentes, por ejemplo, farmacéuticos de hospital, dermatólogos, reumatólogos y gastroenterólogos). La participación del comité de biológicos se consideraba activa si éste participaba en decisiones relevantes en materia de biológicos tales como la selección de qué biológicos podían utilizarse en el hospital. En la segunda sección se preguntaba por el conocimiento de los biosimilares y sobre la importancia de ciertos aspectos de los mismos (desarrollo, biosimilitud, indicaciones sensibles, requisitos y procedimientos de aprobación, eficacia, seguridad, cambio de un fármaco de referencia a un biosimilar, extrapolación de indicaciones, intercambiabilidad, etc.). Las preguntas de la tercera sección hacían referencia al acceso, las actitudes y las percepciones [número y tipo de biosimilares disponibles en cada hospital (se incluyeron todas las marcas comerciales disponibles en España), políticas locales y coordinación, protocolos clínicos, cuestiones formativas, prescripción, sustitución a nivel de farmacia, adherencia, impacto, satisfacción, incentivos, etc.]. La cuarta sección versaba sobre las barreras a la aceptación de medicamentos biosimilares. En la quinta se preguntaba por los facilitadores de la aceptación de los biosimilares y en la sexta sobre el futuro del uso de los biosimilares, entre otras cuestiones. La encuesta estaba integrada por preguntas tipo test y preguntas en las que se solicitaba a los encuestados que valoraran su nivel de conformidad, conocimiento, comodidad o importancia de algunos temas en una escala de 1 a 5 o a 10 puntos. Al final de la mayoría de las preguntas (n = 31) se dejaba un espacio para comentarios.
Análisis estadístico
Se realizó un análisis descriptivo, utilizando frecuencias, media y desviación típica, o mediana y rango intercuartílico, dependiendo de la distribución de la variable. Las respuestas a cada pregunta fueron resumidas como número y porcentaje de encuestados. Las comparaciones se efectuaron usando la prueba t de Student o la de χ². Los comentarios de los encuestados se muestran en la sección de resultados entre comillas y en cursiva.
Resultados
Tasa de respuesta de la encuesta y características de los participantes
Las principales características de los participantes de la encuesta se muestran en la tabla 1.
Tabla 1. Características principales de los encuestados*.
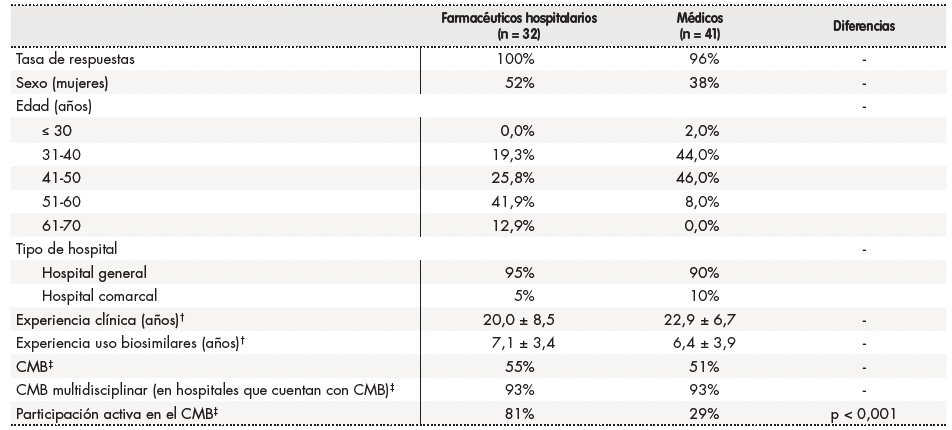
*Los resultados se expresan en números (porcentaje), a menos que se indique lo contrario. Sólo se representan (numéricamente) las diferencias estadísticamente significativas entre los grupos. La distribución de los encuestados entre las distintas comunidades autónomas fue la siguiente: Andalucía (18%), Comunidad Valenciana (10%), Murcia (2%), Extremadura (5%), Galicia (12%), Islas Baleares (7%), Cataluña (13%), Castilla-León (9%), Castilla-La Mancha (8%), Comunidad de Madrid (11%), Aragón (2%), Andorra (1%) y Asturias (1%).
†Media ± desviación estándar.
‡Algunos hospitales cuentan con un CMB en el que los miembros comentan los distintos aspectos del uso de biosimilares, incluido el desarrollo de protocolos. Un CMB multidisciplinar se ha definido como un comité en el que participan ≥ 2 profesionales sanitarios de diferentes especialidades (por ejemplo, farmacéuticos hospitalarios, dermatólogos, reumatólogos y gastroenterólogos). La participación activa del CMB se definió como una participación activa en decisiones relevantes en relación con los medicamentos biológicos, tales como sugerir cuáles de ellos deberían ser aprobados para su uso en el hospital en cuestión.
CMB: comité de medicamentos biológicos (incluye biosimilares).
Nivel de conocimiento sobre los biosimilares y su importancia
El nivel de conocimiento de los encuestados sobre los biosimilares y sobre su importancia se muestra en la tabla 2. El nivel de conocimientos en relación con los principales aspectos del desarrollo de biosimilares fue medio (en una escala del 1 al 5, media de alrededor de 3). El nivel de importancia asignado a estos aspectos del desarrollo y a los datos de la vida real fue en general alto (en una escala del 1 al 10, media de aproximadamente 8). Los participantes consideraron que la seguridad era el aspecto más importante en el desarrollo de biosimilares. Las diferencias observadas entre médicos y farmacéuticos hospitalarios fueron escasas.
Tabla 2. Nivel de conocimiento de los encuestados sobre la importancia de los principales componentes del desarrollo de los biosimilares y sobre los datos en vida real*.

*Los resultados se expresan como media ± desviación estándar. Sólo se representan (numéricamente) las diferencias significativas entre los grupos.
†1-5 (1 = nivel muy bajo de conocimiento a 5 = nivel muy alto de conocimiento).
‡1-10 (1 = nada importante a 10 = extremadamente importante).
Encontramos que el 23% de los farmacéuticos de hospital y el 28% de los médicos sabían lo que es una indicación sensible. Entre el 20% y el 30% de los participantes no sabían qué es la extrapolación de indicaciones, y más del 50% de los encuestados (61% de los farmacéuticos hospitalarios y un 54% de los médicos) no tenían claros los conceptos de intercambiabilidad, cambio o sustitución
Acceso a los biosimilares, actitudes y percepciones en la práctica clínica
Se observó una gran variabilidad en el número, tipos y marcas de los biosimilares en los distintos hospitales. Muchos participantes creían que debería disponerse de más de una marca por dos razones. En primer lugar, para no quedarse sin existencias y, en segundo lugar, para estimular la competencia de medicamentos biológicos. Se encontró también que cada centro tiene sus preferencias, políticas y prácticas en relación con el uso de los biosimilares. La mayor parte de los encuestados consideraron que las principales razones para incorporar biosimilares a un centro tenían que ver con factores económicos o de eficiencia. Cabe destacar que un 28% de los médicos no conocían los criterios ni los procedimientos asociados a la incorporación de biosimilares en sus centros.
La mayoría de los encuestados (85%) señalaron su disposición a prescribir un biosimilar en pacientes sin tratamiento biológico previo. Aunque el 55% de los participantes tiene experiencia con la extrapolación de indicaciones, los farmacéuticos de hospital se sentían significativamente más cómodos que los médicos con las extrapolaciones (74% frente al 38%) (p = 0,039). En este sentido, muchos afirmaron que: “Los biosimilares podrían tener distintos resultados en función de cada enfermedad. Por lo tanto, deben proporcionarse datos en cada indicación”. Alrededor del 10% de los encuestados consideraba apropiado pasar de un medicamento biológico de referencia a un biosimilar. La mayoría se mostraban reacios a pasar de un biosimilar a otro biosimilar. Los participantes comentaron en este sentido: “Existen pocos datos para avalar el paso de un biosimilar a otro”, “He observado una eficacia menor que no puede explicarse por un efecto placebo”, “Necesitaría más tiempo de consulta para explicarle a mis pacientes la realización de un cambio de este tipo”. Por último, fue significativamente mayor el número de médicos que de farmacéuticos hospitalarios con una opinión negativa de la sustitución automática de un medicamento biológico de referencia por un biosimilar a nivel de la farmacia (67% versus 16%) (p < 0,001). Un 22% de los encuestados manifestaron que esta práctica se realizaba en sus centros.
Las preguntas sobre los cambios de un biológico de referencia a un biosimilar revelaron que para el 72% de los encuestados estos no modifican el seguimiento habitual de los pacientes. Un 36% de los médicos indicaron que los pacientes suelen mostrarse bastante reacios/desconfiados al proponerles un cambio a un biosimilar, aunque al final suelen aceptar el cambio. Al preguntar a los farmacéuticos de hospital sobre la reacción de los médicos al proponerles este cambio, un 32% señalaron que los médicos suelen comprender y aprobar los cambios, un 32% que los médicos se suelen mostrar reacios/desconfiados pero que al final lo aceptan, y un 16% que los médicos no suelen aceptar los cambios de un biológico habitual a un biosimilar. Más del 90% de los encuestados creían que la adherencia a los biosimilares era similar a la de los biológicos de referencia. Algunos participantes sugirieron la posibilidad de que la industria farmacéutica podría influir negativamente en la confianza hacia los biosimilares.
El 23% de los farmacéuticos de hospital y el 34% de los médicos indicaron que sus centros contaban con criterios predefinidos sobre el uso de biosimilares. Algunos hospitales siguen objetivos y criterios impuestos por las autoridades autonómicas, mientras que otros han establecido algunos criterios “de obligado cumplimiento” para el uso de biosimilares en pacientes que no han recibido tratamiento con biológicos de referencia, o para cambiar a todos los pacientes con infliximab (original) a este medicamento, pero biosimilar. Algunos encuestados refirieron haber recibido presiones para prescribir biosimilares, especialmente en pacientes que nunca habían recibido medicamentos biológicos de referencia. Casi un 60% de los participantes manifestaron que el director médico, o alguna otra autoridad de su centro, había propuesto la formulación de recomendaciones que priorizaran el uso de biosimilares en pacientes que nunca habían sido tratados con medicamentos biológicos de referencia, así como la incentivación de cambios de tratamiento a un biosimilar.
Por último, un 81% de los médicos admitieron estar bastante o muy satisfechos con el uso de biosimilares. La mayor parte de ellos también consideraron que su uso tenía un impacto positivo en los costes, sin que percibieran una diferencia clara (en comparación con los biológicos de referencia) en cuanto a su eficacia, efectividad, seguridad o inmunogenicidad, ni en la adherencia o satisfacción de los pacientes.
Barreras y facilitadores al uso de biosimilares
Las tablas 3 y 4 presentan las principales barreras y facilitadores relacionados con el uso de biosimilares.
Tabla 3. Principales barreras al uso de biosimilares y la probabilidad de superarlas*.

*A menos que se indique lo contrario, los resultados indican el número (porcentaje) de participantes que identificaron las barreras. No se observaron diferencias significativas entre farmacéuticos de hospital y médicos. La probabilidad de superar las barreras se determinó mediante una escala de 1 (imposible) a 10 (muy probable).
†Media ± desviación estándar.
Tabla 4. Principales facilitadores para el uso de biosimilares y la probabilidad de que éstas sean implementadas*.

*A menos que se indique lo contrario, los resultados indican el número (porcentaje) de participantes que identificaron los facilitadores. Sólo se representan (numéricamente) las diferencias significativas entre los grupos. La probabilidad de introducir facilitadores se determinó mediante una escala de 1 (imposible) a 10 (muy probable).
†Media ± desviación estándar.
El futuro de los biosimilares y otras cuestiones
Cuando se preguntó sobre si los biosimilares podrían llegar a utilizarse en primera línea de tratamiento, e incluso sustituir a los fármacos tradicionales (metotrexato, sulfasalacina, etc.), la mayor parte respondió afirmativamente.
La encuesta incluía una pregunta específica para los farmacéuticos hospitalarios en la que se les pedía que graduaran la importancia de ciertas actividades realizadas con los biosimilares, asignándoles una puntuación del 1 (sin importancia) al 10 (de gran importancia). El resultado fue el siguiente (medias): programas de apoyo al paciente 7,0 ± 2,7; servicio de entrega a domicilio 6,4 ± 2,8; telefarmacia/telemedicina 7,2 ± 2,5; formación en gestión hospitalaria 7,2 ± 2,4.
Por último, se daba a los participantes la posibilidad de manifestar otras preocupaciones que pudiesen tener en torno a los biosimilares. Además de las relacionadas con la falta de datos a largo plazo o en vida real, se mencionaron otras cuestiones como los problemas de trazabilidad de los biosimilares, o el riesgo de que se produzcan roturas de stock de los biológicos de referencia debido a que su comercialización deje de ser rentable para la empresa farmacéutica que los produce.
Discusión
Esta encuesta ha examinado por primera vez la variabilidad en el uso de biosimilares para el tratamiento de enfermedades inmunitarias como la artritis reumatoide, la enfermedad intestinal inflamatoria o la psoriasis en España. En la Unión Europea hay actualmente más de 20 biosimilares (correspondientes a cuatro fármacos biológicos de referencia) para el tratamiento de esas enfermedades1. El uso de biosimilares está muy extendido en España19-22.
Nuestro análisis reveló que el nivel de conocimiento de los encuestados sobre las características fundamentales de los biosimilares y del marco normativo que los regula es insuficiente, especialmente teniendo en cuenta que la mayoría de los participantes llevan muchos años utilizando medicamentos biosimilares y tienen acceso a datos empíricos e información publicada por los órganos normativos1,23-32. Curiosamente, el nivel de importancia de estas cuestiones fue calificado como alto. En la bibliografía se han descrito niveles variables de conocimiento de las características de los biosimilares en los profesionales sanitarios4-7. Esta falta de conocimiento general se hizo aún más notoria en las preguntas específicas sobre las definiciones de conceptos como indicación sensible o extrapolación de indicaciones. Más de la mitad de los encuestados no tenían una idea clara sobre aspectos como la intercambiabilidad, el cambio o la sustitución. Por lo tanto, estos resultados ponen de manifiesto una importante necesidad de formación sobre biosimilares basada en la evidencia. Los profesionales encargados de prescribir estos medicamentos deberían tener un nivel de conocimiento de estos medicamentos muy alto para poder pautárselos a sus pacientes.
A pesar de su experiencia, los médicos mostraban menor seguridad en lo relativo a la extrapolación de indicaciones. Como también se ha publicado en otros estudios, los encuestados consideran que hacen falta más datos empíricos en este sentido. Los encuestados también se mostraron inseguros en relación con los cambios, es decir, administrar un biosimilar a un paciente previamente tratado con un medicamento biológico de referencia o viceversa, y los cambios múltiples. Estas dudas han sido atribuidas por otros estudios al riesgo de efecto nocebo, a una posible menor eficacia, a una mayor inmunogenicidad del biosimilar, o a la percepción de que no está justificado prescribir un cambio únicamente por motivos económicos4-9,15.
Por otro lado, se objetivó una enorme variabilidad en el número, tipos y marcas de biosimilares utilizados en los hospitales españoles. Asimismo, se observaron diferencias en cuanto a las preferencias, políticas y prácticas en materia de uso de biosimilares entre un centro y otro. Aunque este proyecto no estaba diseñado para explorar ni medir estos aspectos en detalle, estamos convencidos de que tienen una influencia directa sobre los prescriptores de biosimilares. Será necesario seguir investigando esta cuestión. También debe señalarse que existe una ausencia generalizada de enfoques, criterios y orientaciones holísticos (basadas en la mejor evidencia disponible) en relación con el uso de medicamentos biosimilares en las especialidades médicas analizadas. En los centros en los que existían unas recomendaciones, éstas estaban dirigidas principalmente a incrementar el uso de biosimilares y a los cambios de medicamentos de referencia por biosimilares. Esta situación se debe probablemente a las presiones económicas que sufren los hospitales. Cabe mencionar que una de las principales barreras encontradas en esta encuesta es la falta de coordinación y de acuerdo entre los distintos estamentos dentro del centro. Podría ser beneficioso implicar a sus profesionales sanitarios en el diseño de políticas y protocolos que ayuden a promover el uso de los biosimilares.
Tal y como han demostrado otros autores4,7,8,13-15, las barreras más habituales al uso de biosimilares incluyen la falta de confianza, conocimientos o experiencia con estos medicamentos. Por otro lado, los principales facilitadores son la existencia de evidencia (ensayos clínicos y datos empíricos de la vida real) sobre disponibilidad, eficacia, seguridad e intercambiabilidad, la guía proporcionada por las sociedades científicas y la opinión de colegas. Estos resultados subrayan la necesidad de llevar a cabo actividades formativas y otros proyectos en torno a los biosimilares.
Sin embargo, este estudio presenta varias limitaciones. La primera tiene que ver con la forma en la que se seleccionó la muestra, que podría limitar la representatividad y reproducibilidad de los resultados. Por ello, los resultados deben ser interpretados con cautela. No obstante, se han tenido en cuenta distintos factores que podrían influir en el conocimiento o las percepciones sobre el uso de biosimilares. Para incrementar la representatividad del estudio, se procuró que la muestra fuese equilibrada, con profesionales sanitarios de distintas regiones que desempeñaran sus funciones en distintos tipos de hospitales y organizaciones. Además, la tasa de respuesta fue muy elevada y muchos de los hallazgos de la encuesta están en consonancia con lo descrito en otros países. También es importante destacar que no se ha aplicado ningún criterio relativo al conocimiento o experiencia de los participantes en relación con el uso de biosimilares para evitar un sesgo de selección. Otra limitación ha sido la longitud de la encuesta, que hizo que se registrara una pequeña disminución en la tasa de respuestas hacia el final. Sin embargo, es poco probable que esta disminución haya influido en la dirección de las respuestas. Por último, debido al tamaño de la muestra, es posible que se hayan infraestimado las diferencias entre los profesionales sanitarios participantes.
Las dudas y preocupaciones de los profesionales sanitarios constituyen un obstáculo para el uso de los biosimilares. Muchas de ellas se deben a una falta de conocimiento sobre las características de los biosimilares. Por ello, es necesario ofrecer actividades formativas para superar esa barrera. La disponibilidad de un mayor número de estudios que avalen el uso de biosimilares contribuirá a un aumento en la adopción de estos medicamentos. Asimismo, teniendo en cuenta la gran variabilidad observada entre los distintos centros en relación con el uso de biosimilares, es necesario realizar mayores esfuerzos para armonizar su uso.
Muchas veces los clínicos también son reacios a cambiar un fármaco de referencia por un biosimilar, no sólo por falta de conocimiento, sino también porque lo más habitual es que el motivo del cambio sea económico (por ejemplo, a consecuencia de las políticas de compras del hospital). Se requiere mayor información sobre la seguridad y eficacia de estos cambios, basada en el seguimiento de los pacientes, los registros y la práctica clínica. También debe recordarse que médicos y farmacéuticos de hospital pueden tener distintas motivaciones y que en ocasiones hay una falta de trabajo en equipo y de colaboración entre ellos33.
Aportación a la literatura científica
Por primera vez se ha constatado una gran variabilidad con el uso de biosimilares en al menos tres especialidades médicas (dermatología, gastroenterología y reumatología), así como en farmacia hospitalaria en España. Destacamos el bajo grado de conocimiento en general sobre los aspectos más relevantes de los biosimilares. Asimismo, los médicos muchas veces no están dispuestos a cambiar entre el medicamento biológico de referencia y el medicamento biosimilar, no sólo por falta de formación, sino también porque la única motivación que encuentran es económica. La disposición de recomendaciones de las asociaciones y sociedades científicas, la demostración de la eficacia de la intercambiabilidad y la disposición de datos de seguridad a largo plazo y de vida real, facilitarían el uso de biosimilares en nuestro país.














