Introducción
Desde su descubrimiento accidental en el año 1891 por parte del científico francés A. Villiers como resultado de la digestión bacteriana del almidón y tras la posterior identificación, elucidación estructural y determinación de sus propiedades fisicoquímicas en la década de 1940, las ciclodextrinas (CD) se han utilizado ampliamente en la preparación de productos cosméticos, dietéticos y farmacéuticos a nivel mundial1,2.
Las CD son oligosacáridos naturales cíclicos que constan de 6 (α-CD), 7 (β-CD) u 8 (γ-CD) monómeros de glucosa unidos mediante enlaces α‑1,4‑O‑glicos.dicos3. Una de las características principales de las CD es la estructura tridimensional en forma troncocónica que adoptan en disolución, con una cavidad interior hidrofóbica y un exterior hidrofílico que les confiere naturaleza anfifílica. Ello les permite formar complejos de inclusión con una gran versatilidad de moléculas, lo cual resulta realmente interesante en el mundo farmacéutico y la principal razón de su utilización en la formulación de medicamentos, pues gracias a esto las CD presentan la propiedad de aumentar la solubilidad aparente y la velocidad de disolución de moléculas poco solubles en medio acuoso4. También se les ha atribuido la capacidad de enmascarar olores y sabores desagradables, reducir el efecto irritante de moléculas a las que acomplejan y optimizar la difusión de moléculas a través de las membranas biológicas. Incluso pueden incrementar la estabilidad de muchas moléculas frente a diferentes procesos de degradación como la hidrólisis, la oxidación, la volatilización, la sublimación, el calor, la luz o la reacción con otros componentes presentes en la formulación1-4. Teniendo en cuenta, además, las pocas incompatibilidades que presentan y su buen perfil de seguridad, la utilización de CD como excipientes de medicamentos está aprobada desde hace aproximadamente 40 años tanto en Japón como en Europa y desde hace 20 años en Estados Unidos1. Su empleo en formas farmacéuticas líquidas tanto de administración oral como oftálmica es el más interesante desde el punto de vista de la farmacotecnia en los servicios de farmacia hospitalaria, aunque pueden incorporarse en multitud de formas farmacéuticas, siendo el empleo en formas farmacéuticas parenterales una buena alternativa en la solubilización de fármacos poco hidrosolubles frente a la utilización de otras técnicas de solubilización, y en formas farmacéuticas sólidas una buena opción para mejorar la biodisponibilidad por vía oral en el caso de los medicamentos de fabricación en la industria farmacéutica1-4. Algunos ejemplos de medicamentos comercializados a día de hoy en nuestro país que contienen CD como excipiente son Caverject dual® (alprostadilo) solución inyectable (α-CD), Yaz® (drospirenona/etinilestradiol) comprimidos (β-CD), Nicorette® (nicotina) comprimidos sublinguales (β-CD), Propulsid® (cisaprida) supositorios (2-hidroxipropil-β-CD [HPβCD]), Vfend® (voriconazol) solución intravenosa (sulfobutiléter-β-CD sal sódica [SBEβCD]) y CardioTec® (99Tc-teboroxima) solución inyectable (γ-CD)2.
A pesar del aparente potencial de las CD como excipientes, su empleo en formulación magistral a día de hoy apenas está instaurado. Son muchos los trabajos de investigación enfocados a utilizar CD con el fin de aumentar la solubilidad aparente de los fármacos o aumentar la estabilidad de fármacos en solución, como isoniazida, rifampicina o hidroclorotiazida5,6. Incluso se está estudiando a nivel académico el uso de CD como moduladores de la liberación de fármacos, tal y como se muestra en el estudio desarrollado por Shende et al., en el que se utiliza β-CD para la formulación de nanoesponjas de carbonato cálcico para el tratamiento de la hiperfosfatemia7, o en el estudio de Lembo et al., donde se demuestra que la inclusión de aciclovir en nanoesponjas de β-CD carboxilada aumenta la actividad viricida frente al virus del herpes simple tipo 1 en cultivos celulares8.
Teniendo en cuenta que su utilización en España está autorizada y su buen perfil de seguridad, no es descabellado plantearse utilizar alguna CD en formulación magistral ante un problema de solubilidad del fármaco que deseamos formular o la búsqueda de un enmascaramiento de un olor o sabor desagradable. De hecho, ya se han realizado trabajos desde la Sociedad Española de Farmacia Hospitalaria en los que se han empleado CD en la formulación magistral de algunos principios activos en forma de colirios, como es el caso del econazol, en el que se emplea α-CD como agente solubilizante del fármaco9, o incluso hidrogeles oftálmicos de voriconazol-CD (hidroxipropil-β-CD [HPβCD]) o hidroxipropil-γ-CD (HPγCD)) o colirios de tacrolimus-HPβCD que mejoran la solubilidad, permanencia y seguridad oftálmica de estos principios activos10,11.
Mediante la presente revisión se pretende evaluar la utilización de CD como excipientes en formulación magistral desde el punto de vista galénico, biofarmacéutico-farmacocinético, toxicológico, regulatorio, económico y comercial.
Métodos
Se ha realizado una búsqueda bibliográfica en PubMed y Google Scholar de acuerdo con los siguientes términos: cyclodextrins AND pharmaceutics, applications, formulation, pharmaceutical preparations, pharmaceutical compounding, drug compounding, complexation efficiency, cyclodextrin complex, inclusion complex, complexation, complex synthesis, complex formation, pediatrics, toxicology, safety, cost. Se han incluido en el estudio artículos de revisión y originales con alto índice de citas, independientemente del año de publicación. Para la profundización de la información recopilada de los artículos de revisión seleccionados se han consultado a su vez las referencias bibliográficas de los mismos y los artículos similares sugeridos por el buscador o la revista científica en que dichos artículos han sido publicados. También se han consultado libros de tecnología farmacéutica, documentos legislativos y regulatorios a través del Boletín Oficial del Estado, la Agencia Española de Medicamentos y Productos Sanitarios y la Agencia Europea del Medicamento y las referencias bibliográficas asociadas a cada documento consultado, junto con las monografías de CD recogidas en diferentes farmacopeas de reconocido prestigio.
Resultados
Tras revisar exhaustivamente 14 artículos de revisión, 5 artículos legislativos, 1 capítulo de libro y 22 artículos originales, se ha establecido que es necesario tener en cuenta las siguientes consideraciones galénicas, biofarmacéuticas-farmacocinéticas, toxicológicas, regulatorias, económicas y comerciales antes de plantearse emplear CD como excipientes en una fórmula magistral.
Consideraciones galénicas
En primer lugar, es importante saber que existen CD naturales y CD modificadas o sustituidas y conocer las diferencias existentes entre ellas en términos de solubilidad, estabilidad frente a la hidrólisis, eficiencia de complejación y las características fisicoquímicas y estructurales de los fármacos que se pretende complejar (Tabla 1)1,2.
Tabla 1. Características de las principales ciclodextrinas empleadas como excipientes en productos farmacéuticos solubilidad lipofilia peso molecular y grado de sustitución molar1,2
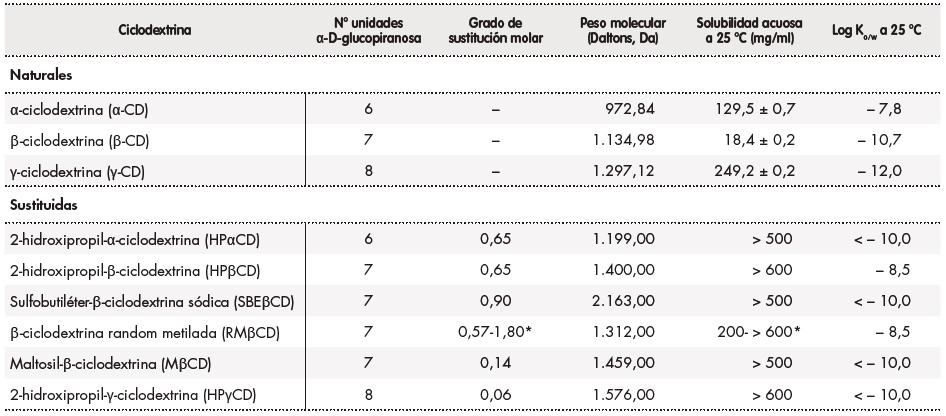
Log Ko/W: coeficiente de reparto octanol/agua.
*Valores dependientes del tipo de proveedor que suministre la materia prima.
Solubilidad
En lo que respecta a la solubilidad, cabe destacar que las CD naturales (α-CD, β-CD y γ-CD) presentan menor solubilidad en agua que sus inclusión es que la molécula huésped, o sea, el fármaco, pueda introducirse total o parcialmente en la cavidad de oligosacáridos homólogos de cadena abierta. Concretamente, la β-CD es la menos soluble de todas al formar un mayor número de puentes de hidrógeno intermoleculares, siendo más susceptible de formar agregados intermoleculares. En el caso de las CD sustituidas (HPβCD, sulfobutiléter- β-CD [SBEβCD], HPγCD, β-CD random metilada [RMβCD], etc.), la solubilidad acuosa es mayor que la de sus predecesoras naturales. Esto es debido a que la introducción de sustituyentes hidroxialquílicos, metílicos o sulfoxialcoxílicos en los grupos hidroxilo libres de las unidades de α-Dglucopiranosa de las CD naturales induce el cambio de estado cristalino de las variantes naturales a amorfo de las sustituidas y conduce, en consecuencia, al aumento de la solubilidad de estas últimas en medios acuosos1. Atendiendo a este aspecto, las CD sustituidas pueden ser de elección en la formulación de soluciones acuosas dada su mayor hidrosolubilidad2, aunque se recomienda, no obstante, realizar estudios de estabilidad de las disoluciones obtenidas. En el caso de que se decida utilizar CD naturales, la realización de estudios de estabilidad de la disolución cobra mayor importancia, dada su mayor tendencia a la formación de agregados intermoleculares. En el caso concreto de la β-CD, la de menor solubilidad, se ha demostrado que la adición de hidroxiácidos a la fórmula como el ácido cítrico y el ácido tartárico, frecuentemente utilizados en la formulación de formas farmacéuticas líquidas como estabilizadores de pH y en formas farmacéuticas sólidas como agentes efervescentes, puede optimizar la solubilidad acuosa de la misma, supuestamente a través de un mecanismo de modificación de los puentes de hidrógeno tanto intramoleculares como intermoleculares de la misma y, con ello, aumentar la estabilidad de la disolución1,2. Otro aspecto a tener en cuenta en relación con la solubilidad es la temperatura a la que se consigue la completa solubilización de la CD en cuestión. Y es que en el caso de la α-CD, por ejemplo, es necesario calentar el medio acuoso a una temperatura aproximada de 40 ºC para conseguir su completa disolución y poder proceder entonces a la formación de complejos de inclusión con el econazol para su formulación en forma de colirio9. En estos casos se considera muy importante evaluar la estabilidad de la disolución como parte de la validación galénica de la fórmula en función de la temperatura, ya que esta puede alterar la calidad del fármaco fundamentalmente si presenta características de termolabilidad o volatilidad.
Por otro lado, esta capacidad de las CD naturales, y sobre todo de la β-CD, de formar agregados entre ellas puede a su vez contribuir al aumento de solubilización de algunos de los fármacos con los que forman complejos de inclusión1,2. En estos casos, en lugar de disoluciones, las CD contribuyen a la formación de sistemas dispersos de poca estabilidad fisicoquímica de tipo suspensión, para lo cual hay que emplear estabilizantes en la formulación como humectantes, viscosizantes, agentes floculantes, etc., que ya de por sí suponen un aumento del coste asociado a la fórmula al incrementar el número de excipientes a utilizar, así como un control de calidad rutinario de las diferentes fórmulas magistrales preparadas como parte de la validación galénica2,10. Teniendo en cuenta esto, es razonable pensar que se prefieran en un primer momento las CD sustituidas (HPβCD, SBEβCD, HPγCD, RMβCD) para elaborar fórmulas magistrales líquidas. De hecho, la β-CD, dada su menor solubilidad y su mayor riesgo de formación de agregados, se emplea fundamentalmente como excipiente en formas farmacéuticas sólidas1-4,7,8,10,12.
Resistencia a la hidrólisis
Otro aspecto importante que se ha de tener en cuenta es la resistencia de las CD a la hidrólisis, concretamente en medio ácido si lo que queremos es emplearlas como excipientes en formas farmacéuticas de administración oral. A excepción de la γ-CD, que se degrada rápidamente en medio ácido, todas las CD mantienen su estructura intacta y su función formadora de complejos de inclusión con fármacos a lo largo de todo el tracto gastrointestinal hasta llegar al colon, donde son degradadas por la acción de la flora bacteriana intestinal2. En el caso de que se requiera elaborar una fórmula magistral en solución acuosa de administración parenteral, la γ-CD se considera la candidata más apropiada. Ello es debido precisamente a su mayor velocidad de hidrólisis y a su menor riesgo de nefrotoxicidad, aunque se ha podido comprobar que el empleo de otras CD sustituidas, como HPβCD y RMβCD, también puede ser adecuado13-16.
Formación de complejos de inclusión ciclodextrina-fármaco
Por otro lado, es muy importante comprender que en la formación de los complejos de inclusión CD-fármaco intervienen una serie de factores que se deben tener en cuenta.
En primer lugar, es importante considerar el peso molecular y la estructura química del fármaco que se pretende complejar para seleccionar la CD más adecuada para tal fin2. El primer requisito para la formación de un complejo de inclusión es que la molécula huésped, o sea, el fármaco, pueda introducirse total o parcialmente en la cavidad de la ciclodextrina1,2,17. En el caso de las CD naturales, los tamaños de la cavidad aumentan en el orden α < β < γ1,2. Además, hay estudios que demuestran que la eficiencia de complejación de las CD puede verse favorecida ante la presencia de determinados requerimientos estructurales en los fármacos, como es el caso de la α-CD, que presenta mayor eficiencia de inclusión de fármacos con estructura de ácidos dicarboxílicos e hidroxicarboxílicos como el ácido azelaico y el ácido acetilsalicílico que el resto de CD1. Como norma general, es importante tener en cuenta que la eficiencia de complejación de las CD se va a ver favorecida por la presencia de grupos hidrófobos en las moléculas huésped y dificultada por la presencia de grupos polares o ionizables. No obstante, existen casos excepcionales en los que no es exactamente así, tal y como se explica más adelante en las estrategias de mejora de la eficiencia de complejación4,18.
En segundo lugar, es importante tener en cuenta la masa total necesaria de CD para conseguir complejar todo el fármaco y, en consecuencia, la masa total de los complejos formados o masa bulk. Una masa bulk demasiado elevada puede acarrear problemas no solo desde el punto de vista galénico, sino también toxicológico. Concretamente, en el caso de formas farmacéuticas líquidas de administración oral u oftálmica, una masa bulk elevada puede dar lugar a problemas de estabilidad de la formulación por la posibilidad existente de formación de agregados, sobre todo en el caso de que se empleen CD naturales en la formulación1,2. En el caso de las formas farmacéuticas sólidas, como los comprimidos o las cápsulas, podría entrañar un aumento del volumen unitario de la forma de dosificación y con ello la aparición de dificultades para su deglución por parte de los pacientes. Por el contrario, en el caso de formas farmacéuticas líquidas de administración parenteral, el empleo de cantidades mínimas de CD es lo más recomendado ya que, aparte de los problemas asociados a la estabilidad de la disolución parenteral de una masa bulk elevada, una cantidad superior de CD y administrada durante un tiempo más o menos prolongado puede desembocar en toxicidad renal e incluso hemólisis13,14. Se han empleado para ello diferentes estrategias optimizantes, como la modificación del pH de la fórmula, el empleo de ácidos o bases, polímeros hidrosolubles, cosolventes, contraiones o metales, que no solo contribuyen a mejorar la eficiencia de complejación, sino también la solubilidad intrínseca del propio fármaco (Tabla 2)2,12. Estas estrategias contribuyen a disminuir la masa bulk y aumentar la estabilidad, la deglutabilidad de la fórmula en caso de formas farmacéuticas sólidas orales y disminuir el riesgo de toxicidad.
Tabla 2. Breve explicación de las estrategias de optimización de formación de complejos de inclusión referenciadas basadas en que la eficiencia de complejación depende directamente de la solubilidad intrínseca del fármaco a complejar y la constante de estabilidad de los complejos ciclodextrinafármaco formados2,12

Validación galénica
En último lugar, hay que tener en cuenta la dificultad en la validación galénica que puede entrañar el empleo de CD en una fórmula magistral. Los procesos de preparación de los complejos de inclusión de los fármacos están expuestos a una alta variabilidad interproceso ya demostrada en la fabricación industrial de medicamentos. Ello es debido a la alta influencia de una serie de factores que pueden ser críticos para que la formación de los complejos de inclusión CD-fármaco se lleve a cabo de forma exitosa a nivel de laboratorio (Tabla 3)19-25. Por otro lado, se ha demostrado también que la capacidad de formación de complejos de inclusión de las CD está muy influenciada por el entorno en el que se produce su síntesis química, dando lugar a diferencias en eficiencia de complejación no solo entre proveedores, sino entre lotes de un mismo proveedor. Esto es más evidente en el caso de las CD sustituidas debido a la aleatoriedad de la introducción de sus sustituyentes durante su proceso de fabricación tanto en número como en posición dentro del oligosacárido1,2. A este respecto, en un estudio de Pitha et al.26se demuestra que la eterificación de los grupos hidroxilo libres de las posiciones 2 y 3 del anillo de la β-CD da lugar a CD sustituidas con menor eficiencia de complejación que cuando la eterificación se produce en el grupo hidroxilo libre de la posición 6.
Tabla 3. Métodos de preparación de complejos de inclusión referidos en la literatura junto con sus factores críticos de proceso19,25
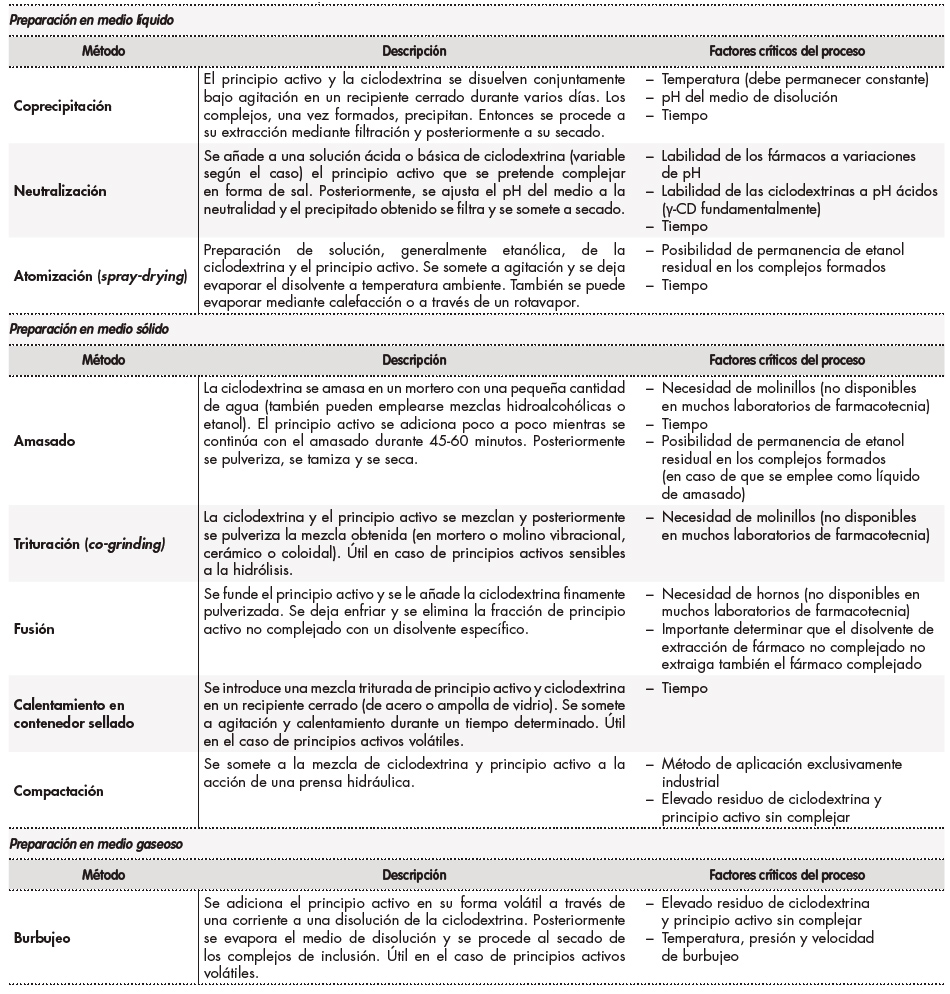
Asimismo, se demuestra también que un mayor grado de eterificación de los hidroxilos conlleva una menor eficiencia de complejación, muy probablemente debido al impedimento estérico generado en los derivados obtenidos26. En otro estudio publicado por los mismos investigadores un par de años más tarde se evalúa la influencia del pH en la eterificación de las CD, concluyéndose que en el caso de los derivados de β-CD las diferencias de pH no influyen apenas en la eterificación de sus hidroxilos, aunque en el caso de los derivados de α-CD y γ-CD no pueden extraerse las mismas conclusiones27. Ante estos resultados, Loftsson et al. consideran en sus diferentes revisiones que el pH del entorno durante la síntesis de CD debe ser un valor constante, y las mínimas variaciones de pH que tienen lugar durante estas reacciones pueden dar lugar a derivados con diferencias en su eficiencia de complejación1,2.
Teniendo en cuenta la alta variabilidad de las CD derivada de su proceso de síntesis química, la falta de robustez del proceso de complejación a escala de laboratorio y la poca reproducibilidad asociada a ambos procesos se considera necesaria la realización de controles de calidad rutinarios tras la elaboración, no solo de cada lote, sino de cada fórmula magistral individualizada en la que se empleen CD como excipientes.
Consideraciones biofarmacéuticas-farmacocinéticas
En lo que respecta a la utilización de CD para aumentar la solubilización de fármacos por vía oral, ha de tenerse en cuenta que las CD han demostrado incrementar la biodisponibilidad oral de los fármacos de clase II del Sistema de Clasificación Biofarmacéutica de la Food and Drug Administration (FDA), caracterizados por presentar una pobre solubilidad acuosa pero una alta permeabilidad. Por el contrario, pueden disminuirla en fármacos de clase I (alta solubilidad acuosa, alta permeabilidad) o clase III (alta solubilidad acuosa, poca permeabilidad)1,4. Esto puede ser un aspecto interesante que se ha de considerar de cara a la coformulación dentro de una misma fórmula magistral de varios principios activos.
Además, debe tenerse en cuenta que la estabilidad de los complejos de inclusión formados puede influir en la biodisponibilidad tanto en magnitud como en velocidad. Cuando la estabilidad de dichos complejos es muy alta, la velocidad de liberación y de disolución del fármaco puede verse ralentizada y reducirse, por tanto, su biodisponibilidad en velocidad17. Por otro lado, el empleo de complejos de inclusión con baja estabilidad puede provocar una rápida liberación del fármaco en el tracto gastrointestinal, con su consiguiente precipitación en el intestino. En este caso, a pesar de que la eficiencia de complejación sea buena, la cantidad de fármaco absorbida puede ser inferior y en este caso se vería reducida, por tanto, su biodisponibilidad en magnitud28.
Es importante tener en cuenta, además, que en el caso de querer preparar fórmulas magistrales de administración pediátrica está el inconveniente añadido de que una gran cantidad de fármacos para los cuales puede estar indicada la formulación con CD para optimizar tanto la biodisponibilidad como para enmascarar características organolépticas desagradables, como por ejemplo el isavuconazol, requieren ser monitorizados en este tipo de pacientes. La alteración de la biodisponibilidad en velocidad derivada de complejos de inclusión de alta estabilidad o de la biodisponibilidad en magnitud derivada de complejos de baja estabilidad puede modificar los niveles plasmáticos alcanzados de dichos fármacos para una dosis que, en un principio, puede ser adecuada29.
En relación con otras vías de administración de interés, como puede ser la oftálmica, la utilización de CD puede resultar interesante para mejorar no solo la solubilidad y estabilidad de algunos fármacos, sino también su permeabilidad a través de la capa mucinosa acuosa y disminuir con ello la irritación local17. En el caso concreto de la formulación de colirios, la α-CD se considera la CD de elección por presentar además la propiedad de interferir directamente con las membranas lipídicas de las láminas lipoideas epiteliales, aumentando la porosidad de las membranas frente al fármaco administrado, aunque también pueden emplearse CD sustituidas como la HPβCD15,16,30,31.
En el caso de que queramos preparar una pomada o crema para la administración tópica de un fármaco que pretendemos complejar tanto para optimizar su solubilidad como para enmascarar sus propiedades irritantes, es importante verificar en primer lugar que no existen problemas de incompatibilidad con el resto de excipientes. Las CD en este tipo de preparados se asocian con un mayor riesgo de formación de grumos y de espuma en las emulsiones. Se recomienda, en el caso de que se decida incluir una CD en la fórmula, utilizar la HPβCD que, además de presentar propiedades surfactantes, también prolonga el tiempo de contacto del fármaco con la piel, aunque también se pueden emplear otras CD sustituidas15,32,33.
Consideraciones toxicológicas
Las CD han demostrado de forma general ser excipientes muy seguros. No obstante, es importante tener en cuenta que la administración de dosis por encima de un umbral y/o durante tiempos prolongados puede producir efectos secundarios. Por ello, se recomienda valorar no solo la viabilidad del empleo de una determinada CD en una fórmula magistral de acuerdo con criterios galénicos y biofarmacéuticos-farmacocinéticos, sino también considerar las dosis máximas establecidas por los diferentes reglamentos a nivel europeo para cada una de las CD autorizadas para uso farmacéutico (Tabla 4)15,16.
Tabla 4. Umbrales de ciclodextrinas sugeridos en población adulta y pediátrica establecidos por el Committee for Human Medicinal Products el 20 de noviembre de 2014 superados los cuales pueden aparecer efectos secundarios asociados a su utilización15

N: no existencia de datos de referencia para la vía de administración correspondiente; PDE: exposición diaria permitida. ±1: estimación basada en propiedades de las ciclodextrinas.
*A pesar de sus diferencias en cuanto a peso molecular y carga en disolución, HPβCD y SBEβCD pueden considerarse similares en cuanto a sus propiedades y perfil toxicológico.
En lo que respecta a su administración por vía oral, se ha demostrado que las CD se absorben en cantidades muy insignificantes al ser metabolizadas a nivel colónico por la flora bacteriana intestinal, siendo la RMβCD la que más se absorbe, con una biodisponibilidad oral del 12% en ratas respecto al 0,1-3% del resto de CD. Existen, no obstante, evidencias de que dosis altas de CD administradas por vía oral (> 1.000 mg/kg/día) pueden producir cuadros diarreicos reversibles y agrandamiento cecal en estudios realizados en animales2,15,16,34-36.
Respecto a otras vías de administración alternativas, se ha demostrado que la absorción de las CD puede verse incrementada por la presencia de algunos componentes en la fórmula o incluso por su propia concentración. Tal es el caso de las vías intranasal e intratraqueal, para las cuales la absorción sistémica de CD es prácticamente insignificante. Concretamente, la administración de medicamentos con dosis muy altas de CD puede influir en la absorción no solo del fármaco complejado, sino también de las propias CD13,29-31,37. Se ha demostrado que tras la administración intranasal en ratas de dipropil-β-CD (no utilizada en productos farmacéuticos) a una concentración de 80 mM se llega a excretar un 16% de la dosis administrada en la orina. Y en el caso de la HPβCD, se ha comprobado que la presencia de agentes estimuladores de la absorción aumenta la absorción de la CD, observándose la excreción del 45% de la dosis administrada en orina respecto a un 3% en el caso en que se administre la CD sola15,34. Del mismo modo, la absorción de CD por vía tópica es prácticamente nula, aunque en combinación con agentes promotores de la absorción como el HPE-101 o de excipientes oclusivos se ha constatado la absorción de un 12% de β-CD, un 43% de RMβCD y un 53% de la HPβCD, sin que esto llegue a suponer la aparición de efectos adversos15,34-36.
En relación con la vía rectal, sí se ha demostrado que la absorción de las CD puede ser significativa, pues pueden actuar por sí mismas como optimizadores de la absorción de fármacos a este nivel y absorberse en consecuencia17. No obstante, el riesgo de que desencadenen reacciones tóxicas tras absorción por vía rectal no es tan relevante como en el caso de que sean administradas por vía parenteral, donde las CD pueden producir toxicidad severa a nivel renal y hematológico si se administran a dosis elevadas13-16,34. La administración intravenosa de preparados farmacéuticos conteniendo CD puede inducir cambios morfológicos en las células sanguíneas y hemólisis debido posiblemente a la complejación de componentes de la membrana celular, como colesterol, fosfolípidos y proteínas. Dicha actividad hemolítica parece seguir el orden β- > α- > γ-ciclodextrina38.
Desde el punto de vista de la seguridad, la CD natural más indicada para la administración parenteral es la γ-CD, la cual no posee una nefrotoxicidad marcada (probablemente como consecuencia de su rápida degradación enzimática) y, además, presenta una baja actividad hemolítica, aunque también hay derivados de β-CD que pueden utilizarse por vía parenteral de forma segura, como la HPβCD y la SBEβCD, siempre y cuando no se administren en cantidades superiores a 15 mg/kg/día y el tiempo de administración de la fórmula magistral con la CD indicada no sea muy prolongado13-16.
Consideraciones regulatorias
Es importante tener en cuenta que no todas las CD comercializadas pueden emplearse en formulación magistral, independientemente de la idoneidad de sus propiedades y de su buen perfil de seguridad. Tal y como se establece en el Real Decreto 175/2001, de 23 de febrero, por el que se aprueban las normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales, todas las materias primas que se utilicen en formulación magistral deben estar reconocidas mediante una monografía específica en la Real Farmacopea Española o, en su defecto, la Farmacopea Europea u otra farmacopea de reconocido prestigio39. Actualmente, en la Real Farmacopea Española se encuentran reconocidas como excipientes aptos para uso farmacéutico las CD naturales (α-CD y β-CD) y la HPβCD. En la Farmacopea Europea, versión 8.7, también existen monografías para la γ-CD y la dimetil-β-CD (DMβCD), que ya apenas se utiliza, al igual que ocurre en el caso de la Farmacopea Británica en su última edición de 2017. En la Farmacopea Americana (USP-40) se encuentra reconocida como excipiente únicamente la γ-CD, aunque en el listado de excipientes de uso farmacéutico de la FDA están incluidas también la HPβCD y la SBEβCD2. Teniendo en cuenta esto, no se recomienda utilizar CD que no estén referenciadas en ninguna de las farmacopeas, aunque en búsquedas bibliográficas sí que se encuentren evidencias de su utilización.
Por otro lado, cabe destacar que las CD naturales (α-CD, β-CD y γ-CD) están incluidas en el listado GRAS de la FDA como estabilizadores del sabor, por lo que podrían ser una opción aceptable en el caso de querer enmascarar sabores desagradables de fármacos en formulaciones pediátricas2. No obstante, es importante tener en cuenta que su solubilidad en agua es menor, por lo que en este caso se considera más viable su formulación como suspensión12 y, en caso de que se empleen en disolución, se recomienda realizar estudios de estabilidad de la fórmula preparada, tal y como ya se ha mencionado anteriormente.
Consideraciones económicas y comerciales
Aunque en la actualidad su precio de venta de laboratorio presenta tendencia decreciente, las CD continúan siendo excipientes caros. El relativo alto coste asociado a emplear una CD en una fórmula magistral, junto con la necesidad de realizar controles de calidad con mayor frecuencia dada la variabilidad existente entre proveedores y lotes para una misma CD, junto con la mayor exhaustividad requerida para realizar la validación galénica de la fórmula en la que se incluye, suponen de por sí un aumento del tiempo a invertir por parte del personal de los laboratorios de farmacotecnia. Si le añadimos el hecho de que a veces es necesario adicionar algún excipiente a la fórmula magistral para aumentar la eficiencia de complejación, el coste asociado a la fórmula puede verse incrementado notablemente40.
Por otro lado, la falta de disponibilidad y de acceso a estos excipientes a través de los proveedores habituales incluidos en el Registro Unificado de Empresas de Sustancias Activas (RUESA) supone también un problema de cara a la adquisición de estas materias primas. Actualmente y desde el año 2021 solo figura en dicho registro la HPβCD, para la cual se incluyen como indicaciones la administración de medicamentos por vía parenteral y el tratamiento de la enfermedad de Niemann-Pick, teniendo la designación de “medicamento huérfano” para esta patología41. Esto implica, en el caso de que se decida incorporar una CD diferente en una fórmula magistral de preparación rutinaria, disponer de proveedores no registrados en RUESA para los que se requiere un análisis de riesgos previo sobre el proceso de síntesis de la CD y los sistemas de garantía de calidad de dichos proveedores según lo establecido en las Directrices (2015/C 95/02) de 19 de marzo de 2015 sobre la evaluación formal de riesgos a efectos de determinar las prácticas correctas de fabricación apropiadas para los excipientes de medicamentos de uso humano42.
Discusión
La solubilidad, la resistencia a la hidrólisis y la eficiencia de complejación son los principales determinantes de la selección de una determinada CD como excipiente más idóneo para una fórmula magistral. No obstante, la poca robustez de los procesos de complejación de fármacos con CD a nivel de laboratorio y la variabilidad existente para una misma CD entre proveedores y lotes para un mismo proveedor en su eficiencia de complejación son las principales limitantes de su utilización desde el punto de vista galénico, pues requieren la realización de controles de calidad rutinarios en cada fórmula elaborada.
Desde el punto de vista biofarmacéutico-farmacocinético conviene considerar que la estabilidad de los complejos CD-fármaco puede alterar la biodisponibilidad oral de los fármacos, considerándose recomendable estudiar sus constantes de estabilidad. Además, algunas CD optimizan la permeabilidad a través de membranas biológicas específicas y el tiempo de contacto con las mismas, lo cual se considera un criterio importante de selección (α-CD por vía oftálmica, HPβCD por vía tópica, como ejemplos).
A pesar de su buen perfil toxicológico, superados determinados umbrales de dosis y tiempos de administración pueden producir efectos secundarios.
A nivel regulatorio, solo las CD que están reconocidas como excipientes en farmacopeas de prestigio pueden utilizarse en formulación magistral, independientemente de que se hayan encontrado evidencias científicas que referencien su utilización.
Asumiendo, por último, que las CD siguen siendo excipientes caros y su empleo, además, se asocia a un mayor uso de recursos, de controles y ocasionalmente de excipientes, resulta evidente que la inclusión de CD como excipientes en fórmulas magistrales supone un importante incremento de la carga de trabajo en los laboratorios de farmacotecnia de los servicios de farmacia hospitalaria, por no hablar de la dificultad de adquisición que además presentan a través de los proveedores registrados en RUESA.
Pese a las grandes ventajas aportadas por las CD como excipientes, y a diferencia de lo que acontece en la industria farmacéutica, la necesidad de mayores controles de calidad en cada fórmula magistral elaborada, de estudiar las constantes de estabilidad de los complejos de inclusión para garantizar una adecuada biodisponibilidad, junto con su alto coste, el mayor uso de recursos que implica su utilización y su dificultad de adquisición a través de los proveedores habituales pueden explicar por qué la utilización de CD en formulación magistral no se considera una alternativa viable en la actualidad.














