Introducción
La leucemia linfocítica crónica (LLC) es el tipo de leucemia más común en adultos, representando el 30% de los casos de leucemia en adultos en los países occidentales1, con una edad media al diagnóstico de 71,7 años2.
En España, la tasa de incidencia en el año 2010 se estimó en 13,6/100.0003. Según el Institut National de la Santé et de la Recherche Médicale (INSERM), en el año 2016 la prevalencia de la LLC en Europa se estimó en 27/100.0001.
La LLC tiene un impacto considerable en la supervivencia y calidad de vida relacionada con la salud de los pacientes que padecen esta enfermedad. Además del impacto en la salud de los pacientes, la LLC supone una carga económica considerable en el Sistema Nacional de Salud (SNS) español1.
En los últimos años se han logrado grandes avances en la comprensión de la biología de la LLC, lo que ha dado lugar a avances significativos en el tratamiento de esta enfermedad. En particular, los agentes orales dirigidos han demostrado resultados notables en pacientes con LLC, consiguiendo mejorar tanto la supervivencia libre de progresión (SLP) tras el tratamiento, como la supervivencia global (SG) de los pacientes. En ese sentido, y tal y como recoge la última guía de práctica clínica de la European Society for Medical Oncology (ESMO), recientemente la United States Food and Drug Administration (FDA) y la European Medicines Agency (EMA) han aprobado diversas combinaciones de fármacos orales para el tratamiento de la LLC, tanto en primera línea como en las recaídas4. Además, se espera que otras terapias estén disponibles en un futuro próximo1,5,6.
Los nuevos tratamientos constituyen un importante desafío debido principalmente a la carga económica que suponen1, siendo una preocupación específica su extensa duración, aspecto que se espera mejore con el desarrollo de terapias para la LLC con duración definida y fija del tratamiento. En este sentido, el objetivo de este estudio es realizar un análisis de minimización de costes de la LLC para el SNS español en dos escenarios, el primero sin las terapias orales dirigidas y el segundo con la introducción de las terapias orales de duración fija (FTD, por sus siglas en inglés). En concreto, las FTD consideradas en el modelo son las combinaciones: venetoclax con obinutuzumab y venetoclax con rituximab.
Métodos
Para la realización del análisis de minimización de costes de la LLC desde la perspectiva del SNS español se adaptó un modelo previamente utilizado en Estados Unidos5 y Canadá7,8. Dicho modelo fue desarrollado con la finalidad de analizar la carga económica de la LLC antes y después de la introducción de las FTD y posteriormente se adaptó al ámbito sanitario español. Para ello, el 19 de noviembre de 2019 se realizó una búsqueda bibliográfica en la plataforma OVID, combinando términos relativos a la patología de interés, con términos relativos a los inputs necesarios para la adaptación del modelo y términos para identificar referencias en población española, limitando la búsqueda a referencias publicadas en los últimos 5 años en inglés o español. Esta búsqueda se completó con una revisión de la literatura gris. Posteriormente, un grupo de expertos (autores de la publicación) validaron mediante consenso los escenarios, asunciones, inputs y completaron la información necesaria para realizar el análisis.
Diseño y población del estudio
La población incluida en el análisis fueron los pacientes adultos (≥ 18 años) diagnosticados con LLC desde 2011 a 2025 en España. Estos pacientes fueron divididos en función de la presencia de deleción en el brazo corto del cromosoma 17 (del17p), estado fit o unfit, edad < 65 o ≥ 65 años y estado de mutación en la cadena pesada de inmunoglobulinas (IGHV), como criterios fundamentales considerados para guiar el tratamiento. La población inicial para el año 2011 se calculó agregando en el modelo nuevos casos incidentes desde el año 2000 al 2010 en España1,3, estratificados utilizando la práctica clínica de este periodo de tiempo. Tras este periodo inicial, el modelo generó una población que reflejaba los datos epidemiológicos de 2011 (prevalencia). Los datos de SLP y la SG se obtuvieron de los ensayos clínicos de los tratamientos considerados en el modelo. Finalmente, se utilizó también la mortalidad general de la población española9.
El curso clínico de los pacientes con LLC se refleja mediante un modelo Markov, incluyendo cuatro estados de salud: vigilancia activa, tratamiento de primera línea, recaída y muerte5. Se asumió que la mayoría de los pacientes con un nuevo diagnóstico de LLC no eran tratados con terapias activas y, por ello, se incluían en el modelo en el estado de vigilancia activa10,11. Una vez el paciente precisaba de tratamiento, pasaba al estado de tratamiento de primera línea. Tras el fracaso del tratamiento de primera línea, los pacientes pasaban al estado de recaída, en el que recibían una segunda línea de tratamiento. Si la duración de los tratamientos utilizados por los pacientes era fija, los pacientes continuaban en el estado de primera línea o recaída sin tratamiento activo. Los pacientes en los que fracasaba el tratamiento de segunda línea abandonaban el tratamiento activo que estuvieran recibiendo. Desde cualquiera de los otros estados descritos los pacientes podían pasar al estado de muerte. Las probabilidades de transición entre los distintos estados de salud se estimaron en función del tiempo de tratamiento, la SLP y los datos de SG de los ensayos clínicos.
Estrategias de tratamiento
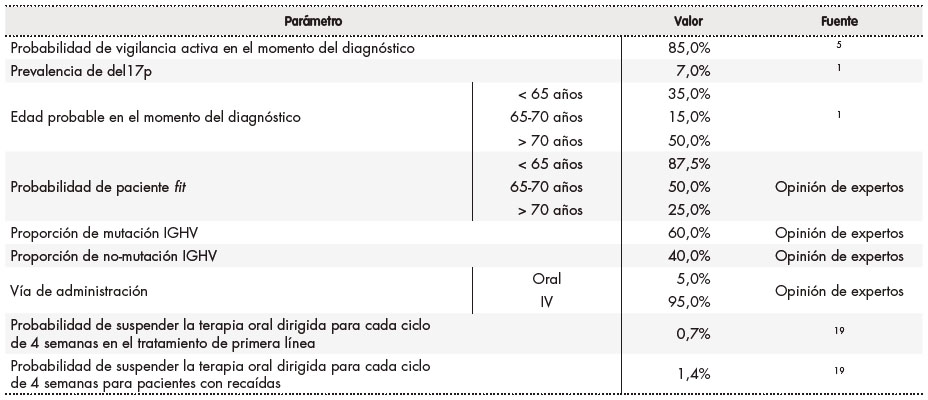
Se definió el patrón de tratamiento para la LLC en función del tipo de paciente por: estado o situación de la enfermedad, edad, presencia o no de del17p por hibridación fluorescente in situ (FISH, por sus siglas en inglés), estado mutacional de IGHV y año de tratamiento. En la tabla 1 se recogen los distintos parámetros incluidos en el modelo, así como los valores para cada uno de ellos.
Tabla 1. Parámetros incluidos en el modelo
del17p: deleción en el brazo corto del cromosoma 17; IGHV: immunoglobulin heavy-chain; IV: intravenosa.
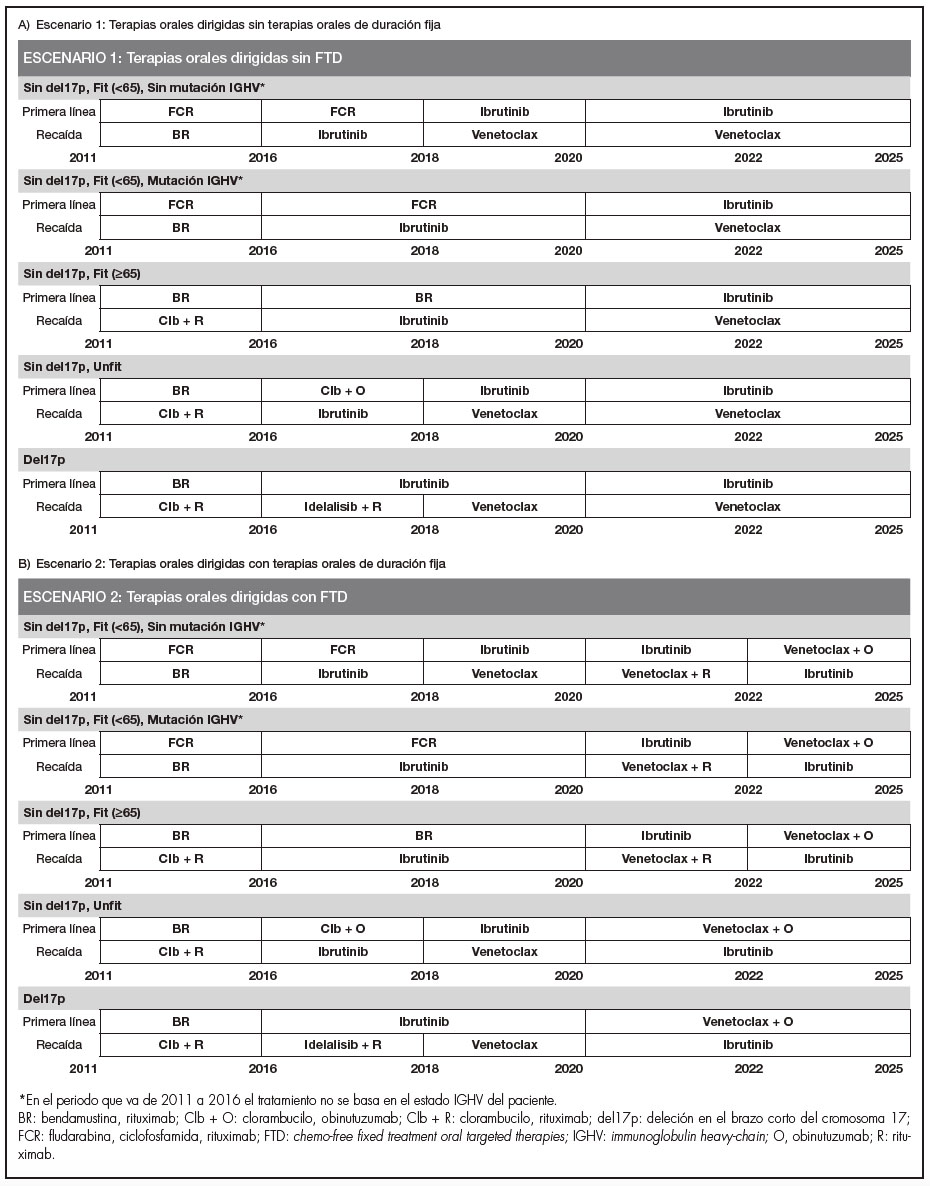
El algoritmo de tratamiento se simuló de 2011 a 2025, dividiendo este intervalo de tiempo en cinco periodos (2011-2015, 2016-2017, 2018‑2019, 2020-2021 y 2022-2025), reflejando la evolución de la atención estándar, así como los cambios en práctica clínica real con la entrada de las terapias orales dirigidas, todo ello validado por expertos clínicos de referencia. A su vez, el modelo consideró un escenario clínico paralelo en el que se considera la introducción del régimen FTD.
Los escenarios propuestos se definieron teniendo en cuenta las terapias disponibles en España y que estaban financiadas por el SNS español en cada periodo de tiempo. Para simplificar el modelo, se asumió una sola opción de tratamiento para cada tipo de paciente y periodo de tiempo, de modo que el 100% de los pacientes estaban en tratamiento con la opción más ampliamente utilizada en cada momento. En este aspecto, ambos escenarios eran idénticos en cuanto a tratamientos y manejo de la LLC en el periodo que va desde 2011 hasta 2019, inclusive, ya que en España los tratamientos FTD se empezaron a comercializar a finales de 2019 y para el análisis se asumió 2020 (Figura 1).
Costes directos
El análisis de minimización de costes se llevó a cabo desde la perspectiva del SNS, por lo que solo se consideraron los costes directos sanitarios: farmacológicos, de administración, pruebas realizadas, visitas rutinarias, hospitalizaciones y manejo de los acontecimientos adversos, todos ellos actualizados a euros de 2019 teniendo en cuenta el índice de precios al consumo medio anual publicado para el año del coste utilizado y su corrección a 201912, sin incluir ninguna tasa de descuento.
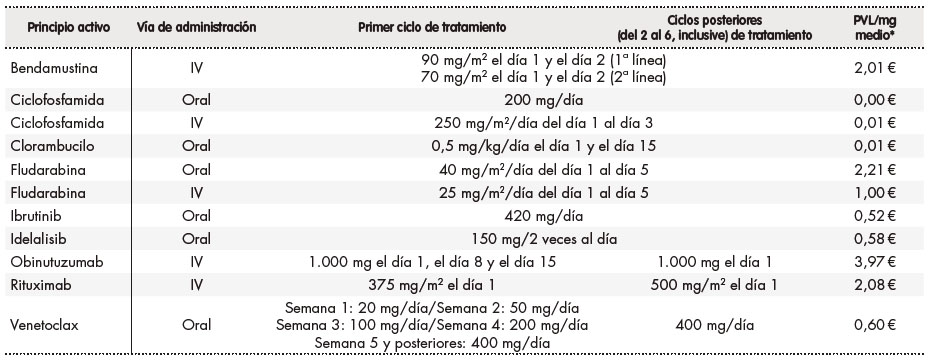
Para estimar el coste farmacológico se recogió la dosis, frecuencia en cada uno de los ciclos y vía de administración de los regímenes de tratamiento considerados en el modelo de la ficha técnica de cada fármaco13, todo ello validado por expertos de referencia en caso de duda o posología poco específica. Para los fármacos con dosis variable según el peso o área de superficie corporal del paciente, se asumió un peso de 79,0 kg y un área de superficie corporal de 1,92 m., medias para la población de pacientes con LLC14. Para cada fármaco se consideró el precio de venta del laboratorio (PVL) sin IVA publicado en la base de datos del Colegio Oficial de Farmacéuticos15 y las deducciones establecidas por el Real Decreto Ley 8/2010, modificado por el Real Decreto Ley 9/201116. En caso de diversas presentaciones para un mismo fármaco, se utilizó el precio medio del coste por mg de todas las presentaciones (Tabla 2).
Tabla 2. Dosis vía de administración y coste de los tratamientos para la leucemia linfocítica crónica considerados en el modelo13
*Coste PVL mediomg de todas las presentaciones
IV: intravenosa; PVL: precio de venta de laboratorio.
El coste de administración se tuvo en cuenta únicamente para administraciones intravenosas (IV), estimándose un coste de 312,19 € por sesión17. En el caso de fludarabina y ciclofosfamida, que se comercializan para su administración tanto por vía oral como por vía IV, se asumió, en base al criterio de los expertos en su práctica clínica, que el 95% de ellos se administraban por vía IV. El modelo asume como número de administraciones IV para cada régimen de tratamiento el número máximo de veces por ciclo que el paciente acudía a que se le administrara algún tratamiento de dicho régimen por vía IV, según lo indicado en la ficha técnica de cada fármaco13, y que, durante el periodo de mantenimiento, no se administraba ningún tratamiento.
El coste de monitorización incluyó pruebas y visitas rutinarias realizadas a los pacientes, y hospitalizaciones. La cantidad de cada uno de estos recursos se cuantificó mediante el juicio de expertos de referencia, mientras que los costes unitarios se obtuvieron de la base de datos de costes sanitarios17. El modelo contempló distintos costes de monitorización en función del tratamiento y del ciclo y/o periodo de tratamiento. De acuerdo con la monitorización validada con los expertos, para el periodo de vigilancia activa se estimó un coste de 184,94 €, independientemente del tratamiento. Además, el modelo estimó un coste de 5.928,19 € para aquellos pacientes con diagnóstico de LLC que progresaron a segunda línea de tratamiento, independientemente de cuál fuera la primera línea.
La estimación del coste de los acontecimientos adversos asociados a cada régimen de tratamiento se limitó a los acontecimientos adversos de grado ≥ 35: neutropenia, trombocitopenia, anemia, infecciones (virales/ bacterianas inespecíficas), fibrilación auricular, hipertensión y sangrado. El porcentaje de pacientes con cada acontecimiento adverso se recogió de la revisión de literatura. El coste de cada acontecimiento adverso, independientemente del tratamiento, se estimó a través del de los grupos relacionados por el diagnóstico (GRD) correspondientes ponderado por el número de casos producidos de cada uno de ellos en ese mismo año18. En el caso de las infecciones, el coste se estimó como la media de los GRD relativos a infecciones bacterianas y virales de localización no especificada18.
Resultados
Se estima que el número total de personas con diagnóstico de LLC aumentaría de 13.726 en 2011 a 19.357 (aumento del 41,0%) en 2025 en el escenario sin FTD. Por el contrario, con la introducción de las FTD, el número de personas con LLC en 2025 sería de 19.196 (aumento del 39,9%) para 2025. Se estima una prevalencia media anual de la LLC desde 2011 a 2025 de 16.436 pacientes en el escenario sin FTD y de 16.413 pacientes en el escenario con FTD.
En la tabla 3 se recogen los distintos costes para cada uno de los tratamientos incluidos en el modelo. Desde la perspectiva del SNS, desde 2011 a 2025 la introducción de las FTD supondría un ahorro de 564,9 millones de €, ascendiendo el coste total en el escenario sin FTD a 4.676,7 millones de € y a 4.111,8 millones de € en el escenario con FTD (Figura 2). Esto implicaría una reducción del 12,1% en el coste de atención de los pacientes LLC durante el periodo evaluado. Como se muestra en la figura 2, las diferencias entre las alternativas evaluadas comienzan a observarse a partir del año 2020, año en el que las FTD empiezan a estar disponibles para su utilización en práctica clínica en España. Tras un ligero incremento de los costes totales durante el año 2020, se observa, a partir del año 2022 y hasta el final del periodo del estudio, una disminución de costes totales de atención a los pacientes LLC relacionada con la duración fija de algunos de los tratamientos utilizados.
Tabla 3. Costes asociados a cada uno de los tratamientos para la leucemia linfocítica crónica considerados en el modelo

*Datos ponderados por paciente teniendo en cuenta la probabilidad de progresión de muerte y de discontinuación de las terapias orales por ciclo y línea de tratamiento BR bendamustina rituximab Clb O clorambucilo obinutuzumab Clb R clorambucilo rituximab FCR fludarabina ciclofosfamida rituximab IV intravenoso O obinutuzumab R rituximab
Del total de ahorro generado, 475,1 millones de € (84,1%) se logran en tratamientos de primera línea tras vigilancia activa y 90,8 millones de € (15,9%) en tratamientos tras recaída o abandono de la primera línea de tratamiento (Figura 2).
El coste total por paciente desde 2011 a 2025 pasaba de 266.019 € en el escenario sin FTD a 236.852 € en el escenario con FTD, suponiendo un ahorro para el SNS de 29.167 € por paciente.
Discusión
La introducción de las terapias orales dirigidas para el tratamiento de la LLC supuso una mejora en la SG en comparación con las terapias convencionales, representando un avance importante para los pacientes con LLC19, al tiempo que implicaba un aumento en el coste de tratamiento de estos pacientes. La aparición de las FTD puede suponer un avance notable en el tratamiento de la LLC, ya que permite a los sistemas de salud ganar predictibilidad en cuanto a la duración de los tratamientos y el coste de atención de los pacientes con LLC. Nuestro estudio proyecta un aumento anual del número de pacientes con LLC, así como del coste directo total de manejo de estos pacientes. En concreto, el coste total de 2011 a 2025 en el escenario sin FTD ascendía a 4.676,7 millones de €, con un aumento en 2025 respecto al 2011 del 1.222,35%, mientras que en el escenario con FTD el coste total ascendía a 4.111,8 millones de €, con un aumento en 2025 respecto al 2011 del 808,64%. Así, la introducción de las FTD permitiría generar un ahorro de recursos considerable de 564,9 millones de € (12,1% del total del coste de atención de los pacientes con LLC) al SNS español durante todo el periodo evaluado. Por lo tanto, de confirmarse en estudios adicionales los resultados presentados en nuestro estudio, las FTD se presentan como una alternativa de tratamiento que ofrece buenos resultados de eficacia a los pacientes, al tiempo que permiten optimizar la utilización de recursos sanitarios a los sistemas de salud.
Si analizamos los costes directos totales se observa que, para todos los tratamientos, el mayor coste es el farmacológico. En el caso de los fármacos en monoterapia, el mayor coste farmacológico es el de ibrutinib (41.289,36 €), uno de los tratamientos más recomendados tanto en primera línea como en recaídas6.
En el caso de los costes de administración, el mayor coste se asocia a la combinación IV de fludarabina, ciclofosfamida y rituximab (5.619,42 €), debido a que es el tratamiento incluido en el modelo con mayor número de administraciones IV13.
Los costes de monitorización oscilaron entre 2.730,64 € para las combinaciones de clorambucilo y 5.587,33 € para la combinación de venetoclax y rituximab, debido al mayor número de recursos utilizados en este último caso, principalmente visitas rutinarias.
No se han identificado muchos estudios disponibles sobre la carga de la enfermedad o de minimización de costes de la LLC, y ninguno de ellos en España. En este sentido, un estudio llevado a cabo en Alemania en 2008 estimó una prevalencia de la LLC de 4,9/10.000 personas, con una carga estimada de la LLC de 4.946 € por paciente y una media de coste total anual de 201 millones de € según la perspectiva del SNS alemán20. La media por paciente de nuestro estudio es muy superior tanto en el escenario sin FTD como con FTD (266.019 € y 236.852 € por paciente y 311,8 y 274,1 millones de € de coste total, respectivamente). Los estudios no son comparables, dado que el estudio alemán está realizado antes de la aparición de las terapias orales dirigidas que, como hemos destacado, supusieron un cambio radical en el manejo de la patología, y por tanto el coste farmacológico es muy inferior al de nuestro estudio.
Este estudio contiene algunas limitaciones, la primera de ellas derivada del hecho de que el modelo representa una simplificación de la realidad que, aunque esté basado en la mejor evidencia posible, nunca será una representación exacta de la práctica clínica real. En este sentido, una de las limitaciones es la asunción de una única opción de tratamiento para cada tipo de paciente y periodo de tiempo, hecho que supone no contemplar los costes asociados a otros tratamientos. Esta simplificación de la realidad implica que los ahorros estimados en nuestro análisis serían los máximos alcanzables, ya que en todos los pacientes se seguirían las estrategias terapéuticas presentadas en el análisis. Aunque la elección del tratamiento se realiza de forma individualizada en cada caso, los expertos clínicos estuvieron de acuerdo en que el paciente tipo en cada una de las categorías descritas en el modelo utilizaba las alternativas de tratamiento reflejadas en cada uno de los periodos de tiempo considerados. Por otro lado, este panel de expertos ha permitido completar y validar la falta de datos de la revisión de literatura realizada, disminuyendo la incertidumbre del modelo. Otra limitación del análisis es que ha sido realizado con los precios notificados de los medicamentos, por lo que, en la medida que existan diferencias entre los precios notificados y los financiados, los resultados podrían variar. El impacto de esta diferencia podría afectar a la magnitud de la diferencia entre las estrategias evaluadas. Sin embargo, es menos probable que afecte en la dirección de los resultados obtenidos favorables a las estrategias que incluyen FTD y, por tanto, a la conclusión del estudio. Otra posible limitación es el hecho de que, en algunos de los subtipos de pacientes incluidos en el modelo no se diferencie entre pacientes con o sin mutación en IGHV o no se incluya el estado mutacional TP53. Tras valorar este hecho se asumió que las diferencias de tratamiento y manejo en estos subtipos de pacientes entre los dos escenarios serían mínimas y se optó por simplificar el modelo. Aunque estas limitaciones podrían suponer una subestimación o sobreestimación de los costes incluidos en el modelo, se estima que el análisis realizado está en línea con la práctica clínica real. En cuanto a la población incluida en el modelo, el hecho de que esté compuesto por numerosos estados de salud, tratamientos y estratificaciones para los que no disponemos de prevalencia específica, supone que ésta se debe estimar a partir de la incidencia de años previos, por lo que los resultados obtenidos en el estudio deben ser interpretados teniendo en cuenta este matiz. Por otro lado, dado que la SLP y la SG incluidas en el modelo se extraen de los ensayos clínicos, es posible que ello suponga una sobreestimación en comparación con la práctica clínica (exclusión de comorbilidades, mejor estratificación, edad de los pacientes, etc.). Por último, no se ha podido evaluar la incertidumbre de la variación de los parámetros incluidos en el modelo sobre los resultados al no haberse realizado un análisis de sensibilidad. Este hecho, aunque no puede obviarse, se ha intentado minimizar con la ayuda del panel de expertos, que ha aportado una visión práctica de la patología, intentando que el modelo se acercara al máximo a la práctica clínica real.
Este análisis económico muestra cómo varía el coste directo de la LLC en la era de las terapias orales dirigidas con la introducción de las FTD. Desde la perspectiva del SNS español, esta introducción supondría un ahorro de 564,9 millones de € (12,1% del total del coste de atención de los pacientes con LLC durante el periodo evaluado). Aunque se requieren más estudios que evalúen todos los efectos y costes asociados al tratamiento de la LLC, el presente estudio puede ayudar a definir futuras estrategias terapéuticas encaminadas al ahorro de costes.