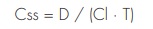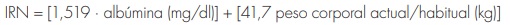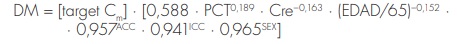Introducción
La digoxina es un glucósido cardíaco indicado para el tratamiento de la insuficiencia cardíaca congestiva (ICC) y la fibrilación auricular (FA), patologías que se dan con mayor frecuencia en personas de edad avanzada1. La digoxina se caracteriza por tener un mecanismo de acción tanto directo como indirecto. Según su efecto directo, la digoxina inhibe la Na/K-ATPasa cardíaca, reduciendo la salida de sodio de la célula e incrementando los niveles de calcio en el ámbito intracelular, lo que potencia el efecto inotrópico positivo y la fuerza de contracción del músculo cardíaco. El efecto indirecto de la digoxina consiste en la inhibición de la bomba Na/K-ATPasa, que interfiere con el transporte activo de sodio y potasio a través de la membrana celular, reduciendo la actividad simpática y la frecuencia cardíaca. Incluso a dosis terapéuticas, la digoxina prolonga el intervalo PR y reduce el segmento ST debido a su efecto sobre las células miocárdicas y el sistema de conducción cardíaco2.
En términos de farmacocinética, la digoxina se caracteriza por una biodisponibilidad oral del 50-90%, unión reducida a proteínas plasmáticas (20%) y un volumen de distribución de 5-10 l/kg, que depende principalmente de la masa magra, y que es alrededor de un 20% inferior en pacientes de entre 20 y 70 años3,4. La digoxina se excreta casi sin sufrir cambios por filtrado glomerular pasivo y secreción tubular activa (30-50%). Un pequeño porcentaje (10-20%) sufre metabolismo hepático o secreción intestinal a través de la glucoproteína P. El nivel de circulación enterohepática es insignificante5,6. La semivida plasmática de eliminación de la digoxina oscila entre las 26 y 48 horas en pacientes con función renal normal, pero puede duplicarse en personas añosas con deterioro renal7,8.
El término “personas de edad avanzada” a menudo se asocia a personas con una edad cronológica de 65 años o más. Se trata de un segmento de la población en continuo aumento. Según el Informe de Perspectivas de la Población Mundial de la Organización de Naciones Unidas de 2019, una de cada seis personas a nivel mundial superará los 65 años en 20509. Existen múltiples cambios fisiológicos relacionados con la edad que pueden modificar los parámetros farmacocinéticos y farmacodinámicos de muchos fármacos en pacientes añosos10 debido al deterioro de ciertos procesos farmacocinéticos como la absorción, la distribución, el metabolismo y la excreción. En lo que concierne a la fisiología del aparato digestivo, cambios relacionados con la edad tales como la elevación del pH gástrico, los retrasos en el vaciamiento gástrico, un flujo esplácnico reducido y una menor superficie de absorción gastrointestinal podrían reducir la capacidad de absorción de los medicamentos. No obstante, puesto que el grado de absorción de la mayoría de los fármacos no se ve generalmente afectado en sujetos añosos, estos cambios fisiológicos no suelen tener repercusión clínica en ellos10,11.
Con el envejecimiento, el peso corporal total (PCT), la masa magra y el porcentaje de agua corporal suelen disminuir, mientras que la masa grasa tiende a aumentar. En personas de edad avanzada, el nivel de líquido corporal suele verse reducido en un 10-15%12-14, lo que modifica la farmacocinética de los medicamentos hidrosolubles como la digoxina. A menudo es necesario reducir la dosis administrada debido al menor volumen de distribución y a la elevación de las concentraciones del fármaco en plasma15. Aunque la concentración de proteínas plasmáticas se reduce y el metabolismo hepático disminuye, estos cambios parecen tener escasa relevancia en lo que se refiere a la digoxina16,17.
En cuanto al riñón, la mayoría de las funciones renales se encuentran disminuidas18-20, lo que podría alterar la eliminación de digoxina, ya que este fármaco se excreta en la orina sin sufrir casi cambios. Además, el declive funcional que sufren las personas de edad avanzada puede verse significativamente influido por una patología renal concomitante11, por lo que es preciso tratarles como si sufriesen de insuficiencia renal21.
Todos estos factores deben tomarse en consideración a la hora de prescribir fármacos a pacientes añosos debido a las implicaciones clínicas de los cambios fisiopatológicos que se producen a resultas del envejecimiento: disminución de la absorción, del metabolismo y de la eliminación, comorbilidades, sensibilidad farmacológica, polimedicación y menor esperanza de vida3,22,23.
La digoxina se caracteriza por tener un rango terapéutico estrecho y se asocia a graves efectos secundarios y altos niveles de toxicidad. Aunque el rango terapéutico de la digoxina ha estado tradicionalmente situado entre los 0,8 y los 2,0 ng/ml, estos valores están siendo cuestionados en la actualidad. Un análisis post hoc de Rathore et al. demostró que concentraciones séricas de digoxina de entre 0,5 y 0,8 ng/ml permitían optimizar el efecto terapéutico, reduciendo la tasa de mortalidad y la duración de las hospitalizaciones24.
Las manifestaciones clínicas de la toxicidad comprenden síntomas gastrointestinales y neurológicos, así como disritmias cardíacas25. La digoxina también participa en múltiples interacciones medicamentosas farmacodinámicas-farmacocinéticas, que podrían provocar toxicidad, especialmente en pacientes añosos26. Por ejemplo, las interacciones farmacodinámicas en pacientes ancianos podrían estar relacionadas con un mayor tono simpático, con la participación de reserpina, β-agonistas, teofilina y ciclopropano, con un desequilibrio electrolítico como la hipocalemia o con la administración de diuréticos y corticosteroides.
En cuanto a las interacciones farmacocinéticas que predisponen a la toxicidad por digoxina, algunas potencian la absorción, como las mediadas por propantelina, atropina, eritromicina o tetraciclina. Otros fármacos, como la quinidina, podrían reducir el volumen de distribución; otros, como la quinina y la amiodarona, disminuir el aclaramiento renal; y otros, como los diuréticos tiazídicos, la hidralazina, la furosemida o la espironolactona, aumentar la eliminación renal.
Todas estas circunstancias hacen necesario monitorizar los tratamientos con digoxina por la posible aparición de deterioro renal, tanto en adultos como en pacientes añosos1,3,8,27. Varios estudios han analizado la farmacocinética poblacional de la digoxina en niños y adultos28-54. El objetivo de este estudio fue llevar a cabo una revisión sistemática para compendiar el conocimiento disponible acerca de la farmacocinética poblacional de la digoxina en pacientes de 65 años o más e identificar las razones que explican la variabilidad en su disposición.
Métodos
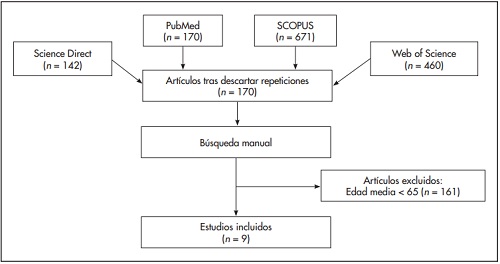
Se llevó a cabo una revisión sistemática en las bases de datos PubMed, ISI Web of Science, SCOPUS y Science Direct, utilizándose los siguientes términos de búsqueda: (“Digoxin”[Mesh]) AND (“Pharmacokinetics”[Mesh]) AND (“Aged”[Mesh]) OR (“Elderly”[Mesh]). Estos descriptores permitieron identificar 170 artículos no repetidos. Puesto que, en algunos casos, los autores no especifican la edad media de los pacientes en el título ni en el resumen de sus artículos, se realizó una búsqueda manual para localizar artículos en los que los pacientes tuviesen de media 65 años o más. La figura 1 ilustra el proceso seguido para seleccionar los artículos incluidos en esta revisión sistemática.
Se incluyeron estudios en humanos, donde los sujetos analizados tuvieran una edad media de 65 años o más y recibieran tratamiento con digoxina. El análisis se llevó a cabo con modelos de efectos mixtos no lineales (programa NONMEM). Se excluyeron estudios en animales, estudios en humanos con pacientes menores de 65 años y estudios escritos en idiomas diferentes al inglés. Para garantizar la calidad del análisis, se incluyeron únicamente estudios publicados en revistas indexadas y aquellos que dieran cuenta de los datos esenciales establecidos por Dartois et al.55, es decir, las características esenciales de los pacientes, dosis y vía de administración, número de observaciones, selección del modelo, modelo estructural, variabilidad interindividual, modelos de error, método de estimación y software utilizado. Esta revisión sistemática fue desarrollada según los criterios PRISMA encaminados a optimizar la calidad de las revisiones sistemáticas56.
Resultados
La aplicación de los criterios de inclusión, exclusión y calidad dio lugar a la selección y revisión de nueve artículos: Konishi et al.41, Hornestam et al.42, Williams et al.43, Choi et al.44, Chen et al.45, Komatsu et al.46, Bauer et al.47, Yukawa et al.48 y Zhou et al.49. El número de pacientes analizados en los estudios revisados oscilaba entre 94 y 294, siendo originarios primordialmente de Asia oriental, concretamente de China, Japón y Corea (66,7%). Todos los artículos usaban el programa NONMEM para desarrollar el análisis de farmacocinética poblacional. No obstante, los modelos finales variaban según el estudio: Williams43, Choi44, Chen45, Yukawa48 y Zhou49 utilizan un modelo unicompartimental para describir la farmacocinética de la digoxina. Hornestam42 aplica un modelo bicompartimental, mientras que Konishi41 se vale del modelo hiperbólico para desarrollar un modelo de farmacocinética poblacional para la digoxina. Esta aproximación, diferente de la de los demás autores, exigía estimar dos constantes de velocidad de absorción (b y g) para calcular el aclaramiento de la digoxina. Komatsu46 y Bauer47 utilizan un modelo de estado estable basado en concentraciones séricas mínimas de digoxina. El modelo farmacocinético utilizado fue el siguiente:
donde Css es la concentración sérica de digoxina en estado estable (ng/ml), D es la dosis de digoxina (µg), Cl es el aclaramiento corporal total de digoxina (l/h) y T es el intervalo de dosificación (h).
En estos estudios se evalúa, entre otros criterios: la edad, el sexo, el peso corporal, la dosis, los niveles y el tiempo de muestreo de la digoxina, la función renal (medida en términos de creatinina sérica o de aclaramiento de creatina [CrCl]), y los tratamientos concomitantes. Las características de los pacientes incluidos en los artículos revisados se resumen en la tabla 1. Sólo uno de los estudios investiga el papel del potasio sérico, que demostró incrementar el aclaramiento de digoxina44. En ese estudio también se estima el estado nutricional de los pacientes mediante el índice de riesgo nutricional (IRN), recogiéndose los siguientes datos: albúmina sérica, colesterol, porcentaje del peso corporal ideal y recuento linfocitario total. El IRN se calcula de la siguiente manera:
Tabla 1. Datos de pacientes incluidos en los estudios.
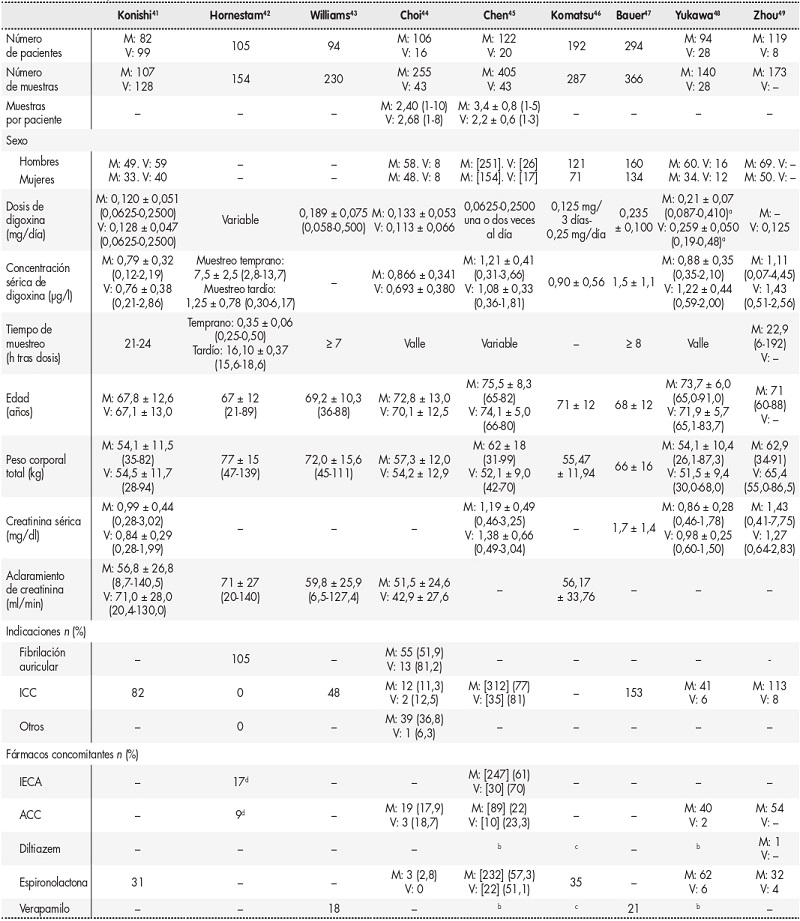
Los valores se presentan en términos de media ± desviación típica (rango); [n]: los resultados se presentan en términos del número de muestras; (–): no se informan datos.
ACC: agonistas de los canales de calcio; FA: fibrilación auricular; ICC: insuficiencia cardíaca congestiva; IECA: inhibidores de la enzima convertidora de la angiotensina; M: grupo de modelado; V: grupo de validación.
aResultado de multiplicar la dosis (mg/día) por el peso medio de la población (kg).
bEvaluado dentro de los ACC.
cEvaluado dentro de los antiarrítmicos de clase IV.
dDatos no reportados si los números no se referían al número de muestras o pacientes.
Un IRN de 100 indica ausencia de riesgo; un índice de 97,5 a 100, riesgo leve; 83,5 a 97,5, riesgo moderado, y un valor < 83,5, riesgo severo. No obstante, este parámetro no mostró tener ninguna influencia sobre el modelo farmacocinético44. Dos autores analizaron la farmacocinética de la digoxina en función de dos interacciones medicamentosas: digoxina-quinidina43,47 y digoxina-verapamilo47. Ambas indicaciones demostraron reducir el aclaramiento de la digoxina. Al analizar las medicaciones concomitantes, se observaron grandes discrepancias. La espironolactona fue el fármaco más estudiado (en cinco de los nueve artículos revisados). Sin embargo, sólo dos ecuaciones incluían este fármaco en el modelo final de farmacocinética poblacional. En ambos estudios, la espironolactona reducía el aclaramiento de la digoxina45,49. Tres autores, Williams43, Choi44 y Chen45, analizaron el efecto de distintas covariables sobre el volumen de distribución. En estos estudios, los pacientes con un PCT más alto demostraron un mayor volumen de distribución. La ecuación final desarrollada por Chen45 también incluía la ICC, que daba lugar a un menor volumen de distribución de digoxina.
Zhou49 realizó un estudio de la farmacocinética poblacional de la digoxina en pacientes añosos procedentes de China. A diferencia de los otros artículos revisados, ese artículo establece como criterio de inclusión el tratamiento con digoxina oral durante más de 7 días en pacientes sin disfunción hepática o renal grave. Puesto que la digoxina se administró por vía oral, los parámetros Cl y Vd se interpretaron como Cl/F y Vd/F, respectivamente.
En lo que respecta a los métodos de evaluación, Konishi41, Hornestam42, Williams43 y Bauer47 utilizaron exclusivamente una evaluación interna básica. Chen45 y Komatsu46 emplearon evaluaciones tanto básicas como avanzada. Yukawa48 evaluó el modelo mediante una evaluación básica tanto interna como externa. Sólo Choi44 y Zhou49 analizaron el modelo de farmacocinética poblacional de la digoxina utilizando una evaluación interna y externa, básica y avanzada, con las métricas apropiadas.
Discusión
El objetivo de esta revisión fue analizar los estudios de farmacocinética poblacional de la digoxina en sujetos de 65 años o más, un grupo de pacientes frágiles que, habitualmente, sufren de múltiples patologías y están polimedicados. Los cambios fisiopatológicos en sujetos añosos podrían tener un efecto importante en la farmacocinética de múltiples medicamentos. Es por ello que los estudios de farmacocinética poblacional revisten gran interés, especialmente si el medicamento analizado es la digoxina. Debido a su estrecho rango terapéutico, sus severos efectos secundarios y la gran variabilidad inter- e intraindividual observada en la respuesta al fármaco, debe considerarse la conveniencia de una dosificación individualizada. La información proporcionada por los estudios de farmacocinética poblacional podría ayudar a aumentar la seguridad de este fármaco, conseguir una óptima eficacia terapéutica y reducir sus efectos adversos.
Independientemente de la edad de los pacientes analizados, la mayoría de los estudios describen el modelo de farmacocinética poblacional de la digoxina como un modelo unicompartimental abierto. Sólo unos pocos autores utilizan un modelo bicompartimental42,57,58. Kramer et al.59 compararon el ajuste de un modelo farmacocinético bicompartimental con el de un modelo tricompartimental para determinar la razón concentración sérica de digoxina/tiempo tras una inyección intravenosa rápida de 1,0 mg del fármaco. El análisis demostró que el ajuste tricompartimental estaba asociado a un mejor desempeño. Yukawa et al.54 observaron que las concentraciones séricas de la digoxina por vía oral y por vía intravenosa experimentan evoluciones diferentes, sin que se observen diferencias significativas en la fase de absorción. Por lo tanto, para reducir la variabilidad en la disposición de la digoxina, los autores aplicaron un modelo bicompartimental abierto, que conseguía explicar mejor los perfiles farmacocinéticos.
El análisis demostró que el PCT, el CrCl y la coadministración de espironolactona y agonistas de los canales de calcio (ACC) fueron las variables que más influyeron en la farmacocinética de la digoxina. Por lo tanto, los autores señalan la conveniencia de considerar estas variables a la hora de establecer pautas de tratamiento con digoxina efectivas.
Según las guías de actuación clínica60, los fármacos que podrían interactuar con la digoxina son la amiodarona, los antiácidos, los ACC, la colestiramina, la tiazida y los diuréticos del asa, los macrólidos, los antiinflamatorios no esteroideos, los diuréticos ahorradores de potasio, los agentes procinéticos, la propafenona, los inhibidores de la bomba de protones, las sulfonilureas y la trazodona. Sin embargo, sólo Komatsu46 evaluó la acción de la amiodarona, uno de los fármacos que con mayor frecuencia se asocian con una interacción con la digoxina. Sus resultados demuestran que este fármaco incrementa los niveles valle de digoxina debido a la inhibición de glucoproteína P y la secreción tubular renal. Estos resultados confirman que la combinación de digoxina con amiodarona aumenta la mortalidad en pacientes con FA61. Además, los fármacos que inhiben la glucoproteína P (itraconazol, ciclosporina y eritromicina), así como el verapamilo y el bepridil, no se incluyeron como covariables, ya que fueron utilizados en un escaso número de pacientes46.
Son varios los fármacos capaces de ejercer una importante influencia sobre la farmacocinética de la digoxina. Entre ellos cabe destacar la espironolactona y los ACC, que inhiben el efecto de la glucoproteína P y reducen el aclaramiento de la digoxina en alrededor de un 23%47, en hasta un 20%45, un 21,6%54 o un 4,3%48, según diferentes autores.
Los pacientes con ICC estudiados en la literatura evidenciaron un aclaramiento de digoxina un 10%45 y un 5,9% inferior48. De hecho, los pacientes con diagnóstico de ICC tratados con espironolactona exhibieron un metabolismo de digoxina aumentado en un 30%45. Los betabloqueantes (bisoprolol y carvedilol), la atorvastatina y el tolvaptán podrían aumentar las concentraciones séricas de digoxina en 1,3 veces, 1,2 veces y 1,3 veces, respectivamente46. Estos datos demuestran la importancia de considerar estas covariables a la hora de establecer una pauta individualizada de digoxina en pacientes añosos. Los autores evaluaron la función renal con diferentes métodos: cinco estudios lo hicieron a través de la CrCl41-44,46, mientras que cuatro analizaron los niveles de creatinina sérica45,47,49. Las covariables evaluadas en los estudios objeto de esta revisión están resumidos en la tabla 2.
Tabla 2.Parámetros farmacocinéticos poblacionales, variabilidad interindividual, variabilidad residual y modelos estructurales.
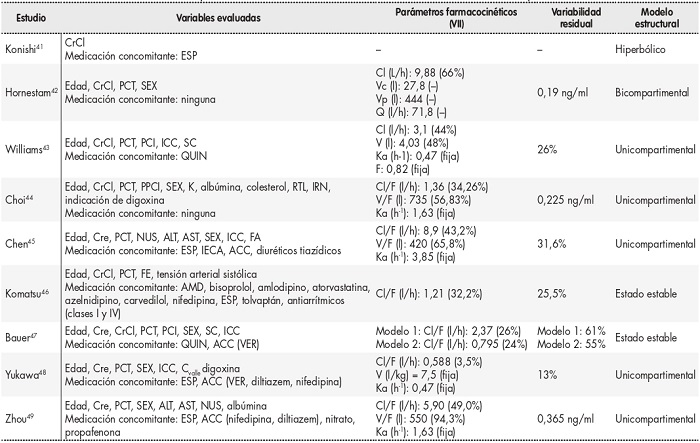
El signo (–) indica ausencia de información.
ACC: agonistas de los canales de calcio; ALT: alanina aminotransferasa; AMD: amiodarona; AST: aspartato aminotransferasa; Cl: aclaramiento; CrCl: aclaramiento de creatinina; Cre: creatinina sérica; Cvalle: concentración valle de digoxina; ESP: espironolactona (asignándose un valor de 1 en caso coadministración de espironolactona y de 0 en los demás casos); F: fracción biodisponible; FA: fibrilación auricular; FE: fracción de eyección; ICC: insuficiencia cardíaca congestiva; IECA: inhibidores de la enzima convertidora de la angiotensina; IMC: índice de masa corporal; IRN índice de riesgo nutricional; K: potasio sérico; Ka: constante de velocidad de absorción; NUS: nitrógeno ureico en sangre; PCI: peso corporal ideal; PCT: peso corporal total; PPCI: porcentaje del peso corporal ideal; Q: aclaramiento intercompartimental; QUIN: quinidina (asignándose un valor de 1 en casos de coadministración de quinidina y de 0 en los demás casos); RTL: recuento total de linfocitos; SC: superficie corporal; SEX: sexo (asignándose un valor de 1 a las mujeres y de 0 a los hombres); V: volumen de distribución; Vc: volumen central de distribución; VER: verapamilo; VII: variabilidad interindividual; Vp: volumen periférico de distribución.
Otra diferencia en los criterios es la relacionada con el tiempo de muestreo. Dos autores utilizaron los niveles valle de digoxina44,48. Los demás estudios no especifican el tiempo de muestreo o no proporcionan esta información. Esta diferencia de criterios al recoger y evaluar los datos de los pacientes podría explicar la discordancia en los resultados farmacocinéticos publicados.
Los autores comprobaron que la coadministración de ACC disminuía el aclaramiento de la digoxina en torno al 20%.
Por último, Yukawa48 desarrolló una ecuación para conseguir que la digoxina obtenga el efecto terapéutico deseado en pacientes añosos:
donde DM es la dosis de mantenimiento, y Cm es la concentración sérica promedio de digoxina. ACC tiene el valor de 1 cuando existe administración concomitante de ACC y 0 en los demás casos, ICC tiene el valor de 1 para pacientes con ICC y 0 en los demás casos, y SEX tiene el valor 0 para hombres y 1 para mujeres.
En relación con los métodos de análisis utilizados, los estudios objeto de revisión emplearon cuatro técnicas diferentes para analizar las concentraciones séricas de digoxina. Hornestam42, Williams43, Choi44, Chen45 y Zhou49 cuantificaron las concentraciones séricas de digoxina con un inmunoensayo de polarización fluorescente. Komatsu46 y Yukawa48 usaron un inmunoensayo de donante de enzima clonado y Bauer47 un radioinmunoensayo. Las técnicas presentaron un coeficiente de variación ≤ 12%.
Konishi41 empleó un ensayo inmunoenzimático de micropartículas. Sin embargo, Cobo et al.62 hallaron reacciones cruzadas entre las concentraciones séricas de digoxina estimadas con este método analítico y las dosis clínicas de espironolactona y canrenoato de potasio, dando lugar a concentraciones engañosamente altas o bajas. Según DeFrance et al.63, el uso de inmunoensayos de inhibición turbidimétrica potenciado por partículas y de inmunoensayos quimioluminiscentes de micropartículas permiten evitar esta interacción, siendo alternativas idóneas al ensayo inmunoenzimático de micropartículas. Además, según el análisis de Bland-Altman, la intercambiabilidad de inmunoensayos no es válida. Por lo tanto, es preciso monitorizar a los pacientes con la misma técnica analítica, aunque no existan interferencias63.
La digoxina se utiliza a menudo para tratar la ICC y la FA, que afectan principalmente a personas de edad avanzada. Varias covariables clínicas, demográficas y farmacológicas pueden afectar al aclaramiento de la digoxina y su volumen de distribución, siendo necesario ajustar la dosificación del fármaco. Según los nueve estudios analizados, las covariables con mayor influencia sobre la farmacocinética de la digoxina fueron la función renal (9/9), el peso corporal (6/9), la coadministración de ACC (3/9) y la presencia de ICC (3/9). Los autores encontraron otras covariables con efecto sobre la farmacocinética poblacional de la digoxina, tales como la edad (2/9); la administración concomitante de espironolactona (2/9), quinidina (2/9) o amiodarona (1/9); el sexo (1/9), y los niveles de potasio sérico (1/9). No obstante, existen tres factores que podrían explicar la diferencia en los resultados obtenidos: la disparidad entre los parámetros clínicos recogidos, el modelo estructural seleccionado y el método analítico aplicado. La tabla 3 muestra las ecuaciones finales de farmacocinética poblacional.
Tabla 3. Ecuaciones finales del modelo.
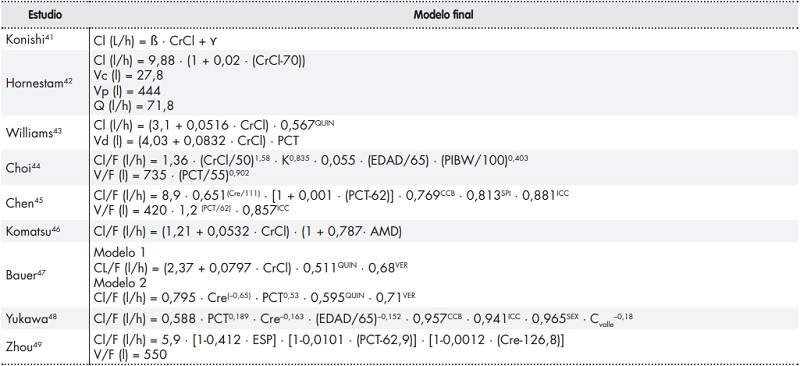
AMD: amiodarona; Cl: aclaramiento; CrCl: aclaramiento de creatina; Cre: creatinina sérica; Cvalle: concentración valle de digoxina; ESP: espironolactona (asignándose el valor 1 en casos de administración concomitante de espironolactona, y 0 en los demás casos); F: fracción biodisponible; ICC: insuficiencia cardíaca congestiva (asignándosele el valor 1 si el paciente tenía diagnóstico de ICC y 0 en los demás casos); K: potasio sérico; PCT: peso corporal total; Q: aclaramiento intercompartimental; QUIN: quinidina (asignándose el valor 1 en casos de administración concomitante de quinidina y 0 en los demás casos); SEX: sexo (asignándose el valor 1 a los hombres y el 0 a las mujeres); V: volumen de distribución; Vc: volumen de distribución central; VER: verapamilo (asignándose el valor 1 en casos de administración concomitante de verapamilo y 0 en los demás casos; Vp: volumen de distribución periférico; β: constante; ϒ: constante.
La revisión sistemática realizada por Abdel Jalil et al.51 analizó la farmacocinética poblacional de la digoxina en pacientes adultos. El análisis incluyó 16 artículos, de los que solamente dos estudiaban a los pacientes añosos como una cohorte independiente. Los autores encontraron una gran dispersión en la edad de los participantes y no analizaron las características fisiopatológicas de los pacientes de edad avanzada ni su influencia en la farmacocinética de la digoxina. La mayoría de los estudios procedían de poblaciones de Asia oriental (66,8%) y en ellos, la farmacocinética de la digoxina se describía habitualmente mediante un modelo unicompartimental. Los predictores de aclaramiento de la digoxina más habitualmente señalados eran el peso, la edad, la función renal, la presencia de ICC y la administración concomitante de medicamentos (ACC). El presente artículo, que ha identificado y revisado nueve artículos de la literatura, se centra exclusivamente en pacientes añosos (≥ 65 años), que son la principal población a la que se dirigen los tratamientos con digoxina. Otro posible factor responsable de un cierto sesgo podría ser la diferencia en el tamaño de las muestras, que oscilaba entre 94 y 294 pacientes, y la ausencia de un grupo de validación en cuatro de los estudios revisados.
Una limitación de esta revisión, así como de la de Abdel Jalil51, tiene que ver con que la mayoría de los estudios (seis de los nueve analizados) se realizaron en pacientes de Asia oriental (China, Japón y Corea). Por lo tanto, las conclusiones obtenidas no pueden extrapolarse a pacientes de otras etnias debido a las naturales diferencias en características genéticas y de estilo de vida. No obstante, no se ha encontrado ningún estudio que relacione los resultados obtenidos con la etnia de los pacientes. Otra limitación de nuestro estudio es que las concentraciones séricas de digoxina se determinaron usando cuatro métodos analíticos, lo cual podría dar lugar a valores diferentes, con mayores variaciones en caso de interferencia de la espironolactona o del canrenoato de potasio con las técnicas de análisis empleadas. Por último, las covariables utilizadas constituyen otra limitación. Se encontró una amplia disparidad, relacionada principalmente con la medicación concomitante. Por ejemplo, la amiodarona, un fármaco que, según las guías de actuación clínica, tiene gran influencia sobre las concentraciones séricas de digoxina, fue evaluada sólo en un estudio46. Además, el potasio sérico, un parámetro habitualmente relacionado con la farmacodinámica de la digoxina, fue evaluado en un artículo, demostrando su capacidad de aumentar el aclaramiento de la digoxina44.
Considerando las características de la digoxina (estrecho rango terapéutico, efectos secundarios graves, alta toxicidad), creemos que deben realizarse estudios adicionales para desarrollar modelos de farmacocinética poblacional en pacientes añosos (≥ 65 años) y así facilitar la identificación de covariables e interpretar la probable importancia de individualizar las dosis en esta población de pacientes.