My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Sociedad Española del Dolor
Print version ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.15 n.6 Madrid Aug./Sep. 2008
Análisis de la densidad de receptores tipo NMDA R1 en el núcleo espinal de trigémino humano
Analysis of the density of NMDA R1 receptors in the spinal nucleus of human trigeminal nucleus
I. C. Suazo1, M. G. Cantín2, D. A. Zavando3
1Jefe Unidad de Anatomía Normal. Facultad de Ciencias de la Salud. Universidad de Talca, Chile
2Docente Anatomía Normal. Facultad de Ciencias de la Salud. Universidad de Talca, Chile
3Docente Cirugía. Facultad de Ciencias de la Salud. Universidad de Talca, Chile
Laboratorio de Morfología. Facultad de Ciencias de las Salud. Universidad de Talca, Chile
Dirección para correspondencia
RESUMEN
El sistema trigeminal es encargado de la sensibilidad dolorosa de la mayor parte de los territorios orales y maxilofaciales, en esta función participan los receptores glutamatérgicos tipo NMDA que se encuentran en el núcleo espinal de trigémino.
El núcleo espinal de trigémino se encuentra subdividido en tres subnúcleos en sentido rostrocaudal, denominados subnúcleo oral, interpolar y caudal. Clásicamente el subnúcleo caudal se ha considerado el sitio de relevo de la información dolorosa trigeminal.
Objetivos. El objetivo del presente estudio fue analizar la distribución del receptor glutamatérgico NMDA en el núcleo espinal de trigémino en humanos.
Material y Métodos. En este estudio se utilizaron 10 troncos encefálicos humanos obtenidos de cadáveres con una data postmortem de 8,7 horas en promedio (devesta 2,75), los cuales fueron sometidos a secciones transversales seriadas, obteniéndose 120 controles anatómicos teñidos con tinción de Mulligan y 120 placas sometidas a inmunohistoquímica con anticuerpos monoclonales anti-NMDA R1 (SigmaR) en dilución 1:500 en 0,3% de Triton X-100 a ph 7,3 0,1 M.
Resultados. Los resultados comprobaron la existencia de receptores glutamatérgicos tipo NMDA R1 en el núcleo espinal de trigémino humano, con un leve predominio en el subnúcleo caudal, sin encontrar una diferencia estadísticamente significativa. Debido a la importante presencia de estos receptores en los subnúcleos oral e interpolar.
Conclusiones. Los resultados sugieren que todos los niveles del núcleo espinal de trigémino participarían en la transmisión dolorosa originada en los territorios orales y maxilofaciales.
Palabras Clave: Núcleo espinal del trigémino, receptor NMDA.
ABSTRACT
The trigeminal system is in charge of the painful sensibility of most the oral and maxilofaciales territory, in this function take part the NMDA type receptors that are in the spinal nucleus of trigeminal nerve.
The spinal nucleus of trigéminal is subdivided in three subnucleuses in rostrocaudal orientation, named oral, to interpólate and caudal subnucleus. Classic the caudal subnucleus has considered trigeminal to be the place of relief of the painful information.
Objective. The objective of the present study was the distribution NMDA analyzed of the glutamatergic receptors in the spinal nucleus of trigéminal nerve.
Method. In this study were in use 10 human encefalic trunk obtained of corpses, which byline post mortem was of 8,7 horas (devesta 2,75), which were submitted to transverse sections, 120 anatomical controls being obtained dyeings by Mulligans tint and 120 plates submitted to inmunohistoquímica by antibodies monoclonales anti-NMDA R1 (SigmaR) in dilution 1:500 in 0,3 % of Tritón X-100 to ph 7,3 0,1 M.
Results. The result show te glutamatergic receptors NMDA R1 type existence in the spinal nucleus on human trigeminal system, with a slight predominance in the caudal subnucleus, without finding a statistically significant difference, its due to the important presence of these recipients in the oral and to interpólate subnuclei.
Conclusions. The results suggest that all the levéis of the spinal nucleus of trigémino would take part in the painful transmission originated in the oral and maxilofaciales territory.
Key Words: Trigeminal Nucleus Spinal, NR1 NMDA receptor.
Introducción
En el territorio oral y maxilofacial, la transmisión dolorosa se encuentra a cargo del sistema trigeminal, donde a partir de una primera neurona ganglionar, las aferencias nociceptivas se proyectan al núcleo espinal de trigémino.
Desde el punto de vista funcional y de acuerdo a las modalidades de sensibilidad somática general que integra, este núcleo espinal trigeminal permite reconocer; una unidad superior (correspondiente al subnúcleo oral), que al igual que el núcleo sensitivo principal está encargada de la sensibilidad táctil discriminativa; y otra unidad caudal o inferior (correspondiente a los subnúcleos interpolar y caudal) que resume tanto la sensibilidad táctil no discriminativa y de presión, como la sensibilidad térmica y dolorosa del territorio cefálico (1,2). La porción caudal del núcleo espinal, que recibe tanto fibras mielínicas como amielínicas delgadas, es el principal centro de relevo para la información termoalgésica en el territorio máxilofacial (3,4,5).
Se ha demostrado que además de los neurotransmisores clásicos (adrenalina, acetilcolina, etc.), existen aminoácidos excitatorios como el glutamato y aspartato, que juegan un importante rol en la transmisión del impulso doloroso en la médula y tronco encefálico (6,7). El glutamato se encuentra presente en las terminales de las fibras de pequeño diámetro (fibras C) (6-8,9,10,11); mientras que los receptores del glutamato se encuentran en las membranas de las neuronas postsinápticas de la vía nociceptiva, siendo de tipo NMDA y no NMDA. Los de tipo NMDA se encuentran bloqueados por un tampón de Mg2+ y, por lo tanto, no descargan en condiciones normales (6-8-11,12,13,14).
Su actividad receptora se relaciona a este nivel con la transmisión dolorosa a través de fibras aferentes nociceptivas, posiblemente A delta y C (15).
Los receptores NMDA están involucrados en el aumento progresivo de la respuesta de ciertas neuronas ante la estimulación nociceptiva sucesiva de su campo receptivo, a una intensidad suficiente para reclutar fibras de tipo C (mayor a 0,3 Hz), fenómeno de facilitación sináptica generada por estímulos aferentes de alta frecuencia o windup (1,2-6-8-11-14-16).
La estimulación de los receptores no NMDA, produce la vía típica del dolor, sin embargo, la reiterada estimulación de las fibras aferentes de primer orden, producen un aumento de la excitabilidad de las neuronas del cuerno posterior y del subnúcleo caudal trigeminal provocando descargas, las que generarán violentos cuadros de dolor (6-8-11-17), iniciando y mantienendo la sensibilización central asociada a daño o inflamación de tejidos periféricos (15).
Es así, como la sensibilización central inducida por la activación del receptor NMDA es la llave del mecanismo del dolor neurogénico, la hiperalgesia y la neuralgia (6-14, 14-18).
En el territorio máxilofacial, se ha detectado a nivel del ganglio trigeminal, RNA mensajero de receptores NMDA pero no su proteína (15), por otro lado, estudios realizados en ratas, por Chiang et al (19), han demostrado que el mecanismo de los receptores NMDA induce neuroplasticidad en las neuronas del subnúcleo caudal trigeminal por estimulación pulpar, esto provoca cambios en la actividad espontánea a nivel del campo mecanorreceptivo, de las neuronas nociceptivas específicas y de las neuronas de amplio rango dinámico (WDR). Los cambios de neuroplasticidad en las neuronas nociceptivas incluyen un incremento en sus descargas espontáneas, las cuales son breves pero de larga duración y un decrecimiento en su umbral mecánico (6-8-19,20). Por lo tanto, la sensibilización reflejada en los cambios de plasticidad sináptica pueden ser gatillados por impulsos nociceptivos aferentes que se van a reflejar a nivel del subnúcleo caudal trigeminal (21).
En este estudio se analiza la distribución de receptores tipo NMDA en el núcleo espinal de trigémino en humanos.
Material y método
Para este estudio se utilizaron 10 troncos encefálicos humanos. Las muestras fueron obtenidas de cadáveres, cuya data postmortem fue de 8,7 horas en promedio (desviación estándar 2,75), para lo cual, una vez retirada la calvaria y removido de los hemisferios cerebrales; se realizó un corte rostral a nivel de la unión de los pedúnculos cerebrales con el puente y uno caudal en la médula cervical 2 centímetros por debajo de la decusación de las pirámides.
Las muestras extraídas se colocaron en formol tamponado al 10% por 24 h, y luego en una solución de sucrosa al 4% y formol neutro al 40%, hasta ser fijadas por congelación. En las piezas obtenidas se procedió a la delimitación anatómica de las porciones oral, interpolar y caudal del núcleo espinal trigeminal, de acuerdo a la descripción de Martín (22), seccionándose a estos niveles para obtener tres bloques; uno rostral, que correspondía al puente caudal y bulbo rostral; uno medio correspondiente al bulbo medio; y uno caudal constituido por bulbo caudal y los dos primeros segmentos cervicales. Cada uno de estos bloques fue seccionado mediante un micrótomo rotatorio en cortes de un espesor de 30 um. a un intervalo de 2 milímetros, de tal manera que se obtuvieron 8 cortes de cada bloque. Se seleccionaron 3 cortes que fueron lavados en intervalos de 15 minutos por 1 hora con una solución de buffer fosfato 0,1 M, ph.7,3 y luego incubados en una solución de suero normal de conejo por 1 hora. La totalidad de los cortes restantes fueron procesados de forma alternada: siendo sometidos uno a la tinción de Mulligan y el siguiente corte a inmunohistoquímica con anticuerpos monoclonales anti-NMDA R1 (SigmaR) en dilución 1:500 en 0,3% de Triton X-100 a ph 7,3 0,1 M, este procedimiento fue repetido sucesivamente en la totalidad de los 30 bloques obtenidos desde los troncos encefálicos.
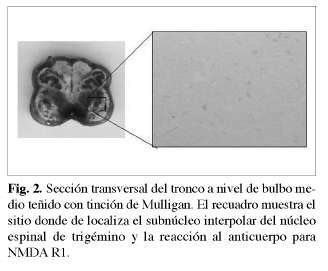
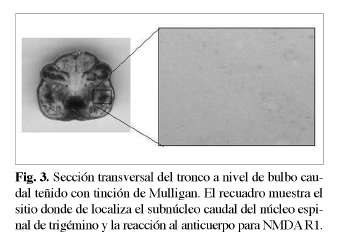
El total de las muestras obtenidas fue de 240, las 120 placas con tinción de Mulligan fueron registradas y ordenadas de manera correlativa con las 120 placas sometidas a inmunohistoquímica y se utilizaron como control anatómico de las relaciones de los elementos celulares identificables a ese nivel del corte (Fig. 1, 2, 3). Luego las placas sometidas a inmunohistoquímica fueron llevadas a análisis morfométrico de densidad óptica (OD) en un programa de computación y los resultados sometidos a test estadísticos T student y ANOVA (análisis de varianza).
Resultados
El total de las muestras fueron medidas por un programa de computación para densidad óptica (OD).
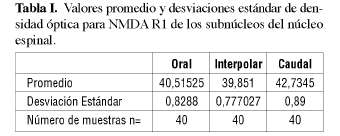
La tabla I muestra los valores promedio de las densidades ópticas (OD), medidas para receptores tipo NMDA R1, en las porciones oral, interpolar y caudal del núcleo espinal de trigémino, con sus respectivos valores de desviación estándar calculados en base a un universo n=40.
Luego las mediciones fueron sometidas a la prueba de T Student, comparando los subnúcleos entre sí y estableciéndose una diferencia cuantitativa entre ellos.
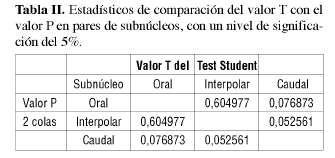
La tabla II indica la comparación de los valores T Student con el valor P en pares de subnúcleos, con un nivel de significación de el 5% (p<0,05).
Discusión
El presente estudio demuestra la presencia de receptores glutamatérgicos tipo NMDA R1 en los subnúcleos oral, interpolar y caudal del núcleo espinal de trigémino humano, coincidiendo con lo encontrado con Bereiter & Benetti, quienes mediante microdiálisis mostraron que la estimulación dolorosa facial producía la activación de las fibras-C trigeminales con la consiguiente secreción aguda de glutamato y aspartato en el núcleo caudal del trigémino (23) el cuál activaría receptores NMDA en el núcleo espinal.
Numerosos estudios consideran que el subnúcleo caudal del núcleo espinal del trigémino presenta analogías con la zona marginal del asta dorsal de la médula (2,3-8), región en la cual Gougis, S. et al (24) comunicaron la presencia de receptores NMDA en estos segmentos de la médula espinal, mientras Watanabe et al (25) detectaron a nivel del ganglio del trigémino RNAm de receptores NMDA, pero no su proteína, mientras Sessle, B. J (21) destaca el rol que los receptores NMDA juegan en la sensibilización del sistema trigeminal.
Basados en la función homóloga del subnúcleo caudal con la zona marginal del asta dorsal medular y su importante rol en la transmisión del impulso nociceptivo, era posible pensar que existiría un claro predominio en la densidad de receptores glutamatérgicos tipo NMDA R1 en esta porción, por sobre las porciones oral e interpolar, a los cuales se le ha asignado una función secundaria dentro de la vía nociceptiva del territorio máxilofacial, sin embargo, los resultados muestran que existe una tendencia que indica mayor densidad de receptores tipo NMDA R1 en el subnúcleo caudal del núcleo espinal, pero que no resultó estadísticamente significativa.
Nuestros resultados reflejan una abundante presencia de receptores glutamatérgicos tipo NMDA R1 en todos los niveles del núcleo espinal de trigémino, lo cual nos permite inferir que éstos participan en la transmisión dolorosa del territorio máxilofacial (26-31).
Este planteamiento coincide con los trabajos de Hayashi et al en 1984 (32) quienes reivindican el rol nociceptivo del subnúcleo interpolar en la organización funcional del sistema trigeminal.
Desde una visión clínica, estos resultados nos van a ayudar a entender la reacción del sistema trigeminal frente a un daño tisular: cuando este está circunscrito o localizado y es de poca magnitud desencadena un dolor de aparición rápida, de corta duración y de fácil remisión, característicos de los potenciales postsinápticos mediados por receptores glutamatérgicos tipo no NMDA como AMPA; a diferencia de lo que ocurre cuando el daño tisular es de gran magnitud, en esta situación la estimulación repetida de receptores del tipo no NMDA especialmente AMPA permite la salida del bloqueo del canal del receptor tipo NMDA produciéndose un potencial postsináptico excitatorio de aparición tardía, de gran intensidad y de larga duración, lo que se traduce en un dolor muy agudo y de difícil remisión. Por lo tanto, la presencia de receptores tipo NMDA en el sistema trigeminal humano debe ser considerado como parte del proceso de sensibilización del territorio oral y maxilofacial.
Bibliografía
1. Manns, A.; Díaz, G. Sistema Estomatognático. Santiago de Chile: Facultad de Odontología, Universidad de Chile 1988. Pág. 95-109. [ Links ]
2. Carpenter, Malcomí B. Neuroanatomía Fundamentos. Buenos Aires, Argentina: Editorial Médica Panamericana SA. 1998. Pág. 176-180. [ Links ]
3. Gobel, S.; Purvis, M. Anatomical studies of the organization of the spinal V nucleis: The deep bundles and the spinal V tract. Brain 1972; 48: 27-44. [ Links ]
4. Dubner, R. Peripheral and central trigeminal pain pathways. Pain Res 1976. Ther, I: 137-148. [ Links ]
5. Dubner, R. Neurophysiology of pain. Dent. Clin. North Am 1978; 22: 11-30. [ Links ]
6. Meller, S.T.; Gebhart, G.F Nitric oxide (NO) and nociceptive processing in the spinal cord. Pain 1993; 52: 127-136. [ Links ]
7. Romera, E.; Perena, M.; Perena, MF; Rodrigo, M. Neurofisiología del dolor. Rev. Soc. Esp. del Dolor 2000; Vol. 7: 11-17. [ Links ]
8. Paeile, C.; Bilbeny, N. Dolor Aspectos Básicos y clínicos. Santiago de Chile: Mediterráneo, Segunda Edición 1997. 1: 19-27; 2: 28-40; 4: 78-88, 103-113, 120-136. [ Links ]
9. Dubner, R.; Ruda, M.A. Activity-dependent neuronal plasticity following tissue injury and inflamation. Trends Neurology. Sci 1992. 15: 96-103. [ Links ]
10. Woolf, G.; Würdig, S.; Schünzel, G. Nitric oxide synthase in rat brain is predominantly located at neuronal endoplasmic reticulum: an electrón microscopic demonstration of NADPH- diaphorase activity. Neuroscience 1992. 147: 63-66. [ Links ]
11. Neira, F; Ortega, J. La neuralgia postherpética. ¿Un problema sin resolver? Rev. Soc. Esp. del Dolor 1998; Vol. 5: 128-143. [ Links ]
12. Bear, Mark F; Connors, Barry W.; Paradiso, Michael A. Neurociencia explorando el cerebro. Barcelona (España): Masson- Williams & Wilkins, Edición Original 1998. Cap. 6 pág 128-142. [ Links ]
13. Kandel, Eric R.; Jessell, Thomas M.; Schwartz, James H. Neurociencia y Conducta. España: Prentice Hall (international (UK) Ltda.). Edición Original 1997. Pág.245-249. [ Links ]
14. Villanueva, L. Asta dorsal medular: ¿Cuál es su rol en el procesamiento de los impulsos que generan la sensación dolorosa? Rev. Soc. Esp. del Dolor 1998; Vol. 5: 52-69. [ Links ]
15. Neira, F; Ortega J.L. Antagonistas de los receptores glutamatérgico NMDA en el tratamiento del dolor crónico. Rev. Soc. Esp. del Dolor 2004 Vol.11 , 210- 219. [ Links ]
16. Rodríguez, R. ¿Existe dolor por desaferentización? Rev. Soc. Esp. del Dolor 1999; Vol. 6: 116-120. [ Links ]
17. Baptista, V; Ogawa, W.; Aguiar, J.; Varanda, W. Electrophysiological evidence for the presence of NR2C subunits of N-mefhyl-D-aspartate receptors in rat neurons of the nucleus tractus solitarius. Brazilian Journal of Medical and Biological Research 2005; 38: 105-110. [ Links ]
18. Olivar, L; Lair, J. Efectos diferenciales del bloqueo de los receptoresde N-metil-D-aspartato en los reflejos nociceptivos somáticos y visceral. Rev. Soc. Esp. del Dolor 2000; Vol. 7: 291-300. [ Links ]
19. Chiang, Chen Yu; et al. NMDA Receptor Mechanisms Contribute to Neuroplasticity Induced in Caudalis Nociceptive Neurons by Tooth Pulp Stimulation. The Journal of Neurophysiology 1998. Vol. 80 Nº 5 pp. 2621-2631. [ Links ]
20. Mayer. S.T.; Westbrook, G.L. The fisiology of excitatory amino acids in the vertébrate central nervous system. Prog. Neurobilogy 1987. 28:197-276. [ Links ]
21. Sessle, B.J. The neurobiology of facial and dental pain: present knowledge, future direccions. Journal Dental Research 1987. 66: 692-981. [ Links ]
22. Martín, J.H. Neuroanatomía. 2a ed. Edit. Prentice Hall. 1998. [ Links ]
23. Bereiter, D.; Benetti, A. Excitatory amino reléase within spinal trigeminal nucleus after mustard oil injection into the temporomandibular joint región of the rat. Pain 1996; 67: 451-9. [ Links ]
24. Gougis, S.; Prudhomme, M.; Rampin O. Presence of the N-methylaspartic acid Rl glutamatergic receptor subunit in the lumbosacral spinal cord of male rats. Neuroscience Letters 2002; Volume 323, Issue 3: Pages 224-228. [ Links ]
25. Watanabe, M.; Mishina, M.; Inoue, Y. Distinct gene expression of the N-methyl-D-aspartate receptor channel subunit in peripheral neurons of the mouse sensory ganglia and adrenal gland. Neurosci Lett 1994; 165: 183-6. [ Links ]
26. Ro, J.; Capra, N.; Masri, R. Contribution of peripheral N-Methyl-D-Aspartate receptors to C-Fos expression in the trigeminal spinal nucleus following acute masseteric inflammation. Neuroscience 2004; 213-219. [ Links ]
27. Neira, F.; Ortega, J. Etiopatogenia y efectos funcionales del dolor postoperatorio. En: Torres L.M. Tratamiento del dolor postoperatorio. Ediciones Ergon S.A., 2003. p. 3-30. [ Links ]
28. Dallel, R.; Raboisson, R Woda, A. Sessle, BJ. Properties of nociceptive and nonnociceptive neurons in trigeminal nucleus oralis of the rat. Brain Research 1990; 521: 95-106. [ Links ]
29. Dong, W.K.; Chudler, E.H.; Kawakami, Y. Tooth pulp-evoked potentials in the trigeminal brainstem nuclear complex. Brain research 1990; 529: 131-142. [ Links ]
30. Sugimoto, T.; Takemura, M.; Wakisaka, S. Tooth pulp primary neurons: Cell seze análisis, central connection, and carbonic anhydrase activity. Brain Research 1988. Bull. 30: 221-226. [ Links ]
31. Hu, J.W.; Sessle, B.J. Comparison of responses of cutaneous nociceptive and nonnociceptive brain stem neurons in trigeminal subnucleus oralis to natural and electrical stimulation of tooth pulp. the Journal of Neurophysiology 1984; Jul.; 52 (1): 39-53. [ Links ]
32. Hayashi, H.; Sumino, R.; Sessle, B.J. Functional organization of trigeminal subnucleus interpolaris: Nociceptive and innocuous afferent inputs, projections to thalamus, cerebellum, and spinal cord, and descending modulation from periaqueductal gray. 1984; 51(5): 890-905. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Oficina 104 Anatomía Normal
Universidad de Talca, campus Lircay.
Avda Lircay S/N, Talca VII región, Chile.
Teléfono: 56-71-201682
Fax: 56-71-200452
isuazo@utalca.cl
Financiación: Ninguna
Conflictos de interés: No declarados
Recibido: 19/03/2007
Aceptado: 13/06/2007