Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de la Sociedad Española del Dolor
versão impressa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.16 no.5 Madrid Jun./Jul. 2009
Evaluación del uso de metadona en el tratamiento del dolor neuropático
Evaluation of methadone use in the treatment of neuropathic pain
E.Y. Cardona Aristizabal* y A. Kassian Rank
Clínica del Dolor, Centro Nacional de Capacitación en Terapia del Dolor, Hospital General de México, México
Dirección para correspondencia
RESUMEN
Introducción: El dolor neuropático resulta de una lesión o disfunción del sistema nervioso. Su tratamiento es básicamente farmacológico e incluye el uso de antidepresivos y anticonvulsivantes, entre otros. Existe controversia en relación con la utilidad de los opioides en el manejo del dolor neuropático. La metadona es un opioide agonista mu, que además actúa bloqueando la recaptación de norepinefrina y serotonina en el asta dorsal, y es un antagonista del receptor de N-metil-D-Aspartato (NMDA).
Objetivo: Valorar la respuesta analgésica obtenida en pacientes con dolor neuropático no oncológico tratados con metadona.
Material y métodos: Se realizó un estudio retrospectivo, transversal. Se revisaron expedientes clínicos y se realizó una entrevista directa a los pacientes con dolor neuropático en tratamiento con metadona, durante el período comprendido entre el 1 de enero y 31 de julio de 2006, para valorar mejoría en la intensidad del dolor, la dosis del fármaco y los efectos adversos.
Resultados: Se incluyó a 31 pacientes con dolor neuropático en tratamiento con metadona. La dosis diaria varió entre 2,5 y 60 mg (moda 10 mg/día). La intensidad del dolor medida por escala analógica visual fue de 8,7 ± 1,2 y 4,3 ± 1,8, antes y después de tratamiento con metadona, respectivamente, con disminución promedio del 49%. El efecto adverso más común fue la constipación (65%).
Conclusiones: La metadona puede ser de utilidad en el tratamiento del dolor neuropático cuando otros fármacos no lo controlan adecuadamente.
Palabras clave: Dolor neuropático; Metadona; Efectos adversos.
ABSTRACT
Introduction: Neuropathic pain results from nervous system injury or dysfunction. Medical treatment is the first line therapy, including antidepressants, anticonvulsants and other drugs. The analgesic efficacy of opioids in the treatment of neuropathic pain is controversial. Methadone is a Ì-opioid receptor agonist, which also acts by blocking norepinephrine and serotonin reuptake into the dorsal horn, and is an N-methyl-D aspartate (NMDA) receptor antagonist.
Objective: To evaluate the clinical characteristics of patients with non-oncological neuropathic pain treated with methadone.
Material and methods: We performed a retrospective, cross-sectional study. Medical records were reviewed and patients with neuropathic pain taking methadone were interviewed between January 1 and July 31, 2006 to evaluate reduction of pain intensity, dosing, and side effects.
Results: We included 31 patients with neuropathic pain who received methadone treatment. The patients were taking between 2.5 mg and 60 mg per day of methadone (mode 10 mg per day). Pain intensity on the Visual Analog Scale was 8.7 ± 1.2, and 4.3 ± 1.8, before and after treatment with methadone, respectively, with a mean decrease of 49%. The most frequent adverse effect was constipation (65%).
Conclusions: Methadone is a useful drug in the treatment of neuropathic pain when other drugs have failed.
Key words: Neuropathic pain; Methadone; Adverse effects.
Introducción
El dolor neuropático es aquel iniciado o causado por una lesión primaria o disfunción del sistema nervioso1. Su fisiopatología incluye mecanismos periféricos, como la presencia de focos ectópicos en las aferentes primarias, parches de desmielinización, la distribución alterada de canales de sodio en nociceptores lesionados y ganglios de la raíz dorsal y la disminución del umbral de nociceptores, y mecanismos centrales, como los cambios plásticos en el asta dorsal, con la acción sostenida de neurotransmisores y neuropéptidos sobre receptores específicos, dentro de los cuales resalta el papel del receptor de N-metil-D-Aspartato (NMDA), implicado en el desarrollo de sensibilización central, y la alteración en las vías inhibitorias descendentes2,3. Típicamente, se clasifica, según el sitio de afección del sistema nervioso, como central y periférico, aunque muchos pacientes pueden tener ambos tipos de dolor. En la Clínica del Dolor del Hospital General de México, los síndromes de dolor neuropático representan cerca de un 50% del total de consultas atendidas por año4.
La base del tratamiento del dolor neuropático es farmacológica. Los fármacos utilizados con más frecuencia para su manejo son los antidepresivos tricíclicos y los anticonvulsivantes. Los opioides ocupan un lugar discutido en el alivio de dolor neuropático5,6. Entre estos últimos, el tramadol es el más comúnmente utilizado en este tipo de patologías; además de su acción sobre receptores mu tiene la propiedad de inhibir la recaptura de serotonina y norepinefrina7.
La metadona es un opioide sintético mejor conocido por su uso en el tratamiento de la dependencia de opioides. Es también efectivo como agente analgésico, probablemente con importante efecto en el tratamiento del dolor neuropático8-10. Los pacientes con inadecuada analgesia o efectos adversos por el uso de otros opioides pueden beneficiarse del uso de metadona8-13. Adicionalmente, algunas propiedades farmacológicas únicas lo hacen un agente importante en el tratamiento analgésico. El perfil farmacológico de la metadona es bien conocido10,14-18.
La metadona consta de un enantiómero R y un enantiómero S; prácticamente, toda su actividad se debe al enantiómero R. Ejerce su actividad a través de la unión y activación de receptores mu a nivel central y periférico. Esta actividad produce los efectos comunes al uso de todos los opioides agonistas mu: analgesia, euforia, estreñimiento, sedación, depresión respiratoria, náuseas y miosis. Además, la metadona antagoniza los receptores NMDA e inhibe la recaptación de serotonina y norepinefrina, lo que puede incrementar su efectividad en el tratamiento del dolor neuropático, comparado con otros opioides14.
Pocos estudios han evaluado la eficacia de la metadona en el tratamiento de dolor neuropático. Morley et al19 analizaron, en un estudio aleatorizado y doble ciego, la eficacia de 10 y 20 mg de metadona en 18 pacientes con dolor neuropático de diferentes etiologías con pobre respuesta a tratamientos convencionales, y pudieron demostrar el efecto analgésico de metadona en este tipo de afecciones. Yoram et al20 analizaron el uso de metadona en un hospital de Jerusalén durante un período de 5 años, con un total de 3.954 pacientes, entre quienes se incluyó a pacientes con dolor por neuropatías periféricas; encontraron buen efecto analgésico, con pocos y bien tolerados efectos adversos. En un estudio aleatorizado, doble ciego, cruzado, se comparó la eficacia de opioides (metadona y morfina) y de antidepresivos tricíclicos (nortriptilina y desipramina) en el tratamiento de 66 pacientes con neuralgia postherpética; se encontró una eficacia analgésica similar entre los dos grupos de fármacos21.
Los efectos adversos secundarios a la administración de metadona generalmente son menos comunes y menos severos que cuando se presentan por otros opioides. Si el efecto adverso es menor, puede resolverse espontáneamente en pocos días. La constipación, presente en el 65% de los pacientes en tratamiento con metadona, es el efecto adverso más común de todos los opioides y requiere de un manejo agresivo. Otros efectos adversos asociados al uso de metadona incluyen náuseas, vómitos, sudoración, prurito y, rara vez, depresión respiratoria22.
El objetivo de este estudio fue evaluar el efecto de la metadona en la intensidad del dolor y la presencia de efectos adversos en pacientes con dolor neuropático.
Material y métodos
Se llevó a cabo un estudio retrospectivo, transversal. Se revisaron los recetarios de narcóticos de los médicos adscritos a la Clínica del Dolor del Hospital General de México utilizados durante el período comprendido entre el 1 de enero y 31 de julio de 2006, tomando los datos de los pacientes que reciben recetas de metadona y que tienen diagnóstico de dolor neuropático de cualquier etiología, excluidos los pacientes con dolor mixto y dolor por cáncer. Se revisaron los expedientes clínicos de dichos pacientes, tomando de ellos sus datos demográficos, diagnóstico, tiempo de evolución del cuadro doloroso, las características del dolor y la intensidad del dolor existente antes del inicio del opioide, por medio de la puntuación de la escala analógica visual (EVA). Durante cita de control se pidió a los pacientes su consentimiento informado; se realizó un interrogatorio directo para determinar la dosis actual de metadona, el número de fármacos utilizados de manera concomitante, la intensidad del dolor según la puntuación en la EVA y los efectos adversos atribuidos a su uso. Se realizó un análisis estadístico cuantitativo, con medidas de tendencia central y de dispersión, y se determinó el efecto en la intensidad del dolor y la incidencia de efectos adversos.
Resultados
Se incluyó a 31 pacientes con diagnóstico de dolor neuropático de diferente etiología, a quienes se les inició manejo con metadona por vía oral después de haber tenido una pobre respuesta a tratamiento con tres o más fármacos. El promedio ± desviación estándar de edad de los pacientes fue de 58 ± 14,5 años; 18 (58,1%) eran varones y 13 (41,9%) mujeres. Diez (32,3%) pacientes tenían diagnóstico de dolor central, 8 (25,8%) de neuralgia postherpética, 6 (19,4%) de canal lumbar estrecho, 3 (9,7%) de síndrome poslaminectomía, 3 (9,7%) de neuropatía diabética y 1 (3,2%) de polineuropatía por citomegalovirus. La mediana del tiempo de evolución del cuadro doloroso fue 18 meses, con un máximo de 260 meses y un mínimo de 3 meses. Veintitrés (74,3%) pacientes describieron el dolor como predominantemente tipo urente, 5 (16,1%) como tipo piquete, 2 (6,5%) como tipo toque eléctrico y 1 (3,2%) como lancinante; el 45% de los pacientes refirió dolor tipo toque eléctrico además del predominante. Todos los pacientes habían recibido algún opioide durante su tratamiento previo al inicio del tratamiento con metadona; en 26 (83,9%) casos se trató de tramadol, en 2 (6,5%) de codeína, en 1 (3,2%) de dextropropoxifeno y 2 (6,5%) habían recibido dos opioides (un paciente recibió inicialmente dextropropoxifeno y otro codeína, y posteriormente ambos recibieron tramadol); en todos los casos, los pacientes refirieron mínima o nula mejoría con el opioide administrado previamente.
La mediana de tiempo de tratamiento con metadona fue 3 meses, con un mínimo de 1 y un máximo de 18 meses. La moda de la dosis de metadona fue 10 mg/día (29% de pacientes), con una dosis máxima de 60 y una dosis mínima de 2,5 mg/día. La puntuación promedio en la EVA de dolor referido por los pacientes como previo al inicio de tratamiento con metadona fue de 8,7 ± 1,2, y la actual de 4,3 ± 1,8, con una disminución promedio del 49,5%. Los pacientes con diagnóstico de neuralgia postherpética mostraron una disminución promedio del 58% en la intensidad del dolor en la puntuación de la EVA después del tratamiento con metadona, los de dolor central del 47,2% y los de canal lumbar estrecho del 32,7%. Los pacientes con dolor tipo urente mostraron una disminución promedio de la puntuación de la EVA del dolor en el 50% y los de tipo piquete, en el 31,8%.
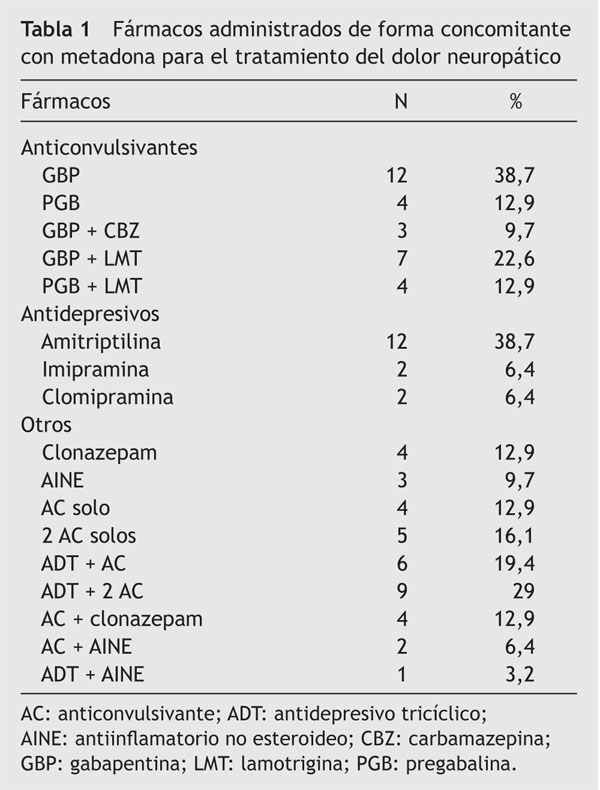
El número de fármacos administrados de manera concomitante a la metadona fue, en promedio, de 2,2 ± 0,6; 30 (96,8%) pacientes recibieron anticonvulsivantes, 4 de ellos como único fármaco además de la metadona (2 gabapentina y 2 pregabalina), 5 pacientes recibieron una combinación de dos anticonvulsivantes (gabapentina o pregabalina + carbamazepina o lamotrigina) y 21 pacientes recibieron uno o dos anticonvulsivantes en combinación con un antidepresivo tricíclico, clonazepam o un antiinflamatorio no esteroideo. Los detalles sobre el consumo de estos fármacos se muestran en la tabla 1.
Veintisiete (87,1%) pacientes presentaban por lo menos un efecto adverso en el momento de la entrevista; un paciente presentó únicamente efectos adversos transitorios (estreñimiento, sedación y retención urinaria), que se resolvieron en pocos días; 3 (9,7%) pacientes refirieron no haber presentado ningún efecto adverso durante el tiempo de tratamiento con metadona. El 32,2% de los pacientes (10) referían presentar un efecto adverso, el 45% (14 pacientes) dos efectos adversos y el 9,7% (3 pacientes) tenían más de dos efectos adversos. El estreñimiento fue el efecto adverso más común; se presentó en 20 pacientes (64,5%), con buena respuesta a tratamiento habitual; 15 (48,4%) pacientes refirieron presentar sedación y 5 (16,1%) pacientes, náuseas. Otros efectos adversos, poco frecuentes, incluyeron disminución de apetito, insomnio, hipoglucemia, sudoración y pesadillas, presentes en un paciente cada uno de ellos, y retención urinaria en dos pacientes.
Discusión
Se han realizado pocos estudios para valorar el uso de la metadona en el tratamiento de dolor neuropático. En los pacientes de nuestro estudio, la disminución promedio en la puntuación de dolor mediante la EVA fue, en promedio, del 49,5%, la mayoría de ellos tomaban una dosis diaria de 10 mg (29%). Este resultado es comparable con el de Morley et al19, quienes evaluaron la respuesta de 18 pacientes con dolor neuropático crónico de diferentes etiologías, que habían tenido una pobre respuesta a regímenes analgésicos tradicionales, a la administración de una dosis de 10 y de 20 mg de metadona, y encontraron un efecto analgésico importante, con una disminución en la intensidad del dolor después de ambos esquemas, aunque sólo la dosis de 20 mg mostró diferencias estadísticamente significativas, con extensión del efecto analgésico hasta 48 h después de su administración; el efecto analgésico no se limitó a un tipo específico de afección.
En nuestro estudio, los pacientes con diagnóstico de neuralgia postherpética (25,8%) fueron los que mostraron mayor mejoría, con una disminución promedio en la intensidad del dolor del 58%. Raja et al21 compararon la eficacia analgésica de antidepresivos tricíclicos y opioides en 44 pacientes con neuralgia postherpética, a quienes se les administró, de forma cruzada, dosis promedio diaria de 91 mg de morfina o 15 mg de metadona, o 89 mg de nortriptilina o 63 mg de desipramina, que encontraron alivio significativo del dolor con los 4 esquemas, comparados con placebo, con tendencia a una mejor respuesta con los opioides; la mayoría de los pacientes que terminaron el estudio prefirieron los opioides a los antidepresivos (el 54 frente al 30%). De los pacientes con neuralgia postherpética, en nuestro estudio, 5 (62,5%) reciben un antidepresivo tricíclico como parte de su manejo farmacológico, cuatro de ellos amitripitlina y uno clomipramina.
Los efectos adversos asociados al uso de metadona son similares a los encontrados con otros opioides agonistas mu. En nuestro estudio el efecto adverso más común fue el estreñimiento, presente en el 64,5% de los pacientes; este hallazgo es similar al referido por otros autores, que señalan que este efecto se encuentra en aproximadamente el 65% de los pacientes en tratamiento crónico con metadona9,22. El 48,4% de los pacientes de nuestro estudio refirió presentar sedación, una cifra mayor que la reportada por Nicholson23, quien encontró una incidencia del 25% en los estudios revisados en su metanálisis. La presencia de náuseas se refirió en el 16,1% de nuestros pacientes, acorde con la cifra reportada por Nicholson23, del 12,5 al 20% en los pacientes en tratamiento con metadona23. Toombs y Kral24 refieren que la sudoración y los bochornos son comunes con el uso de metadona, y Nicholson23 encontró sudoración en el 6,6 al 15% de los pacientes de algunos de los estudios analizados. En nuestro estudio, un solo paciente (3,2%) reportó la presencia de sudoración. Otros efectos adversos reportados por Nicholson23 incluyen vómito, en el 6,6 al 20% de los pacientes, presente de forma transitoria en solo un paciente de nuestro estudio, y mareo, en el 10 al 15% de los pacientes, no referido por ninguno de los de nuestro estudio. Uno de nuestros pacientes presentó episodios de hipoglucemia, efecto esperado teniendo en cuenta la amplia unión a proteínas de la metadona, a diferencia de otros opioides, y que se resolvió tras el ajuste de la dosis administrada. Un paciente más refirió la presencia de pesadillas.
La mayoría de los estudios referentes a metadona, y de los cuales tomamos datos comparativos, se han realizado con este fármaco como único tratamiento. Es importante señalar que ninguno de nuestros pacientes recibe metadona como monoterapia y que en todos estos casos constituye parte coadyuvante del tratamiento farmacológico, lo que puede explicar la buena respuesta de los pacientes, aun en dosis menores de 10 mg (35,5% de los pacientes recibían 2,5, 5 o 7,5 mg/día). Sólo 4 de los 31 pacientes recibe un solo fármaco además de la metadona; en los 4 casos se trata de anticonvulsivantes, gabapentina en 2 casos y pregabalina en los otros dos, todos ellos con diferentes diagnósticos, tipos de dolor y grado de alivio con el tratamiento. Dieciséis (51,6%) pacientes reciben un antidepresivo tricíclico; 12 de ellos reciben amitriptilina, 2 reciben imipramina y 2 reciben clomipramina, en dosis de 25 a 75 mg al día; 15 de estos pacientes reciben además uno o dos anticonvulsivantes. Nueve (29%) pacientes reciben un antidepresivo tricíclico y dos anticonvulsivantes, además de metadona, más de la mitad de ellos con diagnóstico de dolor central y con intensidad de dolor en la EVA de 8 a 10, previo al tratamiento con metadona, lo que resalta la dificultad en el manejo médico de este tipo de patología, y el 88% de ellos refiere disminución de la intensidad del dolor mayor de un 50% después del inicio de tratamiento con metadona.
Con estos hallazgos consideramos que la metadona representa una opción farmacológica útil como coadyuvante en el tratamiento de dolor neuropático en pacientes con pobre respuesta al tratamiento farmacológico habitual. En la mayoría de los pacientes de nuestro estudio fue bien tolerado, con pocos efectos adversos. Hacen falta estudios de mejor diseño metodológico para determinar el verdadero valor del fármaco en el manejo de esta difícil afección.
Conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Bibliografía
1. Merskey H, Bugduk N. Classification of chronic pain. Descriptions of chronic pain syndromes and definitions of pain terms. 2nd ed. Seattle: IASP Press; 1994. [ Links ]
2. Woolf C, Mannion R. Neuropathic pain: aetiology symptoms mechanisms and management. Lancet. 1999;353:1959-64. [ Links ]
3. Bruera E, Sweeney C. Methadone use in cancer patients with pain: a review. J Palliat Med. 2002;5:127-38. [ Links ]
4. Kassian RA, Gutiérrez GJ, Bautista SS. Epidemiología del dolor neuropático. En: Intersistemas Editores. Dolor neuropático: sistema de actualización médica en dolor neuropático. 1.ª ed. México: Intersistemas Editores; 2004. p. 26-8. [ Links ]
5. Chou R, Ballantyne JC, Fanciullo GJ, Fine PG, Miaskowski C. Research gaps on use of opioids for chronic noncancer pain: findings from a review of the evidence for an American Pain Society and American Academy of Pain Medicine clinical practice guideline. J Pain. 2009;10:147-59. [ Links ]
6. Eisenberg E, McNicol E, Carr DB. Opiáceos para el dolor neuropático (Cochrane Review). En: La Biblioteca Cochrane Plus, Issue 3, 2008. Oxford: Update Software. [ Links ]
7. Rowbotham M. Neuropathic pain: from basic science Tl evidence based treatment pain 2002. En: Update Review Refresher Course Syllbun. Seatle: IASP Press; 2002. p 17-22. [ Links ]
8. Morley J, Makin M. The use of methadone in cancer pain poorly responsive to other opiates. Pain Reviews. 1998;5:51-8. [ Links ]
9. Brown R, Kraus C, Fleming M, Reddy S. Methadone: applied pharmacology and use as adjunctive treatment in chronic pain. PMJ. 2004;80:654-9. [ Links ]
10. Ayonrinde OT, Bridge DT. The rediscovery of methadone for cancer pain management [comment]. Med J Aust. 2000;173:536-40. [ Links ]
11. Bruera E, MacMillan K, Hanson J, MacDonald RN. Palliative care in a cancer center. Results in 1984 versus 1987. J Pain Symptom Manage. 1990;5:1-5. [ Links ]
12. Crews J, Sweeney N, Denson D. Clinical efficiency of methadone in patients refractory to other mu-opioid receptor agonist analgesics for management of terminal cancer pain. Cancer. 1993;72:2266-72. [ Links ]
13. Fredheim OM, Moksnes K, Borchgrevink PC, Kaasa S, Dale O. Clinical pharmacology of methadone for pain. Acta Anaesthesiol Scand. 2008;52:879-89. [ Links ]
14. Brown R, Kraus C, Fleming M, Reddy S. Methadone: applied pharmacology and use as adjunctive treatment in chronic pain. PMJ. 2004;80:654-9. [ Links ]
15. Olsen G. Methadone binding to human plasma proteins. Clin Pharmacol Ther. 1973;14:338. [ Links ]
16. Anggard E, Gunne LM; Homstrand J, McMahon RE, Sandberg CG, Sullivan HR. Disposition of methadone in methadone maintenance. Clin Pharmacol Ther. 1975;17:258-66. [ Links ]
17. Baselt RE, Casarett LJ. Urinary excretion of methadone in man. Clin Pharmacol Ther. 1972;13:64. [ Links ]
18. Inturrisi CE, Colburn WA, Kaiko RF, Houde RW, Foley KM. Pharmacokinetics and pharmacodynamics of methadone in patients with chronic pain. Clin Pharmacol Ther. 1987;41:392-401. [ Links ]
19. Morley J, Bridson J, Nash T, Miles J, White S, Makin M. Low-dose methadone has an analgesic effect in neuropathic pain: a double-blind randomized controlled crossover trial. Palliative Med. 2003;17:576-87. [ Links ]
20. Yoram S, Gila R, Alexander Z, Davidson EMl. Methadone is safe for treating hospitalized patients with severe pain. Canadian J Anest. 2001;48:1109-13. [ Links ]
21. Raja S, Haythornthwaite J, Pappagallo M, Clark MR, Travison TG, Sabeen S, et al. Opioids versus antidepressants in postherpetic neuralgia: a randomized, placebo-controlled trial. Neurology. 2003;60:1052-3. [ Links ]
22. Hays L, Reid C, Doran M, Geary K. Use of methadone for the treatment of diabetic neuropathy. Diabetes Care. 2005;28:485-7. [ Links ]
23. Nicholson AB. Metadona para el dolor por cáncer (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2006 Número 2. Oxford: Update Software Ltd. [ Links ]
24. Toombs JD, Kral LA. Methadone treatment for pain states. Am Fam Physician. 2005;71:1353-8. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: eduinyadir@hotmail.com
(E.Y. Cardona Aristizabal).
Recibido el 8 de diciembre de 2007;
Aceptado el 14 de mayo de 2009