Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.19 no.2 Madrid mar./abr. 2012
Bloqueo de ganglio estrellado
Stellate ganglion block
C. E. Restrepo-Garcés1, C. M. Gómez Bermudez1, S. Jaramillo Escobar2, L. Jazmín Ramírez3, L. M. Lopera4 y J. F. Vargas2
1Clínica de Alivio del Dolor. Departamento de Cirugía e Imágenes. Hospital Pablo Tobón Uribe. Unidad de Alivio del Dolor. Clínica Las Américas y Instituto de Cancerología.
2Clínica de Alivio del Dolor. Departamento de Cirugía e Imágenes. Hospital Pablo Tobón Uribe.
3Clínica de Alivio del Dolor. Departamento de Cirugía, Oncología e Imágenes. Hospital Pablo Tobón Uribe.
4Departamento de Anestesiología. Clínica Universitaria León XIII. Medellín, Colombia
Dirección para correspondencia
RESUMEN
El bloqueo de ganglio estrellado es una de las técnicas intervencionistas más frecuentemente empleadas en medicina del dolor. Sus indicaciones incluyen patologías dolorosas y no-dolorosas. Aunque las descripciones originales se fundamentan en límites anatómicos, el uso de guía fluoroscópica o el empleo de el ultrasonido, deben ser considerados el enfoque estándar. En el presente manuscrito se realiza una descripción detallada de las indicaciones y de las técnicas (fluoroscópica y ultrasonido) guiadas por imagen. Se destaca que el empleo del ultrasonido tiene la ventaja específica de visualizar las estructuras viscerales relacionadas (esófago), las vasculares (vasos tiroideos inferiores, carótida) y finalmente evalúa la dispersión del inyectado en tiempo real en el músculo longus colli.
Palabras clave: Ganglio estrellado. Bloqueo. Síndrome doloroso regional complejo. Dolor crónico.
ABSTRACT
Stellate ganglion block is a frequent interventional technique on the field of pain medicine. The indications included painful and non-painful pathologies. The original descriptions were based on anatomical landmarks, but the use of fluoroscopy or ultrasound as a guidance, should be the standard approach. In the present article there is a detailed description of the indications and the image guided techniques (fluoroscopy and ultrasound). The manuscript highlight the advantage of the ultrasound visualizing the visceral structures (esophagus), the vascular bed (inferior thyroid vessels, carotid artery) and finally on real time detect the dispersion of the injectate.
Key words: Stellate ganglion. Block. Complex regional pain síndrome. Chronic pain.
Introducción
El bloqueo de ganglio estrellado es probablemente una de las intervenciones más frecuentemente empleados por el especialista en medicina del dolor. Su descripción original fue implementada por Leriche en la década de 1930 y posteriormente refinada por Findley y Patzer.
La técnica ha evolucionado desde ser un procedimiento fundamentado en referencias anatómicas, a un procedimiento guiado por imágenes; incluyendo guía fluoroscópica y más recientemente ultrasonido.
En su momento fue parte fundamental del diagnóstico del síndrome doloroso regional complejo tipo I (distrofia simpática refleja), pero no en la actualidad, con los criterios diagnósticos IASP de 1994 y los modificados propuestos en 2007 por Harden.
Es de anotar que su papel no se ha restringido al área de Medicina del Dolor, sino que se ha empleado en neurocirugía para vaso espasmos en pacientes con hemorragia subaracnoidea, hiperhidrosis y arritmias ventriculares entre otras.
Indicaciones y contraindicaciones
Se pueden dividir en 3 categorías:
- Analgésicas: las cuales a su vez pueden ser vistas como diagnósticas o terapéuticas.
- Vasculares.
- Misceláneas.
Las primeras son las más frecuentes e incluyen manejo del síndrome doloroso regional complejo, neuropatías isquémicas, dolor asociado a zoster, neuritis post-radiación, dolor facial atípico y dolor potencialmente mantenido por el simpático.
En el grupo de las vasculares se destacan el Raynaud, "frostbite", vaso espasmos y enfermedad vasoclusiva.
Finalmente las misceláneas incluyen hiperhidrosis, angina de pecho, arritmias ventriculares y vaso espasmo por hemorragia subaracnoidea. Hay reportes de su empleo en síndrome de estrés post-traumático y en estados post-menopáusicos para disminuir las oleadas de calor.
Este procedimiento como cualquier otro procedimiento está contraindicado cuando no existe un conocimiento adecuado de la técnica y de la anatomía relevante, así mismo en la presencia de coagulopatía adquirida incluyendo terapia anticoagulante o coagulopatía congénitas, infección localizada, alergia a los anestésicos locales e incapacidad para obtener consentimiento informado. Se ha propuesto que la presencia de glaucoma, infarto de miocardio reciente y baja reserva cardiaca deben ser evaluados de manera particular en cada paciente. Se debe además preguntar por alergia al medio de contraste cuando va a ser empleada la técnica fluoroscópica.
Anatomía
Las fibras simpáticas de cabeza, cuello y de las extremidades superiores pasan a través del ganglio estrellado. El ganglio estrellado o ganglio cervicotorácico está presente en el 80% de la población por la fusión del ganglio cervical inferior y el primer ganglio simpático torácico, encontrándose en frente del cuello de la primera costilla, y extendiéndose hasta la unión de la séptima vértebra cervical y la primera torácica. El ganglio puede tener forma fusiforme, triangular o globular (Fig. 1).
En la porción más inferior está situado posterior al borde superior de la primera porción de la arteria subclavia y al origen de la arteria vertebral, posterior al ápice del pulmón. A nivel de C6 se encuentra en íntima relación con el tubérculo anterior de la apófisis transversa denominado tubérculo de Chassaignac y a nivel de C7 está más medial a nivel del aspecto antero lateral del cuerpo vertebral.
Se debe recordar que existe una variación importante en términos de referencia anatómica, sugiriendo que el blanco final debe estar medialmente donde la apófisis transversa se une al margen lateral del cuerpo vertebral bajo el proceso encimado donde se encuentra con más estructura ósea. De igual manera el músculo longus colli es la referencia muscular del ganglio estrellado, refiriéndose de manera clásica lateral al ganglio, con una variación en su grosor de 5 a 10 mm en C6 y de 8 a 10 mm en C7. Esta profundidad sumada desde el tejido subcutáneo hasta la apófisis transversa de C6 tiende a no ser mayor que 16,6 mm.
Las relaciones vasculares más importantes son la arteria carótida palpable anatómicamente y la arteria vertebral, encontrándose a nivel de C7; pero puede existir hasta un 10% de variación anatómica en la que la arteria vertebral ingresa en niveles superiores a C7. Además a nivel de C7 se debe destacar que no es extraño que no exista una osteogénesis completa a este nivel y por tanto se debe mantener la dirección lo más medial posible para evitar punción de arteria vertebral.
La inyección de anestésico local a nivel de C6 supone una disección hasta la ubicación final del ganglio estrellado, por tanto se ha propuesto denominar a esta inyección como bloqueo simpático cervical, destacando que el tronco simpático a este nivel se encuentra inferior a la fascia cervical profunda encima del longus colli.
Descripción de la técnica
Aunque la inyección de ganglio estrellado ha sido descrita y empleada ampliamente a ciegas empleando referencias anatómicas; la inyección intravascular inadvertida, la no dispersión adecuada del anestésico local hasta el blanco y la lesión a estructuras adyacentes hacen que la inyección de ganglio estrellado guiado por imágenes sea la estándar a emplear, ya sea por fluoroscopio o por ultrasonido.
El empleo de tomografía axial computarizada identifica de forma clara las apófisis transversas de C6, C7, las estructuras musculares y vasculares, pero no ofrece una inyección en tiempo real, por lo cual tampoco es la técnica de elección de manera rutinaria. Finalmente es importante explicar de manera detallada los diferentes efectos secundarios y las complicaciones del procedimiento (ver sección de complicaciones y de efectos secundarios).
Fluoroscopia
Antes de iniciar el procedimiento, es necesario que el paciente llene el consentimiento informado que debe incluir la presencia de efectos secundarios y las posibles complicaciones existentes. Se deberá proceder a la consecución de un acceso intravenoso en el miembro contra lateral al procedimiento y se deberá monitorizar con ECG, SaO2 y presión arterial no invasiva.
Se debe mantener durante todo el procedimiento contacto verbal a manera de monitoreo neurológico. En términos generales no se administra sedación, pero si esta se necesitara se sugieren bajas dosis de benzodiacepinas tipo midazolam. El empleo de opioides tipo fentanilo puede de alguna manera alterar la respuesta analgésica esperada, especialmente si el procedimiento es diagnóstico en naturaleza. De manera ideal se deberá tener registro térmico desde antes del procedimiento para continuar con el en recuperación, para evaluar el cambio térmico. Se deberá disponer además de todo el equipo necesario para reanimación cardio cerebro pulmonar. No es necesaria la aplicación de antibiótico profiláctico.
1. El paciente es posicionado en decúbito supino sobre la mesa radio lúcida con la cabeza ligeramente extendida (se puede emplear una pequeña almohada entre los hombros para este propósito) y esta deberá estar neutra o con una ligera rotación al lado contrario al procedimiento.
2. El fluoroscopio (arco en c) debe estar sobre la espina cervical inferior sin anulación, reconociendo los cuerpos vertebrales y las apófisis transversas de C6 y de C7. Se podrá dar una ligera anulación cefalocaudal para eliminar el doble contorno y generar una verdadera proyección AP.
3. Esterilización del campo quirúrgico de manera regular.
4. Aplicación de anestésico local con aguja 26 G a nivel de piel. Se puede separar la carótida manualmente, pero no es absolutamente necesario.
5. Identificación del blanco, el cual es encontrado en el punto de unión de la apófisis transversa y el cuerpo vertebral, el cual está debajo del proceso uncinado. Se puede escoger ya sea el nivel de C6 o C7, prefiriéndose el primero por las condiciones anatómicas explicadas previamente de C7. Una alternativa es realizar una proyección lateral en la cual se evidencie el foramen después de tener sin doble imagen el disco de C6 o C7 y por debajo del proceso uncinado, anterior al foramen dirigir la aguja.
6. Se emplea una aguja 22G o 25G conectada a una extensión con llave de tres vías (stopcock) (por una el anestésico local y por otra el medio de contraste) y sujetada por un fórceps para mantener una visión coaxial (visión túnel). Se realizarán avances de 2 a 5 mm verificándolos con toma de imagen en el arco en c.
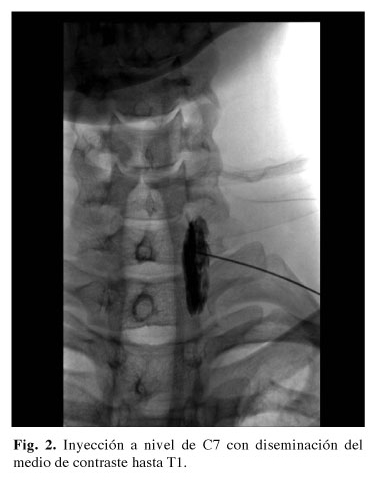
7. Cuando la superficie ósea sea encontrada se retirara ligeramente la aguja inyectando en tiempo real el medio de contraste el cual deberá mostrar un patrón paraespinal (fusiforme frecuentemente), no radicular ni intravascular, llegando hasta T1 (Fig. 2). Una toma lateral confirma la dispersión adecuada del medio de contraste. Inmediatamente se cambia el sentido de la llave de 3 vías y se inyecta el anestésico local (ropivacaína 0,5%, bupivacaína 0,5%) en alícuotas de 2 ml realizando aspiración constante, hasta un volumen de 10 ml máximo.

8. El paciente será trasladado a recuperación por un periodo de 30 a 60 minutos, para descartar la presencia de hematomas y verificar el cambio térmico de por lo menos 1 grado centígrado.
Ultrasonido
1. El paciente es posicionado ya sea en decúbito supino o en decúbito lateral para realizar una aproximación a longus colli, ya sea antero-posterior o postero-latero-anterior. Se emplea un transductor de alta frecuencia lineal de 8 a 12 MHz o en su defecto curvo pequeño de 5 a 10 MHz.
2. Se realizará un escaneo inicial para identificar las estructuras relevantes para la inyección guiada por ultrasonido, que incluyen: arteria carótida, vena yugular interna y tiroides. Se identificara la apófisis transversa de C6 que es reconocida por que su tubérculo anterior es prominente a diferencia de C5 que es plano y C7 en el cual la estructura está ausente. Encima de esta apófisis transversa se identifica una estructura muscular y su fascia respectiva lo que corresponde al músculo longus colli y la fascia cervical profunda. El uso de modo doppler identifica estructuras vasculares como los vasos tiroideos inferiores los cuales son una causa frecuente de hematoma y así mismo en el lado izquierdo identifica el esófago, el cual puede ser puncionado fácilmente (Fig. 4). Así mismo el empleo del doppler a nivel de C7 confirma la presencia de la arteria vertebral, disminuyendo por tanto la posibilidad de lesión.
3. Se realiza asepsia en piel de manera convencional y se esteriliza el transductor de acuerdo a la práctica institucional.
4. Se emplea una aproximación en plano (de manera ideal para ver la punta de la aguja en todo momento) o en su defecto fuera de plano. Esta última más empleada en individuos de índice de masa corporal aumentada en el que el trayecto lateral sea muy pronunciado.
5. Se emplea una aguja ecogénica o no, 22 G con conector a llave de tres vías semejante a lo empleado en la técnica fluoroscópica, pero se reemplaza el medio de contraste por solución salina. Idealmente se emplea "en plano" para poder ver la punta de la aguja en todo momento, pero la técnica de plano no está contra indicada. Se dirige la aguja hasta pasar la fascia cervical profunda por encima del longus colli y se inyecta 0,5 a 1 ml de solución salina, observándose una hidro disección alrededor del músculo, pero sin evidenciar inyección intramuscular. Si no se visualiza dicha disección la aguja deberá ser re posicionada por la posibilidad de estar intravascular. Después de verificar la disección se inyectan 5 ml de anestésico local (ropivacaína 0,5%, bupivacaína 0,5%).
6. El paciente será trasladado a recuperación por un periodo de 30 a 60 minutos, para descartar la presencia de hematomas y verificar el cambio térmico de por lo menos 1 grado centígrado.
Signos de bloqueo de ganglio estrellado exitoso
1. Incremento en la temperatura de por lo menos 1 grado centígrado. Es el signo más importante de la simpaticolisis cervical. Su presencia evidencia éxito en el procedimiento. Simpaticolisis adecuada no necesariamente se asocia a mejoría en el síntoma doloroso y por tanto un elemento es el éxito del bloqueo y otro es el resultado del mismo.
2. Presencia de síndrome de Horner: miosis, ptosis palpebral y enoftalmos.
3. Anhidrosis.
4. Congestión nasal y conjuntival.
5. Venodilatación.

Complicaciones y efectos secundarios
La presencia de síndrome de Horner, además de ser signo de éxito del bloqueo debe ser visto de alguna manera como efecto secundario. Así mismo la diseminación de anestésico local en los tejidos circundantes puede producir bloqueo de otras estructuras nerviosas.
Se destaca el bloqueo del nervio laríngeo recurrente produciendo disfonía y sensación de disfagia, dificultad para deglutir y sensación de disnea. Esta razón es la más importante para no realizar bloqueo estrellado de manera bilateral en un mismo procedimiento, por que el bloqueo bilateral del nervio laríngeo recurrente puede llevar a perdida de los reflejos faríngeos y compromiso respiratorio subsecuente. Otros nervios que se pueden bloquear con la inyección de anestésico local, incluyen las raíces del pleno braquial lo que lleva a un bloqueo somático, el cual altera la evaluación analgésica del paciente. Si este se presenta se deben dar instrucciones al paciente para evitar un trauma inadvertido por el bloqueo denso anestésico, semejante a lo que ocurre cuando se realiza un bloqueo de pleno braquial anestésico.
Las complicaciones mayores incluyen la inyección de anestésico local de manera inadvertida a nivel vascular con la asociada toxicidad que se asocia a convulsiones y toxicidad cardiovascular. Se destaca que las convulsiones se presentan de manera casi inmediata con bajas dosis de anestésico local (hasta 0,2 ml pueden presentarlas), por ser un vaso de alto flujo cerca del sistema nervioso central. De igual manera tienden a ser rápidas en resolución, pero de igual manera se debe proceder a realizar manejo semejante a cualquier toxicidad de anestésico local. Recientemente la ASRA publica sus guías para el empleo de lípidos en el escenario de toxicidad por anestésicos locales.
La otra toxicidad mayor que se presenta es el bloqueo neuroaxial. La forma más frecuente es inyección vía epidural, generalmente al entrar al foramen con una angulación antero lateral. Dependiendo del avance puede penetrarse la dura y aplicarse el anestésico local a nivel intra-tecal. El manejo de la complicación se fundamenta en el soporte de vía aérea, respiratorio y cardiovascular, incluyendo todas las maniobras pertinentes de reanimación cardiopulmonar disponibles.
Otras complicaciones incluyen la perforación y punción esofágica, la cual tiende a ser inadvertida en las técnicas a ciegas y por fluoroscopio, pero prevenida teóricamente por el empleo de ultrasonido. La punción tiroidea no supone en términos generales complicaciones, salvo las vasculares a expensas de los vasos tiroideos inferiores, los cuales como se menciono son una fuente frecuente de hematoma en cuello.
Puntos de interés y recomendaciones prácticas
1. Fluoroscopia vs. ultrasonido: es cada vez más evidente que realizar este tipo de inyección debe ser realizada bajo guía imagenológica y no a ciegas. El punto de discusión se traslada entonces a si se debe realizar bajo ultrasonido o bajo fluoroscopia. No existe aún la suficiente evidencia para que la práctica se cambie completamente a ultrasonido, siendo en este momento un nivel de evidencia III la literatura publicada. Pero simultáneamente se destaca que el empleo del ultrasonido se asocia a la identificación de estructuras de tejidos blandos y vasculares no identificables con el empleo de fluoroscopia. Así mismo la inyección fluoroscópica casi siempre se asocia a inyección intramuscular en algún grado, lo cual no es deseable. Finalmente el empleo de ultrasonido se asocia al empleo de mínimos volúmenes minimizando el bloqueo somático y del frénico potencialemente asociado al procedimiento.
2. Si piensa en cambiar su técnica de fluoroscopia a ultrasonido, se recomienda hacerlo de manera gradual, empleando las dos técnicas casi de manera simultánea y en individuos delgados (IMC inferiores a 30). En nuestro grupo este cambio se dio en un término de 6 meses y todas las inyecciones de ganglio estrellado son llevadas a cabo bajo ultrasonido.
3. Se recomienda la técnica "en plano" para visualizar la aguja durante la aproximación con ultrasonido para poder ver la punta de la misma durante todo el procedimiento. Si el operador esta familiarizado con la técnica "fuera de plano" la puede emplear.
4. El empleo de llaves de 3 vías (stopcock) es útil en ambas técnicas para evitar la inyección no intencional de anestésico local, principalmente a nivel vascular.
5. El empleo de la técnica oblicua en fluoroscopio, se puede asociar a una menor punción carotidea, pero no existe ningún trabajo aleatorio prospectivo que lo confirme o lo niegue.
6. Los volúmenes a emplear no deben ser mayores a 10 ml bajo fluoroscopia o 5 ml bajo ultrasonido, para disminuir el bloqueo del frénico y del pleno braquial. El mínimo volumen empleado, se asocia a cambio térmico y a menor severidad de síndrome de Horner.
7. No se justifica el empleo de esteroides al realizar el bloqueo.
8. Si el paciente presenta cambios que sugieren mantenimiento simpático del dolor, pero el bloqueo no fue exitoso ni produjo un impacto en el dolor del paciente, se debe replantear la técnica. Si fue en C6 con fluoroscopio intentar en C7 o pensar en inyección guiada por ultrasonido, siendo esta la preferida en nuestro grupo. Si la técnica inicial fue realizada por ultrasonido, debe recordar que hasta un 25% de las fibras simpáticas de miembro superior pueden viajar por medio de ramicomunicantes incluyendo fibras que se asocian a los nervios de Kuntz y por tanto la realizacion de simpaticolisis torácica puede ser la alternativa.
9. El empleo de técnicas tipo radiofrecuencia, son realizadas de manera semejante empleando el mismo tipo de ayuda imagenológica, recordando que si es realizada a nivel de C6, la lesión se produce realmente a nivel del ganglio cervical medio y el tronco simpático y no en el ganglio estrellado como tal.
10. El paciente al ser dado de alta del centro hospitalario, debe ser dado de alta con una escala visual análoga horaria el primer día, cada hora por 6 horas y diaria.
11. En presencia de síndrome doloroso regional complejo el paciente debe ser adherido después del procedimiento a un programa de rehabilitación intensiva, que va a incluir la repetición del bloqueo, la realización de un bloqueo continuo o una lesión con radiofrecuencia si hay respuesta positiva pero corta. No se recomienda por ningún motivo el empleo de soluciones neurolíticas a nivel estrellado por el alto riesgo de lesión de estructuras adyacentes.
Bibliografía
1. van Eijs F, Stanton-Hicks M, Van Zundert J, et al. Evidence-based interventional pain medicine according to clinical diagnoses. Complex regional pain syndrome. Pain Pract 2011;11:70-87. [ Links ]
2. Cha YD, Lee MH, Yoon YH, et al. Depth by ultrasound from skin surface to the C6 transverse process while applying pressure. Pain Med 2011;12:1026-31. [ Links ]
3. Janik JE, Hoeft MA, Ajar AH, Alsofrom GF, Borrello MT, Rathmell JP. Variable osteology of the sixth cervical vertebra in relation to stellate ganglion block. Reg Anesth Pain Med 2008;33:102-8. [ Links ]
4. Ates Y, Asik I, Ozgencil E, Açar HI, Yagmurlu B, Tekdemir I. Evaluation of the longus colli muscle in relation to stellate ganglion block. Reg Anesth Pain Med 2009;34:219-23. [ Links ]
5. Abdi S, Zhou Y, Doshi R, Patel N: Stellate ganglion block. Emphasis on the new oblique fluoroscopic approach. Tech in Reg Anesth Pain Management 2005;9:73-80. [ Links ]
6. Gofeld M, Bhatia A, Abbas S, Ganapathy S, Johnson M. Development and validation of a new technique for ultrasound-guided stellate ganglion block. Reg Anesth Pain Med 2009;34;475-9. [ Links ]
7. Rathmell, JP. Atlas of Image-Guided Intervention in Regional Anesthesia and Pain Medicine. Stellate Ganglion Block. Chapter 10. 1st Edition. Lippincott Williams & Wilkins 2006. [ Links ]
8. Narouze SN: Ultrasound-guided interventional procedures in pain management: Evidence-based medicine. Reg Anesth Pain Med 2010;35(Supl. 2):S55-S58. [ Links ]
9. Higa K, Hirata K, Hirota K, Nitahara K, Shono S. Retropharyngeal hematoma after stellate ganglion block: Analysis of 27 patients reported in the literature. Anesthesiology 2006;105:1238-45. [ Links ]
10. Feigl GC, Rosmarin W, Stelzl A, Weninger B, Likar R: Comparison of different injectate volumes for stellate ganglion block: an anatomic and radiologic study. Reg Anesth Pain Med 2007;33:203-8. [ Links ]
11. Neal JM, Mulroy MF, Weinberg GL. American society of regional anesthesia and pain medicine checklist for managing local anesthetic systemic toxicity: 2012 version. Reg Anesth Pain Med 2012;37:16-8. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Carlos Eduardo Restrepo-Garcés
Unidad de Alivio del Dolor
Clínica Las Américas
Medellín, Colombia
e-mail: Carlosedo75@gmail.com
Financiación: Ninguna
Conflicto de intereses: No declarados
Recibido: 05-10-11.
Aceptado: 08-12-11.