Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.19 no.4 Madrid jul./ago. 2012
La transición de dolor agudo postoperatorio a crónico: ¿qué sabemos?
The transition from acute to chronic postoperative pain: what we know?
H. Ribera, N. Esteve y J. P. Garrido
Servicio de Anestesia, Reanimación y Terapéutica del Dolor. Hospital Universitario Son Espases. Palma de Mallorca
Dirección para correspondencia
RESUMEN
La transición del dolor agudo postoperatorio a crónico es un proceso complejo, poco conocido y de interés creciente en los últimos años. Los cuadros dolorosos crónicos derivados de determinados procedimientos quirúrgicos como la toracotomía, la mastectomía o la amputación se asocian a una elevada prevalencia. Sin embargo, han sido identificados una serie de factores pronósticos o predictivos relacionados con la aparición de dichos cuadros dolorosos. Su detección precoz permitiría iniciar tratamientos analgésicos preventivos con el objetivo de evitar dicha transición.
Palabras clave: Factores predictivos. Dolor crónico postoperatorio. Dolor agudo postoperatorio.
ABSTRACT
The transition from acute to chronic postoperative pain is a complex process, little well known process and of increasing interest in the last years. Certain surgical procedures such as thoracotomy, mastectomy or amputation are associated to high prevalence of painfull chronic syndromes. Nevertheless, series of predictive factors have been identified in development of chronic postoperative pain. Its early detection would allow initiating analgesic preventive treatments with the aim of avoiding this transition.
Key words: Predictive factors. Chronic postoperative pain. Acute postoperative pain.
Introducción
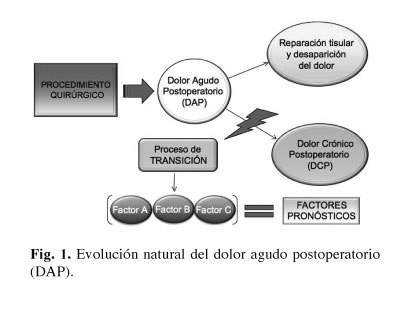
Toda intervención quirúrgica se asocia a un dolor agudo postoperatorio (DAP) cuya intensidad va disminuyendo durante los primeros días y semanas, paralelamente al proceso de reparación tisular. Sin embargo, en ocasiones dicho dolor perdura más tiempo de lo razonable en relación a la agresión quirúrgica (1). Este hecho puede conducir a la aparición de unos síndromes dolorosos crónicos severos e invalidantes, frecuentemente asociados a determinados procedimientos quirúrgicos.
La definición de dolor crónico postoperatorio (DCP) no encuentra un consenso entre los diferentes autores en la literatura revisada. Parece lógico pensar que cada procedimiento quirúrgico conlleva un periodo razonable de dolor agudo postoperatorio y cuya duración varía en función del tipo de cirugía. Sin embargo, la definición más comúnmente utilizada sigue siendo la de Mc Rae (2,3) basada en los siguientes aspectos: dolor tras un procedimiento quirúrgico, con una duración mínima de dos meses, que otras etiologías del dolor hayan sido excluidas y que haya sido descartada cualquier causa preexistente.
Este proceso de transición de dolor agudo a dolor crónico postoperatorio está mediado por una serie de factores pronósticos o predictivos (Fig. 1). La identificación preoperatoria de alguno de ellos nos permitiría predecir qué pacientes serían más susceptibles de sufrir dichos cuadros dolorosos crónicos y, además, se podrían llevar a cabo estrategias analgésicas multimodales perioperatorias con una finalidad preventiva.
En este artículo se pretende profundizar en la problemática actual que genera el dolor postoperatorio crónico mediante la revisión de su epidemiología, sus presentaciones clínicas y la descripción de los factores predictivos descritos en la literatura así como los métodos de prevención analgésica actuales.
Epidemiología
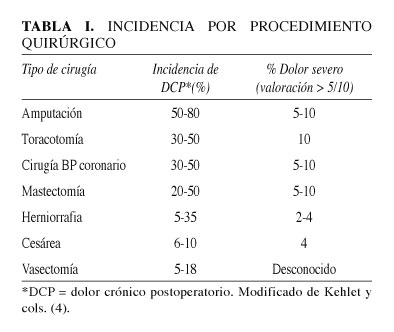
La incidencia DCP es elevada y de carácter variable en función del tipo de procedimiento quirúrgico (Tabla I). Los rangos de incidencia son amplios debido a la heterogeneicidad en la definición de DCP. Cuanto más amplia es la definición, mayor es el número de pacientes incluidos y viceversa. La amputación quirúrgica de miembros, la esternotomía, la toracotomía y la mastectomía son los procedimientos asociados a una mayor incidencia (4,5). La incidencia de dolor severo asociada a dichas cirugías oscila entre un 5-10%.
Llama la atención que la mayoría de los estudios publicados hacen referencia a la incidencia de DCP hasta el primer año de la cirugía. Tan solo cuatro trabajos hacen un seguimiento en un periodo superior de tiempo: dos tras la cirugía de herniorrafia a los 5 años (6,7) con una incidencia del 8-19% y dolor severo en un 1,8% y dos más a los 2 años de la amputación con una incidencia del 60% de dolor de miembro fantasma y un 21-57% de dolor de muñón (8,9).
Presentación clínica
Desde el punto de vista fisiopatológico existen dos tipos de DAP: el dolor inflamatorio y el neuropático. La implicación de cada uno de ellos va a resultar determinante en las características y severidad del cuadro doloroso cuando se produce la transición de DAP a DCP.
El dolor inflamatorio se produce en respuesta a la liberación de mediadores inflamatorios locales ante un estímulo doloroso. Dichas sustancias disminuirán el umbral de excitación de los nociceptores periféricos (sensibilización periférica) y generarán una despolarización neuronal que se transmitirá a través de las vías periféricas hasta el asta dorsal, magnificando la señal dolorosa (sensibilización central) hacia estructuras espinales y supraespinales. Por este motivo, el paciente presentará dolor en la zona de la cicatriz quirúrgica (hiperalgesia primaria) y alrededor de la misma (hiperalgesia secundaria). Dichos cambios son reversibles habitualmente y posteriormente se restaurará la sensibilidad normal del sistema nociceptivo. Este tipo de dolor se asocia normalmente a DAP, tiene un inicio conocido y un final en relación directa con la reparación tisular. Además, responde eficazmente a los antiinflamatorios no esteroideos, paracetamol y opioides menores o mayores.
Finalmente, el dolor neuropático se desarrolla tras una lesión de los nervios o de los sistemas transmisores sensitivos de la médula espinal y cerebro. Un factor clave en este tipo de dolor es la coexistencia de pérdida de sensibilidad con hipersensibilidad paradójica, que se traducen en la aparición de fenómenos sensitivos negativos (pérdida de sensaciones de tacto, temperatura o presión) y positivos (dolores espontáneos, disestesias, alodinia, hiperalgesia e hiperpatía). El diagnóstico definitivo de dolor neuropático se establecerá si se cumplen los siguientes requisitos: localización en una zona neroanatómica definida, existencia de una historia previa de lesión nerviosa, evidencia de pérdida sensitiva completa o parcial del área dolorosa y la confirmación de la lesión a través de una prueba específica. Este dolor, una vez establecido, probablemente será resistente a los mismos analgésicos mencionados anteriormente.
Los síndromes dolorosos crónicos postoperatorios se han asociado más frecuentemente a la percepción de dolores con características neuropáticas. Ello es debido probablemente a la lesión de alguna estructura nerviosa durante el acto quirúrgico generada por un corte, avulsión, contusión, retracción o estiramiento de la misma. Los tipos de cirugía asociados a este tipo de dolor son la toracotomía, mastectomía, la amputación o la cirugía de hernia inguinal. Las alteraciones neurológicas más frecuentemente asociadas a la toracotomía son las alteraciones electromiográficas intraoperatorias (10) y los cambios de los potenciales evocados en la cicatriz (11). En cambio, en la mastectomía, la cirugía de hernia inguinal y la osteotomía mandibular, la alteración neurológica más frecuente es la hipoestesia (12-14). Sin embargo, no siempre la presentación clínica del dolor tiene características neuropáticas y en ocasiones los pacientes relatan dolores de características neuropáticas sin haber existido una lesión nerviosa intraoperatoria evidente.
La implicación del dolor inflamatorio en el DCP parece mayor de lo que se pensaba en un principio. Por lo tanto, es posible que un dolor postoperatorio mantenido más allá de dos o tres meses de la cirugía sea debido a la incompleta reparación de los tejidos lesionados, a pesar de haber transcurrido un periodo razonable de recuperación. El problema radica en determinar en cuántos meses ciframos como "normal" ese tiempo de reparación tisular, ya que hay pacientes que se recuperan rápidamente y otros que no, a pesar de haber sido sometidos a técnicas quirúrgicas idénticas.
Descripción de los factores predictivos
Desde que en 1998 McRae acuñara el término "dolor crónico postoperatorio", el interés de la literatura científica ha ido creciendo de forma exponencial hasta el día de hoy, en forma de casos clínicos, estudios observacionales, algunos ensayos clínicos y revisiones recientes.
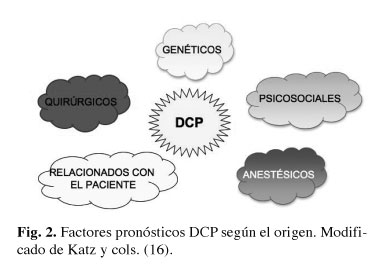
Dichos trabajos han permitido identificar una serie de factores pronósticos o predictivos (15,16), que se describen a continuación en función de dos tipos de criterios:
1. Según el periodo operatorio (Tabla II).
2. Según el origen (Fig. 2).
Factores quirúrgicos asociados a DCP
Los siguientes factores quirúrgicos se han asociado a una probabilidad elevada de desarrollar DCP: el incremento de la duración de la cirugía (17,18), la unidad quirúrgica de bajo volumen (19), el acceso abierto frente al laparoscópico (20), los puntos pericostales frente a los intracostales (21), la reparación herniaria convencional (20) y la lesión nerviosa intraoperatoria (22).
Factores psicosociales asociados a DCP
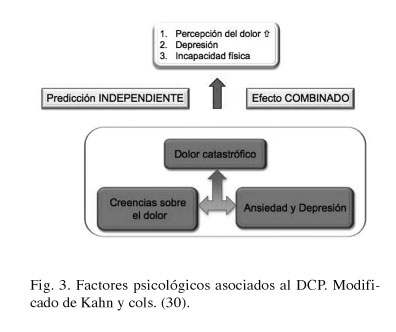
Recientemente ciertos investigadores han empezado a estudiar los factores de riesgo psicosociales en el desarrollo de DCP. Se han identificado los siguientes: la ansiedad preoperatoria incrementada (23), la personalidad introvertida (24), el menor soporte social y respuesta solícita en la primera semana después de la amputación (25,26), valoraciones elevadas concurrentes de hipersensibilidad emocional a los 6 y 12 meses (27), el miedo a la cirugía (18), la vulnerabilidad psíquica (28), la construcción mental cercana al neuroticismo (29) y el catastrofismo (27) (Fig. 3).
Especial atención merece el catastrofismo ("pain catastrophizing") puesto que está considerado por los expertos como el factor psicológico más importante asociado al dolor (30). Se define como aquel estado de expectación o preocupación acerca de las consecuencias negativas de una experiencia dolorosa actual o anticipada. Está construida sobre tres componentes cognitivos: la magnificación ("Tengo miedo de que algo serio va a pasar"), la rumiación ("No puedo dejar de pensar en cuánto duele") y la falta de ayuda ("No hay nada que pueda hacer para reducir la intensidad del dolor").
Factores relacionados con el paciente, asociados a DCP
La existencia previa de dolor (preoperatorio) concurrente o pasado parece ser uno de los factores más consistentes asociados a DCP (4,30) independientemente del tipo de intervención quirúrgica y de la duración de la misma. El dolor preoperatorio también es un factor de riesgo para el desarrollo de DAP inmediato (31), en los primeros días (32), en las primeras semanas (33) o a largo plazo (34,35). Además, la severidad del DAP en los días y semanas después de la cirugía predice el dolor tras el alta y es otro factor de riesgo para el desarrollo de DCP (36-38). Investigaciones recientes se han concentrado en la identificación de predictores experimentales preoperatorios para estratificar el riesgo de padecer DCP mediante el estudio de la valoración de la función neurofisiológica estática y dinámica (16). Los resultados más prometedores se han obtenido mediante el estudio de la valoración dinámica de la calidad del sistema inhibitorio endógeno mediante el "control difuso inhibitorio nocivo" o DNIC (39), aunque la valoración del sistema excitatorio también ha sido estudiado mediante la medición de la sumación temporal (40).
El sexo femenino (34,41) y las edades más jóvenes (34,37,42) también son predictivos de DCP, pero no posee la consistencia con la que el dolor predice el dolor, como hemos visto anteriormente. Queda por determinar qué aspecto/s del dolor relacionados con el paciente son determinantes en la predicción de DCP. Aunque existen muchas posibilidades y no excluyentes entre sí desde un punto de vista teórico, todavía no ha podido establecerse dicha asociación basada en una suficiente evidencia científica.
Factores anestésicos asociados a DCP
El DAP es el factor predictivo más relevante (40,42) sobre el cual la técnica anestésica utilizada puede resultar determinante en su evolución. Dicha asociación se ha demostrado en múltiples estudios, en todos los tipos de cirugía estudiados y es directamente proporcional a la intensidad y la duración del DAP. Es importante reseñar que la severidad del DAP durante los primeros 7 días después de la cirugía (mediana) parece mejor predictor que la valoración máxima de dolor obtenida (43).
No existe ningún estudio prospectivo que haya confirmado que ninguna técnica anestésica reduzca el riesgo de padecer DCP. Sí existen datos retrospectivos para la histerectomía (44) y la cesárea (45), que demuestran un efecto protector de la anestesia espinal respecto a la anestesia general.
Especial atención merece el concepto de "hiperalgesia inducida por opioides" y que abre un debate entre los anestesiólogos sobre el uso del remifentanilo endovenoso en las técnicas anestésicas. Ampliamente utilizado hoy en día, el remifentanilo es un potente agonista del receptor opioide μ de acción corta, que se inactiva rápidamente por las esterasas plasmáticas. Recientemente ha sido relacionado con el incremento paradójico del DAP en ratas (46,47) y en humanos (48-50) mediante la implicación de complejos mecanismos centrales y/o periféricos que alteran la sensibilización de la señal dolorosa. El factor más importante relacionado con este fenómeno parece ser la dosis de infusión. Concretamente, el factor crítico implicado en la hiperalgesia inducida por opioides es la concentración del opioide en el receptor μ (49). Recientemente, Salengros y cols. (52) ha publicado un estudio prospectivo y randomizado en el que 38 pacientes sometidos a toracotomía fueron divididos en dos grupos: el primero recibió dosis altas de remifentanilo y analgesia epidural postoperatoria; el segundo recibió dosis bajas de remifentanio y analgesia epidural durante el intraoperatorio y postoperatorio. No se hallaron diferencias estadísticamente significativas en la escala numérica durante las mediciones de las primeras 72 horas. La medición del área de alodinia pericicatricial con filamentos de Von Frey a las 24, 48 y 72 horas fue más amplia en el grupo de altas dosis de remifentanilo. Por último, el número de pacientes con DCP valorado con el cuestionario DN4 fue estadísticamente mayor en el grupo remifentanilo a altas dosis a los 1, 3, 6 y 9 meses.
Factores genéticos asociados a DCP
Supone un campo muy novedoso y poco conocido hasta la fecha. De hecho, no existen publicaciones sobre los genes que predisponen a la transición DAP-DCP. Sin embargo, sabemos que existen determinados polimorfismos genéticos (51,52) que se asocian a determinados cuadros de dolor crónico (Tabla III).
Los conocimientos actuales en este campo se basan en los estudios genéticos en animales. Concretamente, se han publicado trabajos que han estudiado la transmisión hereditaria en ratas con dolor neuropático y se han evaluado las diferencias genéticas en relación a rasgos relevantes de DCP en humanos (53). Se ha podido realizar también un mapeo de las regiones cromosómicas que albergan los genes relacionados con el DCP (54-56). Por último, se han identificado cientos de genes y proteínas en el ganglio dorsal y de la médula espinal en modelos de animales con DCP (56-59). Actualmente están identificados unos 240 genes de ratones con algún papel en modelos de dolor agudo y crónico, algunos relevantes en DCP y accesibles por Internet (60).
La existencia de dichos factores implicaría una asociación estadísticamente significativa entre un marcador genético y algún rasgo doloroso que caracterizara su DCP, normalmente un polimorfismo nucleótido simple próximo a dichos genes. Sin embargo, no existe consenso sobre qué rasgos del dolor deberían ser. La recogida de los mismos a través de cuestionarios multidimensionales nos permitiría la caracterización del dolor de cada paciente de la forma más detallada posible y aplicable a la práctica clínica diaria. Es fundamental tener en cuenta la variabilidad genética interindividual del DCP, de manera que probablemente existan diferentes genes que codifiquen cada aspecto del dolor: intensidad, frecuencia de cada episodio, características y otros más.
Métodos de prevención
Técnica quirúrgica
Parece razonable reconsiderar la cirugía ante determinados escenarios: por ejemplo, hernias asintomáticas en pacientes con antecedentes de DCP previos o síndromes hiperalgésicos (fibromialgia reumática o síndrome de colon irritable, por ejemplo).
La utilización del abordaje quirúrgico más adecuado y con menor asociación teórica con DCP es otro de los aspectos críticos a tener en cuenta por los equipos quirúrgicos. Como se mencionó anteriormente, el uso de la técnica laparoscópica frente a la abierta (5,6) y la utilización de malla (61) en la herniorrafia inguinal, la toracoscopia mínimamente invasiva (3,30) frente a la cirugía abierta o la toracotomía "sparing-muscle" (11) respecto al abordaje posterolateral para la preservación de los nervios intercostales en cirugía torácica. Las técnicas mínimamente invasivas en otras cirugías (nefrectomías o estereotomías, por ejemplo) deberían ofrecer beneficios parecidos.
Técnica anestésica-analgésica
Desde un punto de vista teórico, la sensibilización central y periférica podría inhibirse mediante la utilización de técnicas analgésicas preventivas mediante la combinación de analgésicos (analgesia mutimodal). Dichas técnicas atenuarían el impacto de las descargas nociceptivas periféricas asociadas a los estímulos quirúrgicos intraoperatorios y postoperatorios. Se ha estudiado que, desde un punto de vista farmacológico, una analgesia preventiva eficaz es aquella que es capaz de alargar la duración de la acción del analgésico más allá de 5,5 vidas medias (62). Desde un punto de vista práctico, la utilización de técnicas analgésicas preventivas preoperatorios se muestra eficaz en la mayoría de ocasiones, aunque no siempre es así ni sabemos por qué ocurre para el mismo tipo de cirugía.
Las técnicas de analgesia preventiva multimodal deberían seleccionarse en función del tipo de cirugía al que es sometido el paciente. A pesar de que los datos basados en estudios randomizados no son generalmente favorables (63-68), es recomendable la utilización de técnicas locorregionales analgésicas para la analgesia postoperatoria de forma precoz, siempre que exista una indicación precisa con el objetivo de disminuir la intensidad del DAP y, por lo tanto, minimizar la probabilidad de desarrollar un síndrome doloroso crónico. Las técnicas analgésicas basadas en el ahorro de opioides ("opioide-sparing", "opioid-free") intentan evitar o minimizar el desarrollo de la hiperalgesia inducida por opioides, a la vez que bloquean la entrada de los estímulos nociceptivos a través del bloqueo regional con anestésicos locales. Además, el uso simultáneo de antiinflamatorios no esteroideos (AINE) tiene como objetivo disminuir la concentración de prostaglandina E2, mediador clave en la sensibilización central y periférica desencadenada por la inflamación (69).
Otro campo de acción analgésica lo constituyen los fármacos antihiperalgésicos con capacidad para prevenir potencialmente la neuroplasticidad y, por lo tanto, la incidencia de dolor neuropático: ketamina, cuyo mecanismo de acción es la antagonización del receptor NMDA, o los ligandos alpha-2-delta gabapentina y pregabalina. Respecto a la ketamina endovenosa, recientemente se han publicado dos ensayos clínicos: Remerand y cols. (70) seleccionaron a 154 pacientes intervenido de prótesis total de cadera e hicieron un seguimiento durante 6 meses de los pacientes del grupo tratado con ketamina endovenosa frente a suero fisiológico, hallando una incidencia menor en dicho grupo de DCP en el primer y sexto mes. Sen y cols. (71) randomizaron en tres grupos a 60 pacientes sometidas a histerectomía para recibir gabapentina, ketamina o placebo. La incidencia de DCP en el primer, tercer y sexto mes fue menor en el grupo gabapentina que con ketamina o placebo. Otros ensayos clínicos (72,73) no han podido demostrar la eficacia preventiva de la ketamina endovenosa.
En cuanto a los ligandos alpha-2-delta gabapentina y pregabalina, han demostrado su eficacia en el control del DAP en la cirugía de artroplastia de rodilla, mastectomía, laminectomía, histerectomía y colectomía. En cuanto a la prevención del DCP, la pregabalina a dosis única preoperatoria no demuestra se eficacia en la mayoría de los estudios. Sin embargo, en un reciente ensayo clínico, la pregabalina administrada 15 días antes de la cirugía de prótesis total de rodilla reduce la incidencia de dolor neuropático a los 3 y 6 meses (8 y 15% respectivamente) y mejora la flexión activa de la rodilla a los 30 días (74).
Analgesia preventiva y síndromes dolorosos crónicos más frecuentes
Síndrome postamputación
En la década de los 90 la analgesia epidural perioperatoria con bupivacaína-morfina o bupivacaína-diamorfina no pudo demostrar su eficacia en la prevención del síndrome postamputación en tres estudios (Tabla IV). En el primero (75) se valoró la incidencia de dolor de miembro fantasma (DMF) en 60 pacientes tras la analgesia epidural continua de bupivacaína-morfina frente a suero fisiológico-analgesia convencional, iniciada 18 horas antes de la intervención y mantenida durante la amputación quirúrgica. En la valoración a los seis meses y al año, la incidencia de DMF en los dos grupos fue similar. En el segundo trabajo realizado por el mismo autor (76) se incluyeron 31 pacientes randomizados en dos grupos con los mismos tratamientos analgésicos y tampoco encontraron diferencias estadísticamente significativas en cuanto a sensibilidad mecánica, térmica, o proporción de alodinia e hiperpatía.
Lambert y cols. (77) realizaron un ensayo clínico aleatorio, a doble ciego, en 30 pacientes divididos en dos grupos: uno de ellos recibió una infusión epidural de bupivacaína-diamorfina iniciada 24 horas antes de la intervención y mantenida hasta el tercer día postoperatorio, frente a infusión continua epidural de bupivacaína durante el mismo periodo de tiempo. Los resultados mostraron un mejor control del dolor agudo postoperatorio en el primer grupo durante los tres primeros días después de la cirugía. Sin embargo, cuando los pacientes fueron evaluados a los 6 y a los 12 meses después de la intervención la incidencia de DMF fue similar en ambos grupos.
Sin embargo, recientemente se ha publicado un ensayo clínico (78) en el que la utilización de la analgesia epidural perioperatoria con bupivacaína y fentanilo se ha demostrado eficaz para disminuir la intensidad, la frecuencia y la prevalencia del DMF.
En los últimos años otros tratamientos analgésicos preventivos han sido evaluados y mostrado su eficacia: la gabapentina oral versus placebo (79) (en 1 de 3 ensayos clínicos) y el bloqueo axilar continuo con ropivacaína durante 7 días con nemantina oral versus placebo mantenido durante cuatro semanas. Dicho tratamiento fue eficaz en el primer mes y a los 6 meses después de la cirugía, pero no a los 12 meses (80). En cambio, la ketamina endovenosa intraoperatoria y mantenida 72 horas en el postoperatorio no ha demostrado poseer ninguna eficacia analgésica preventiva (81).
Por lo tanto, en el DMF la mayoría de estudios arrojan resultados negativos respecto a la analgesia epidural postoperatoria, puesto que no es capaz de bloquear las aferencias suficientes para prevenir la sensibilización central y la transmisión rostral de las aferencias dolorosas.
Síndrome postoracotomía
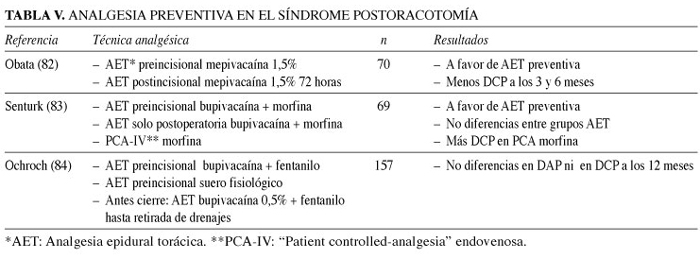
Los artículos revisados que tienen como objetivo principal la prevención del DCP valoran la eficacia de la analgesia epidural torácica (AET) y el momento de inicio en el periodo preoperatorio, intraoperatorio o postoperatorio inmediato. En general, los estudios muestran que el inicio preoperatorio es más efectivo tanto para el control del DAP como del DCP (Tabla V).
Obata y cols. (82) llevaron a cabo un estudio prospectivo, randomizado y a doble ciego en 70 pacientes divididos en dos grupos: el primero recibió AET con mepivacaína 1,5% veinte minutos antes de la incisión quirúrgica; el segundo recibió la misma analgesia al finalizar la intervención. El DAP fue menor en el primer grupo a las cuatro horas, segundo y tercer día después de la cirugía. En cuanto al DCP, la incidencia fue menor a los 6 meses en el primer grupo (33 vs 67%).
Senturk y cols. (83) compararon tres técnicas analgésicas: AET iniciada 30 minutos antes de la intervención con bupivacaína-morfina seguida de una infusión durante la cirugía y analgesia postoperatoria con la misma solución durante las primeras 48 horas; AET iniciada en el postoperatorio con la misma pauta analgésica y, por último, PCA de morfina intravenosa. El primer grupo presentó una menor intensidad de DAP en reposo, al toser o a la movilización. Además, 6 meses después de la intervención, la incidencia global de DCP fue del 62%, la mayor en el grupo PCA de morfina intravenosa (78%) y la menor en el grupo AET preoperatoria (45%), diferencias estadísticamente significativas.
Ochroch y cols. (84) realizaron un estudio randomizado con AET preincisional de bupivacaína-fentanilo vs suero fisiológico y no hallaron diferencias estadísticamente significativas en cuanto a eficacia analgésica ni en DAP ni en DCP a los 12 meses.
En resumen, aunque el síndrome post-toracotomía es bastante frecuente, la severidad y la duración del cuadro recogida en los estudios es muy variable, debido a las diferencias en el tiempo de seguimiento, los métodos de valoración del dolor y las definiciones utilizadas. Por lo tanto, aunque la evidencia es poco consistente, pensamos que hoy en día es recomendable la utilización de la analgesia epidural torácica en las toracotomías como tratamiento preventivo.
Síndrome postmastectomía
Fassoulaki y cols. es el grupo que mejor ha estudiado su prevención en tres publicaciones (Tabla VI). En el primer trabajo (85) aplicaron EMLA o bien placebo en el área esternal 5 minutos antes de la cirugía o EMLA en el área supraclavicular y axila al finalizar la intervención. Los primeros 4 días del postoperatorio también se les aplicó EMLA o placebo. En estas pacientes, la incidencia de DCP a los seis meses fue menor que en el grupo control, no encontrando diferencias significativas en los requerimientos de analgésicos utilizados en el tratamiento del dolor agudo postoperatorio (DAP). En un segundo estudio (86), compararon cuatro grupos de pacientes: infiltración local intraoperatoria de la zona mastectomizada con ropivacaína y mexiletina oral los primeros seis días del postoperatorio, infiltración local y placebo, suero fisiológico y mexiletina, o bien suero fisiológico y placebo. Los resultados mostraron que la combinación de técnicas analgésicas mejoró el control del DAP, pero no modificó la aparición de DCP aunque sí disminuyó las disestesias con la combinación de los dos tratamientos. En un último artículo del mismo grupo (87) las pacientes fueron asignadas aleatoriamente a tres grupos para recibir mexiletina oral (600 mg/día) durante diez días, gabapentina 1.200 mg/día durante el mismo periodo de tiempo o placebo. Ambos regímenes analgésicos disminuyeron los requerimientos de analgésicos en el postoperatorio inmediato, pero no modificaron la incidencia del DCP a excepción del dolor urente que fue más frecuente en el grupo placebo.
Bell y cols. (88) diseñaron un modelo clínico en la mamoplastia de reducción bilateral, de manera que a las mismas pacientes en una mama se infiltraba la herida quirúrgica con lidocaína y adrenalina y la otra con suero fisiológico y adrenalina (grupo control). Los resultados pusieron en evidencia mejor control del DAP cuando se infiltró con lidocaína, estadísticamente significativo, pero no se encontraron diferencias entre grupos respecto a la incidencia del DCP. Sin embargo, debido al reducido tamaño de la muestra, los resultados no pueden considerarse concluyentes.
En definitiva, en los ensayos clínicos revisados el uso de la analgesia preventiva con adyuvantes como la gabapentina, mexiletina así como la infiltración local pre e intraoperatoria con anestésicos locales no se muestran eficaces en la prevención del dolor crónico.
Conclusiones
Aunque existe cierta evidencia sobre la eficacia de la analgesia multimodal preventiva, todavía existen estudios contradictorios. Además, no sabemos qué pacientes se beneficiarán más de determinada técnica analgésica ni por qué. Cuando una determinada analgesia preventiva no se muestra eficaz, se desconoce todavía si es porque las dosis son insuficientes, a los cambios farmacocinéticos y/o farmacodinámicos, o porque el dolor preoperatorio ya establece una sensibilización central o que, finalmente, las diferencias genéticas entre los individuos puedan ser determinantes. Por último, no se conocen bien los mecanismos implicados cuando la analgesia preventiva es eficaz, es decir, todavía existe poca evidencia científica respecto a la sensibilización de la señal dolorosa.
La falta de información clínica concluyente impide la elaboración de recomendaciones basadas en la evidencia científica acerca de las mejores intervenciones preventivas o terapéuticas en el DCP. La causa principal es el diseño inadecuado de los estudios y la falta de estudios prospectivos que cubran un periodo de tiempo postoperatorio suficiente. En este sentido, la investigación deberá orientarse en un futuro hacia cada procedimiento quirúrgico y a los factores de riesgo específicos de los pacientes para poder extraer conclusiones aplicables a la práctica clínica diaria (89).
Mientras no se produzcan nuevas evidencias, una de las claves en la prevención del DCP es el tratamiento adecuado del DAP. Todas las técnicas anestésicas y analgésicas capaces de bloquear específicamente los impulsos de los estímulos nociceptivos a la médula espinal, potencialmente pueden contribuir a la disminución de la incidencia de DCP, aunque desconocemos todavía la magnitud de este efecto preventivo.
En los próximos años es previsible un importante desarrollo en investigación genética y su relación con los síndromes dolorosos crónicos postoperatorios. En este sentido, las expectativas futuras permitirían la identificación de las variaciones genéticas asociadas a DCP, la creación de nuevos métodos diagnósticos que nos permitan establecer un riesgo individualizado de padecer DCP, realización de predicciones pronósticas para la elección del mejor tratamiento individualizado, aplicar nuevos tratamientos analgésicos que generen una adecuada protección perioperatoria y, en el último escalón, la terapia génica nos permitirá anular los genes que conllevan el riesgo de padecer DCP (90).
Bibliografía
1. Voscopoulos C, Lema M. When does acute pain become chronic? Br J Anaesth 2010;105(Suppl 1):i69-85. [ Links ]
2. Macrae WA. Davies HTO. Chronic postsurgical pain. Epidemiology of pain. Seattle: IASP Press 1999. p. 125-42. [ Links ]
3. Macrae WA. Chronic pain after surgery. Br J Anaesth 2001;87:88-9. [ Links ]
4. Kehlet H, Jensen TS, Woolf CJ. Persistent postsurgical pain: risk factors and prevention. Lancet 2006:367:1618-25. [ Links ]
5. Akkaya T, Ozkan D. Chronic post-surgical pain. Agri 2009;21:1-9. [ Links ]
6. Grant AM, Scott NW, O'Dwyer PJ. Five-year follow-up of a randomized trial to assess pain and numbness alter laparoscopic or open repair of groin hernia. Br J Surg 2004;91:1570-4. [ Links ]
7. Aasvang EK, Bay-Nielsen M, Kehlet H. Pain and functional impairment 6 years alter inguinal herniorraphy. Hernia 2006;10:316-21. [ Links ]
8. Hanley MA, Jensen MP, Ehde DM, et al. Psychosocial predictors of long-term adjustment to lower-limb amputation and phantom limb pain. Disabil Rehabil 2004;26:882-93. [ Links ]
9. Jensen TS, Krebs B, Nielsen J, Rasmussen P. Inmediate and long-term phantom limb pain in amputees: incidente, clinical characteristics and relationship to pre-amputation limb pain. Pain 1985;21:267-78. [ Links ]
10. Rogers ML, Henderson L, Mahajan RP, Duffy JP. Preliminary findings in the neuropshysiological assessment of intercostal nerve injury during thoracotomy. Eur J Cardiothorac Surg 2002;21:298-301. [ Links ]
11. Benedetti F, Vighetti S, Ricco C, et al. Neurophysiologic assessment of nerve impairment in posterolateral and muscle-sparing thoracotomy. J Thorac Cardiovasc Surg 1998;115:841-7. [ Links ]
12. Mikkelsen T, Werner MU, Lassen B, Kehlet H. Pain and sensory dysfunction 6 to 12 months after inguinal herniotomy. Anesth Analg 2004;99:146-51. [ Links ]
13. Gottrup H, Andersen J, Arendt-Nielsen L, Jensen TS. Psycophysical examination in patients with post-mastectomy pain. Pain 2000;87:275-84. [ Links ]
14. Jääskeläinen SK. Clinical neurophisiology and quantitative sensory testing in the investigation of orofacial pain and sensory function. J Orofac Pain 2004;18:85-107. [ Links ]
15. Estebe JP. Incidence et facteurs de risque de la douleur chronique postchirurgicale. Ann Fr Anesth Reanim 2009;28, e71-4. [ Links ]
16. Katz J, Seltzer Z. Transition from acute to chronic postsurgical pain: risk factors and protective factors. Expert Rev Neurother 2009;9:723-44. [ Links ]
17. Kalso E, Mennander S, Tasmuth T, Nilsson E. Chronic post-sternotomy pain. Acta Anesthesiol Scand 2001;45:935-9. [ Links ]
18. Peters ML, Sommer M, de Rijke JM, et al. Somatic and psychologic predictors of long-term unfavorable outcome after surgical intervention. Ann Surg 2007;245:487-94. [ Links ]
19. Tasmuth T, Blomqvist C, Kalso E. Chronic post-treatment symptoms in patients with breast cancer operated in different surgical units. Eur J Surg Oncol 1999;25:38-43. [ Links ]
20. Liem MS, van Duyn EB, van der Graaf Y, von Vroonhoven TJ; Coala Trial Group. Recurrences after conventional anterior and laparoscopic inguinal hernia repair: a randomized comparison. Ann Surg 2003;237:136-41. [ Links ]
21. Cerfolio RJ, Price TN, Sale Bass C, Bartolucci AA. Intracostal sutures decrease the pain of thoracotomy. Ann Thorac Surg 2003;76:407-11. [ Links ]
22. Hayes C, Browne S, Lantry G, Burstal R. Neuropathic pain in the acute pain service: a prospective study. Acute Pain 2002;4:45-8. [ Links ]
23. Harden RN, Bruehl S, Stanos S, et al. Prospective examination and pain-related and psychological predictors of CRPS-like phenomena following total knee arthroplasty: a preliminary study. Pain 2003;106:393-400. [ Links ]
24. Borly L, Anderson IB, Bardram L, et al. Preoperative prediction model of outcome after cholecystectomy for symptomatic gallstones. Scand J Gastroenterol 1999;34:1144-52. [ Links ]
25. Hanley MA, Jensen MP, Ehde DM, et al. Psychosocial predictors of long-term adjustment to lower-limb amputation and phantom limb pain. Disabil-Rehabil 2004;26:882-93. [ Links ]
26. Jensen MP, Ehde DM, Hoffman AJ, et al. Cognitions, coping and social environtment predict adjustment to phantom limb pain. Pain 2002;95:133-42. [ Links ]
27. Katz J, Asmundson GJ, McRae K, Halket E. Emotional numbing and pain intensity predict the development of pain disability up to one year after lateral thoracotomy. Eur J Pain 2009;13:870-8. [ Links ]
28. Jorgenssen T, Teglbjerg JS, Wille-Jorgensen P, et al. Persisting pain after cholecystectomy. A prospective investigation. Scand J Gastroenterol 1991;26:124-8. [ Links ]
29. Perkins FM, Kehlet H. Chronic pain as an outcome of surgery. A review of predictive factors. Anesthesiology 2000;93:1123-33. [ Links ]
30. Kahn RS, Ahmed K, Blakeway E, et al. Catastrophizing: a predictive factor for postoperative pain. Am J Surg 2010;201:122-31. [ Links ]
31. Kalkman CJ, Visser K, Moen J, et al. Preoperative prediction os severe postoperative pain. Pain 2003;105:415-23. [ Links ]
32. Caumo W, Schmidt AP, Schneider CN, et al. Preoperative predictors of moderate to intense acute postoperative pain in patients undergoing abdominal surgery. Acta Anesthesiol Scand 2002;46:1265-71. [ Links ]
33. Thomas T, Robinson C, Champion D, et al. Prediction and assessment of the severity of post-operative pain and satisfaction with management. Pain 1998;75:177-85. [ Links ]
34. Hanley MA, Jensen MP, Smith DG, et al. Preamputation pain and acute pain predict chronic pain after lower extremity amputation. J Pain 2007;8:102-9. [ Links ]
35. Gerbershagen HJ, Ozgür E, Dagtekin O, et al. Preoperative pain as a risk factor for chronic post-surgical pain -six-month follow-up after radical prostatectomy. Eur J Pain 2009;13:1054-61. [ Links ]
36. Poleshuck EL, Karz J, Andrus CH, et al. Risk factors for chronic pain following breast cancer surgery: a prospective study. J Pain 2006;7:626-34. [ Links ]
37. Hanley MA, Jensen MP, Smith DG, et al. Preamputation pain and acute pain predict chronic pain after lower extremity amputation. J Pain 2007;8:102-9. [ Links ]
38. Gottschalk A, Ochroch EA. Clinical and demographic characteristics of patients with chronic pain after mayor thoracotomy. Clin J Pain 2008;24:708-16. [ Links ]
39. Yarnitsky D, Crsipel Y, Eisenberg E, et al. Prediction of chronic post-operative pain: pre-operative DNIC testing identifies patients at risk. Pain 2008;138:22-8. [ Links ]
40. Schnabel A, Pogatzky-Zahn E. Predictors of chronic pain following surgery. What do we know? Schmertz 2010;24:517-31;quiz 532-3. [ Links ]
41. Kalkman CJ, Visser K, Moen J, et al. Preoperative prediction of severe postoperative pain. Pain 2003;105:415-23. [ Links ]
42. McRae WA. Chronic post-surgical pain: 10 years on. Br J Anaesth 2008;101:77-86. [ Links ]
43. Bisgaard T, Klaslkov B, Rosenberg J, Kehlet H. Characteristics and prediction of early pain after laparoscopy choleciystectomy. Pain 2001;90:261-9. [ Links ]
44. Brandsborg B, Nikolajsen L, Hansen CT, et al. Risk factors for chronic pain after hysterectomy: a nationwide questionnaire and database study. Anesthesiology 2007;106:1003-12. [ Links ]
45. Nikolajsen L, Sorensen HC, Jensen TS, Kehlet H. Chronic pain following caesarean section. Acta Anaesthesiol Scand 2004;48:111-6. [ Links ]
46. Celerier E, González JR, Maldonado R, et al. Opioid-induced hyperalgesia in a murin model of postoperative pain: role of niric oxide generated from the inducible nitric oxide synthase. Anesthesiology 2006;104:546-55. [ Links ]
47. Cabañero D, Campillo A, Célérier E, et al. Pronociceptive effects of remifentanil in a mouse model of postsurgical pain: effect of a second surgery. Anesthesiology 2009;111:1344-5. [ Links ]
48. Joly V, Richebe P, Guignard B, et al. Remifentanil-induced postoperative hyperalgesia and its prevention with small-dose ketamine. Anesthesiology 2005;103:147-55. [ Links ]
49. Schmidt S, Bethge C, Förster MH, Schäfer M. Enhanced postoperative sensitivity to painful pressure stimulation after intraoperative high dose remifentanil in patients without significant surgical site pain. Clin J Pain 2007;23:605-11. [ Links ]
50. Salengros JC, Huybrechts I, Ducart A, et al. Different anesthetis techniques associated with different incidences of chronic posy-thoracotomy pain: low-dose remifentanil plus presurgical epidural analgesia is preferable to high-dose remifentanil with postsurgical epidural analgesia. J Cardiothorac Vasc Anesth 2010;24:608-16. [ Links ]
51. Foulkes T, Wood JN. Pain genes. PloS Genet 2008 Jul 25; 4(7),e1000086. [ Links ]
52. Seltzer Z, Mogil JS. Pain and genetics. Quintessence Publ., IL, USA 2008. p. 69-75 [ Links ]
53. Mogil JS. The genetics of pain. IASP Press WA, USA 2004. [ Links ]
54. Seltzer Z, Wu T, Max HB, Diehl SR. Mapping a gene for neuropathic pain-related behavior following peripheral neurectomy in the mouse. Pain 2001;93:101-6. [ Links ]
55. Devor M, Gilad A, Arbilly M, et al. Sex-specific variability and a cage-effect independently mas a neurpathic pain quantitative trait locus detected in a whole genome scan. Eur J Neurosci 2007;26:681-8. [ Links ]
56. Costigan M, Samad TA, Allchorne A, et al. High basal expression and injury-induced down regulation of two regulatorof G-protein signaling transcripts, RGS3 and RGS4 in primary sensory neurons. Mol Cell Neurosci 2003;24:106-16. [ Links ]
57. Lacorix-Fralish ML, Tawfik VL, Tanga FY, et al. Differential spinal cord gene expression in rodent models of radicular and neuropathic pain. Anesthesiology 2006;104:1283-92. [ Links ]
58. Mechaly I, Bourane S, Piquemal D, et al. Gene profiling during development and after a peripheral nerve traumatism reveals genes specifically induced by injury in dorsal root ganglia. Mol Cell Neurosci 2006;32:217-29. [ Links ]
59. Rodríguez Parkitna J, Korostynski M, Kaminska-Chowaniec D, et al. Comparison of gene expression profiles in neuropathic and inflammatory pain. J Physiol Pharmacol 2006;57:401-14. [ Links ]
60. Pain genetics laboratory. http://paingenetics.ca/4105/06_02_pain_genetics_database.asp. [ Links ]
61. O'Dwyer PJ, Kingsnorth AN, Molloy RG, et al. Randomised clinical trial assessing impact of a lightweight or heavyweight mesh on chronic pain after hernia repair. Br J Surg 2005;92:166-70. [ Links ]
62. Katz el al. Preventive analgesia and beyond: current status, evidence and futures directions. In: Macintyre PE (editor). Clinical Pain Management: Acute Pain. UK 2008. p. 154-98. [ Links ]
63. Brennan TJ, Kehlet H. Preventive analgesia to reduce wound hyperalgesia and persistent postsurgical pain. Anesthesiology 2005;103:681-3. [ Links ]
64. Moiniche S, Kehlet H, Dahl JB. A qualitative and quantitative systematic review of preemptive analgesia for postoperative pain relief: the role of timing of analgesia. Anesthesiology 2002;96:725-41. [ Links ]
65. Ong CKS, Lirk P, Seymour R, Jenkins BJ. The efficacy of preemptive analgesia for acute posoperative pain management: a meta-analysis. Anesth Analg 2005;100:757-73. [ Links ]
66. Gottschalk A, Smith DS, Jobes DR, et al. Preemptive epidural analgesia and recovery from radical postatectomy: a randomized controlled trial. JAMA 1998;279:1076-82. [ Links ]
67. Katz J, Cohen L. Preventive analgesia is associated with reduced pain disability 3 weeks but not 6 months after mayor gynecologic surgery by laparotomy. Anesthesiology 2004;101:169-74. [ Links ]
68. Reuben SS. Preventing the development of complex regional pain syndrom after surgery. Anesthesiology 2004;5:1215-24. [ Links ]
69. Grosu I, de Kock M. New concepts in acute pain management: strategies to prevent chronic postsurgical pain, opioid-induced hyperalgesia, and outcome measures. Anesthesiol Clin 2011;29:311-27. [ Links ]
70. Remerand F, Le Tendre C, Baud A, et al. The early and delayed analgesic effects of ketamine after total hip asthroplasty: a prospective, randomized, controlled, double-blinded study. Anesth Analg 2009;109:1963-71. [ Links ]
71. Sen H, Sizlan A, Yanarates O, et al. A comparison of gabapentin and ketamine in acute and chronic pain after hysterectomy. Anesth Analg 2009;109:1645-50. [ Links ]
72. Crousier M, Cognet V, Khaled M, et al. Effect of ketamine on prevention of postmastectomy chronic pain. A pilot study. Ann Fr Anesth Reanim 2008;27:987-93. [ Links ]
73. Dualé C, Silbaud F, Guastella V, et al. Perioperative ketamine does not prevent chronic pain after thoracotomy. Eur J Pain 2009;13:497-505. [ Links ]
74. Buvanendran A, Kroin JS, Della Valle CJ, et al. Perioperative oral pregabaline reduces chronic pain after total knee arthroplasty: a prospective, randomized, controlled trial. Anesth Analg 2010;110:199-207. [ Links ]
75. Nikolajsen L, Ilkjaer S, Christensen JH, et al. Randomised trial of epidural bupivacaine and morphine in prevention of stump and phantom pain in lower-limb amputation. Lancet 1997;350:1353-7. [ Links ]
76. Nikolajsen L, Ilkjaer S, Jensen TS. Effect of preoperative extradural bupivacaine and morphine on stump sensation in lower limb amputees. Br J Anaesth 1998;81:348-54. [ Links ]
77. Lambert AW, Dashfield AK, Cosgrove C, et al. Randomized prospective study comparing preoperative epidural and intraoperative perineural analgesia for the prevention of postoperative stump and phantom limb pain following major amputation. Reg Anesth Pain Med 2001;26:316-21. [ Links ]
78. Karanikolas M, Aretha D, Tsolakis I, et al. Optimized perioperative analgesia reduces chronic phantom limb pain intensity, prevalence, and frequency: a prospective, randomized, clinical trial. Anesthesiology 2011;114:1144-54. [ Links ]
79. Bone M, Critchley P, Buggy DJ. Gabapentin in postamputation phantom limb pain: a randomized, double-blind, placebo-controlled, cross-over study. Reg Anesth Pain Med 2002;27:481-6. [ Links ]
80. Schley M, Topfner S, Wiech K, et al. Continous brachial plexus blockade in combination wit the NMDA receptor antagonist nemantine prevents phantom pain in acute traumatic upper limb amputees. Eur J Pain 2007;11:299-308. [ Links ]
81. Hayes C, Armstrong-Broen A, Burstal R. Perioperative intravenous ketamine infusion for the prevention of persistent post-amputation oain: a randomized, controlled trial. Anaesth Intensive Care 2004;32:330-8. [ Links ]
82. Obata H, Saito S, Fujita N, et al. Epidural block with mepivacaine before surgery reduces long-therm post-thoracotomy pain. Can J Anaesth 1999;46:1127-32. [ Links ]
83. Sentürk M, Ozcan PE, Talu GJ, et al. The effects of three different analgesia tecniques on long-term post-thoracotomy pain. Anesth Analg 2002;94:11-5. [ Links ]
84. Ochroch EA, Gottschalk A, Augostides J, et al. Long-term pain and activity during recovery from major thoracotomy usind thoracic epidural analgesia. Anesthesiology 2002;97:1234-44. [ Links ]
85. Fassoulaki A, Sarantopoulus C, Melemini A, Hogan Q. EMLA reduces acute and chronic pain after breast surgery for cancer. Reg Anesth Pain Med 2000;25: 350-5. [ Links ]
86. Fassoulaki A, Sarantopoulus C, Melemini A, Hogan Q. Regional block and mexiletine: the effect on pain after cancer breast surgery. Reg Anesth Pain Med 2001;26:223-8. [ Links ]
87. Fassoulaki A, Patris K, Sarantopoulus C, Hogan Q. The analgesic effect of gabapentin and mexiletine after breast surgery for cancer. Anesth Analg 2002;95:985-91. [ Links ]
88. Bell RF, Sivertsen A, Mowinkel P, Vindenes H. A bilateral clinical model for the study of acute and chronic pain after breast-reduction surgery. Acta Anaesthesiol Scan 2001;45:576-82. [ Links ]
89. Kehlet H, Rathmell JP. Persistent postsurgical pain: the path forward through better design of clinical studies. Anesthesiology 2010;112:514-5. [ Links ]
90. Seltzer Z, Dorfman R. Identifying genetic and environmental risk factors for chronic orofacial pain syndromes: human models. J Orofoac Pain 2004;18:311-7. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
H. Ribera.
Servicio de Anestesia, Reanimación y Terapéutica del Dolor.
Hospital Universitario Son Espases.
Palma de Mallorca
e-mail: www.h.ribera@hotmail.com
Financiación: Ninguna
Conflicto de intereses: No declarados
Recibido: 19-12-11.
Aceptado: 25-02-12.