Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.19 no.6 Madrid nov./dic. 2012
¿Es la Buprenorfina una buena opción en el manejo de dolor postoperatorio?
Buprenorphine is a good choice in postoperative pain management?
J. V. Pergolizzi Jr.1, R. Taylor Jr.2, R. Plancarte3, D. Bashkansky y E. Muniz4
1Departamento de Medicina, Johns Hopkins University School of Medicine, Baltimore, MD y Departamento de Anestesiología, Georgetown University School of Medicine, Washington, D.C.
2NEMA Research Inc., Naples, FL
3Manejo Intervencionista del Dolor y Cuidados Paliativos, UNAM
4Bonita Springs, FL
5Laboratorio Raffo S.A., Munro, Buenos Aires. Argentina
Dirección para correspondencia
RESUMEN
Antecedentes: El dolor es uno de los eventos más temidos por los pacientes después de una cirugía, y en la actualidad el manejo del dolor es subóptimo. La falta de control del dolor agudo postoperatorio puede tener una serie de consecuencias que afectan a los aspectos físicos y emocionales de los pacientes. El manejo habitual del dolor postoperatorio se basa en la utilización de opioides, pilar de tratamiento desde hace muchos años. Sin embargo, el uso de opioides puede tener riesgos moderados, como son las náuseas y vómitos, mareos y constipación, o riesgos más severos que incluyen a la inmunosupresión y depresión respiratoria.
Objetivo: Para poder determinar algunos de los factores circundantes del dolor postoperatorio, se realizó una reunión cumbre internacional en la que un grupo de líderes de opinión analizó las prácticas habituales de manejo de dolor postoperatorio. Uno de los temas abordados fue el rol de la buprenorfina en el manejo del dolor perioperatorio, y la información discutida se presenta a lo largo de este artículo.
Conclusión: La buprenorfina ha demostrado ser eficaz y segura en muchos modelos de dolor postoperatorio. Su versatilidad de administración, sus efectos secundarios manejables y su posibilidad de ser combinada con otros analgésicos hacen que la buprenorfina sea exitosa en el manejo del dolor perioperatorio.
Palabras clave: Buprenorfina. Dolor. Perioperatorio. Opioide. Dolor agudo.
ABSTRACT
Background: Pain is one of the most feared outcomes of surgery by patients, yet current practices of pain management are suboptimal. Failure to address acute postoperative pain can have a variety of consequences that affect physical and psychological aspects of the patient. Current perioperative pain management normally consists of opioid therapy, which has been a mainstay for many years. However, use of opioids can have moderate risks, including nausea/vomiting, dizziness, and constipation, or more severe risks, including respiratory depression and immunosupression.
Aim: In order to address some of the issues surrounding perioperative pain management, a group of key opinion leaders gathered at an international summit to analyze the current practices of perioperative pain management. One of the topics focused on buprenorphine's role in perioperative pain and the information discussed is presented throughout this article.
Conclusion: Buprenorphine has been demonstrated to be effective and safe in many postoperative pain models. Its administration versatility, its manageable side effects, and its use in combination with other analgesics allow buprenorphine therapy to be successful in perioperative pain management.
Key words: Buprenorphine. Pain. Perioperative. Opioid. Acute pain.
Introducción
Objetivo de la conferencia
Un grupo multidisciplinario de expertos en el área de manejo del dolor y anestesia se reunió en Cancún, México en Abril de 2011 por la 1ra Reunión Cumbre Internacional de Anestesia. El objetivo de la reunión fue discutir factores relacionados con el manejo perioperatorio de los pacientes. Durante la conferencia, las áreas que fueron cubiertas incluyeron el alivio del dolor perioperatorio, náuseas y vómitos postoperatorios y medicaciones para el manejo de los efectos secundarios.
Dolor postoperatorio y complicaciones
El dolor es una experiencia sensorial y emocional displacentera e inevitable que con frecuencia se presenta en el periodo perioperatorio. Cuando se les solicita a los pacientes que establezcan un ranking de las consecuencias más indeseables de la cirugía, los pacientes (1) mencionan el dolor y consideran el alivio del mismo dentro de los 5 factores de mayor importancia. Los médicos sostienen que el dolor es la consecuencia más indeseable. Al consultarle a los pacientes como distribuirían U$S 100 para el manejo de 10 eventos postoperatorios, alrededor del 30% fue asignado a prevenir el dolor y a despertar sin dolor (1). Los pacientes desean asignar gran parte de los recursos a la prevención del dolor debido a que 77% ha sufrido dolor en el postoperatorio y de ellos, aproximadamente 72% ha sido de moderado a severo (2). Sufrir dolor postoperatorio ha sido una preocupación para los pacientes antes de someterse a una cirugía. En encuestas sobre preocupaciones de los pacientes antes de una cirugía realizadas en 1995 y en 2003, alrededor del 60% de los encuestados rankearon al dolor como preocupación número 1 (2,3).
Por todo esto, el entendimiento del dolor y el establecimiento de prácticas de manejo del dolor son un deseo de los pacientes y una necesidad en el ámbito perioperatorio.
Comprender el desarrollo del dolor es esencial para el diseño de estrategias adecuadas de manejo. Los procedimientos quirúrgicos generalmente producen un bombardeo aferente de señales que a su vez pueden generar respuestas inflamatorias no beneficiosas (4). Además, estas señales pueden iniciar cambios en el Sistema Nervioso Central y Periférico que llevan a la amplificación y prolongación del dolor postoperatorio (4). El fracaso en entender y tratar el dolor agudo puede provocar una serie de consecuencias que someten al paciente a un mayor riesgo o disconfort y por, sobre todo, reducir la satisfacción general (5,6).
El dolor no aliviado puede incrementar la actividad simpática, aumentar el miedo y la ansiedad y también aumentar la respiración superficial o entrecortada. Estos síntomas pueden desencadenar hipertensión o taquicardia, falta de sueño y/o sensación de desamparo, atelectasia, hipercarbia, algunos de los cuales pueden derivar en condiciones clínicas de mayor riesgo de vida, como la isquemia miocárdica, infección, neumonía y dificultad en la rehabilitación.
En suma, el dolor agudo no tratado puede generar una activación de la sensibilización central y periférica que puede llevar a la instalación de un dolor crónico.
La transición de dolor agudo a crónico no está totalmente entendida, pero requiere de la remodelación de la cascada nociceptiva y del comportamiento, que se produce normalmente en el dolor agudo (7).
El dolor agudo gatillado por lesión tisular puede interpretarse como la fase inicial de una extensa respuesta nociceptiva que incluye liberación de neurotransmisores, respuestas electrofisiológicas, respuestas intracelulares por estrés, respuestas estructurales y neurofisiológicas (8).
Esta cascada tiene el potencial de abarcar órdenes de magnitud espacial y temporal, pero generalmente desaparece en semanas. Una respuesta individual durante meses, después de una injuria transitoria, puede ser determinada por procesos que ocurrieron dentro del primer día de la lesión. Como ocurre con otros complejos sistemas dinámicos, pequeñas diferencias en el estado inicial del paciente, y la intensidad, calidad y significado del estímulo nociceptivo pueden provocar grandes diferencias en la forma en la que este proceso se desenvuelve. Si la supresión de la respuesta dolorosa no fue movilizada a lo largo del proceso de amplificación del dolor, aún una mínima lesión puede progresar hacia dolor crónico (8).
El dolor crónico no aliviado no solo puede provocar problemas fisiológicos y psicológicos, sino que además tiene un impacto económico y médico agregado. La cantidad de cirugías ambulatorias que se realiza en EE.UU. se ha incrementado de manera constante en la última década (9).
Actualmente, 65% de todos los procedimientos quirúrgicos se realizan de forma ambulatoria, pero este porcentaje se incrementa cada año (10). La desviación hacia el cuidado ambulatorio ha generado preocupación sobre morbilidad inesperada en los pacientes, consultas hospitalarias no planificadas, internamiento postcirugía ambulatoria, y costos adicionales. Cuando un paciente es internado después de una cirugía ambulatoria, se considera un internamiento no programado y en general resulta en un internamiento prolongado. Estos internamientos no programados debido a dolor son muy costosos para el hospital, los pacientes y los seguros de salud. Los costos extras habitualmente superan los miles de dólares. El dolor es responsable del 38% de los internamientos no programados y reinternamientos después de una cirugía ambulatoria, con un coste medio de $1,869 ± $4,553 por visita (9).
Una mejor calidad de atención en el área de manejo del dolor tendría un impacto en la reducción de costes de salud, además de mejorar la satisfacción de los pacientes.
Las prácticas actuales no están optimizadas para aliviar el dolor. Los médicos pueden estar creando de manera inconsciente "barreras" que impiden el manejo adecuado del dolor (11,12).
Derribar estas barreras y promover una adecuada evaluación del dolor es esencial para lograr un buen alivio del mismo, recuperación, aseguramiento de calidad y finalmente la mejora en la funcionalidad y calidad de vida de los pacientes. Algunas de estas barreras incluyen la falta de entrenamiento especializado en técnicas de manejo del dolor, que incluyen el uso adecuado de analgésicos opioides y no opioides o anestesia regional postoperatoria. Agregado a esto, algunos médicos pueden no tener conocimiento sobre lo rápido que evoluciona el entendimiento de la percepción del dolor y por esto ser resistentes a cambiar sus métodos de tratamiento (11,12). Para que el tratamiento del dolor sea exitoso, los médicos deben seguir una serie de pasos simples, además de considerar al dolor como el quinto signo vital (13,14). La evaluación de la fuente (incisional, neurogénico, muscular, óseo) y la naturaleza (agudo vs. crónico) del dolor debe ser llevado a cabo con el uso combinado de escalas de valoración. Además, una historia clínica exhaustiva y un examen físico general tienen que ser realizados junto con la documentación del tiempo y severidad del dolor.
Mecanismos de dolor agudo
El dolor agudo ha sido definido como "la respuesta normal y fisiológica esperada ante un estímulo adverso químico, mecánico o térmico... asociado con cirugía, trauma o enfermedades agudas" (8). La provocación de una respuesta dolorosa normalmente sigue una vía general y varía discretamente en relación al tipo de estímulo. Amenazas a la integridad de los tejidos de origen térmico, mecánico o químico hacen que las neuronas nociceptivas incrementen su frecuencia de descarga, mientras que el dolor agudo asociado a una lesión tisular postoperatoria puede adicionalmente llevar a la liberación de mediadores inflamatorios (prostaglandinas, bradiquinina, 5-HT, etc.) (15). Estos mediadores pueden activar nociceptores periféricos los que a su vez inician la transducción a nivel del sistema nervioso central y la inflamación neurogénica (vasodilatación y extravasación plasmática). Los estímulos agudos son transmitidos por fibras Aδ y C hacia el asta dorsal de la médula espinal y los impulsos viajan a través de los haces espinotalámicos y espinoreticulares hacia los centros más superiores en el sistema nervioso central para generar la percepción del dolor (16). Comprender los componentes químicos y los sistemas involucrados en la formación de las señales dolorosas puede ayudar en la adecuada selección de medicaciones analgésicas.
Opioides
La utilización adecuada y segura de los opioides en el manejo del dolor postoperatorio requiere de la educación, tanto de médicos como pacientes sobre una apropiada transición desde los analgésicos opioides a los no opioides. Todos los atributos positivos de los opioides presuponen que los pacientes no continuarán utilizándolos cuando el dolor moderado a severo ha cedido.
Los opioides han sido una de las herramientas más importantes dentro del armamento terapéutico para tratar el dolor agudo. Tienen la versatilidad de poder ser administrados de diferentes formas (Tabla I). Más importante aún, los agonistas opioides producen muy buena analgesia principalmente mediante la interacción con receptores mu centrales y periféricos, pero también a través de su interacción con receptores kappa y delta. Estos receptores son esenciales en la génesis del dolor agudo y por ello son excelentes blancos para el manejo del dolor. Uniéndose a estos receptores, los agonistas opioides inhiben la transmisión de impulsos nociceptivos desde la periferia hacia la médula espinal y pueden activar las vías descendentes inhibitorias que modulan la transmisión del dolor. Además, los opioides pueden modificar la actividad dentro del sistema límbico, un área del cerebro involucrada en la "interpretación" del dolor (componentes, afectivo y sensorial-discriminativo). En conjunto, los opioides son muy eficaces para enlentecer o frenar la transmisión del dolor percibido (17-19).
Mientras que los opioides brindan analgesia principalmente mediante su unión a receptores centrales localizados en el cerebro y la médula espinal, también activan receptores opioides centrales y periféricos localizados en el sistema entérico, que producen disfunción intestinal por opioides (20,21). La activación de receptores mu en las terminaciones nerviosas del plexo mientérico inhibe la actividad neural responsable de la peristalsis, resultando en una disminución en el tránsito intestinal (20,21). Los receptores opioides submucosos además reducen la secreción intestinal y contribuyen a provocar íleo. Agregado a esto, los opioides endógenos liberados durante la cirugía podrían exacerbar aún más el íleo postoperatorio (20,21). La eficacia de los opioides varía de un individuo a otro. Hay numerosos factores que contribuyen a esta variabilidad en la respuesta (22). Algunos de estos factores incluyen:
- Exposición previa: podría desarrollarse dependencia física (conocida como tolerancia).
- Genética: el polimorfismo de los receptores mu y la capacidad para tolerar y metabolizar opioides es heredado en forma parcial.
- Tipo de cirugía: diferencias en el tipo de trauma y manipulación de sistemas en el organismo.
- Etnia: el metabolismo de fármacos puede variar entre diferentes grupos étnicos.
- Función hepática y renal: la capacidad para metabolizar y eliminar medicaciones y sus metabolitos.
- Género: variaciones en tolerabilidad entre hombres y mujeres.
- Dolor preexistente/severidad de dolor: puede amplificar la capacidad de los pacientes para tolerar el dolor.
- Edad: se asocia con insuficiencia hepática y renal.
- Forma de administración: variaciones en la concentración plasmática y velocidad en la que la Cmax se obtiene.
La mayoría de los opioides utilizados en la clínica son relativamente selectivos para los receptores mu. Sin embargo, drogas que son relativamente selectivas a dosis estándar interactuarán con subtipos adicionales de receptores cuando se las administra a dosis suficientemente altas, pudiendo llevar a cambios en su perfil farmacológico.
Estas diferencias pueden provocar variabilidad en la respuesta, diferencias en el perfil de efectos secundarios, tolerancia cruzada incompleta, y la utilidad clínica y eficacia de la rotación de opioides (23).
Debido a la variabilidad entre pacientes, el monitoreo de quienes reciben opioides es esencial. Generalmente los opioides afectan a múltiples aspectos del sistema nervioso central. Los efectos basales entre los diferentes opioides son similares (Tabla II). Frecuencia cardiaca, respiración, motilidad gastrointestinal, etc., se ven disminuidos. Si el receptor kappa es activado, se puede provocar cierta agitación con tensión arterial elevada. Se debe controlar la frecuencia respiratoria, tensión arterial y frecuencia cardiaca, en especial cuando el paciente está en el postoperatorio y su respuesta a los opioides debe ser evaluada.
Cuando se dosifican opioides en los pacientes, deben evaluarse otros factores. Dos de los más importantes son la variación en la potencia de diferentes opioides y la vía de administración. Una forma de solucionar las diferencias en potencia es seguir las guías y recomendaciones sobre dosis equianalgésicas. Hay diferentes referencias y variantes, pero sobre todo las guías ayudarán al médico a comprender la potencia analgésica de los opioides y le permitirán utilizar diferentes opioides para el manejo del dolor (24,25). Además, diferentes opioides son metabolizados de manera diferente. Algunos tienen metabolitos activos, en ocasiones metabolitos tóxicos, y muchos de ellos son eliminados por vía renal. Por ello, algunos opioides deberían ser evitados en caso de insuficiencia renal o hepática (Tabla III).
Estrategias actuales para el manejo del dolor postoperatorio con buprenorfina
La falta de conocimiento sobre la farmacodinamia, farmacocinética y seguridad de buprenorfina ha hecho que muchos médicos pasen por alto su utilización en la clínica. Revisiones recientes en la literatura han intentado aclarar estos temas (26,27). Han demostrado que la buprenorfina es superior a otros opioides en muchos aspectos y algunas de las características ventajosas de la buprenorfina se discuten a continuación.
Farmacología
La clasificación de buprenorfina como agonista parcial o total ha sido discutida en la literatura. La dificultad para aplicar o interpretar correctamente los términos "actividad intrínseca", "eficacia" y agonista "total" o "parcial" ha llevado a una errónea percepción y predicción de la utilidad clínica de la buprenorfina. La afinidad caracteriza la unión e interacción entre una droga y el receptor. La actividad intrínseca involucra la activación del receptor y la transducción por segundos mensajeros (proteína G en el caso de los opioides). La eficacia caracteriza el nivel de un efecto específico. La buprenorfina tiene una alta afinidad por el receptor mu (28), baja actividad intrínseca en ensayos in vitro (29), y presenta un efecto techo para analgesia en algunos modelos animales y en humanos para la depresión respiratoria. Estas propiedades han llevado a muchos médicos a malinterpretar las diferencias fundamentales entre actividad intrínseca y eficacia; llevando a una incorrecta extrapolación de los resultados para interpretar la eficacia clínica de la buprenorfina y también que se considere a la buprenorfina como un "agonista parcial" en humanos. Trabajos más recientes han demostrado que no es adecuado caracterizar a la buprenorfina como agonista "parcial" en base a datos preclínicos o inferir un efecto techo en el contexto clínico (26,30). En varios modelos animales la buprenorfina ha demostrado producir un efecto agonista puro (31) que depende de la intensidad del estímulo (32). Estudios radio-marcados en humanos han demostrado que se obtiene analgesia total con menos del 100% de ocupación de receptores opioides mu (33), por eso se comporta como agonista puro. Como la presencia o ausencia de un efecto techo depende de la intensidad del estímulo y del resultado esperado, es perfectamente factible exhibir un techo para una determinación en particular (ej. depresión respiratoria), mientras que no se presenta para otra (ej. analgesia).
Farmacocinética y metabolismo
La farmacocinética de algunos opioides en la actualidad presenta cierto riesgo para pacientes con insuficiencia renal. La buprenorfina tiene menos riesgos en insuficiencia renal (Tabla IV). Es metabolizada en el hígado por la isoenzima CYP3A4 (también CYP2C8 parece estar involucrada) del citocromo P-450. Mediante N-desalquilación es convertida a norbuprenorfina. Además, la glucuronización es llevada a cabo por UGT1A1 y UGT2B7, y en el caso de la norbuprenorfina por UGT1A1 y UGT1A3. La norbuprenorfina es el mayor metabolito activo, actuando como agonista opioide mu y delta, agonista puro de nociceptina y agonista parcial kappa. En un estudio de balance de masa, para evaluar la eliminación corporal de buprenorfina, se demostró una recuperación de metabolitos de buprenorfina marcada en orina de 30% y en materia fecal de 69%, recolectados hasta 11 días después de la administración (34). Casi la totalidad de la dosis eliminada fue buprenorfina, norbuprenorfina y dos metabolitos no identificados. En orina, parte de la buprenorfina se encontraba conjugada (buprenorfina 1% libre y 9,4% conjugada; norbuprenorfina, 2,7% libre y 11% conjugada). En las heces, parte de la buprenorfina y norbuprenorfina se encontraron en forma libre (buprenorfina, 33% libre y 5% conjugada; norbuprenorfina, 21% libre y 2% conjugada). Los glucurónidos formados son eliminados mayoritariamente a través de la bilis. Esta característica es altamente ventajosa sobre otros opioides (morfina, oxicodona, hidromorfona, fentanilo, metadona), cuyas dosis deben reducirse en pacientes con insuficiencia renal (26). Debido a la importante eliminación hepática, el riesgo de acumulación en pacientes con insuficiencia renal se encuentra significativamente reducido (34).
Buprenorfina para manejo de dolor postoperatorio
En base a la flexibilidad de administración y el perfil de eventos adversos, la buprenorfina resulta una opción atractiva para el manejo de dolor postoperatorio en comparación con otros opioides. En las tablas IV y V se enumeran las diferentes vías de administración y dosificación, junto con un resumen de estudios que documentan la eficacia y seguridad de la buprenorfina. Las vías de administración incluyen la vía intravenosa, intravenosa controlada por el paciente (PCA), epidural, intratecal, intramuscular, sublingual, oral, subcutánea, intraarticular y transdérmica. Algunos de los resultados en los estudios mostraron que la buprenorfina puede tener propiedades analgésicas similares o superiores a la morfina, puede tener la capacidad de incrementar la duración de la analgesia, y puede reducir el requerimiento de analgésicos adicionales (Tabla IV). Además, la buprenorfina tiene un perfil de seguridad muy razonable. De manera similar a otros opioides, se ha documentado que la buprenorfina puede provocar mareos, somnolencia, sudoración, prurito, sequedad de boca, miosis, hipotensión ortostática, dificultad en la eyaculación, disminución de la libido y retención urinaria. La constipación y los efectos sobre el SNC son observados con menor frecuencia que con morfina y se produce menor liberación de histamina (26). Se han reportado necrosis hepática con ictericia, en especial después de la administración intravenosa de tabletas trituradas (35).
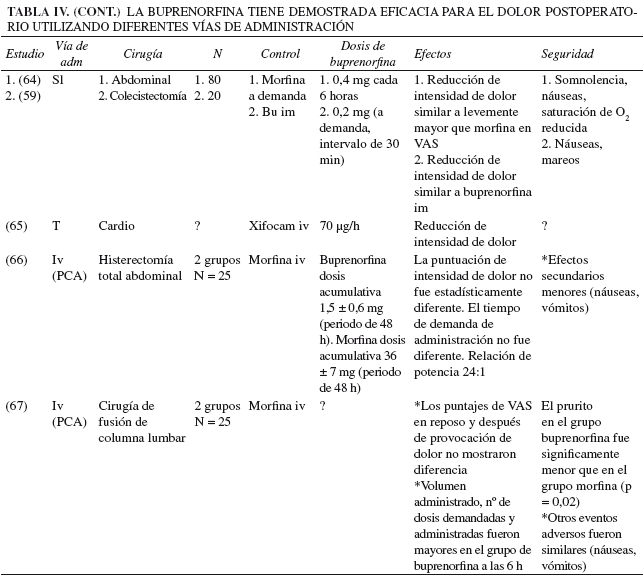
Aspectos clínicos específicos
Aun cuando está comprobado que la buprenorfina tiene un perfil de seguridad razonable, es muy importante utilizar diferentes estrategias para minimizar la posibilidad de experimentar efectos adversos. En casos en los que los efectos adversos puedan resultar demasiado severos para ser manejados por un paciente se deberán utilizar otras estrategias para mitigarlos.
Depresión respiratoria y su reversibilidad
Una preocupación habitual con los opioides es su capacidad para provocar depresión respiratoria cuando se utilizan en altas dosis. Durante una sobredosis con un opioide puede provocarse una severa depresión del sistema nervioso central que amenaza la vida. Para contrarrestar este efecto, los médicos típicamente indican un antagonista de los receptores opioides. Inicialmente se creía que la alta afinidad de la buprenorfina por el receptor opioide muy la lenta cinética de asociación/disociación impedirían la reversión por naloxona. Sin embargo, en 21 voluntarios vírgenes de opioides, se demostró que la naloxona revirtió de manera completa el efecto depresor sobre la respiración generado por buprenorfina (36). Estudios adicionales también han demostrado resultados similares (26,37). En consecuencia, la buprenorfina tiene un efecto techo aparente en relación a la depresión respiratoria, aunque debe ser considerado un riesgo relacionado con sobredosis y la cautela en relación a la depresión respiratoria sigue siendo la mejor práctica (26,38).
Hiperalgesia
Si en un paciente que está recibiendo un agonista puro mu el control de dolor resulta gradualmente menos eficaz, puede ser difícil determinar si esto es causado por el desarrollo de tolerancia (requiriendo mayores dosis o rotación de opioides) o debido a hiperalgesia inducida por opioides (en donde se requiere la discontinuación del opioide) (39,40). Esta es un área de potencial ventaja para la buprenorfina en función de su posible efecto antihiperalgésico. Se ha investigado el tiempo de desarrollo del efecto analgésico y antihiperalgésico de la buprenorfina sublingual (sl) e intravenosa (iv) en un modelo experimental en humanos, utilizando estimulación eléctrica intradérmica para provocar dolor e hiperalgesia mecánica secundaria (41). La intensidad de dolor se redujo en un 26 ± 5% para la administración iv y 10 ± 6% para la administración sl después de 180 minutos mientras que las reducciones correspondientes en las áreas hiperalgésicas fueron 66 ± 9% y 43 ± 10%, respectivamente. Este efecto antihiperalgésico teórico podría brindar una ventaja potencial para la buprenorfina.
Inmunosupresión
Aunque la morfina y el fentanilo tienen un efecto negativo sobre el sistema inmunológico, la buprenorfina puede ser considerada neutral (42). Los mecanismos responsables de esta diferencia de efectos no están del todo comprendidos, pero pueden resultar de las diferentes proteínas G involucradas como segundos mensajeros. Luego de unirse a los receptores opioides, cada agonista opioide activa proteínas G específicas, y estas varían en sus efectos sobre el eje hipotálamo-hipofisario y sobre el sistema nervioso simpático. La importancia clínica de estas diferencias radica en que, en pacientes vulnerables como los niños y ancianos, es deseable evitar el riesgo de inmunosupresión. Los pacientes sometidos a estrés psicosocial o estrés quirúrgico pueden tener también comprometido su sistema inmunológico, lo que indica que el uso de un analgésico carente de actividad inmunosupresora no incrementará el riesgo de infección (43). La inmunosupresión también debe tenerse en cuenta en pacientes con dolor por cáncer, como resultado de su enfermedad de base y su tratamiento concomitante con otras drogas potencialmente inmunosupresoras, como los corticosteroides y agentes quimioterápicos. Por todo esto, las propiedades inmunosupresoras de cada fármaco deberían ser una consideración importante a nivel perioperatorio y en pacientes oncológicos que requieren analgesia opioide.
Rotación de opioides
Otra alternativa para limitar los efectos adversos es la rotación entre diferentes opioides. Existe una gran variabilidad entre individuos en cuanto a la respuesta (44), y la rotación de opioide puede ser la mejor opción para identificar el agente que produce el balance más favorable entre analgesia y efectos secundarios (45). Para poder realizar una correcta rotación se debe considerar la equipotencia, definida como la relación entre las dosis de dos opioides que producen un mismo efecto analgésico (46). Por ejemplo, una relación de 1:75 se ha propuesto entre buprenorfina transdérmica y morfina oral, aunque esto no ha sido evaluado en ensayos clínicos. Un estudio retrospectivo de cohorte comparó dosis equipotentes calculadas de morfina oral a buprenorfina transdérmica en 4.742 pacientes en la base de datos IMS Disease Analyzer-Mediplus (47). Los resultados sugirieron que una relación de equipotencia de 1:110-1:115 sería más adecuada que la relación de 1:75, resaltando el concepto que mayor potencia no implica mayores efectos secundarios.
Combinación de opioides
En algunos casos puede ser de utilidad la administración combinada de diferentes opioides de forma tal que se incrementen los efectos analgésicos y se reduzcan los efectos secundarios. El uso de dosis más bajas de dos opioides puede contribuir a reducir efectos secundarios asociados con cada opioide en particular y mediante el sinergismo obtener eficacia analgésica similar a la lograda con dosis mayores de cada droga utilizada individualmente. Muchos estudios han demostrado ventajas cuando la buprenorfina fue utilizada en combinación con otros opioides. Por ejemplo, datos de ensayos clínicos descritos por la Sociedad Española de Dolor demuestran la combinación exitosa de buprenorfina con tramadol o morfina. En un estudio sobre 361 pacientes con dolor crónico nociceptivo, los pacientes que recibieron tramadol como medicación de rescate mientras eran tratados con buprenorfina transdérmica no presentaron efectos secundarios adicionales (48). Otros estudios han demostrado resultados similares (49,50). Además, un estudio ha demostrado que la rotación de morfina a buprenorfina transdérmica o el uso de morfina como medicación de rescate para el tratamiento de dolor por osteoartritis no produjeron complicaciones e incrementó la satisfacción de los pacientes en comparación con buprenorfina sola (51).
Cambios en titulación o vía de administración
En algunas situaciones de manejo del dolor se utiliza la titulación partiendo de una dosis baja. Este método puede ser útil en pacientes vírgenes de opioides para evitar efectos secundarios tempranos. Los médicos pueden utilizar también analgésicos adyuvantes para el manejo de efectos secundarios, como son los antieméticos para las náuseas y vómitos. Además, la vía de administración puede variarse para reducir la velocidad de obtención de la Cmax en plasma. Por ejemplo, el Grupo de la Sociedad Española de Dolor demostró que pacientes tratados por dolor nociceptivo crónico con buprenorfina transdérmica presentaron una menor frecuencia de eventos adversos. La incidencia de eventos locales se mantuvo razonablemente constante en un 10% de los pacientes y la incidencia de eventos adversos sistémicos se redujo de 45,4% en la semana 1 a 16,7% en la semana 8 (48).
Conclusión
En pacientes que serán sometidos a cirugía, el reconocimiento precoz de aquellos con mayor riesgo mediante la detección de signos de alarma es esencial para reducir la incidencia de complicaciones y para prevenir secuelas serias antes que estas se desarrollen. El personal de la salud debería evaluar de manera exhaustiva el dolor de los pacientes, de forma tal que se pueda prevenir la oligoanalgesia postoperatoria. Los opioides son el pilar fundamental para el manejo del dolor agudo postoperatorio severo, pero tienen conocidos efectos secundarios que pueden limitar su eficacia. La buprenorfina resulta una buena elección y tiene una adecuada eficacia y seguridad en distintos modelos de dolor postoperatorio, en diferentes grupos etarios y en diversas formas de administración. Los efectos secundarios pueden ser manejados, minimizados o evitados. Puede combinarse la buprenorfina con otros analgésicos opioides y no opioides. La buprenorfina es una opción terapéutica que los médicos no deberían pasar por alto.
Bibliografía
1. Macario A, Weinger M, Carney S, Kim A. Which clinical anesthesia outcomes are important to avoid? The perspective of patients. Anesth Analg. 1999;89:652-8. [ Links ]
2. Warfield CA, Kahn CH. Acute pain management. Programs in U.S. hospitals and experiences and attitudes among U.S. adults. Anesthesiology. 1995;83:1090-4. [ Links ]
3. Apfelbaum JL, Chen C, Mehta SS, Gan TJ. Postoperative pain experience: results from a national survey suggest postoperative pain caontinues to be undermanaged. Anesth Analg. 2003;97:534-40. [ Links ]
4. Woolf CJ. Pain: moving from symptom control toward mechanism-specific pharmacologic management. Ann Intern Med. 2004;140:441-51. [ Links ]
5. Middleton C. Understanding the physiological effects of unrelieved pain. Nursing Times. 2003;99:28-31. [ Links ]
6. McCarberg BH, Nicholson BD, Todd KH, et al. The impact of pain on quality of life and the unmet needs of pain management: results from pain sufferers and physicians participating in an internet survey. Am J Ther. 2008;15:312-20. [ Links ]
7. Katz J, Seltzer Z. Transition from acute to chronic postsurgical pain: risk factors and protective factors. Expert Rev Neurother. 2009;9:723-44. [ Links ]
8. Carr DB, Goudas LC. Acute pain. Lancet. 1999;353:2051-8. [ Links ]
9. Coley KC, Williams BA, DaPos SV, et al. Retrospective evaluation of unanticipated admissions and readmissions after same day surgery and associated costs. J Clin Anesth. 2002;14:349-53. [ Links ]
10. Twersky R. Ambulatory surgery update. Can J Anaesth. 1998;45(5 Pt 2):R76-90. [ Links ]
11. Sinatra R. Causes and consequences of inadequate management of acute pain. Pain Medicine. 2010;11:1859-71. [ Links ]
12. Macrae WA, Davies HT, Crombie IK. Pain: paradigms and treatments. Pain. 1992;49:289-91. [ Links ]
13. Quality improvement guidelines for the treatment of acute pain and cancer pain. American Pain Society Quality of Care Committee. JAMA. 1995;274:1874-80. [ Links ]
14. Davis MP, Walsh D. Cancer pain: how to measure the fifth vital sign. Cleve Clin J Med. 2004;71:625-32. [ Links ]
15. Julius D, Basbaum AI. Molecular mechanisms of nociception. Nature. 2001;413:203-10. [ Links ]
16. Wu C. Acute postoperative pain. 6th ed. Philadelphia, PA: Elsevier; 2005. [ Links ]
17. Stein C. The control of pain in peripheral tissue by opioids. N Engl J Med. 1995;332:1685-90. [ Links ]
18. Duggan AW, North RA. Electrophysiology of opioids. Pharmacol Rev. 1983;35:219-81. [ Links ]
19. Benedetti C. Neuroanatomy and biochemistry of antinociception. In: Bonica J, Ventafridda V (editors). Advances in Pain Research and Therapy. New York, NY: Raven Press. 1979. p. 31-44. [ Links ]
20. Spiller RC. Mechanisms of postoperative intestinal motor dysfunction. Curr Opin Gastroenterol. 2003;19:103-5. [ Links ]
21. Holte K, Kehlet H. Postoperative ileus: progress towards effective management. Drugs. 2002;62:2603-15. [ Links ]
22. Seminars in Perioperative Nursing. 2001;10:3-16. [ Links ]
23. Reisine T, Pasternak G. Opioid analgesics and antagonists. In: Goodmanm ≈ Gilman's (editors). The Pharmacological Basics of Therapeutics. 9th ed. New York, NY: McGraw-Hill. 1996. p. 521-56. [ Links ]
24. Foley KM. The treatment of cancer pain. N Engl J Med. 1985;313:84-95. [ Links ]
25. Education for physicians on end-of-life care (EPEC) Curriculum. Chicago: Robert Wood Johnson Foundation. 1999. [ Links ]
26. Pergolizzi J, Aloisi AM, Dahan A, et al. Current knowledge of buprenorphine and its unique pharmacological profile. Pain Practice. 2010;10:428-50. [ Links ]
27. Pergolizzi J, Böger RH, Budd K, et al. Opioids and the management of chronic severe pain in the elderly: consensus statement of an international expert panel with focus on the six clinically most often used world health organization step III opioids (buprenorphine, fentanyl, hydromorphone, methadone, morphine, oxycodone). Pain Practice. 2008;8:287-313. [ Links ]
28. Huang P, Kehner GB, Cowan A, et al. Comparison of pharmacological activities of buprenorphine and norbuprenorphine: norbuprenorphine is a potent opioid agonist. J Pharmacol Exp Ther. 2001;297:688-95. [ Links ]
29. Traynor JR. G-Protein coupling and efficacy of mu-opioid agonists: relationship to behavioral efficacy. Reviews in Analgesia. 2004;8:11-22. [ Links ]
30. Pergolizzi J, Raffa R. The use of high-dose transdermal buprenorphine in the treatment of cancer pain. J Medicine. 2009;2:111-20. [ Links ]
31. Christoph T, Kogel B, Schiene K, et al. Broad analgesic profile of buprenorphine in rodent models of acute and chronic pain. Eur J Pharmacol. 2005;507:87-98. [ Links ]
32. Raffa RB, Ding Z. Examination of the preclinical antinociceptive efficacy of buprenorphine and its designation as full- or partial-agonist. Acute Pain. 2007;9:145-52. [ Links ]
33. Greenwald MK, Johanson CE, Moody DE, et al. Effects of buprenorphine maintenance dose on mu-opioid receptor availability, plasma concentrations, and antagonist blockade in heroin-dependent volunteers. Neuropsychopharmacology 2003;28:2000-9. [ Links ]
34. Reckitt Benckiser Pharmaceuticals Inc. Suboxone Package Insert. 2010. [ Links ]
35. Berson A, Gervais A, Cazals D, et al. Hepatitis after intravenous buprenorphine misuse in heroin addicts. J Hepatol. 2001;34:346-50. [ Links ]
36. Dahan A. Opioid-induced respiratory effects: new data on buprenorphine. Palliat Med. 2006;20 Suppl 1:s3-8. [ Links ]
37. van Dorp E, Yassen A, Sarton E, et al. Naloxone reversal of buprenorphine-induced respiratory depression. Anesthesiology. 2006;105:51-7. [ Links ]
38. Dahan A, Yassen A, Romberg R, et al. Buprenorphine induces ceiling in respiratory depression but not in analgesia. Br J Anaesth. 2006;96:627-32. [ Links ]
39. Raffa RB, Pergolizzi Jr JV. Multi-mechanistic analgesia for opioid-induced hyperalgesia. J Clin Pharm Ther. 2012 Apr;37(2):125-7. [ Links ]
40. Raffa RB, Pergolizzi JV Jr. Opioid-induced hyperalgesia: is it clinically relevant for the treatment of pain patients? Pain Management Nursing. 2011. [ Links ]
41. Koppert W, Ihmsen H, Korber N, et al. Different profiles of buprenorphine-induced analgesia and antihyperalgesia in a human pain model. Pain. 2005;118:15-22. [ Links ]
42. Martucci C, Panerai AE, Sacerdote P. Chronic fentanyl or buprenorphine infusion in the mouse: similar analgesic profile but different effects on immune responses. Pain, 2004; 110:385-92. [ Links ]
43. Sacerdote P. Opioid-induced immunosuppression. Curr Opin Support Palliat Care. 2008;2:14-8. [ Links ]
44. Mercadante S, Bruera E. Opioid switching: a systematic and critical review. Cancer Treat Rev. 2006;32:304-15. [ Links ]
45. Portenoy RK, Lesage P. Management of cancer pain. Lancet. 1999;353:1695-700. [ Links ]
46. Pereira J, Lawlor P, Vigano A, et al. Equianalgesic dose ratios for opioids. A critical review and proposals for long-term dosing. J Pain Symptom Manage. 2001;22:672-87. [ Links ]
47. Sittl R, Likar R, Nautrup BP. Equipotent doses of transdermal fentanyl and transdermal buprenorphine in patients with cancer and noncancer pain: results of a retrospective cohort study. Clin Ther. 2005;27:225-37. [ Links ]
48. Camba M. Transdermal buprenorphine for the management of nociceptive chronic pain. Rev Soc Esp Dolor. 2004;11 (Suppl V):22-30. [ Links ]
49. Rodríguez-López M. Transdermal buprenorphine in the management of neuropathic pain. Rev Soc Esp Dolor. 2004;11 (Suppl V):11-21. [ Links ]
50. Muriel C. Assessment of buprenorphine transdermal patch in patients with cancer pain. Rev Soc Esp Dolor. 2004;11 (Suppl V):41-8. [ Links ]
51. de Barutell C, Gonzalez E, Ramon J. Efficacy and safety of buprenorphine TDS in conjunction with oral tramadol or morphine as rescue medication in the treatment of 390 patients with chronic pain: a summary of two retrospective Spanish multicenter studies. Journal of Applied Therapeutic Research. 2007;6:14-24. [ Links ]
52. Conner M, Deane D. Patterns of patient-controlled analgesia and intramuscular analgesia. Appl Nurs Res. 1995;8: 67-72. [ Links ]
53. Margetts L, Sawyer R. Transdermal drug delivery: principles and opioid therapy. Continuing Education in Anaesthesia, Critical Care & Pain. 2007;7:171-6. [ Links ]
54. Nies A, Spielberg S. In: Goodman and Gilman's (editors). The pharmacological basics of therapeutics. 9th Edition. New York, NY: McGraw-Hill; 1996. p. 43-62. [ Links ]
55. Inagaki Y, Mashimo T, Yoshiya I. Mode and site of analgesic action of epidural buprenorphine in humans. Anesth Analg. 1996;83:530-6. [ Links ]
56. Miwa Y, Yonemura E, Fukushima K. Epidural administered buprenorphine in the perioperative period. Can J Anaesth. 1996;43:907-13. [ Links ]
57. Varrassi G, Marinangeli F, Ciccozzi A, et al. Intra-articular buprenorphine after knee arthroscopy. A randomised, prospective, double-blind study. Acta Anaesthesiol Scand. 1999;43:51-5. [ Links ]
58. Payne KA, Murray WB, Barrett H. Intramuscular buprenorphine compared with morphine for postoperative analgesia. S Afr Med J. 1987;71:359-61. [ Links ]
59. Shah MV, Jones DI, Rosen M. "Patient demand" postoperative analgesia with buprenorphine. Comparison between sublingual and i.m. administration. Br J Anaesth. 1986;58:508-11. [ Links ]
60. Ipe S, Korula S, Varma S, et al. A comparative study of intrathecal and epidural buprenorphine using combined spinal-epidural technique for caesarean section. Indian J Anaesth. 2010;54:205-9. [ Links ]
61. Oifa S, Sydoruk T, White I, et al. Effects of intravenous patient-controlled analgesia with buprenorphine and morphine alone and in combination during the first 12 postoperative hours: a randomized, double-blind, four-arm trial in adults undergoing abdominal surgery. Clin Ther. 2009;31:527-41. [ Links ]
62. Bullingham RE, McQuay HJ, Moore RA, et al. An oral buprenorphine and paracetamol combination compared with paracetamol alone: a single dose double-blind postoperative study. Br J Clin Pharmacol. 1981;12:863-7. [ Links ]
63. Kawamata T, Sato Y, Niiyama Y, et al. Pain management after lumbar spinal fusion surgery using continuous subcutaneous infusion of buprenorphine. J Anesth. 2005;19:199-203. [ Links ]
64. Cuschieri RJ, Morran CG, McArdle CS. Comparison of morphine and sublingual buprenorphine following abdominal surgery. Br J Anaesth. 1984;56:855-9. [ Links ]
65. Eremenko AA, Urbanov AV, Avetisian MI. Use of a Transtec transdermal therapeutic system of buprenorphine for analgesia in the early periods after cardiosurgical operations. Anesteziol Reanimatol. 2006:40-4. [ Links ]
66. Ho ST, Wang JJ, Liu HS, et al. The analgesic effect of PCA buprenorphine in Taiwan's gynecologic patients. Acta Anaesthesiol Sin. 1997;35:195-9. [ Links ]
67. Chang KY, Chang WK, Chang WL, et al. Comparison of intravenous patient-controlled analgesia with buprenorphine versus morphine after lumbar spinal fusion--a prospective randomized clinical trial. Acta Anaesthesiol Taiwan. 2006;44:153-9. [ Links ]
68. Buprenorphine Hydrochloride. Accessed 06/27/2011, 2011, at http://www.drugs.com/monograph/buprenorphine-hydrochloride.html. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Robert Taylor Jr.
NEMA Research Inc.
840 111th Avenue North, Suite 9
Naples, FL 34108
Tel. 239.597.3662
e-mail: robert.taylor.phd@gmail.com
Recibido: 26-07-12.
Aceptado: 29-10-12.



















