INTRODUCCIÓN
Aproximadamente el 17 % de la población adulta en España sufre de dolor crónico 1,2. En muchos pacientes, la administración de un único analgésico no consigue aliviar completamente el dolor 3, por lo que se usan terapias combinadas que requieren la administración de más de un fármaco. La asociación de dos agentes con mecanismos de acción complementarios, que potencien el efecto analgésico y reduzcan el riesgo a desarrollar posibles acontecimientos adversos (AA) 4, puede ser una opción terapéutica que mejore la comodidad y la adherencia del paciente.
La combinación de clorhidrato de tramadol y paracetamol está indicada para el tratamiento sintomático del dolor moderado a intenso 5. Tramadol es un analgésico opioide que actúa sobre el sistema nervioso central. Está compuesto de 2 enantiómeros: el isómero (+) presenta actividad preferente por el receptor opioide µ y el isómero (-) actúa inhibiendo la recaptación de noradrenalina y serotonina y potenciando el efecto analgésico del anterior 3,6. Por otra parte, el paracetamol es un analgésico no opioide cuyo mecanismo de acción no se conoce completamente 7. Se cree que actúa a nivel central y periférico, inhibiendo tanto la síntesis de prostaglandinas como la vía del óxido nítrico 8. La combinación de ambos analgésicos ha demostrado ser sinérgica y, con ello, más eficaz que los componentes por separado. Mientras que la acción del tramadol es lenta y de larga duración, la del paracetamol es rápida y de corta duración 9. La eficacia de la combinación se ha demostrado en el alivio del dolor dental postoperatorio, en la lumbalgia crónica y en el dolor agudo causado por la artrosis 3,10,11,12. Además, permite disminuir la dosis requerida de cada uno de los agentes y, con ello, reducir el riesgo de desarrollar AA.
La Organización Mundial de la Salud (OMS) ha detectado que hasta el 50 % de los pacientes incumple con su tratamiento, afectando negativamente a su eficacia terapéutica 13. De hecho, la OMS considera el incumplimiento de los tratamientos de las enfermedades crónicas "como un problema mundial de alarmante magnitud". Uno de los factores que afecta a la adherencia a un tratamiento es la forma farmacéutica utilizada. Además, muchos pacientes tienen problemas a la hora de tragar comprimidos o cápsulas de gelatina dura 14. Los comprimidos bucodispersables son comprimidos no recubiertos destinados a ser colocados en la boca, donde se dispersan rápidamente sin necesidad de agua, lo que puede ayudar a mejorar el cumplimiento terapéutico 15. Debido a que no hay necesidad de masticarlos ni de ingerirlos con agua, permiten que puedan tomarse en cualquier momento y en cualquier lugar, por lo que están idealmente destinados a aquellos pacientes activos que no dispongan de agua en todo momento, por ejemplo jóvenes, personas ocupadas, personas para las que no sea el momento más adecuado el disponer de agua (trabajadores, deportistas, etc.) o que viajen con asiduidad. En este último caso, según el destino, puede ser más o menos complicado tener acceso a agua, o incluso si se dispone de ella puede que no sea potable o no se encuentre en perfectas condiciones para beber 16. Por otra parte, los comprimidos bucodispersables son adecuados en pacientes con problemas de deglución (disfagia), ancianos, encamados, víctimas de accidente cerebrovascular o con fallo renal, y para aquellos con problemas de desarrollo o volitivos para la deglución, como pacientes pediátricos, geriátricos y psiquiátricos 15. También es importante tener en cuenta a aquellos con aversión a los comprimidos y cápsulas 16, ya que varios estudios han demostrado que entre el 26-50 % de los pacientes tienen problemas a la hora de tragar estas formas farmacéuticas, principalmente debido al tamaño, la textura, la forma o el sabor 14. Otra de las ventajas que ofrecen los comprimidos bucodispersables es que, al disolverse tan rápidamente en la boca, se consigue una mejora en la biodisponibilidad y una rápida absorción entre la boca, faringe y esófago 15.
Paxiflas(r) es la combinación de clorhidrato de tramadol/paracetamol (37,5 mg/325 mg) en forma de comprimidos bucodispersables, con sabor mentolado y que se disgregan en la boca en menos de 30 segundos. Ha sido comercializado por Laboratorios Gebro Pharma S.A., y se ha autorizado por la Agencia Española de Medicamentos y Productos Sanitarios en julio de 2016 17. Para obtener su registro y autorización de comercialización, se realizó un estudio de bioequivalencia frente a Zaldiar(r), el producto de referencia en España de tramadol/paracetamol (37,5 mg/325 mg) y comercializado por Grünenthal Pharma S. A. 18. El objetivo del estudio fue demostrar la bioequivalencia entre Paxiflas(r), administrado con y sin agua en diferentes periodos, y Zaldiar(r), administrado con agua, en individuos sanos en ayunas.
MATERIAL Y MÉTODOS
Diseño del estudio
El estudio se llevó a cabo entre septiembre y noviembre de 2014 siguiendo un diseño abierto, balanceado, aleatorizado, cruzado, de dosis única, con 3 tratamientos de 3 periodos y secuencias distintos (periodo I: 25-27 de septiembre; periodo II: 2-4 de octubre; y periodo III: 10-12 de octubre), y con un tiempo de lavado de 7 días entre el periodo I y II y de 8 días entre el II y III. La duración total del estudio fue de 17 días. Los voluntarios sanos fueron asignados al azar para recibir una dosis oral única (2 comprimidos) del producto en investigación, Paxiflas(r), administrado sin agua (producto A) o con agua (producto B), y de Zaldiar(r) con agua (producto de referencia). Aunque el diseño fue abierto, la secuencia de administración de los productos se mantuvo ciega para el investigador. Todos los voluntarios firmaron el consentimiento informado antes de participar en el estudio. Tanto la versión final del protocolo del estudio como la del consentimiento informado fueron revisadas y aprobadas por el Comité Ético de Investigación Clínica en diciembre de 2013. Todos los procedimientos se llevaron a cabo de acuerdo con los principios éticos establecidos en la Declaración de Helsinki.
Participantes
El estudio se realizó en un total de 42 voluntarios sanos. Los principales criterios de inclusión en el estudio fueron: hombre o mujer (no gestante) de edad entre 18 y 45 años y peso ≥ 50 kg; índice de masa corporal entre 18,5 y 24,9 kg/m2; no fumador; exploración física normal, signos vitales normales (presión sanguínea, pulso, frecuencia respiratoria y temperatura axilar) y parámetros clínicos normales (hemograma, bioquímica, análisis de orina, electrocardiograma de 12 derivaciones y radiografía torácica); y sin antecedentes de alcoholismo. Los voluntarios fueron ingresados en el centro de estudio al menos 11 horas antes de la administración del fármaco y permanecieron en observación hasta 36 horas después. En el momento de la administración de cada producto, los voluntarios se encontraban en ayuno nocturno de, al menos, 10 horas.
Productos y tratamientos
El producto en investigación Paxiflas(r) (clorhidrato de tramadol 37,5 mg/paracetamol 325 mg en comprimidos bucodispersables), comercializado por Laboratorios Gebro Pharma S. A., se evaluó administrado con y sin agua. En la administración sin agua (producto A), los voluntarios bebieron 20 ml de agua antes de la administración con el fin de humedecer la boca. A continuación, se colocaron en la lengua 2 comprimidos que chuparon sin masticar hasta su desintegración, ingiriendo la suspensión resultante sin agua adicional. En la administración con agua (producto B), la suspensión resultante fue ingerida con la ayuda de 240 ± 2 ml de agua a temperatura ambiente. El producto de referencia Zaldiar(r) (clorhidrato de tramadol 37,5 mg/paracetamol 325 mg en comprimidos) fue administrado con 240 ± 2 ml de agua a temperatura ambiente.
Determinación analítica
Se extrajeron 19 muestras de sangre de todos los voluntarios desde 1 hora antes de la administración de cada producto hasta 36 horas después (tomadas a las 0,25, 0,5, 0,75, 1, 1,25, 1,5, 2, 2,5, 3, 4, 5, 6, 8, 10, 12, 16, 24 y 36 horas postdosis).
Evaluación farmacocinética y evaluación de la seguridad
Para evaluar la farmacocinética del producto en investigación A o B, cada voluntario debió haber recibido, al menos, el producto A y el de referencia, o el B y el de referencia, respectivamente. Las concentraciones plasmáticas del (+) tramadol, (-) tramadol y paracetamol se midieron mediante un método analítico validado de cromatografía líquida acoplada a espectrometría de masa en tándem (LC/MS/MS). La bioequivalencia relativa del producto en investigación (A y B) con respecto al de referencia se evaluó determinando los siguientes parámetros farmacocinéticos para (+) tramadol, (-) tramadol y paracetamol: concentración plasmática máxima observada durante el estudio (Cmax), tiempo para alcanzarla (Tmax), área bajo la curva de concentración plasmática-tiempo para la última concentración disponible, usando la regla de trapecios (AUC0-t), constante de eliminación (Ke) calculada mediante el semi-logaritmo de la curva de concentración plasmática-tiempo, usando el método de regresión de mínimos cuadrados, área bajo la curva de concentración plasmática-tiempo de cero a infinito (AUC0-00), calculado como AUC0-t más la adición del cociente entre la última concentración disponible y ke, y tiempo de vida media (t1/2), calculado como la relación entre el logaritmo neperiano de 2 y ke. La seguridad se evaluó mediante el reporte de AAs, exploración física, recogida de constantes vitales, electrocardiograma de 12 derivaciones y pruebas clínicas y de laboratorio.
Determinación del tamaño de la muestra
Con la finalidad de conseguir una potencia estadística del 85 % para que el intervalo de confianza del 90 % (IC 90 %) de la relación de los valores logotransformados de Cmax y AUC de los productos comparados quedase dentro del rango de bioequivalencia aceptado de 80-125 %, se estimó un número de 32 participantes. Esta estimación se basó en que la relación nula de los productos comparados sería de 0,95 y la máxima variación intraindividual del 25 % 19. Finalmente se propuso un número total de 42 participantes, por ser un estudio de 3 tratamientos y asumiendo la probabilidad de abandonos y retiradas.
Análisis estadístico
Se consideró bioequivalencia cuando el IC 90 % de la relación de la media geométrica de Cmax y AUC0-t entre el producto en investigación A o B y el de referencia se encontró dentro del rango 80-125 % para (+) tramadol, (-) tramadol y paracetamol. La bioequivalencia estadística se determinó utilizando la prueba de Schuirmann 20. La media geométrica se obtuvo como el antilogaritmo (exponencial) de la media de mínimos cuadrados de los valores logotransformados. Se realizó un análisis de varianza (ANOVA) para determinar posibles efectos del tratamiento, del periodo y de las secuencias en los parámetros farmacocinéticos Cmax, AUC0-t y AUC0-00 no transformados y transformados logarítmicamente para (+) tramadol, (-) tramadol y paracetamol. La diferencia de Tmax entre los distintos productos se analizó con la prueba no paramétrica de Wilcoxon. Se calculó el IC 90 % para la proporción de la media geométrica de mínimos cuadrados para (+) tramadol, (-) tramadol y paracetamol. Salvo indicación expresa, los valores se muestran como la media aritmética junto con la desviación estándar (DE). El efecto significativo se estableció ante un valor p ≤ 0,05. La aleatorización y el análisis farmacocinético mediante el modelo no-compartimental se realizó utilizando el programa SAS 9.2.
RESULTADOS
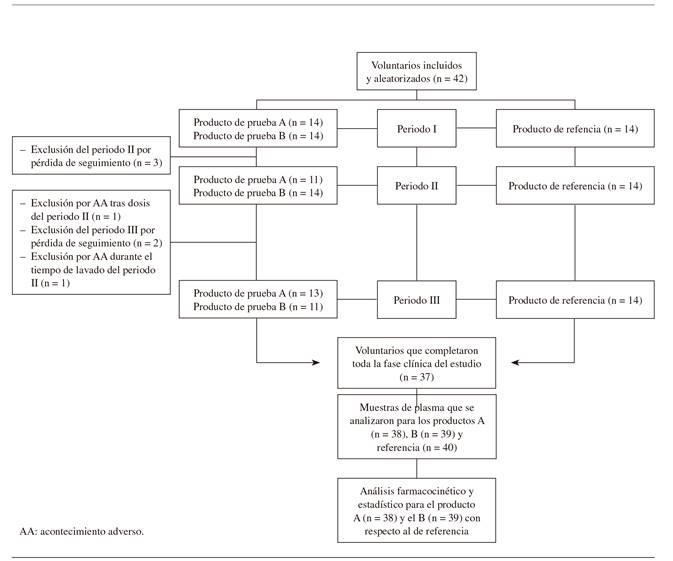
Al tratarse de un estudio cruzado, todos los sujetos debían tomar cada uno de los productos: A, B y referencia. Del total de 42 voluntarios incluidos en el estudio, 38 recibieron la administración de, al menos, el producto A, 39 la del B, y 40 la del de referencia. El sujeto número 1 (secuencia seguida: B-referencia-A), el 4 (referencia-A-B) y el 22 (referencia-A-B) completaron al menos 2 periodos del estudio, tomando el de referencia en uno de los periodos. Se analizaron muestras de plasma de los 40 participantes que estuvieron involucrados en una o ambas comparaciones (A vs. referencia y B vs. referencia). La disposición de los sujetos durante el estudio se muestra en la Figura 1. La edad media de los mismos fue 27,9 ± 5,6 años, con un peso medio de 61,4 ± 7,2 kg, y una media de índice de masa corporal de 22,3 ± 2,2 kg/m2. El (+) tramadol, (-) tramadol y paracetamol se absorbieron rápidamente tras la administración de cada uno de productos. Se alcanzaron concentraciones plasmáticas adecuadas de (+) tramadol a las 0,75-3 h para el producto A, a las 0,5-4 h para el B, y a las 0,5-3 h para el producto de referencia (Figura 2). En el caso del (-) tramadol se alcanzaron a las 0,75-3 h para el A, a las 0,5-4 h para el B, y 0,5-3 h para el de referencia. Finalmente, para el paracetamol, se alcanzaron a las 0,25-2,5 h para el A, a las 0,5-2 h para el B, y a las 0,25-2,5 h para el de referencia.
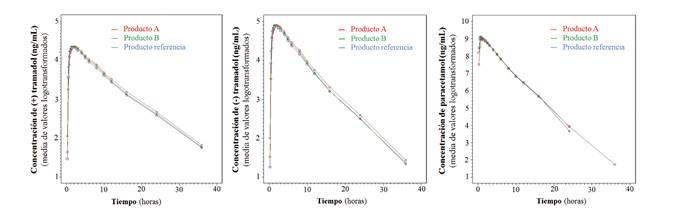
Fig. 2 Concentración plasmática de (+) tramadol, (-) tramadol y paracetamol tras la administración oral de cada uno de los productos en investigación.
Bioequivalencia
Los parámetros farmacocinéticos logotransformados tras la administración de los productos de estudio (A y B) y el de referencia se presentan en la Tabla I. En el análisis de (+) tramadol, (-) tramadol y paracetamol, el IC 90 % de los parámetros principales se situó dentro de los rangos de aceptación del 80-125 % en los 38 voluntarios para el producto A y en los 39 para el producto B. La relación entre el producto A o B y el de referencia en los parámetros farmacocinéticos para (+) tramadol, (-) tramadol y paracetamol calculados para un IC 90 % se presentan en la Tabla II. No se detectó ningún efecto significativo respecto a la secuencia en los parámetros farmacocinéticos logotransformados Cmax, AUC0-t y AUC0-00 para (+) tramadol, (-) tramadol y paracetamol. El análisis para identificar efectos del tratamiento, periodo y secuencia en los parámetros farmacocinéticos para (+) tramadol, (-) tramadol y paracetamol se muestran en la Tabla III. Se observaron efectos respecto a tratamiento y periodo, principalmente para (+) tramadol y (-) tramadol. La potencia estadística para Cmax y AUC0-t logotransformados fue superior al 80 % para (+) tramadol, (-) tramadol y paracetamol.
Tabla I Parámetros farmacocinéticos estimados para los distintos productos de estudio
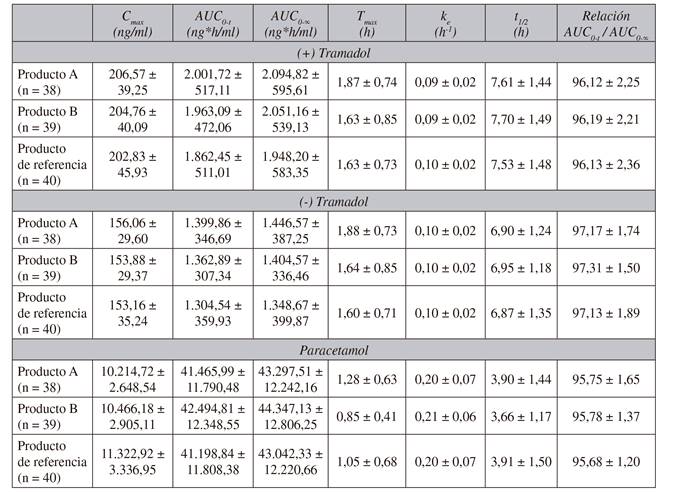
Cmax: concentración máxima. AUC0-t: área bajo la curva de concentración plasmática-tiempo para la última concentración disponible. AUC0-0-0: área bajo la curva de concentración plasmática-tiempo de cero a infinito. Tmax: tiempo para concentración máxima. Ke: constante de eliminación. t1/2: tiempo de vida media.
Tabla II Análisis de bioequivalencia entre los productos A o B y el de referencia para (+) tramadol, (-) tramadol y paracetamol con un intervalo de confianza del 90 %

AUC0-t: área bajo la curva de concentración plasmática-tiempo para la última concentración disponible. Cmax: concentración máxima. IC 90 %: intervalo de confianza al 90 %.
Tabla III Análisis estadístico para determinar posibles efectos del tratamiento, periodo y secuencia en los parámetros farmacocinéticos para (+) tramadol, (-) tramadol y paracetamol
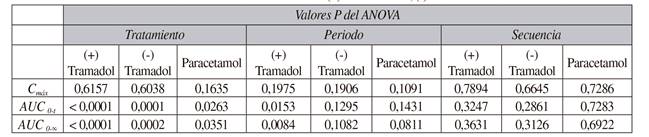
Cmáx: concentración máxima. AUC0-t: área bajo la curva de concentración plasmática-tiempo para la última concentración disponible. AUC0-00 área bajo la curva de concentración plasmática-tiempo de cero a infinito.
Perfil de seguridad
Se reportaron un total de 6 AAs durante el estudio en 6 sujetos participantes: dolor de cabeza (2,4 % del total de voluntarios), mareo (2,4 %), dolor abdominal (2,4 %), picor en antebrazos (2,4 %) y muslos (2,4 %), y elevado recuento de eosinófilos (2,4 %). De los AA, 3 eran esperados y posiblemente relacionados con el producto en investigación. La intensidad de los AA fue desde leve a moderada. No se observó ningún AA grave.
DISCUSIÓN
La demanda de los comprimidos bucodispersables ha ido en aumento a lo largo de la última década 15. El término bucodispersable se refiere a que, al colocar los comprimidos en la boca, se dispersan en menos de 3 minutos antes de tragarlos 21. Al no ser necesaria agua para su ingesta, su administración está ideada para pacientes activos que no dispongan de agua en todo momento, por ejemplo personas ocupadas, trabajadores, deportistas o personas que viajan con asiduidad (16). Además, los comprimidos bucodispersables son idóneos para pacientes con problemas para la deglución, ancianos, encamados, víctimas de ictus 15 y para los que tienen problemas para tragar comprimidos o cápsulas 14. En un cuestionario realizado en 3.279 médicos para conocer su opinión sobre lo que los pacientes piensan respecto a la prescripción de medicamentos, las fórmulas bucodispersables recibieron las mejores puntuaciones en atributos asociados a formas orales 14. De hecho, el 68,3 % y el 49,3 % destacaron la rapidez de acción y la comodidad de uso, respectivamente, como atributos principales de las formas bucodispersables. Por el contrario, las cápsulas y los comprimidos fueron las formas peor puntuadas respecto a rapidez de acción. Además, la ausencia de dificultad en la deglución es un factor que influye positivamente en la adherencia de los pacientes a su terapia.
A su vez, si a esto le añadimos el hecho de combinar dos agentes analgésicos en un único comprimido, se ofrece una posología más cómoda y se reduce el número de fármacos a ingerir, lo que puede facilitar el cumplimiento terapéutico 4.
Según la OMS "dos productos farmacéuticos son bioequivalentes si son farmacéuticamente equivalentes o alternativas farmacéuticas y sus biodisponibilidades, en términos de Cmax, Tmax y de exposición total (AUC), tras su administración en las mismas dosis molares y condiciones, son similares, en tal grado que se puede esperar que sus efectos sean esencialmente los mismos" 22. En el estudio expuesto, los parámetros farmacocinéticos estimados se encontraron dentro del IC 90 % (80-125 %) establecido para confirmar la bioequivalencia. La potencia estadística fue superior al 80 % para (+) tramadol, (-) tramadol y paracetamol. Además, el diagrama de concentración del fármaco en plasma a lo largo del tiempo de Paxiflas(r) (con agua y sin agua) fue coincidente con el de Zaldiar(r). Aunque no se detectaron efectos significativos respecto a la secuencia de administración de los productos, sí se observaron efectos del tratamiento y del periodo en ciertos parámetros farmacocinéticos logotransformados, como AUC0-t. Una de las posibles explicaciones al efecto del tratamiento pudo ser la baja variación intraindividual de los participantes. Respecto al del periodo, se trata de un efecto que se suele observar en estudios de bioequivalencia cruzados tras comparar parámetros farmacocinéticos de un periodo con respecto a otro, independientemente del tratamiento administrado. Este efecto del periodo no se puede eliminar completamente debido a la existencia de factores no controlables durante la realización del estudio clínico, como por ejemplo el estado psicológico de los individuos, que puede diferir entre los periodos del estudio, afectando con ello al tránsito intestinal y la absorción del medicamento. No obstante, la decisión de bioequivalencia se ha establecido en base a la prueba de Schuirmann y el IC 90 % se sitúa dentro de los criterios de aceptación, es decir, 80-125 %, por lo que, en opinión de los autores, los resultados sobre los efectos de tratamiento y de periodo no tienen significación clínica. Finalmente, los comprimidos bucodispersables de Paxiflas(r) fueron bien tolerados, administrados con agua y sin agua. Los AA reportados fueron los mismos descritos para el producto de referencia 18.
CONCLUSIÓN
Los datos del presente estudio demuestran la bioequivalencia entre los comprimidos bucodispersables de Paxiflas(r) (clorhidrato de tramadol 37,5 mg/paracetamol 325 mg), administrados con y sin agua, y los comprimidos de Zaldiar(r), administrados con agua, en términos de velocidad y magnitud de la absorción en condiciones de ayuno. Paxiflas(r) podría facilitar, por su comodidad, el cumplimiento terapéutico, especialmente en pacientes activos y en aquellos con problemas de deglución.