INTRODUCCIÓN
El síndrome de dolor regional complejo (SDRC) fue definido en 1993 por la International Association for Study of Pain (IASP) como una "variedad de condiciones dolorosas de localización regional, posteriores a una lesión, que presentan predominio distal de síntomas anormales, excediendo en magnitud y duración al curso clínico esperado del incidente inicial, ocasionando con frecuencia un deterioro motor importante, con una progresión variable en el tiempo" 1), (2), (3.
Pueden distinguirse dos tipos: el síndrome de dolor regional complejo tipo I (SDRC I), también conocido como distrofia simpático refleja o Sudeck, y el tipo II (SDRC II) denominada causalgia. Aunque la etiología es similar en ambos casos, en el SDRC II es indispensable que exista una lesión nerviosa parcial o total. Esto hace que la incidencia del SDRC II sea menor que la del SDRC I 1),(2),(4.
El SDRC se presenta en 1 de cada 2.000 traumatismos y, según los estudios epidemiológicos realizados, la edad media de presentación se encuentra entre los 32 y 42 años, con predominio del sexo femenino en un 60-80 % 1), (2),(3), (5) (6), (7.
En cuanto a su topografía, la extremidad superior es la más involucrada, pues está más expuesta a lesionarse debido a que es la que nos permite interaccionar con el entorno que nos rodea 7. Aunque es más frecuente la afectación unilateral, no existe predominio estadísticamente significativo de una lateralidad concreta 1), (2), (7.
En el mecanismo fisiopatológico, la lesión inicial origina un impulso doloroso que llega al sistema nervioso central (SNC) y de ahí al sistema nervioso simpático, produciendo un espasmo vascular que genera extravasación, edema y dolor, iniciando así un círculo vicioso de edema y dolor 1), (5) ,(7), (8), (9), (10.
Clínicamente, la evolución se realiza en dos tiempos: una "fase caliente" pseudo-inflamatoria o edematosa, y una "fase fría" que cursa con fibrosis cutánea y amiotrofia más o menos asociada a otros trastornos tróficos 8), (11). Sin embargo, su evolución es imprevisible, llegando a ocasionar un deterioro funcional importante y afectación de la calidad de vida 8.
Existen diversos abordajes terapéuticos entre los que encontramos el tratamiento médico y farmacológico, tratamiento psicológico, terapia ocupacional, tratamiento rehabilitador y más recientemente el tratamiento con estimulación eléctrica medular (EEM). Aunque el abordaje terapéutico del SDRC requiere de un enfoque multidisciplinar, lo más importante es que el tratamiento sea precoz, individual, progresivo e indoloro 1), (2), (5), (8).
La EEM está basada en la teoría de la compuerta propuesta por Melzack y Wall en 1965. Dos años más tarde, Shealey fue el primero en aplicar EEM en clínica humana. Sin embargo, en los primeros estudios no se obtuvieron resultados regulares, ya que no se siguió ningún criterio de selección para la patología o el tipo de paciente. Debido a esto, en 1998 el grupo europeo para el estudio del dolor estableció los criterios de selección para la implantación de la EEM (Tabla I) 4), (5), (12.
El equipo de la EEM está formado por los electrodos que son implantados a nivel medular, el generador que se inserta a nivel subcutáneo y un programador mediante el cual se puede controlar la intensidad de la estimulación 4), (5), (13), (14
La estimulación medular se realiza en dos fases: en la primera fase solo se implantan los electrodos en el nivel deseado y durante una semana el paciente permanece con estimulación de prueba. Si durante este tiempo el dolor disminuye más del 50 %, se da paso a la segunda fase en la que se implanta el sistema definitivo y, mediante un programador externo, se adapta la intensidad de la estimulación 4), (5), (9), (12), (14), (15), (16.
Los objetivos de este artículo son identificar los parámetros de intervención de la EEM y las variables analizadas en los estudios, así como conocer la eficacia de la EEM en el SDRC I.
MATERIAL Y MÉTODOS
Para cumplir los objetivos se realizó una revisión bibliográfica. Se consultaron las bases de datos y plataformas editoriales Pubmed, LILACS, IBECS, SPORTDiscus, Academic search complete, CINAHL, PEDro, Proquest, Elsevier, OVID, ScienceDirect y SpringerLink. La última búsqueda en todos los recursos documentales se realizó en junio de 2016.
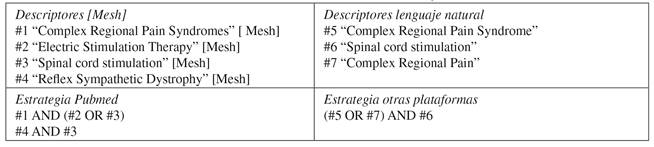
Los descriptores y estrategias utilizadas pueden observarse en la Tabla II. Solo en las bases de datos EBSCO, PEDro y ScienceDirect se especificó que los descriptores apareciesen en título y resumen. Una vez recopilados todos los artículos, se realizó una búsqueda en abanico a partir de sus referencias bibliográficas.
La búsqueda se limitó a estudios publicados en los últimos 15 años. Se incluyeron los ensayos clínicos e informes de casos donde la patología estudiada fuera el SDRC I y el tratamiento, de al menos un grupo, debía incluir la EEM.
Los criterios de exclusión aplicados fueron que la patología estudiada fuese dolor crónico o neuropático, síndrome postquirúrgico (FBSS) y el SDRC II; y que el tratamiento se basara exclusivamente en bloqueos del ganglio estrellado, tratamiento farmacológico y estimulación eléctrica no medular (TENS, electroacupuntura, etc.). Además, fueron excluidos artículos en los que se presentaron complicaciones con la anestesia y estudios realizados en animales.
RESULTADOS Y DISCUSIÓN
Se seleccionaron 22 estudios (Figura 1), de los cuales 11 fueron ensayos clínicos (8 ensayos clínicos aleatorizados y 3 ensayos clínicos no controlados) y 11 informes de casos (5,10,14,15,17-34).
Como podemos observar en la Tabla III, en general las muestras estaban formadas por más mujeres que hombres, la edad media fue de 33 años en los ensayos clínicos y 44 años en los informes de casos, y el número de sujetos con afectación del miembro superior fue mayor que el número de sujetos con afectación de miembro inferior.
Tabla III CARACTERÍSTICAS DE LOS ESTUDIOS SELECCIONADOS
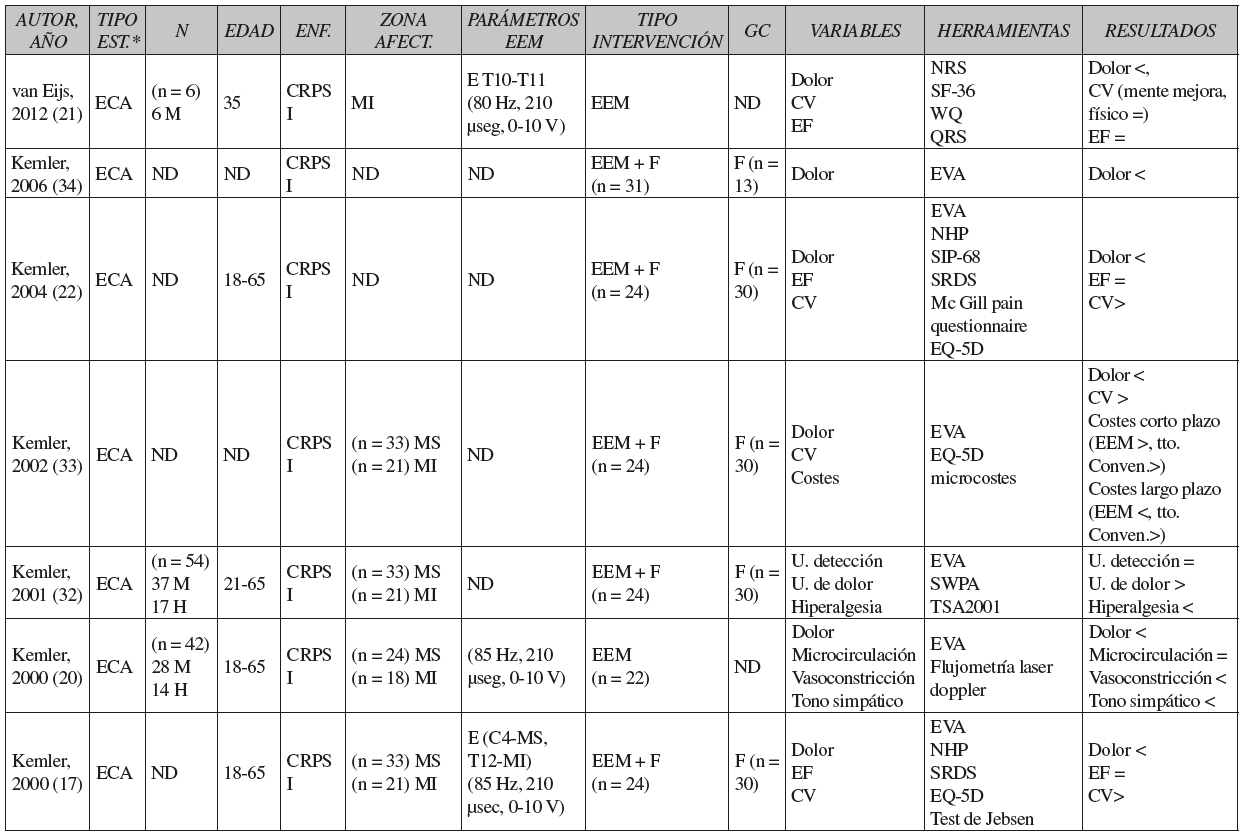
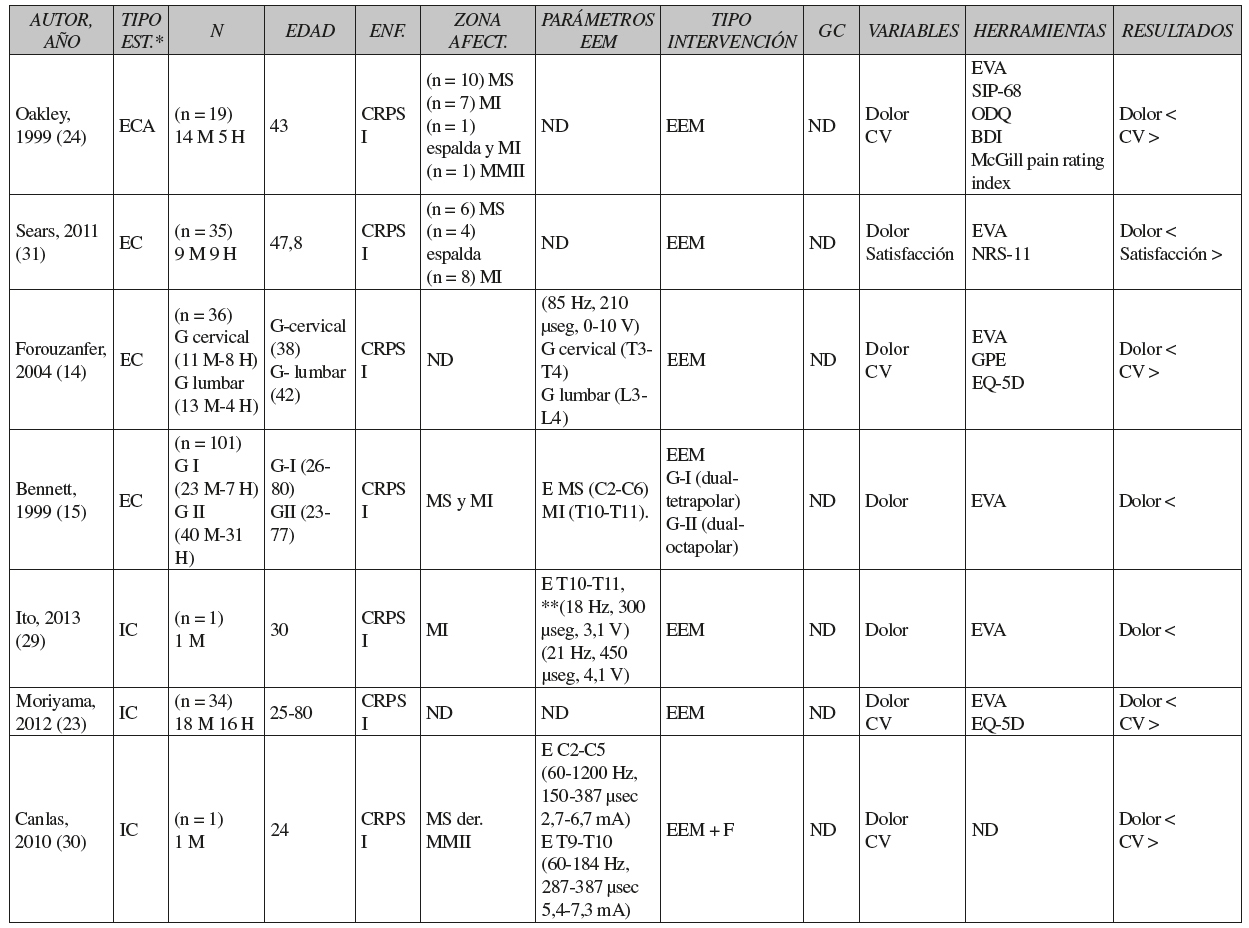
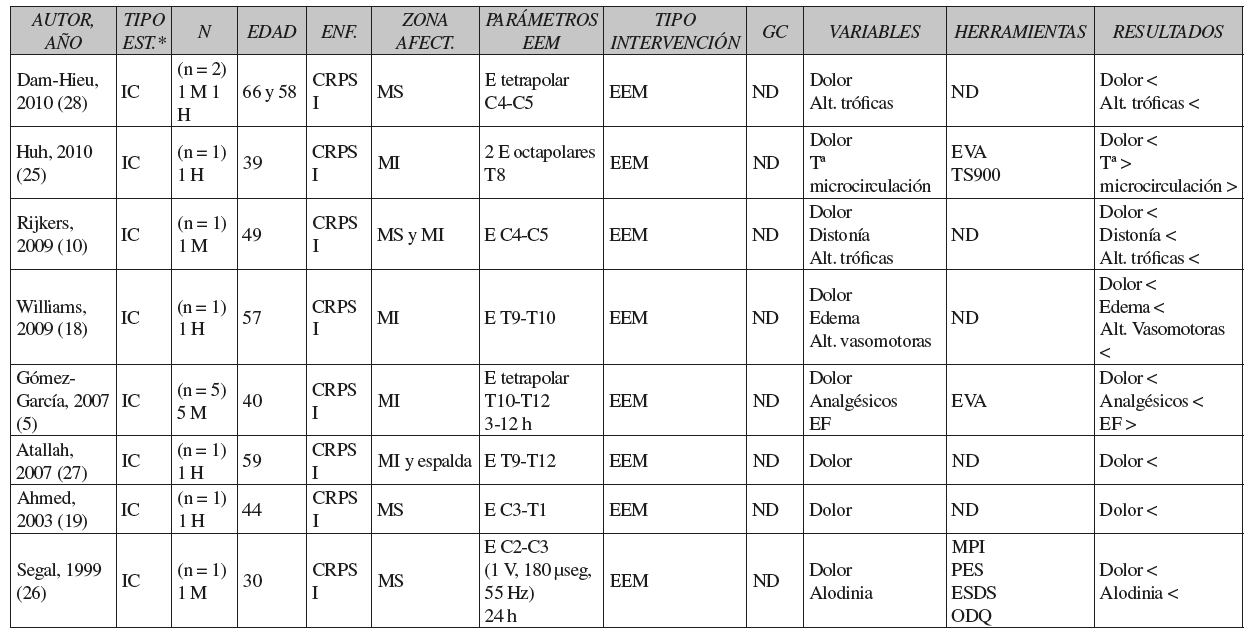
*Tipo de estudio. ECA: ensayo clínico aleatorizado. EC: ensayo clínico no controlado. IC: informes de casos o casos clínicos. N: tamaño de la muestra. M: mujer. H: hombre. ND: no describe. G I y G II: grupos de intervención 1 y 2. MS: miembro superior. MI: miembro inferior. C: vértebras cervicales. T: vértebras torácicas. L: vértebras lumbares. EEM: estimulación eléctrica medular. F: fisioterapia. GC: grupo control. U: umbral. CV: calidad de vida. EF: estado funcional. E: electrodo. >: aumenta. <: disminuye. =: no varía.
**Parámetros de la EEM antes y durante el embarazo. SWPA: The Semmes-Weinstein Pressure Aesthesiometer. TSA2001: Thermal Sensory Analyser. NHP: Nottingham Health Profile. SRDS: Self rating depression scale. SIP-68: Sickness Impact Profile 68. ODQ: Oswestry disability questionnaire. BDI: Beck depression inventory. NRS: Numerical pain rating score. SF-36: Short Form. WQ: Walking questionnaire. QRS: Questionnaire rising and sitting down. MPI: multidimensional pain inventory. PES: pain experience scale. ESDS: epidemiological studies depression Scale. GPE: Global Perceived Effect. TS900: Thermovision Scanner 900 SW-TE. EVA: Escala visual analógica del dolor. EQ-5D: EuroQol 5 dimensions.
En todos los estudios, al menos un grupo de pacientes recibió EEM y solo en 5 ensayos clínicos y 1 informe de casos se aplicó la EEM combinada con fisioterapia 17), (22), (30), (32), (33), (34. Por otro lado, 5 ensayos clínicos aplicaron al grupo control un programa de fisioterapia formado por ejercicios para mejorar la fuerza y la movilidad 17), (22), (32), (33), (34.
VARIABLES Y HERRAMIENTAS DE MEDICIÓN
En cuanto a las variables, cabe destacar que todos los artículos centraron su atención en el dolor. Además, 8 estudios analizaron la variable calidad de vida 14), (17), (21), (22), (23), (24), (30), (33, 4 artículos estudiaron el estado funcional 5), (17), (21), (22, 3 estudios analizaron las alteraciones tróficas 10), (18), (28 y 3 artículos estudiaron las alteraciones vasomotoras 18), (20), (25.
En relación a los instrumentos utilizados para evaluar las intervenciones, la mayoría de los artículos analizaron el dolor con la escala visual analógica (EVA); además de esta, 3 artículos utilizaron el McGill Pain Questionnaire 17), (22), (24), 2 estudios emplearon el Numerical Pain Raiting Score (NRS-11) 21), (31 y 1 artículo utilizó el Multidimensional Pain Inventory y la Pain Experience Scale 26.
Para evaluar la calidad de vida, 5 artículos emplearon la EuroQol-5 Dimensions (EQ-5D) 14), (17), (22), (23), (33, 2 artículos emplearon el Nottingham Health Profile y la Self Rating Depression Scale 17), (22, el Sickness Impact Profile-68 22), (24, y el Oswestry Disability Questionaire 24), (26, 1 artículo empleó la SF-36 21 y 3 estudios usaron el Beck Depression Inventory, la Epidemiological Studies Depression Scale y el Global Perceived Effect (GPE) 14), (24), (26.
El estado funcional y las alteraciones vasomotoras fueron analizadas con herramientas como el Walking Questionnaire (WQ), Questionnaire Rising And Sitting Down (QRS) y la flujometría láser doppler, entre otras 20),(21.
También fueron analizadas, aunque en menor medida, la temperatura, la satisfacción de los pacientes y los costes del tratamiento 25), (31), (33, para las que se utilizaron herramientas como Thermovision Scanner 900 SW-TE (TS900) o los estudios de microcostes 25), (33.
EFICACIA DE LA EEM SOBRE EL DOLOR
Todos los autores coinciden en que la aplicación de EEM en sujetos con SDRC tipo I en los cuales han fracasado el resto de tratamientos supone una reducción importante del dolor 5), (10), (14), (15) ,(17), (18), (19), (20), (21), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34.
7 ensayos clínicos y 10 informes de casos analizaron la variación del dolor antes y después de la EEM. Dichos estudios observaron que, previo al implante, el dolor oscilaba de 6 a 10 puntos según EVA y, posteriormente, tras recibir la EEM, los valores disminuían hasta un rango de 0 a 5 puntos según EVA 5), (10), (14), (15), (17), (18) ), (19), (20), (24), (31), (32), (33), (34.
Bennett y cols. (1999) compararon la variación del dolor según el tipo de electrodo implantado. En su estudio, el grupo que recibió estimulación con 2 electrodos tetrapolares obtuvo valores de 8 puntos según EVA preimplante; estos disminuyeron hasta 4,26 puntos según EVA postimplante. Sin embargo, aunque la reducción del dolor fue significativa en ambos grupos, el grupo que recibió la estimulación con 2 electrodos octapolares obtuvo una reducción mayor, pasaron de 8,17 puntos a 2,17 puntos según EVA 15.
Por otro lado, 5 ensayos clínicos hacen referencia a la mejoría del dolor cuando combinamos la EEM con la fisioterapia. De este modo, aquellos sujetos que recibieron EEM junto a fisioterapia, experimentaron una reducción de 2 a 3 cm según EVA 17), (22), (32), (34, mientras que en 3 de los 5 ensayos clínicos el grupo control que solo recibió tratamiento con fisioterapia, experimentó una reducción del dolor de 0 a 1 cm según EVA 32) (33), (34.
Cabe destacar que en 2 ensayos clínicos, el dolor empeoró en el grupo control. El grupo control que fue tratado exclusivamente con fisioterapia experimentó un aumento del dolor de 0 a 0,2 puntos según EVA 17), (22, ya que en determinadas ocasiones, sobre todo en la fase aguda de la enfermedad, la fisioterapia puede constituir un factor nocivo al aumentar el tono simpático 1), (8.
Del mismo modo, 5 ensayos clínicos y 1 informe de casos mencionan que la reducción del dolor es más significativa a corto plazo 14), (17), (19), (22), (33), (34, pues a partir de los 2 años de estimulación los efectos de la EEM sobre el dolor comenzaron a disminuir, pero aun así la reducción del dolor que se obtuvo posteriormente fue significativa.
No obstante, esto dependerá de cada paciente, ya que 3 informes de casos defienden la efectividad de la EEM sobre el dolor a largo plazo, pues en dichos artículos, a partir de los 2 años, la reducción del dolor continuó siendo tan importante que los pacientes incluso llegaron a desconectar el dispositivo, desde unas horas, a todo el día 18), (28), (29.
En definitivas, de forma general el dolor mejoró tanto en el grupo experimental como en el grupo control, aunque la reducción fue mayor en el grupo experimental que recibió la EEM. Sin embargo, cabe destacar que en 2 ensayos clínicos, el dolor aumentó en el grupo control que solo fue tratado con fisioterapia 17), (22.
EFICACIA DE LA EEM SOBRE LA CALIDAD DE VIDA
En esta revisión se incluyen 6 ensayos clínicos y 2 informes de casos que hacen referencia a la calidad de vida 14), (17) ,( 21) (22), (23), (24), (30), (33.
En todos los estudios que midieron la calidad de vida del paciente se observó una relación directa con el efecto de la EEM sobre el dolor, de forma que en todos los casos se produjo una mejoría de la calidad de vida.
Esta idea se refuerza con estudios como el de Kemler y cols. (2000), en el que la calidad de vida solo mejoró en el grupo experimental, mientras que en el grupo control, donde el dolor empeoró, la calidad de vida no mejoró 17.
Cabe destacar que Forouzanfer y cols. (2004) compararon la efectividad de la EEM en la calidad de vida en función del nivel de estimulación. En su estudio, compararon los resultados de la estimulación a nivel T3-T4 con la estimulación a nivel L3-L4. En ambas intervenciones se obtuvo una reducción del dolor y un aumento de la calidad de vida. No se encontraron diferencias significativas entre los dos grupos 14.
Finalmente, en 2 informes de casos, la mejora es tan importante que el paciente pudo ayudar en las tareas de casa o incluso reincorporarse a su trabajo 5), (19.
EFICACIA DE LA EEM EN OTRAS VARIABLES
Respecto a la relación del dolor con las alteraciones vasomotoras, William y cols. (2009) y Kemler y cols. (2000) coinciden en que la vasoconstricción disminuye con la EEM 18), (20. A pesar de esto, Kemler y cols. (2000) no encontraron cambios significativos en la microcirculación. Por ello se intuye que la reducción del dolor que origina la EEM parece no estar mediada por la influencia de dicho tratamiento en la microcirculación tisular, sino que la reducción del dolor se debe a la inhibición del sistema simpático que provoca la vasoconstricción 20.
Aunque en los ensayos clínicos no se evidenció cambios en la microcirculación, en el caso clínico presentado por Huh y cols. (2010) sí se aprecia un aumento de la microcirculación. Esto parece estar relacionado con el hecho de que en este caso la estimulación fue aplicada mediante dos electrodos octapolares 25.
Por otro lado, son múltiples las alteraciones tróficas que ocasiona el SDRC. Dichas alteraciones condicionan en gran medida la vida de las personas que las sufren. Es por ello que 3 informes de casos centraron su investigación en observar los efectos de la EEM sobre las alteraciones tróficas. Así pues, tras realizar la estimulación, los tres estudios concluyeron que la EEM mejora las alteraciones del trofismo tisular, llegando incluso en algunos casos a desaparecer por completo 10), (18), (28.
Con relación al estado funcional, 3 ensayos clínicos concluyen que la EEM no ocasiona cambios significativos en la funcionalidad 17), (21), (22. Sin embargo, un caso clínico en el que se estudió a 5 mujeres con afectación del miembro inferior, concluyó que la EEM mejoró el estado funcional, ya que permitió conseguir un 90 % de independencia para las actividades de la vida diaria y un 70 % de independencia para la marcha 5.
Del mismo modo, Canlas y cols. (2010) estudiaron el caso de una mujer con afectación del miembro superior y el miembro inferior que estaba obligada a desplazarse con una silla de ruedas. Tras la estimulación mejoró su funcionalidad y fue capaz de deambular con la ayuda de una muleta 30.
En relación a la temperatura, 1 ensayo clínico centró su atención en estudiar los efectos de la EEM sobre los umbrales de detección del frío y el calor. Tras aplicar la estimulación, no se apreció ninguna variación en los umbrales de detección 32.
Por otro lado, el caso clínico presentado por Huh y cols. (2010) estudió los efectos de la EEM sobre la temperatura de los miembros afectados. En dicho estudio se evidenció un aumento de la temperatura en los miembros afectados debido al aumento de la microcirculación 25.
En base a estos resultados, se intuye que la EEM puede modificar la temperatura de los miembros afectados gracias a su efecto inhibitorio de la vasoconstricción, pero no puede modificar el umbral de frío o calor 25), (32.
En relación a los costes de los tratamientos, 2 ensayos clínicos y 1 informe de casos afirmaron que, a partir del tercer año, los costes del tratamiento con EEM son menores que los del tratamiento convencional, dado que el 83 % del gasto ocasionado el primer año referente a los costes de la implantación del dispositivo ya no se realiza 22) ,(30), (33.
Finalmente, un ensayo clínico recogió datos sobre la satisfacción de los pacientes en relación a los beneficios obtenidos con la EEM. Este estudio concluye que los pacientes volverían a utilizar la EEM, ya que este tratamiento es el único que les aporta un resultado positivo en la reducción del dolor una vez que han fracasado el tratamiento médico y rehabilitador 31.
En conclusión, la estimulación eléctrica medular es efectiva en la reducción del dolor y en la mejora de la calidad de vida, sobre todo a corto plazo. Además existen expectativas respecto a su efectividad a largo plazo.
Del mismo modo, la EEM influye sobre la temperatura, mejora las alteraciones tróficas y disminuye los costes del tratamiento. Sin embargo, no está claro el papel de la EEM en las alteraciones vasomotoras y el estado funcional del paciente.