INTRODUCCIÓN
A finales del siglo pasado se publicó en el Reino Unido uno de los primeros artículos sobre dolor asociado a cirugía y traumatismos 1 y en ese mismo periodo Mac Rae y su grupo de trabajo realizaron la primera definición de dolor crónico posquirúrgico (DCPQ) 2. En la primera década del presente siglo, el propio Mc Rae publicó una revisión sobre el tema donde se reflexiona sobre la definición y los problemas en la investigación 3, y a finales de la pasada década se realizó una nueva publicación revisando la definición y situación del problema 4. Gracias a estos trabajos y a los de otros investigadores, la comunidad científica ha tomado conciencia de la importancia del problema y se ha promovido un cambio en la valoración de la importancia que el dolor crónico posoperatorio supone tanto en la vertiente de sufrimiento físico y emocional de los pacientes, como de su carga económica. De una manera simbólica, podemos entender que los esfuerzos promovidos por la IASP con la proclamación del 2017 como "Año Internacional Contra el Dolor Después de la Cirugía" 5 y su reciente incorporación del término dolor crónico posquirúrgico o dolor postraumático en la clasificación ICD-11 6, como el reconocimiento al esfuerzo de todos estos investigadores por promover un cambio de mentalidad en la percepción de este problema tanto en los ámbitos sanitarios, como en los gubernamentales y de organizaciones de pacientes.
En la revisión de Werner 4 se define el DCPQ como el dolor que se desarrolla o incrementa después de una intervención, la duración del dolor se amplía a un periodo de 3-6 meses y debe afectar la calidad de vida del paciente (Health-related quality of life [HR-QOL]); el dolor se presenta como continuación de un dolor agudo posoperatorio o aparece después de un periodo asintomático. El dolor se localiza en el campo operatorio, se proyecta al territorio nervioso de un nervio situado en el campo quirúrgico o se refiere a un dermatoma y finalmente se deben excluir otras causas.
El síndrome doloroso posmastectomía (SDPM) ha sido definido recientemente por Waltho y Rockwell 7 (estos criterios han sido publicados en nuestra lengua en una carta al Director en la RESED) 8, que describen esta situación como: un dolor que se produce después de cualquier cirugía de mama; es de, al menos, intensidad moderada, presenta características neuropáticas, se localiza en la mama, pared torácica, axila, o brazo ipsilateral, tiene una duración mínima de 6 meses, ocurre al menos el 50 % del tiempo y puede ser exacerbado por los movimientos de la cintura escapular. Es probablemente secundario a una lesión del nervio intercostobraquial y/o intercostales durante la disección a nivel axilar, lo que explica las características neuropáticas de este dolor 9 10-11. El SDPM aparece en la nueva clasificación ICD-11 como un subgrupo de DCPQ. 6
La incidencia documentada de SDPM varía según las publicaciones entre un 11-57 %, bajando a un 5-10 % en caso de que sea severo, destacando que hasta el 65 % de los casos presentan características neuropáticas 12.
El objetivo del estudio fue determinar la frecuencia y la intensidad del dolor crónico tras mastectomía e identificar posibles factores de riesgos para su desarrollo.
PACIENTES Y MÉTODOS
Se realizó un análisis retrospectivo de todas las mastectomías parciales o totales, con o sin vaciamiento ganglionar, realizadas en el Hospital Meixoeiro de Vigo, entre el 1 de enero de 2017 y el 31 de diciembre de 2017. El protocolo del estudio fue aprobado por el comité de ética (n.º 486) y todos los pacientes, excepto uno, dieron su consentimiento para incluirlos en el estudio. Se excluyeron del análisis los pacientes varones, las reintervenciones y las pacientes fallecidas.
A todas las pacientes que cumplían criterios de inclusión se les realizó un cuestionario telefónico un año después de la intervención quirúrgica para evaluar la presencia, localización, intensidad y temporalidad del dolor. Las pacientes que tras tres llamadas no fueron localizadas se excluyeron del estudio.
Las variables de estudio fueron recogidas de la base de datos del hospital.
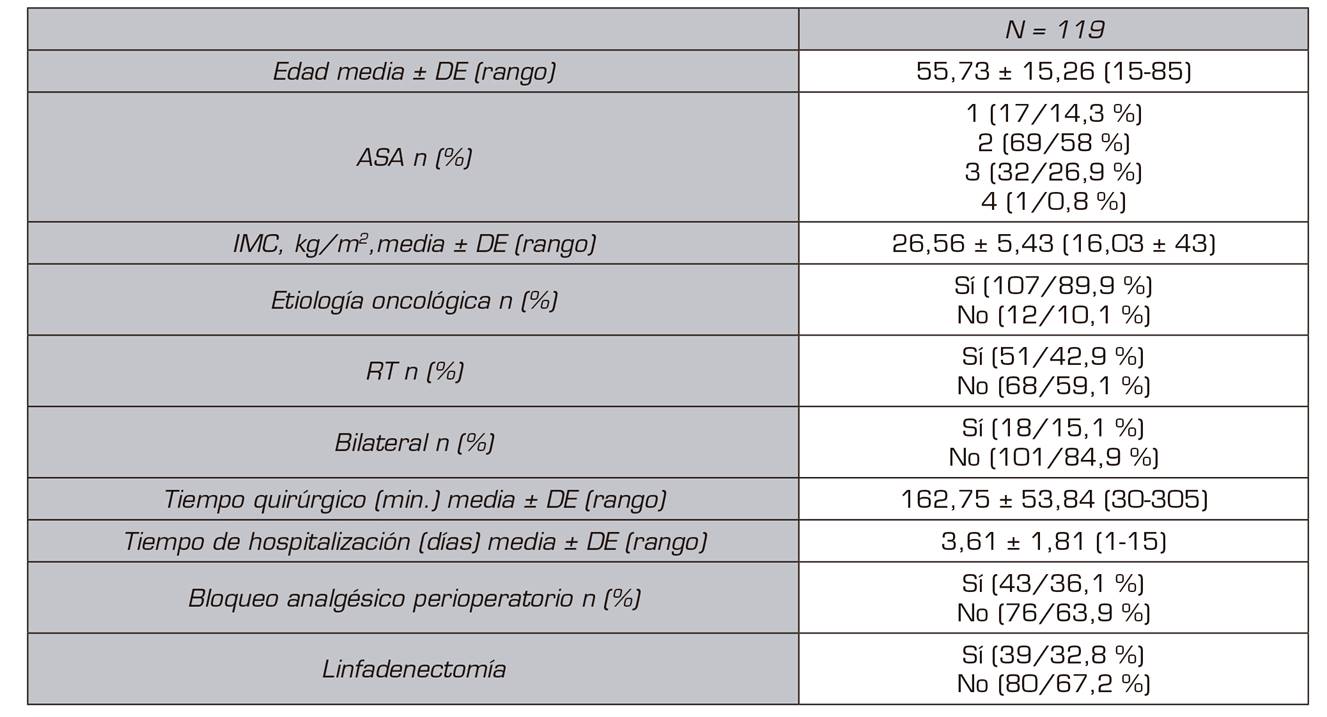
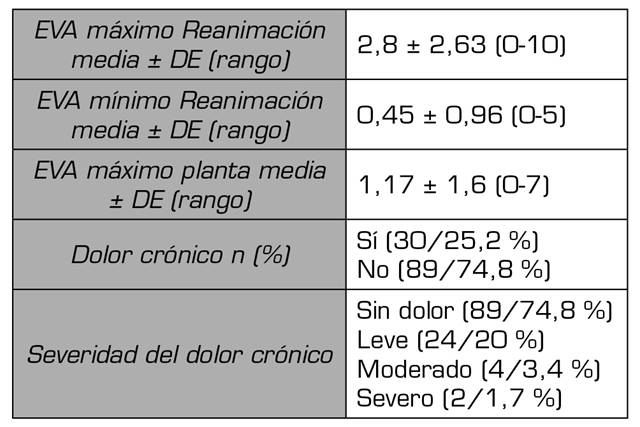
La variable principal fue el dolor crónico posquirúrgico evaluado al año de la intervención; se recogió la variable existencia del dolor y la variable intensidad de dolor evaluada mediante la Escala Verbal Numérica (EVN), con un rango de 0 (nada de dolor) a 10 (el máximo dolor). Para el presente estudio se establecieron tres intensidades de dolor estandarizadas: dolor leve EVN ≤ 3 , dolor moderado 4-7, dolor severo ≥ 8.
Las variables secundarias evaluadas fueron: dolor posoperatorio máximo en la unidad de reanimación, dolor máximo en la planta de hospitalización, variables demográficas: edad, sexo, IMC; estado físico previo estratificado mediante la escala de riesgo anestésico (American Society of Anesthesiologists o ASA), indicación quirúrgica (mastectomía de etiología oncológica o no), si precisó linfadenectomía, tiempo de cirugía, tipo de anestesia (general o combinada) y si precisó radioterapia como tratamiento coadyuvante.
Para las variables categóricas los resultados se presentaron como número de casos y porcentaje. Para las variables cuantitativas se expresaron como media ± desviación estándar. La comparación de las variables con el dolor crónico posoperatorio se realizó con el test de Chi cuadrado. Se utilizó el test de la t de Student o el test de ANOVA para variables cuantitativas y las pruebas Chi cuadrado y test exacto de Fisher para las variables cualitativas. Con los resultados clínicamente relevantes y que mostraron diferencias estadísticamente significativas en el análisis bivariado se realizó un análisis multivariado con regresión logística. Para validar dicho modelo, se empleó el test de bondad de ajuste de Hosmer y Lemeshow. El análisis estadístico se realizó con el programa SPSS (versión 25.0). Se fijó la probabilidad de cometer un error de tipo I en un 5 % ((= 0,05) con una aproximación bilateral.
RESULTADOS
En el periodo de estudio se realizaron por parte de la unidad de mama un total de 654 cirugías, de las cuales fueron mastectomías 130, se excluyó un paciente varón, 8 pacientes fallecidos. Se contactó con 121 pacientes, se excluyeron del análisis 2 pacientes, uno que expresó su deseo de no participar y uno que no se localizó tras 3 llamadas repetidas, dejando para el análisis 119 pacientes (91,5 %).
De estos, 119 pacientes refirieron dolor 30 pacientes (25,2 %), dolor leve 24 pacientes, dolor moderado 4 pacientes y dolor severo 2 pacientes. En la Tabla 1 se muestran las variables demográficas y perioperatorias. En la Tabla 2 podemos observar la incidencia de dolor estratificada por grupos de edad, ASA, causa de la cirugía, RT perioperatoria, mastectomía unilateral vs. bilateral, linfadenectomía, tipo de anestesia. No hubo relación entre el riesgo de dolor crónico y cualquiera de las variables analizadas.
Cuando analizamos el resto de variables (tiempo quirúrgico, tiempo de hospitalización, dolor máximo en reanimación o dolor máximo en planta de hospitalización) se observa en el diagrama de cajas para la variable EVA máximo en Reanimación (EVAmaxREA) en relación con la presencia o no de dolor crónico que en esta distribución podría haber diferencias entre ambos grupos. Para el resto de variables cuantitativas, la distribución del diagrama de cajas fue similar en ambos grupos. Haciendo una t de student se confirma que la diferencia entre ambos grupos en relación con EVA máximo en Reanimación es significativa (p = 0,02) (Figura 1). A continuación realizamos modelo de regresión logística con todas las variables. En el modelo sigue apareciendo como significativa la variable EVAmaxREA, pero ninguna de las demás (Tabla 3).
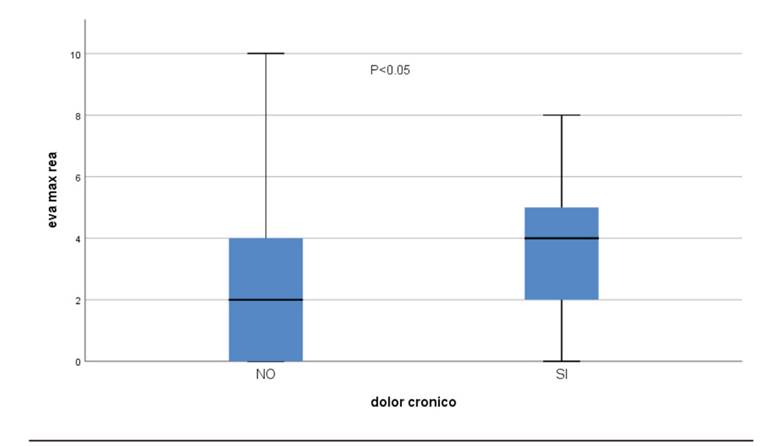
FIG. 1. DIAGRAMA DE CAJAS PARA LA VARIABLE EVAMAXREA EN RELACIÓN CON LA PRESENCIA O NO DE DOLOR CRÓNICO.
TABLA III. VARIABLES EN LA ECUACIÓN
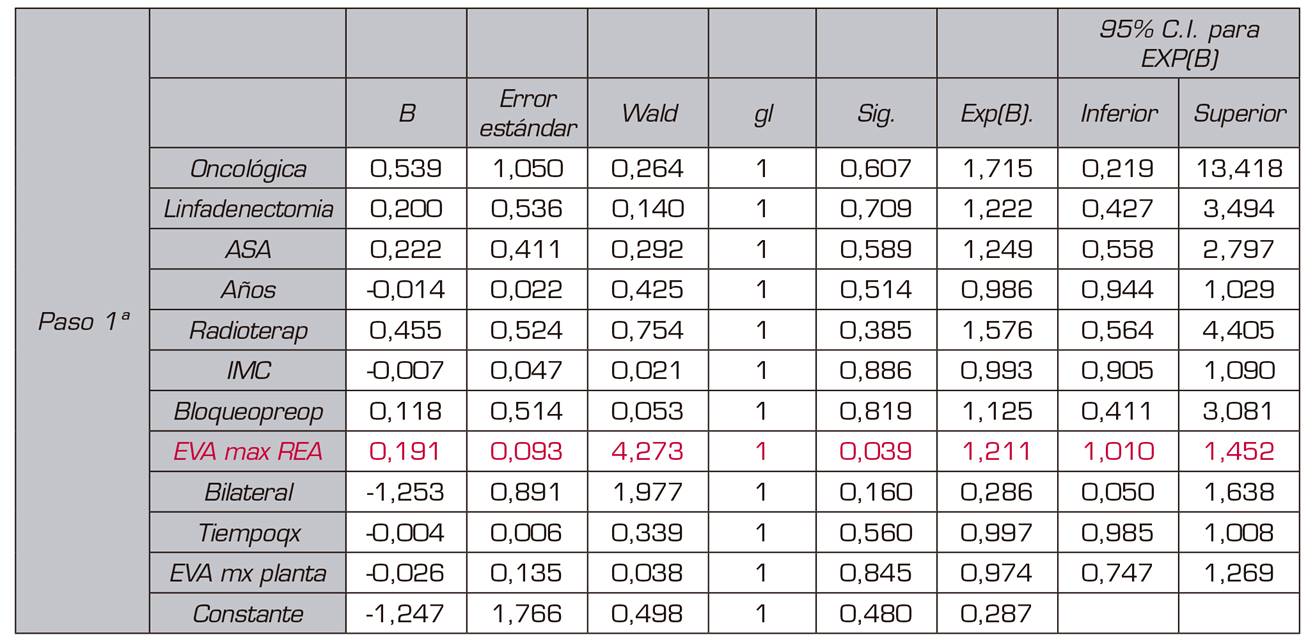
a. Variables especificadas en el paso 1: oncológica, linfadenectomía, asa, años, radioterap, IMC, bloqueopreop, eva max rea, bilateral, tiempoqx, eva mx planta
El test de bondad de ajuste nos sale significativo (p < 0,05), lo que significa que nuestro modelo no se ajusta correctamente a nuestras observaciones. El modelo de regresión logística binaria con un McFadden del pseudo R-cuadrado de 0,0340 es muy bajo para nuestro modelo; este valor nos indicaría que nuestro modelo solo explicaría correctamente el 6 % de la ocurrencia de la variable dependiente. Por tanto, este modelo no es válido para explicar el desarrollo de dolor crónico tras mastectomía.
En el caso del primer y principal objetivo del estudio, calcular la incidencia en nuestra población de SDPM, hemos hallado la proporción y su intervalo de confianza al 95 %. Para una n = 119, el margen de error estimado en nuestro estudio es del 8 %.
DISCUSIÓN
El síndrome de dolor posmastectomía (SDPM) es una entidad clínica que no ha sido bien definida, a pesar de que se han utilizado varias definiciones en la literatura. Esto se ha traducido en una diferencia metodológica en los estudios clínicos, por lo que dichos resultados no se pueden extrapolar entre los diferentes estudios por carecer de una definición estandarizada y el criterio de referencia, en muchos artículos, es el diagnóstico del clínico experimentado basado en guías de práctica clínica 13.
La incidencia del SDPM se describe en la bibliografía con una media de 36,2 % con unas variaciones entre el 13 y 69 % 10,11.
En nuestro estudio de los 119 pacientes estudiados, 30 pacientes refirieron dolor de diferente intensidad al cabo de un año de su cirugía, lo que representa el 25,2 % del total.
De estos 119 pacientes 24 presentaron dolor leve, 4 pacientes dolor moderado y 2 pacientes dolor severo. Vilholm y cols. 14 encuentran al aplicar una encuesta a pacientes en que se había practicado mastectomía oncológica, y al compararlo con un grupo de mujeres con cáncer de mama que recibieron tratamiento no quirúrgico, que el 23 % padecían dolor crónico compatible con síndrome de dolor posmastectomía, del cual el 6 % al ser cuestionada por cuánto afectaba su dolor en las actividades diarias respondió como "demasiado" o "bastante". Los pacientes del estudio de Vilholm y cols. tuvieron una incidencia de dolor crónico muy similar a nuestro estudio: el 23,9 % frente al 25,2 % de nuestro estudio. Además, de estos pacientes con SDPM un 6 % presentaron una dolor crónico moderado/intenso frente al 5,1 % de nuestro estudio. Por tanto, ambos estudios presentan unas incidencias similares. Incidencias similares fueron previamente descritas en las cohortes estudiadas por Carpenter y cols. 27 %. 15. Sin embargo, encontramos otros estudios, como el de Perkins, que encuentra una incidencia de dolor crónico en su estudio de 50 % para mastectomía 16 y Smith y cols. del 43 % 17. Toda esta variabilidad viene determinada por los diferentes criterios para establecer el SDPM y la sintomatología asociada.
En la bibliografía se asocian varios factores de riesgos para la aparición de SDPM posterior en cirugía oncológica de mama 18,19. Couceiro publicó en febrero de 2014 un estudio de 250 pacientes donde objetiva un SDPM en el 44,4 % de las pacientes y tras haber valorado distintas variables como características sociales, biológicas, dismenorrea, cefalea, dolor agudo posoperatorio y tipo de cirugía, concluye que el SDPM se asociaba a cuadrantectomía con linfadenectomía axilar, historia previa de cefalea y menores de 50 años 20. Johannsen y cols. realizaron un estudio a escala nacional con el propósito de investigar la prevalencia y factores de riesgo del SDPM en dos periodos (a los 15 meses y a los 7-9 años) tras la cirugía donde incluyeron a 3343 pacientes de las cuales fueron analizadas 1905. A los 15 meses, un 32,7 % refería dolor al menos diario, disminuyendo la prevalencia a los 7-9 años al 20,4 %. Los factores significativamente asociados con dolor a los 15 meses fueron edad joven, bajo nivel cultural, cirugía axilar, cirugía más agresiva tratamiento endocrino posmenopáusico, hábitos tóxicos (fumadora mayor 10 cigarrillos día), obesidad con IMC entre 30-35 % y a los 7-9 años solo la cirugía axilar, el tratamiento endocrino y peor estado físico. Esto hace pensar a los autores que la influencia de los factores de riesgo cambia con el paso del tiempo 21. Lo mismo concluye Mejdahl y cols., que observan en un periodo de 4 años ligero descenso de la prevalencia del dolor del 45 % (N = 1090) a los 2 años y desciende a un 37 % cuatro años después 22, por lo que es importante determinar en qué momento se realiza el estudio, debido a que la prevalencia en un primer momento asciende y luego tiende a disminuir con el paso del tiempo.
Con respecto a los factores perioperatorios, aunque no era el objetivo principal del estudio, no se han encontrado diferencias significativas entre las variables estudiadas (edad, ASA, causa de la cirugía, radioterapia perioperatoria, mastectomía unilateral vs. bilateral y linfadenectomía) o la técnica anestésica y analgésicas empleadas en el perioperatorio. Únicamente el EVA máximo en la Unidad de Reanimación posoperatoria fue estadísticamente significativa entre los dos grupos. Sin embargo, aunque la diferencia no es significativa en el modelo multivariado, sí hay una tendencia que apunta a que un mayor dolor en reanimación conlleva mayor riesgo de SDPM. Quizás estas diferencias llegarían a ser estadísticamente significativas si la muestra analizada fuese mayor. Esto concuerda con las referencias de la literatura, donde uno de los factores para la aparición del SDPM es el manejo subóptimo del dolor perioperatorio 23,24, ya sea con técnicas locorregionales preincisionales 25 como el el perioperatorio. Una revisión Cochrane sobre cómo la anestesia regional puede reducir el riesgo de dolor crónico concluye que los bloqueos regionales son efectivos para reducir el dolor crónico después de la cirugía de cáncer de mama 26.
A nivel nacional no contamos con estadísticas referentes al SDPM que nos permitan evaluar su magnitud y plantear la posibilidad de intervenciones oportunas, e incluso preventivas, que permitan disminuir su incidencia. Nuestra percepción es que la incidencia de SDPM es similar a la del resto de pacientes oncológicos a diferencia de lo que se publica en otros, como el de Perkins 16, que habla de un porcentaje del 50 % de los pacientes mastectomizados.
Las limitaciones de este estudio son debidas a que la recogida de casos solo se ha realizado en un solo centro (con todos los sesgos que eso produce, tanto de tipo de cirugía, técnicas anestésicas...); además es un estudio retrospectivo, por lo tanto, no aleatorizado.
Una de las limitaciones principales de nuestro estudio es el tamaño muestral, aunque el estudio es válido para demostrar la incidencia del SDPM. Al calcular el número de pacientes necesarios en el caso del segundo objetivo del estudio, determinar los factores de riesgo de SDPM mediante regresión logística, nos hemos basado en el modelo de Peduzzi y cols.27. Considerando que en el modelo final multivariante hemos incluido 11 variables, tendremos un número de eventos por variable (EPV) de 2,72, y por tanto necesitaríamos una muestra ideal de 140 pacientes. Asumimos que el EPV con el que trabajamos es muy bajo, y se aleja mucho de los 10 o incluso 20 que se recomienda en la literatura. Para EPV inferiores a 10, como es nuestro caso, los coeficientes de regresión pueden verse sesgados tanto en sentido positivo como negativo, lo que limita claramente la potencia estadística de la regresión logística en nuestro estudio.
Se necesitarán más estudios de alta calidad, prospectivos y multicéntricos para dilucidar completamente la incidencia y sus factores de riesgo.
Aunque nuestro estudio no fue diseñado para encontrar factores de riesgo, llama la atención que no se han encontrado diferencias significativas en relación con estos parámetros.
Aunque nuestro estudio fue diseñado para encontrar la incidencia del síndrome de dolor posmastectomía, parece necesario realizar nuevos estudios prospectivos para evaluar los posibles factores de riesgo que afecten tanto en incidencia, intensidad e impacto en la calidad de vida posterior en el SDPM de nuestros pacientes.
Sería necesario en los próximos estudios utilizar a partir de ahora una definición consensuada del SDPM.











 text in
text in