INTRODUCCIÓN
El dolor neuropático fue definido por la Asociación Internacional para el Estudio del Dolor (IASP) en 2007 como el "dolor que se origina como consecuencia directa de una lesión o enfermedad que afecta al sistema somatosensorial" 1. El dolor crónico afecta al 19 % de los adultos europeos y el dolor neuropático aproximadamente al 20 % de estos 2,3,4.
El tratamiento del dolor neuropático es extremadamente difícil, ya que este tipo de dolores no suele responder a los analgésicos convencionales, incluidos los opioides mayores, siendo fármacos de primera línea de tratamiento los anticomiciales o los antidepresivos, pero con una tasa de éxito muy baja, lo cual habitualmente obliga a combinar varios fármacos para obtener un alivio significativo, con el consiguiente incremento de sus efectos secundarios.
Cuando el tratamiento farmacológico es insatisfactorio recurrimos a bloqueos nerviosos y otras técnicas, como la radiofrecuencia convencional o pulsada. Desgraciadamente, estas técnicas con demasiada frecuencia resultan inefectivas o su eficacia es de muy corta duración, en estos casos la alternativa será la neuroestimulación invasiva.
La neuroestimulación para el tratamiento del dolor puede ser central o periférica, dependiendo de que se estimulen estructuras del sistema nerviosos central o nervios periféricos. La neuroestimulación central tradicional es la medular o de los cordones posteriores medulares (ECP), técnica que se inició en 1963 y que constituye el "gold standart" de la neuroestimulación. Esta técnica es aplicada en nuestra unidad desde 1995, con un notable éxito, dentro de la dificultad mencionada en el tratamiento de los dolores neuropáticos.
En los últimos 8 años se ha desarrollado una variante de estimulación central, la estimulación del ganglio de la raíz dorsal (EGRD). Mientras en la estimulación medular de cordones posteriores el electrodo se emplaza en el espacio epidural posterior a los cordones posteriores medulares (paramedial o medial), en la EGRD el electrodo se localiza en la proximidad del ganglio de la raíz dorsal que inerva el territorio nervioso desde el que se genera el dolor neuropático.
Hoy en día sabemos que el GRD juega un importante papel en la modulación de la señal nerviosa que llega desde los nociceptores periféricos y se trasmite hacia el sistema nervioso central (SNC). Las neuronas del GRD pueden frenar la señal nerviosa, permitir su paso normal o facilitar el paso de potenciales de acción que en condiciones normales no se permitiría; además, en ciertas situaciones de hiperexcitabilidad, pueden generar descargas ectópicas que se traducen en señal dolorosa. Estos fenómenos constituyen la base del dolor crónico y de fenómenos como la hiperalgesia y la alodinia.
Con la idea de frenar este estado de hiperexcitabilidad neuronal se ha planteado la estimulación eléctrica del GRD. Teóricamente podría tratarse de un "target" de estimulación mucho más selectivo y eficiente que la tradicional estimulación de los cordones posteriores medulares. Nos permite estimular una sola raíz nerviosa de forma aislada, con un consumo eléctrico más reducido y una gran estabilidad del electrodo, que aminora los cambios en el estímulo y los estímulos dolorosos relacionados con los cambios posturales 5.
Hasta la actualidad, la estimulación del GRD se ha utilizado en múltiples procesos dolorosos, siendo los más frecuentes publicados los síndromes de dolor regional complejo (SDRC), los síndromes de cirugía fallida de espalda (SCFE), los dolores neuropáticos postherniorrafia inguinal, las neuralgias postherpéticas y otros dolores neuropáticos en miembros. Esta técnica está disponible en Europa y Australia desde hace 7-8 años y en los Estados Unidos de América del Norte (EE. UU.) desde hace 4 años, habiéndose implantado hasta 2017 más de 4000 dispositivos. Sin embargo, el número de pacientes implicados en los estudios que hasta este momento se han publicado es reducido. En estos trabajos vemos cómo en muchos casos los resultados son mejores que los obtenidos con la estimulación de los cordones posteriores 5 .
La técnica del implante es prácticamente idéntica a la de la ECP, con la única diferencia de la necesidad de utilizar unas vainas que rodean al electrodo dentro del espacio epidural y nos permiten emplazar el extremo de este en el espacio periganglionar, y la conveniencia de realizar un doble bucle en el electrodo para conferirle estabilidad (Figura 1). El generador del que disponemos es no recargable, requerimos una amplitud de pulso menor que la de ECP, unos 0,8 miliamperios de media, y una frecuencia de 20 hercios. Estas diferencias en la técnica incrementan la complejidad y duración del procedimiento, pero no hay hasta ahora evidencia de mayores complicaciones 6,7. El aprendizaje de la técnica requiere un training en un centro de amplia experiencia, el cual, en el caso del implantador de los casos descritos en este trabajo, fue efectuado de la mano del Dr. Isaac Peña en la Unidad del Dolor del Hospital Virgen del Rocío de Sevilla.
La EGRD es una alternativa a la ECP que se viene desempeñando en la Unidad de Tratamiento del Dolor del Hospital Universitario de Gran Canaria Dr. Negrín (UTD-HUGCDN) desde hace algo más de dos años y medio.
MATERIAL Y MÉTODOS
Se trata de un estudio observacional, prospectivo y siguiendo la práctica clínica habitual, en el cual a partir de noviembre de 2018 se han reclutado 10 pacientes consecutivos sometidos a EGRD para el tratamiento de dolores neuropáticos. Se ha obtenido el visto bueno del Comité Ético y de Investigación Clínica del Hospital Universitario de Gran Canaria Dr. Negrín (código de protocolo EsGanRaDor).
La población de estudio ha consistido en adultos en tratamiento en la Unidad del Dolor del Hospital Universitario de Gran Canaria Dr. Negrín por dolor neuropático refractario al tratamiento farmacológico y otras técnicas antiálgicas. Se trata de dolores neuropáticos que han demostrado en estudios previos responder bien a la EGRD, especialmente dolores neuropáticos en MMII (idóneamente dolores en los pies) o torácicos, muy localizados y con etiología tales como los síndromes de dolor regional complejo, neuralgias postherpéticas o lesiones de nervios periféricos 5,8.
Los 10 pacientes reclutados fueron 5 varones y 5 mujeres, con una edad media de 54 ± 6 años (rango 30-82 años). En todos los pacientes se habían agotado las alternativas terapéuticas que habitualmente utilizamos en los dolores neuropáticos persistentes, tanto farmacológicas como de otras técnicas antiálgicas (bloqueos a diferentes niveles y radiofrecuencia pulsada).
Todos los electrodos han sido implantados actuando como cirujano principal por un único médico, con una experiencia previa en esta técnica mínima, de solo dos electrodos implantados en otro centro con monitorización de un experto. No obstante, el implantador tenía previamente una amplísima experiencia en el implante de electrodos epidurales para el estímulo de los cordones posteriores. El material de implante utilizado ha sido el sistema Proclaim DRG de Saint Jude Medical (ABBOTT), distribuido en España por Cardiva 2 S.L.
Los criterios de inclusión han sido los siguientes:
Adultos, mayores de 18 años y menores de 85.
Padecer un dolor neuropático refractario a otros tratamientos y de las características previamente descritas.
Haber firmado y fechado el documento de consentimiento informado específico para el estudio y también el específico para el implante de electrodos epidurales.
Los criterios de exclusión han sido:
Pacientes con alteraciones en la columna o estructuras del SNS que dificulten de forma importante la colocación del electrodo.
Con incapacidad para cumplimentar los instrumentos de medida de las variables que se consideran en este estudio.
Que no puedan o no deseen cumplir el protocolo del estudio (contestar las preguntas de los cuadernos de recogida de datos).
Signos de alerta de posible enfermedad sistémica (como infección o cáncer) que no hayan sido previamente investigados.
Embarazo.
Situaciones descompensadas o no controladas de diabetes, hipertiroidismo, insuficiencia cardiaca o cardiopatía isquémica, nefropatía o hepatopatía.
Trombopenia con cifra inferior a 50.000 plaquetas en el momento de realizar la técnica.
Tratamiento con anticoagulantes orales: dicumarol y otros. El paciente se podrá incluir en el estudio si se decide pasar a tratamiento con heparinas durante el procedimiento.
Antiagregación plaquetaria que no se pueda suspender.
Infección local, patología subcutánea o tumoral que impidan el acceso transcutáneo al espacio epidural.
Los criterios de retirada del estudio han sido:
Los pacientes que deseen retirarse del estudio (dejar de responder a los cuestionarios).
Pacientes que dejen de cumplir los criterios de inclusión o pasen a cumplir algún criterio de exclusión.
Los objetivos del estudio los clasificamos en principales y secundarios:
Objetivos principales:
Cambios en la intensidad del dolor.
Mejoría funcional.
Cambios en los niveles de ansiedad y depresión.
Objetivos secundarios:
Valoración de la relación entre el área de la parestesia y el área del dolor.
Variabilidad en la percepción de la parestesia en relación con movimientos o cambios posturales.
Complicaciones.
Las variables de estudio también las clasificamos en principales o secundarias:
Variables principales:
Evolución del dolor mediante la EVA.
Porcentaje de pacientes que no superan la primera fase.
Evolución del dolor mediante la cuantificación del porcentaje de disminución del dolor.
Cambios en la funcionalidad del paciente mediante la escala Oswestry. La escala de incapacidad por dolor lumbar de Oswestry es un cuestionario autoaplicado, específico para dolor lumbar, aunque se utiliza frecuentemente para la valoración funcional de pacientes con dolores de otros orígenes. Mide las limitaciones en las actividades cotidianas y consta de 10 preguntas con 6 posibilidades de respuesta cada una. Una puntuación mayor indica una mayor gravedad de los síntomas. Flórez y cols. realizaron la adaptación transcultural a la población española en 1995 9.
Cambios en los niveles de ansiedad y depresión mediante las escalas de ansiedad y depresión hospitalarias (HAD). La Escala hospitalaria de Ansiedad y Depresión (HADS), desarrollada por Zigmond y Snaith (1983), es una escala autoaplicada conformada por 14 ítems que permite utilizarse en medios hospitalarios no psiquiátricos o en atención primaria. Es un instrumento que considera dimensiones cognitivas y afectivas, omitiendo aspectos somáticos. La HAD está estructurada como una escala de tipo Likert que va de 0 a 3, en donde los pacientes tienen que describir los sentimientos que han experimentado durante la última semana. Esta breve escala consta de dos subescalas de 7 ítems intercalados, en donde una puntuación mayor indica una mayor gravedad de los síntomas 10.
Variables secundarias:
Cuantificación del área de parestesia y de dolor y cálculo del porcentaje de superficie de no coincidencia.
Número de reprogramaciones necesarias por cambios en el área de estimulación.
Existencia o no de cambios en la intensidad de la parestesia relacionados con los cambios posturales.
Número de complicaciones, diferenciado las graves de las no graves.
Evaluación y seguimiento: los pacientes han sido evaluados en los siguientes momentos:
Antes del implante del electrodo.
14 días más tarde, antes del implante del generador, si este llega a estar indicado. De no estar indicado, el paciente saldrá del estudio y se le ofrecerán terapias alternativas.
Tras 1 mes del implante del generador.
A los 3 meses del implante del generador.
A los 6 meses del implante del generador.
En los 5 tiempos descritos se interrogó al paciente para la cuantificación del total de las variables, cumplimentando los cuestionarios mencionados (Oswestry y HAD). En el tiempo 1 lógicamente no procederá la cuantificación del porcentaje de mejoría.
El análisis estadístico se realizó mediante el software SPSS (versión 15 para Windows). La normalidad de la distribución de los datos se analizó mediante el test de Kolmogorov-Smirnov. Las comparaciones entre la situación basal (evaluación 1) y las evaluaciones en los distintos momentos postimplante se realizaron mediante el t-test de Student para datos apareados (media ± DE). Se consideraron estadísticamente significativos los valores de p < 0,05.
Se considerará acontecimiento adverso cualquier acontecimiento clínico no deseado que afecte a un paciente, esté o no relacionado con el procedimiento, que incluya un signo, síntoma o proceso clínico no deseado.
No ha habido aportación económica de ningún tipo para la realización del este estudio y los autores declaran la no existencia de conflictos de intereses.
RESULTADOS
Se implantáron un total de 13 electrodos, un solo electrodo en 7 pacientes y dos en 3, con la siguiente localización:
En 4 pacientes los electrodos se implantaron para el estímulo de ganglios torácicos.
En 5 pacientes los ganglios estimulados fueron lumbares. Se pusieron 4 electrodos para el estímulo del ganglio de L5.
En un paciente se implantó un electrodo para el estímulo de un ganglio torácico y otro lumbar.
Ocho de los diez pacientes superaron la fase de prueba, que en todos los casos fue de 14 días.
Los diagnósticos que llevaron al implante fueron los siguientes (Tabla 1):
Tabla I. Características generales de los pacientes, diagnóstico, nivel del implante y porcentaje de mejoría a los 6 meses

Neuralgia postherpética: en 2 pacientes (1 no supera 1.ª fase).
Neuropatía persistente postquirúrgica en 6 pacientes:
Neuropatía de nervio dorsal escapular.
S. túnel tarsiano en 2 pacientes.
Neuropatía del nervio peroneo.
Neuropatía nervio ilioinguinal.
Lesión medular tras cirugía de hemangioma, paciente que no superó la primera fase.
Síndromes de dolor regional complejo (SDRC) en los miembros inferiores en dos pacientes.
A continuación se describen los resultados basales y de evolución, en los 8 pacientes que superaron la fase de pruebas, y en los que se colocaron implantes definitivos.
La intensidad del dolor medida en la escala visual analógica (EVA) respecto a la situación basal (9,0 ± 1,3) mostró una disminución estadísticamente significativa (p < 0,001) a las 2 semanas (2,3 ± 2,2), 1 mes (2,4 ± 2,4), 3 meses (2,7 ± 2,1) y 6 meses (3,4 ± 2,4) (Figura 2).
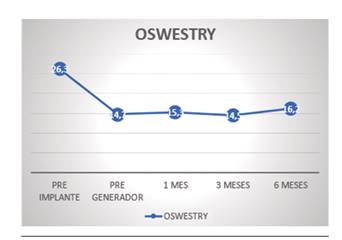
Los cambios en la funcionalidad según la escala Oswestry respecto a la situación basal (26 ± 9,6) fueron: 14,8 ± 10,2 (p = 0,001) a las 2 semanas, 15,4 ± 10,9 (p = 0,001) a 1 mes, 14,5 ± 11,2 (p = 0,002) a 3 meses y 16,3 ± 10,3 (p = 0,011) a 6 meses (Figura 3).
Hubo una disminución significativa en los niveles de ansiedad y depresión medida mediante las escalas de ansiedad y depresión hospitalarias (HAD), respecto a la basal (19,4 ± 7,5): 10,5 ± 6,8 (p = 0,009) a 2 semanas, 12,6 ± 8,3 (p = 0,036) a 1 mes, 13 ± 6,9 (p = 0,43) a 3 meses y 12,1 ± 7,4 (p = 0,042) a 6 meses (Figura 4).
En la subescala de ansiedad, respecto al valor basal (9,9 ± 4,5), la disminución fue significativa a las 2 semanas (6,6 ± 4,7; p = 0,048), y mostró una tendencia a la significación en el resto de evaluaciones: 6,8 ± 4,4 (p = 0,064) a 1 mes, 6,6 ± 3 (p = 0,056) a 3 meses y 6,5 ± 3,9 (p = 0,061) a 6 meses (Figura 4).
En la subescala de depresión: respecto al valor basal (9,5 ± 4,4), la disminución fue significativa a las 2 semanas (3,9 ± 3,3; p = 0,004) y a los 6 meses (4,9 ± 4,4; p = 0,030), y mostró una tendencia a la significación en las evaluaciones a 1 mes (5,9 ± 4,5; p = 0,064) y a 3 meses (6,4 ± 4,3; p = 0,099) (Figura 4).
El número de descriptores de dolor neuropático de la escala DN4, respecto al valor basal (7 ± 1,3), solo disminuyó de forma significativa a los 6 meses (4,6 ± 2,6; p = 0,034), mostrando una tendencia a la significación en las valoraciones a 2 semanas (4,5 ± 3,4; p = 0,083), 1 mes (4,5 ± 3,8; p = 0,086) y 3 meses (4,6 ± 3; p = 0,062) (Figura 5). Nueve de los diez pacientes tenían inicialmente alodinia patente y en todos los implantados hubo una disminución o desaparición total de esta.
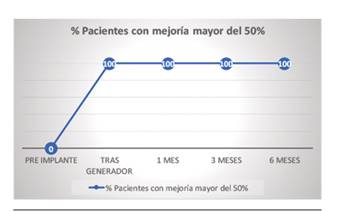
El porcentaje de mejoría subjetiva reflejado en los cuatro tiempos tras el implante del electrodo fue: 75,6 % ± 19,9 % a las 2 semanas, 72,5 % ± 24,3 % a 1 mes, 73,8 % ± 17,7 % a 3 meses y 70,6 % ± 14,3 % a 6 meses (Figura 6). Todos los pacientes que superaron la fase de prueba mantuvieron al menos una mejoría del 50 % a los 6 meses de tratamiento.
Todos los pacientes a los que se les implantó el generador tuvieron una mejoría del dolor superior al 50 % y esta cifra se mantuvo en el tiempo (Figura 7).
En todos los pacientes se consiguió un área de parestesia bastante concordante con el área de dolor, excediéndola en poca medida.
No se constató en ningún caso variabilidad en la percepción de la parestesia en relación con movimientos o cambios posturales. Sí fueron precisas reprogramaciones en cuatro pacientes por cambios en el área de estimulación permanentes (sin relación postural).
En todos los pacientes, excepto uno, se constató una clara disminución de los fármacos analgésicos tras el implante. Solo en un caso se abandonó la medicación analgésica por completo.
Las complicaciones que vimos a lo largo del periodo de seguimiento fueron las siguientes:
Pérdida de estímulo tras una hora del implante por motivo desconocido.
La retirada inadvertida de dos electrodos.
La mencionada necesidad de reprogramación en 4 pacientes. Necesidad de cambio de mando del paciente por avería en un paciente.
Molestias inespecíficas en las relaciones sexuales en una paciente.
Durante el acto de implante de los electrodos la complicación o molestia más patente fue el dolor que los pacientes manifiestan en el momento de salida del extremo del electrodo a través del agujero de conjunción, problema presente en todos los pacientes.
No fue calificada como grave ninguna de las complicaciones aparecidas.
DISCUSIÓN
Realizaremos un análisis crítico de nuestros resultados y los compararemos con los obtenidos en otros estudios similares.
Los diagnósticos de nuestros pacientes son similares a los de otras series, lo cual resulta lógico, ya que se indicó la técnica en aquellas patologías en las cuales la EGRD se había mostrado más efectiva. Con respecto a otras series, el número de pacientes con diagnóstico de dolor neuropático secundario a lesión nerviosa postraumática o postquirúrgica es mayor, 5 de los 8 pacientes implantados.
La intensidad del dolor en la EVA pasó de 9,1 antes del implante a 3,4 a los 6 meses, lo cual supone una mejoría del 63 %, con una caída mínima a lo largo de los meses. El porcentaje de mejoría subjetiva a los 6 meses fue del 70,6 %. Un indicador de la mejoría obtenida es la mencionada disminución o cese en la ingesta de fármacos analgésicos. Otro dato llamativo es el caso del paciente afecto de síndrome del túnel de tarso, el cual con solo 39 años estaba en lista de espera quirúrgica para la amputación del pie, por la imposibilidad de aguantar el dolor, y sin embargo en la actualidad lleva una vida prácticamente normal, deambulando con leve limitación.
En nuestra serie los 8 pacientes que superaron la fase de prueba mantuvieron un porcentaje de mejoría superior al 50 %. Los 4 pacientes con dolor en pie o tobillo en los cuales se implantó un electrodo en L5 pasaron la fase de prueba y obtuvieron un porcentaje de mejoría mayor que la media, un 71,25 %, a pesar de que en dos de estos pacientes coexistía un dolor nociceptivo, especialmente al deambular. Los pacientes que manifestaron claramente mayor mejoría son todos mujeres, un 79 % de mejoría media a los 6 meses, frente a un 56,6 % de los varones; en este caso hay que tener en cuenta la posible interferencia en la verbalización del dolor de la búsqueda o mantenimiento de las percepciones económicas relacionadas con la invalidez laboral, posiblemente más patente entre los pacientes varones de nuestra muestra.
En el metanálisis publicado por Huygen y cols. en Neuromodulation, en 2020, en el cual se incluyeron 217 pacientes, el 63 % de los pacientes refirieron al año de seguimiento una mejoría de al menos el 50 %. Las tasas de respuesta según las áreas de dolor tratadas fueron del 80 % para pies e ingles, 75 % para miembros inferiores y del 70 % para el dolor lumbar 11.
El estudio Accurate publicado por T. Deer y cols. en Pain, en 2017, randomizó 152 pacientes afectos de síndrome de dolor regional complejo tipo 1 (SDRC-1) en los miembros Inferiores. Comparando los 115 pacientes evaluables, 61 pacientes sometidos a EGRD y 54 bajo ECP, el pocentaje de pacientes con mejoría mejoría mayor del 50 % a los 6 meses fue del 74 % para la EGRD y del 60 % para la ECP. La tasa de implantados por superar la primera fase fue del 75 %. La tasa de disminución del dolor al año de seguimiento fue del 80 % para la EGRD y del 67 % para la ECP (12).
En el estudio de Liem y cols. publicado en Neuromodulation, en 2015, con 32 pacientes implantados de 51 testados, revela un 74 % de mejoría a los 12 meses, siendo los mejores resultados en los dolores en los pies. Una tasa de implantados del 62 % 13.
Van Buyten y cols. publicaron en Pain Practice, en 2015, una serie de 11 pacientes con SDRC en los miembros inferiores, refiriendo una disminución inicial del dolor del 82 %. A los 12 meses el 71,4 % tenían un alivio mayor del 50 % y la disminución media del dolor del era del 62 % 14.
Schu y cols. publicaron también en Pain Practice, en 2015, un estudio retrospectivo sobre 29 pacientes con dolor neuropático, de los cuales fueron implantados 25 por mejoría mayor del 50 %. A los 6 meses la mejoría obtenida fue del 67,5 % 15.
Vemos que nuestros resultados en eficacia son ligeramente inferiores a las series de Deer y Liem, y similares a los de Van Buiten y Schu. Sin embargo, en nuestro caso superaron la fase de prueba el 80 % de los pacientes, y el 100 % de los pacientes implantados definitivos mantuvieron al menos el 50 % de mejoría a los 6 meses; cifras mejores que las referidas en los estudios comentados.
Nuestros mejores resultados, al igual que en las series mencionadas, se obtienen en los dolores de los pies, con un porcentaje de mejoría del 71,25 %.
En el metanálisis de Huygen y cols. se diferencian los 5 estudios que individualizan los resultados de los pacientes afectos de dolor por lesión nerviosa periférica 12,13,16,17,18; en ellos la mejoría obtenida fue del 68 %. En los 5 pacientes de nuestra muestra tratados por dolor secundario a lesión de nervio periférico (tras accidente o cirugía) el porcentaje de mejoría fue del 66 %.
En cuanto a la evolución del grado funcional, vemos cómo los resultados de la escala de Oswestry pasan de reflejar una incapacidad moderada (26,3) a una limitación leve (16,2). En el estudio Accurate se constata una mejoría en la subescala de funcionalidad del Short-Form-36 de 27 puntos para la EGDR y de 19 para la ECP. En los estudios de Kallewaard, que reclutaron 23 pacientes, los cambios en la escala de Oswestry fueron de 43,8 a 17,5, manifestando una limitación inicial mucho mayor que en nuetra serie 19,20.
El número de descriptores de dolor neuropático de la escala DN4 evolucionó de 7 a 4,6. Es de destacar que, si bien persisten en muchos casos síntomas o signos propios del dolor neuropático, estos se aminoran en todos los casos. No existen claros predictores de la eficacia de la ECP, sin embargo hay datos clínicos y experimentales que hacen pensar que los pacientes con importante alodinia son malos respondedores a la ECP, siendo este un síntoma que se mitiga habitualmente con la EGRD 21. Esto ha sido patente en nuestra muestra, en la cual los ocho pacientes implantados obtuvieron una importante mejoría en este tipo de dolor.
Los cambios en el humor o los niveles de ansiedad sufrieron una mejoría similar, patente y mantenida en el tiempo. El estudio Accurate 12 pone de manifiesto una diferencia estadísticamente significativa en los parámetros del Short-form-36 en humor, tensión y depresión a favor de los pacientes sometidos a EGRD con respecto a los portadores de dispositivos de ECP, también con estabilidad en la mejoría en los diferentes controles hasta los 12 meses de seguimiento.
En ningún paciente se constataron cambios en la parestesia en relación con las posiciones; esto es concordante con todas las publicaciones consultadas y una de las grandes ventajas de la EGRD con respecto a la ECP.
El área de parestesia más ajustada al área del dolor que en la ECP también fue patente en nuestra serie, especialmente en los dolores circunscritos a pie y tobillo en los que se estimula L5, algo también patente en los estudios consultados.
Las complicaciones más frecuentes reflejadas en la serie de Huygen fueron: dolor en el bolsillo del implante, fractura del electrodo, migración de este, infección, estimulación motora temporal e incremento de la impedancia en la estimulación 11.
Las complicaciones más frecuentes que aparecieron en el estudio Accurate 12 son clasificadas según las características del evento adverso, observando que predominan las complicaciones relacionadas con el procedimiento del implante, superando las aparecidas en el grupo de ECP. Plantean que la menor experiencia y cierta mayor dificultad de la técnica pueden se la causa de este resultado (Tabla 2).
Según publica Vancamp en Neuromodulation, en 2017, las complicaciones más frecuentes son: emplazamiento incorrecto del electrodo, posicionamiento subóptimo alrededor del GRD, posicionamiento anterior en el foramen, desplazamiento postoperatorio del electrodo, hemorragia o hematoma espinal, compresión o lesión medular, nerviosa o del GRD, infección de la herida quirúrgica, dolor en el bolsillo subcutáneo, erosión en la piel, pérdida de LCR y complicaciones con la anestesia local o la sedación 8.
Curiosamente, ninguna de las complicaciones más frecuentes relatadas en los dos estudios anteriores aparecieron en nuestra serie. Es de destacar la pérdida del estímulo tras una hora del implante en un paciente no implantado definitivamente. En la radioscopia posterior no se encontró alteración o desplazamiento el electrodo, se revisaron las conexiones con el generador externo no encontrando alteraciones y tampoco en las impedancias. Comentar también la retirada involuntaria de dos electrodos en la segunda fase de la cirugía, posiblemente por la inexperiencia y el no fijar el electrodo a la fascia muscular en los primeros casos operados. Tal y como asevera Deer 12, la menor experiencia en esta cirugía puede llevar a la aparición de más efectos adversos relacionados con la técnica de implante. Por último, hacer referencia a una complicación o efecto secundario también difícilmente explicable, las molestias en las relaciones sexuales en el área genital en una paciente con implantes en L4 y L5.
CONCLUSIONES
La EGRD es una técnica efectiva en pacientes bien seleccionados, pudiendo esperar un porcentaje de mejoría de entre el 63 y el 70 %, con disminución de los requerimientos de analgésicos, mejoría que parece mantenerse en el tiempo. Además de la disminución de la intensidad del dolor, se constata una clara mejoría funcional y de los niveles de ansiedad y depresión.
Los mejores resultados probablemente se encontrarán en los pacientes con dolores neuropáticos en los miembros inferiores, sobre todo en el pie y tobillo, y si padecen alodinia.
La parestesia está más ajustada al área del dolor que con la ECP, especialmente en dolores en los pies. A diferencia de lo que ocurre con la ECP, con la EGRD desaparecen los cambios en la intensidad de la parestesia en relación con las modificaciones posturales.
La técnica es algo más complicada que la ECP. Posiblemente puede haber más complicaciones y el training necesario puede ser mayor.
Nuestros datos son bastante concordantes, salvo en las complicaciones, con la mayor parte de las series hasta ahora publicadas.
Sería conveniente realizar estudios con mayor tiempo de seguimiento, con una muestra más amplia y que permita diferenciar resultados en las diversas causas de dolores ya que hasta la actualidad, exceptuando el SDRC-1, no existen clara evidencia de eficacia en otras patologías.