INTRODUCCIÓN
La diabetes mellitus (DM) es un conjunto de trastornos metabólicos con una alta presencia en la población. Se estimó que para el año 2000 habría un total de 171 millones de personas diabéticas en el mundo y que esta cifra se duplicaría para el año 2030, llegando a alcanzar los 370 millones1. Los datos epidemiológicos indican una prevalencia de la DM de entre el 7% y el 7,5% de la población global, mayoritariamente en pacientes diabéticos tipo 22.
Entre algunas de las consecuencias de la DM podemos encontrar la afectación de los vasos sanguíneos y la consecuente enfermedad arterial periférica, así como complicaciones crónicas cardiovasculares, neuropatías y daños microvasculares2. Esto puede desembocar en la aparición de lesiones en los pies de los diabéticos que con frecuencia se traducen en graves complicaciones, como infecciones, amputaciones y en ocasiones la muerte de las personas que las padecen3,4.
La Organización Mundial de la Salud (OMS) define el pie diabético (PD) como “la presencia de ulceración, infección, y/o gangrena del pie asociada a la neuropatía diabética (ND) y a diferentes grados de enfermedad vascular periférica, y resultantes de la interacción compleja de diferentes factores inducidos por una hiperglicemia mantenida”3.
Las úlceras del pie en personas con diabetes son uno de los precursores más comunes para una posible amputación3,5, además de constituir un grave problema de salud pública, lo que conlleva un enorme coste económico a los sistemas sanitarios6.
En la práctica clínica, los pacientes diabéticos son mal cumplidores y, en los inicios, la propia enfermedad vascular suele ser asintomática, elementos que hacen aumentar el riesgo de que estos pacientes puedan acabar teniendo una úlcera. Se estima que entre el 15% y el 25% de los pacientes diabéticos presentarán una ulceración en el pie a lo largo de su vida2.
El riesgo de tener una amputación y la mortalidad asociada son mayores en los pacientes diabéticos que en los no diabéticos4,5, con una prevalencia de amputación del 14-20%, una recurrencia de las lesiones del 79% a los 3 años y una mortalidad del 70% tras sufrir una amputación mayor a los 5 años1,2,3,4,5,6,7. La Asociación Americana de Diabetes ha estimado que el 40-50% de las amputaciones son previsibles8.
Se han publicado diversos sistemas de clasificación para las lesiones de pie diabético, si bien ninguno de los propuestos se ha impuesto como el sistema definitivo hasta el momento9,10. Esto es debido a múltiples factores.
Por un lado, los sistemas de clasificación de PD publicados difieren en gran medida en aspectos tales como los parámetros a evaluar, los métodos de puntuación o la estadificación utilizada, o la complejidad de su uso9,10. Por otra parte, estos sistemas se deben usar en diferentes poblaciones, las cuales no siempre tienen características similares, lo que incide en su fiabilidad11.
Además, debemos tener en cuenta que un sistema puede ser apropiado para un determinado objetivo, pero totalmente inadecuado para otro9,10. Así, un sistema puede ser válido para ayudar a los clínicos en la elección del tratamiento adecuado o ser útil en el cálculo del pronóstico de una posible amputación, pero ser totalmente inútil en aportar datos e información fiable que pueda ser utilizada en el ámbito de la investigación o la evaluación de la costo-efectividad9,10.
Esto conlleva que la elección del sistema de clasificación de lesiones en PD sea con frecuencia un aspecto problemático para los clínicos que se enfrentan a esta patología9,11, ya que en esta elección se debe conseguir un complicado equilibrio entre diversas disyuntivas, como, por ejemplo, la opción del uso de un sistema simple de fácil uso frente a la selección de un sistema más complicado de manejo más difícil y que requiere de más equipo y experiencia, pero que puede proporcionar mayor cantidad de información10.
Es por este motivo que el conocimiento de todos los sistemas disponibles es un aspecto importante para los clínicos involucrados en la atención del PD, ya que esto les permite conocer cuál es el sistema que mejor se ajusta a los objetivos que persiguen o cuál es la opción más adecuada según el ámbito asistencial donde desempeñan su actividad profesional9,11.
En un anterior trabajo publicado en el año 2012 se llevó a cabo un análisis de 15 sistemas de clasificación de lesiones en PD9. Debido a que en estos últimos años han surgido nuevas clasificaciones para las lesiones de PD, actualizamos nuestro anterior trabajo con el presente artículo donde se pretende dar visibilidad a los nuevos sistemas, además de poder contrastarlos con los sistemas ya conocidos anteriormente.
MATERIAL Y MÉTODO
Se realizó una búsqueda bibliográfica en las bases de datos Scopus, PubMed/Medline, WOS, CINHAL, Cochrane y CUIDEN. Para la búsqueda se utilizaron los términos MeSH: “diabetic foot” y “classification”. La ecuación de búsqueda utilizada fue “diabetic foot AND classification”. La búsqueda se realizó en las citadas bases de datos entre el 1 febrero de 2018 y el 30 de marzo de 2018. Como límites en la búsqueda se establecieron: acceso a texto completo y disponibilidad del “abstract” o resumen. No se establecieron límites en referencia al idioma, año de publicación o tipo de artículo.
Dos de los autores realizaron la búsqueda en las bases de datos, leyeron los “abstract”-resúmenes, seleccionaron aquellos trabajos que hacían referencia a posibles sistemas de clasificación de PD y accedieron a los textos completos, que remitieron a otros dos autores. A su vez, estos dos autores leyeron los artículos a texto completo y desecharon aquellos que abordaban los sistemas de clasificación del posible riesgo de padecer lesiones de PD o hacían alusión a sistemas de clasificación de otros tipos de heridas crónicas. Además, contrastaron los sistemas encontrados con los recogidos en un anterior trabajo9 con el objetivo de obtener un listado con los nuevos sistemas.
Finalmente, otros dos autores tradujeron y analizaron los nuevos sistemas y confeccionaron una nueva tabla resumen.
RESULTADOS
Se detectaron 25 sistemas de clasificación de lesiones en PD (ordenados por orden del año de publicación original): Clasificación de Meggitt-Wagner, Clasificación de Gibbons, Clasificación de Forrest y Gamborg-Neilsen, Clasificación de Pecoraro y Reiber, Clasificación de Brodsky, Clasificación de la Universidad de Texas, Clasificación de Liverpool, Clasificación S(AD) SAD, Simple Staging System-SSS, Clasificación de Van Acker/Peter, CHS-Curative Health Services Wound Grade Scale, Sistema Margolis y cols., Clasificación PEDIS, Clasificación DEPA, Wound Score de Strauss y Aksenov, Diabetic Ulcer Severity Score-DUSS, Clasificación SINBAD, Clasificación de Saint Elian-SEWSS, Clasificación de Kobe, sistema de Lipsky y cols., SVS-WIfI classification system, Algoritmo de Tardivo, Clasificación de Amit Jain, Diabetic foot ulcer assessment scale-DFUAS y DIAFORA-DIAbetic FOot Risk Assessment.
A continuación, exponemos los sistemas no recogidos en el anterior trabajo9.
Sistemas de clasificación de lesiones en pie diabético
Clasificación de Saint Elian (Saint Elian Wound Score System-SEWSS)
Esta clasificación fue desarrollada en México a partir del estudio de 235 sujetos diabéticos y dada a conocer en el año 2010 por Martínez de Jesús12. Se puede considerar una modificación del sistema PEDIS13.
Incluye 10 parámetros-variables englobados en tres dominios (anatomía, factores agravantes y afectación tisular). Estas variables son: isquemia, infección, neuropatía, área, profundidad, localización de la úlcera, aspecto topográfico de la lesión, número de zonas afectadas, fase de cicatrización y existencia de edema del pie (las últimas cinco variables son las no incluidas con anterioridad en el sistema PEDIS). Cada variable se puntúa con una puntuación que oscila del 1 al 3, estableciéndose unos grados de severidad: I-Leve (puntuaciones menores a 10 puntos), II-Moderado (puntuaciones de 11 a 20 puntos) y III-Severo (puntuaciones de 21 a 30 puntos)12 (tabla 1).
Los autores de esta clasificación defienden que permite la recalificación de las lesiones durante su evolución, es una herramienta útil para el seguimiento y aporta un valor pronóstico de éxito o fallo de la cicatrización, lo que permite el ajuste del tratamiento seleccionado14.
Sistema del Curative Health Services (CHS-Curative Health Services Wound Grade Scale)
Aunque cuenta con bastantes años, no fue incluido en nuestro anterior trabajo9. Este sistema se desarrolló con datos provenientes de pacientes tratados en los Curative Health Services (CHS), organismo estadounidense que había gestionado más de 150 centros de atención de heridas en 38 estados de los Estados Unidos desde 1988 hasta el año 200015. Posteriormente fue utilizado por David J Margolis y sus colaboradores para su sistema predictivo de cicatrización de úlceras diabéticas neuropáticas16,17 (véase más adelante en Sistemas de predicción de cicatrización-amputación).
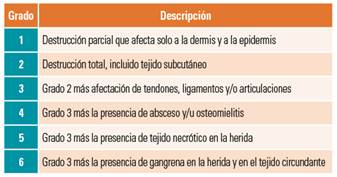
Este sistema lo componen seis grados que pueden considerarse acumulativos. Los tres primeros grados describen profundidad (grado 1, grado 2 y grado 3). El grado 4 lo constituye el grado 3 más la presencia de absceso u osteomielitis. El grado 5 lo constituye el grado 3 más la presencia de tejido necrótico en la herida y el grado 6 lo constituye el grado 3 más gangrena en la extremidad15 (tabla 2).
Ha sido validado tres veces por el mismo grupo de investigadores y optimizado en un estudio posterior (véase más adelante en Sistemas de predicción de cicatrización-amputación). Los estudios muestran que el sistema CHS permite predecir la no cicatrización/amputación de miembro inferior en úlceras diabéticas16,17.
Clasificación de Kobe
Surgida en 2011, recibe el nombre de la ciudad de Kobe, Japón, donde ha sido ideada18. Sus creadores defienden que debido a que existen diferencias inherentes entre las poblaciones diabéticas asiáticas y caucásicas se necesitaba establecer un nuevo sistema de clasificación de úlceras de PD que diera respuesta a este problema, siendo la clasificación de Kobe una posible solución18.
La clasificación de Kobe establece cuatro tipos de lesiones en PD, según predomine un factor etiológico determinado (neuropatía periférica, enfermedad arterial periférica e infección). La combinación fisiopatológica de esta tríada va a conducir a un tipo concreto de lesión.
Así, el tipo I son aquellas lesiones donde predomina la neuropatía periférica; el tipo II, las lesiones donde prevalece la enfermedad arterial periférica; el tipo III, las lesiones donde domina la infección, y finalmente las lesiones de tipo IV, donde los tres factores están presentes o combinados en un grado considerable. Esta clasificación también aporta una recomendación de tratamiento según el tipo de lesión considerado18 (tabla 3).
Clasificación WIfI (Society for Vascular Surgery Lower Extremity Threatened Limb/SVS WIfI Classification System)
Esta compleja clasificación nació en 2014 desde el enfoque de crear un sistema capaz de establecer con mayor precisión el componente isquémico en las lesiones de PD. De hecho, este sistema fue desarrollado por la Sociedad Americana de Cirugía Vascular. WIfI es un acrónimo en inglés de “Wound, Ischemia and foot Infection”, que son los tres componentes que se integran en esta clasificación, cada uno definido específicamente19.
El primer componente, Wound (herida o úlcera), está basado en una descripción clínica de la úlcera en función de la profundidad y extensión de la lesión, así como la existencia de gangrena y dolor, estableciéndose 4 grados para este parámetro que oscilan del 0 al 3 (0 = sin herida/ 1 = herida menor-grado leve/2 = herida profunda-grado moderado/3 = herida extensiva y grave-grado severo).
Para el segundo componente, Ischemia (isquemia), se establecen 4 grados (0 = sin isquemia/1 = isquemia leve/2 = isquemia moderada/ 3 = isquemia grave) determinados por la combinación de los valores obtenidos mediante el uso del índice de presión tobillo-brazo, la presión transcutánea de oxígeno y presión sistólica del dedo del pie.
Finalmente, para la valoración del tercer componente, Infection (infección), esta clasificación adapta los criterios para la estadificación de infecciones de PD propuestos por la Asociación Americana de Enfermedades Infecciosas (Infectious Diseases Society of America-IDSA)20 y la valoración de la infección del sistema PEDIS13. De esta forma, la clasifi cación WIfI-SVS establece cuatro grados de infección posibles: grado 0 (ninguna infección), grado 1 (infección leve), grado 2 (infección moderada) y grado 3 (infección grave potencialmente amenazante de la integridad de las extremidades y/o potencialmente mortal)19. Un resumen de este sistema puede consultarse en la tabla 4, si bien por lo complejo de este sistema recomendamos la consulta del artículo original.
Clasificación de Amit Jain
Esta clasificación toma su nombre de su creador, el cirujano indio Amit Kumar C Jain21. De acuerdo con esta clasificación, las lesiones en PD se pueden encuadrar en tres tipos: úlceras simples (Úlceras diabéticas Clase 1), úlceras complejas (Úlceras diabéticas Clase 2) y úlceras complicadas (Úlceras diabéticas Clase 3)21. Mientras que en las úlceras clase 1 no existen causas intrínsecas que afectan a su cicatrización, en las úlceras clase 2 sí existen factores intrínsecos que causan o perpetúan las lesiones (tales como la existencia de deformidades, enfermedad arterial o pies de Charcot). En las úlceras clase 3, el factor determinante es la presencia de osteomielitis o infección.
Según su autor, este simple sistema permite encuadrar cualquier lesión diabética, y es especialmente práctica y útil en países en vías de desarrollo22. Sin embargo, recientemente el mismo autor ha desarrollado un sistema de códigos para complementar esta clasificación y poder añadir información en referencia al tamaño de cada lesión y el área anatómica involucrada23 (tabla 5).
Diabetic Foot Ulcer Assessment Scale (DFUAS)
Este reciente sistema dado a conocer en 2016 ha sido desarrollado a partir del consenso de dos grupos de investigación procedentes de Japón e Indonesia24. Esta herramienta está concebida específicamente como una escala para evaluar el estado de las úlceras de pie diabético a lo largo del tiempo y persigue el objetivo de que los profesionales puedan evaluar la efectividad de sus intervenciones24.
La escala resultante consta de 11 dominios-parámetros: profundidad, tamaño (medido en centímetros cuadrados), puntuación de tamaño (size score), inflamación/infección, proporción de tejido de granulación (medido en porcentajes), tipo de tejido necrótico, proporción de tejido necrótico (medido en porcentajes), proporción de esfacelos (medido en porcentajes), maceración, tipo de borde de herida y tunelización (medido en centímetros). Las puntuaciones mínimas y máximas en esta escala son 0 y 98, respectivamente, donde las puntuaciones más altas indican mayor gravedad24 (tabla 6).
Para validar esta escala los autores realizaron un estudio que comparaba esta con las escalas Bates-Jensen Wound Assessment Tool (BWAT)25 y la escala Pressure ulcer scale for healing (PUSH)26. Las relaciones entre DFUAS y los criterios externos (BWAT, PUSH y área superficial de la herida) demostraron una excelente correlación (r = 0,92, 0,87 y 0,83, respectivamente)24. Este estudio defendía que el DFUAS era una herramienta válida para predecir qué úlceras diabéticas pueden cicatrizar y cuales no en 4 semanas24. Como limitación hay que señalar que en este estudio se manejó una muestra pequeña de pacientes indonesios seleccionada mediante un muestreo de conveniencia.
Sistemas de predicción de cicatrizaciónamputación
Margolis y cols.
En 2003, David J Margolis y sus colaboradores idearon un modelo pronóstico de cicatrización para úlceras neuropáticas16. Para ello se basaron en una muestra de 27.630 pacientes con úlceras neuropáticas reclutados dentro del sistema de los Curative Health Services.
Los autores recabaron diferentes variables de fácil recogida de las bases de datos de estos centros (edad, sexo, duración de la lesión en meses, tamaño de la herida en milímetros cuadrados, grado de la herida según la puntuación en el sistema CHS y número de lesiones en el pie) y a partir de un análisis de regresión multivariante de estos datos crearon cuatro modelos de predicción de cicatrización (usando de 3 a 6 variables para cada modelo)17. Así, por ejemplo, el modelo más simple otorgaba 1 punto si la duración de la herida era superior a 2 meses, el área de la lesión era superior a 2 cm2 o tenía un grado ≥3 en la escala CHS de 6 grados. Este modelo presentó un valor de área bajo la curva (curva ROC) de 0,66 (intervalo de confianza [IC] del 95%: 0,64 a 0,67), para predecir las úlceras que no cicatrizarían a las 20 semanas27. Los modelos restantes tenían valores que oscilaban de 0,66 a 0,7027.
Este sistema posee una excelente validez interna, aunque como limitación los autores señalaban que otras posibles variables predictivas de cicatrización (como la localización de la lesión) no habían sido consideradas. Para los interesados en este sistema recomendamos la consulta de los trabajos originales16,17.
Lipsky y cols.
Desarrollado en el año 2011 en Estados Unidos por Lipsky y cols., este es un sistema de puntuación de riesgo de amputación en pacientes hospitalizados por infección de PD28. Para ello se usaron datos de 2.230 pacientes hospitalizados en 97 hospitales entre los años 2003 y 2007, aunque los autores informaron de potenciales sesgos de selección en la muestra28.
Fueron muchas las variables recogidas para la consecución de este modelo, incluyendo valores analíticos, datos demográficos o enfermedades asociadas. Mediante un análisis de regresión y comparando la predicción con la probabilidad observada de amputación se consiguió un sistema que estratificaba a los pacientes en 5 grupos de riesgo según las puntuaciones obtenidas (Grupo 1/Puntuaciones de 0, Grupo 2/Puntuaciones 1-4, Grupo 3/Puntuaciones 5-11, Grupo 4/Puntuaciones 12-20 y Grupo 5/Puntuaciones +21)28. Estas puntuaciones se correspondían con las tasas de amputación en las cohortes de derivación y validación (p < 0,0001 por la prueba de tendencia Cochran-Armitage para ambas cohortes). Así, la probabilidad de amputación en el grupo 5 era aproximadamente del 50%28. Para los interesados en este sistema recomendamos la consulta del trabajo original28.
Algoritmo de Tardivo
Publicado en 2015 por J.P. Tardivo y cols., este algoritmo es un sistema de evaluación sencillo que pretende predecir el riesgo de amputación en PD29. Se desarrolló a partir de una muestra de 62 pacientes y está basado en la valoración y puntuación de tres parámetros principales: la clasificación Megitt-Wagner, los signos de enfermedad arterial periférica-EAP (que se evalúan mediante la clasificación de la enfermedad arterial periférica) y la localización de las lesiones29. La puntuación final es el producto de las puntuaciones obtenidas para cada parámetro y oscilan de 1 a 32, siendo peor el pronóstico cuanto más alta es la puntuación (tabla 7).
Según los autores, puntuaciones de 12 o más se asocian a un mayor riesgo de amputación (odds ratio y regresión logística-IC 95%: 12,21886,5)29.
Monteiro-Soares M y Cols. (DIAFORA-Diabetic Foot Risk Assessment)
El sistema DIAFORA es un nuevo modelo de clasificación que persigue un doble objetivo: puede utilizarse como sistema de estratificación de riesgo de desarrollar úlceras diabéticas y también como sistema de predicción de amputación en pacientes diabéticos que ya padecen lesiones activas30. Ha sido desarrollado en Portugal por el equipo liderado por Monteiro-Soares a partir del estudio durante 3 años (del año 2010 al año 2013) de una cohorte prospectiva de 293 participantes30.
El sistema otorga una serie de puntos según 8 parámetros considerados: 4 parámetros son factores de riesgo en PD bien conocidos (presencia de neuropatía diabética periférica, presencia de deformidad, presencia de enfermedad arterial periférica, historia previa de amputación) y otros 4 parámetros son aspectos relacionados directamente con la presencia de úlceras (presencia de múltiples úlceras, presencia de infección, gangrena o afectación ósea)30.
Según las puntuaciones obtenidas se pueden establecer tres escenarios: bajo riesgo de amputación (menos de 15 puntos obtenidos), riesgo medio (entre 15 y 25 puntos) y alto riesgo (más de 25 puntos) (tabla 8).
Tabla 8 DIAFORA: DIAbetic FOot Risk Assessment. Instrucciones de la escala de predicción

AEI: Amputación en la extremidad inferior AP: arteriopatía periférica; MSW: monofilamento de Semmes-Weinstein; MTT: metatarsianos; NP: neuropatía diabética; UPD: úlcera de pie diabético.
Los autores informaron de que este modelo tenía un área bajo la curva característica de funcionamiento del receptor de 0,91 (IC 95%: 0,87-0,95) y como clasificación para la predicción de amputación de extremidades inferiores de 0,89 (IC del 95%: 0,84-0,93)30. El grupo de alto riesgo presentó un balance positivo de 5 (IC 95%: 3 a 8) y un valor predictivo de 58 (46 a 71)30.
DISCUSIÓN
Desde que en 1976 Meggitt propusiera la primera clasificación para lesiones de PD31, el número de clasificaciones y sistemas propuestos no ha hecho más que incrementarse. En este trabajo se han identificado 25 sistemas de clasificaciones de lesiones en PD. En la tabla 9 se puede consultar un resumen con la mayor parte de las clasificaciones-sistemas de las que tenemos conocimiento, tanto las incluidas en este como en el anterior trabajo9.
Tabla 9 Tabla resumen de los sistemas de clasificación de lesiones de pie diabético

IN = infección; IS = isquemia; L = localización; NP = neuropatía; OT = otras variables-parámetros; P = profundidad, T-A = tamaño-área.
aSe consideran validados los sistemas con estudios propios de validación (interna o externa) y/o con estudios comparativos con otros sistemas.
Si bien todos estos sistemas y clasificaciones tienen en común que están específicamente diseñados para su uso en PD, debemos tener en cuenta un aspecto importante que ya han señalado algunos autores: la diferencia entre lo que denominamos una clasificación (que tiene un propósito básicamente descriptivo) y un sistema de puntuación o escala (más enfocado a dar una idea de la severidad y que permite establecer un pronóstico de la evolución de la lesión)10,27.
Es lógico, por tanto, que en los últimos años los investigadores y clínicos se hayan decantado más por el desarrollo de sistemas de puntuación o predicción frente al diseño de clasificaciones de corte más descriptivo. Sistemas como la clasificación WIfI o el DFUAS son un claro ejemplo de esta tendencia. Sin embargo, siguen surgiendo sistemas puramente descriptivos y relativamente simples, como son la clasificación de Amit Jain o la clasificación de Kobe.
Esto generalmente también ha conllevado un aumento exponencial de la complejidad de los sistemas, siendo tal vez la clasificación WIfI el sistema que marca actualmente el mayor grado de complejidad de un sistema de estadificación para lesiones de PD. De hecho, debemos considerar que este es un sistema compuesto que integra a su vez a otros sistemas, ya que incluye la clasificación de infecciones en PD de la Asociación Americana de Enfermedades Infecciosas-IDSA o parte del sistema PEDIS). Algo similar hace Tardivo y cols., que integra en su algoritmo la clasificación de Meggitt-Wagner29.
La complejidad no siempre asegura la total idoneidad y eficacia de un sistema. Un reciente estudio de Vela y cols. señalaba que el sistema WIfI era útil para identificar correctamente la gravedad de las úlceras diabéticas, pero que era insuficiente para identificar con exactitud la isquemia32. Además, en este estudio, la clasificación WIfI se correlacionó mal con los resultados clínicos con respecto al riesgo de amputación durante el primer año, si bien se necesitan más estudios para verificar estos resultados32.
A favor del sistema WIfI queremos señalar que es de muy reciente creación, por lo que futuros estudios pueden confirmar su utilidad clínica, existiendo margen de mejora. Además, es un sistema que combina bien las dos características antes comentadas que deberían estar presentes en un sistema de clasificación de lesiones en PD: capacidad descriptiva y capacidad pronóstica10.
Otro sistema reciente como el DFUAS sigue esta estela de complejidad, si bien sus autores prefirieron compararlo con sistemas de evaluación de heridas y no con otras clasificaciones específicas de PD24.
El DFUAS introduce algunos aspectos interesantes escasamente abordados en las lesiones de PD como puede ser la valoración del estado de maceración de la piel perilesional de las úlceras diabéticas, punto al que tal vez no se le ha concedido suficiente importancia33. En otros sistemas de evaluación de severidad y cicatrización de heridas crónicas como el RESVECH sí se ha prestado atención a este punto34. De hecho, el diseño del DFUAS es bastante similar al RESVECH, aunque este último sistema concede más importancia y peso al parámetro infección, en contraposición al DFUAS que no incluye este parámetro24,34.
Esto nos parece una limitación importante de este sistema, ya que está bastante aceptado la importancia de este factor en la valoración de las lesiones de PD, y es un aspecto clave para el pronóstico y determinación de las acciones terapéuticas a realizar ante una determinada lesión diabética3,4,5 . De hecho, algunos de los nuevos sistemas de PD están diseñados precisamente para la evaluación de pacientes hospitalizados por infección de PD, como el propuesto por Lipsky y cols.28.
Tal vez una posible solución sería su uso conjunto con algún sistema específico de valoración de infecciones de PD, como el de la Asociación Americana de Enfermedades Infecciosas-IDSA20.
Un aspecto importante es la validación de los sistemas9,10. No todos los sistemas-clasificaciones están sólidamente validados9,10. La validación de un sistema depende de factores como la población donde se evalúan, la disponibilidad de determinadas terapias o tratamientos (p. ej., el acceso a antibióticos o terapias avanzadas de desbridamiento) o el manejo clínico que se hace ante una determinada situación (isquemia, osteomielitis)10. Además, debemos distinguir entre la validación interna y externa de un sistema10. Según Game, solo las clasificaciones de Meggitt-Wagner, Universidad de Texas y la clasificación SINBAD han pasado por procesos de validación en regiones o países diferentes de donde de idearon10.
A la hora de seleccionar qué sistema-clasificación debemos usar sería recomendable valorar detenidamente qué sistemas se han empleado en entornos similares al nuestro, tanto desde el punto de vista poblacional como respecto a los recursos disponibles. Clasificaciones como la de Lipsky y cols., que requieren de determinaciones de laboratorio, o el sistema PEDIS o WIfI, que requieren de equipamiento especial, pueden no ser adecuados para determinados países o entornos asistenciales.
Es obvio que esta multiplicación de sistemas-clasificaciones de PD ha complicado la dificultad en la elección, pero ha permitido la publicación de trabajos y estudios de investigadores que pretenden comparar entre sí los diferentes sistemas-clasificaciones35,36,37,38,39,40,41. Estos estudios generalmente se han centrado en la comparación de las clasificaciones-sistemas a partir de la evaluación de los resultados según el estadio o la puntuación de las lesiones27.
Sin embargo, los resultados de estos estudios a veces arrojan resultados contradictorios. Por ejemplo, según el estudio de Jeon, los sistemas de Meggitt-Wagner y de la Universidad de Texas, aunque son sistemas relativamente simples, son mejores predictores de amputación de miembro inferior que los sistemas DEPA, SINBAD y DUSS35. Sin embargo, Chuan en su estudio de validación del sistema PEDIS aboga por el uso de este sistema, sin duda más complejo, pero que mostraba mejor precisión diagnóstica y predictiva, especialmente cuando se comparaba con los sistemas de SINBAD y Meggitt-Wagner42.
A pesar de estos resultados, para Game, el sistema SINBAD es la mejor opción para la realización de auditorías clínicas de comparación entre diferentes centros con el objetivo de implementar mejoras de la gestión clínica de estos centros10.
Hay que destacar en este sentido el trabajo del grupo investigador liderado por Monteiro-Soares desde Portugal11,27. Este grupo ha dedicado los últimos años al estudio y realización de la validación externa de la mayoría de los múltiples sistemas de clasificación de PD existentes. Muchos de los valores predictivos positivos y negativos, así como el cálculo de los cocientes de probabilidad de amputación de miembro inferior de muchos de los sistemas publicados, se los debemos al extraordinario trabajo de este grupo11. Para aquellas personas interesadas en los sistemas de clasificación de PD, la consulta de los trabajos publicados por este grupo de investigadores es imprescindible.
Idealmente, un sistema de clasificación de lesiones en PD debería tener una alta reproducibilidad en términos de interobservador (es decir, mediciones repetidas producen resultados similares cuando son calificadas por diferentes observadores9,37,43. Por ello, una perspectiva que despierta cada vez más interés es el estudio de qué sistemas poseen mejores valores interobservadores.
Por ejemplo, para el sistema Meggitt-Wagner, uno de los sistemas más usados, Santema TB y cols., obtuvieron un valor interobservador discreto, con un valor de Kappa (κ) de 0,415 (IC 95%: 0,413-0,418)40, valor parecido al obtenido por Bravo-Molina y cols., en su estudio, que calculó para este sistema un valor κ = 0,55 (IC 95%: 0,522-0626)37.
Curiosamente, las enfermeras mostraron en el estudio de Santema y cols. un valor interobservador ligera pero significativamente más alto (p = 0,006) (0,423; IC 95%: 0,420-0,426) que los médicos (0,404; IC 95%: 0,390-0,417) para este sistema40. En el estudio de Bravo-Molina y cols., las evaluaciones fueron realizadas siempre por médicos especialistas pertenecientes al Servicio de Angiología y Cirugía Vascular37, por lo que no es posible contrastar este aspecto.
Creemos que en los futuros estudios que se realicen para el cálculo de los valores interobservadores de un determinado sistema es conveniente incluir profesionales de diferentes disciplinas (como profesionales de la medicina, enfermería o podología), ya que el abordaje del PD debe realizarse siempre desde una perspectiva multidisciplinar y los sistemas por tanto serán manejados por diferentes tipos de profesional3,4,44. Forsythe y cols., en su estudio para calcular la variabilidad interobservador de los sistemas de la universidad de Texas, SINBAD y PEDIS, se valió de cirujanos vasculares, podólogos y diabetólogos, lo que apoya nuestra idea38. Sistemas más complejos como el PEDIS obtuvieron valores kappa levemente superiores en el estudio de Bravo-Molina A y cols. (κ = 0,578; IC 95%: 0,522-0,626)37.
Es necesario ahondar en el estudio de la variabilidad de interobservador de los sistemas de clasificación de PD. Según nuestros datos, solo los sistemas de la Universidad de Texas, PEDIS, Meggitt-Wagner y SINBAD cuentan con estudios específicos en esta dirección, siendo además los resultados obtenidos bastante dispares, en parte por las diferencias en la metodología utilizada por los diferentes investigadores37,38,40. Otros sistemas notifican valores kappa discutibles en sus estudios de validación.
Una posible línea futura de investigación en el campo de las clasificaciones de lesiones en PD es el uso de sistemas y dispositivos informáticos para la monitorización y clasificación de úlceras diabéticas. En los últimos años estos sistemas están despertando mucho interés en los investigadores respecto a la monitorización de todo tipo de heridas crónicas45,46,47. Existen ya algunas propuestas para la estratificación del riesgo en PD a partir del uso de clasificaciones basadas en la medición de las presiones plantares mediante dispositivos informatizados y sistemas de captura de imagen48,49.
No hemos encontrado datos publicados sobre el grado de implantación de las diferentes clasificaciones de PD en nuestro país. En la reciente actualización del documento de la Conferencia Nacional de Consenso sobre las úlceras de la extremidad inferior (CONUEI) se sigue recomendando el uso de las clasificaciones de Meggitt-Wagner y la Universidad de Texas con un grado de recomendación de 1A y un nivel de evidencia alto2. Este documento también recomienda el uso del sistema PEDIS para la valoración de la infección en PD2.
A pesar de que siguen surgiendo nuevas clasificaciones de PD, parece claro que algunos de estos nuevos sistemas no aportan aspectos novedosos y útiles a la práctica clínica. Tal vez haya llegado el momento de intentar conseguir un cierto grado de consenso entre los clínicos para decidir cuáles de los sistemas de clasificación de PD existentes son los que deben ser adoptados y asumidos de forma general por la comunidad científica. En otros tipos de lesiones como las úlceras por presión, por ejemplo, se han conseguido sistemas de estadificación-clasificación más estandarizados y con mayor grado de consenso entre los profesionales implicados en su atención64,65.
Otra medida importante para los clínicos involucrados en la atención del PD en el futuro es reforzar la validación de los sistemas de PD ya existentes, así como evaluar la utilidad de los diferentes sistemas en diversos entornos asistenciales y poblaciones. Contamos con número elevado de sistemas de clasificación de PD, pero de muchos de ellos tenemos pocos datos fiables.
CONCLUSIONES
La elección del sistema de PD a utilizar va a estar condicionada por aspectos como el ámbito asistencial, los recursos disponibles o los objetivos que se persiguen.
Existe un número muy elevado de sistemas de clasificación de PD publicados, y es un tema cuyo interés, lejos de decaer, sigue atrayendo a los profesionales involucrados en la atención del PD. La importancia de una correcta clasificación de las lesiones se explica por qué esta determina el tratamiento a realizar y puede aportar datos sobre el pronóstico de los pacientes respecto a posibles amputaciones.
Por ello, en los últimos años la tendencia es el desarrollo de sistemas más complejos que vayan más allá de los aspectos meramente descriptivos y que sean capaces de prever el riesgo de amputación de forma eficaz.
El presente trabajo ahonda en esta temática, visibilizando nuevos sistemas de clasificación de lesiones en PD desarrollados en los últimos años.