My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Salud Pública
On-line version ISSN 2173-9110Print version ISSN 1135-5727
Rev. Esp. Salud Publica vol.80 n.3 Madrid May./Jun. 2006
Análisis de un modelo económico de una estrategia poblacional de vacunación gripal en trabajadores sanos
Analysis of a Economic Model of a Populational Influenza Immunization Strategy in Healthy Employees
Jesus Martín Fernández
Centro de Salud San Martin de Valdeiglesias. Área 8 de Atención Primaria. Servicio Madrileño de la Salud.
Dirección para correspondencia
RESUMEN
Fundamento: Existe un debate sobre la conveniencia de extender los programas de vacunación antigripal a toda la población, posiblemente por el impacto económico de la medida. Se pretende analizar la razón coste-beneficio de una estrategia de vacunación antigripal en población trabajadora en nuestro país.
Métodos: Estudio económico desde una perspectiva social. Se incluyen los costes directos e indirectos (tiempo productivo perdido, efectos adversos) de la vacunación. Entre los costes evitados se incluyen las pérdidas de productividad (bajo la perspectiva del capital humano) y los costes sanitarios eludidos cuando se evita la infección. Se construye una ratio costes evitados/incurridos, denominada Indice de retorno (IR). Los costes se transforman en euros constantes de 2003. Los datos se recogen de la literatura existente y se presenta un análisis de sensibilidad.
Resultados: El coste medio de cada vacunación es de 13, 58 (IC 95% 13,54- 13,62) euros. Cada caso evitado de gripe, ahorra un gasto medio 374,71 (IC 95% 372,59- 376,83) euros. Cada 1.000 vacunaciones evitarían una media de 29,3 casos de gripe (IC 95% 29,0- 29,5). El coste neto de la vacunación es 2,60 (IC 95% 2,51-2,70) euros. El IR tiene un valor medio de 0,80 (IC 95% 0,79- 0,81), mediana 0,74; rango intercuartílico (0,53- 1,02) euros. En el supuesto de evitar más de 36 casos de gripe por cada 1.000 vacunas, el IR toma valores >1.
Conclusiones: La estrategia de vacunación antigripal para población trabajadora solo es coste efectiva para situaciones de alta incidencia de gripe y alta efectividad de la vacuna.
Palabras clave: Influenza. Modelos económicos. Análisis coste-beneficio. Análisis económico.
ABSTRACT
Background: A debate exists as to whether it is advisable to extend the influenza immunization programs to the entire population, possibly due to the economic impact of this measure. This study is aimed at analyzing the cost-benefit ratio of an influenza immunization strategy among our country's working population.
Methods: Economic study from a social standpoint, including the direct and indirect costs (lost productive time, adverse effects) of the immunization. The costs avoided include the loss of productivity (from the human capital standpoint) and the health costs avoided when the infection is prevented. A costs avoided/costs incurred ratio, known as the Return Rate (RR) is constructed. The costs are converted into constant 2003 euros. The data was compiled from published sources and a sensitivity analysis presented.
Results: The average cost of each immunization is 13.58 (95% CI 13.54 - 13.62) euros. Each case of influenza avoided saves an average expense of 374.71 (95% CI 372.59 - 376.83) euros. Every 1,000 immunizations would avoid an average of 29.3 influenza cases (95% CI 29.0 - 29.5 ). The net cost of immunization is 2.60 (95% CI 2.51 - 2.70) euros. The RR has an average value of 0.80 (95% CI 0.79 - 0.81), median 0.74, interquartile range (0.53 - 1.02) euros. In the case of avoiding more than 36 cases of influenza per 1,000 immunizations, the RR takes on values >1.
Conclusions: The influenza immunization strategy for the working population is solely cost-effective for situations of high influence incidence and high vaccine effectiveness.
Key words: Influenza. Models, Economic. Cost-Benefit analysis. Economic analysis.
Introducción
Las epidemias de gripe ocurren cada año y suelen estar producidas por variantes menores de los tipos A y B. Estas infecciones no producen inmunidad más que frente a la cepa viral infectante por lo que los individuos pueden sufrir varios episodios a lo largo de su vida. La evolución del cuadro es generalmente benigna y autolimitada, los síntomas mayores (mialgia, tos, coriza, fiebre...) duran entre tres y cuatro días por término medio, aunque la astenia y la tos pueden persistir una e incluso dos semanas más1.
Esto puede significar una pérdida media de dos a cinco días de trabajo por proceso2,3, además de un periodo posterior de baja productividad. En nuestro país las epidemias de gripe pueden provocar pérdidas de hasta 70 millones de horas de trabajo anuales4, lo que implica un alto coste de la enfermedad para el conjunto de la sociedad.
Aunque ciertos tratamientos antivirales como los inhibidores de la proteína M2 y de la neuraminidasa se han mostrado efectivos en el abordaje de la gripe5, la medida cuya eficacia a nivel poblacional ha sido más ampliamente estudiada es sin duda la vacunación antigripal6.
En nuestro medio las recomendaciones de vacunación provenientes de las autoridades sanitarias sólo incluyen personas con alto riesgo de sufrir complicaciones en caso de padecer la gripe, a sus contactos y a profesionales que prestan servicios públicos7. No se incluye en los planes de vacunación generales a sujetos sanos en edad productiva. Tampoco recomienda la vacunación en sujetos sanos la Asociación Española de Vacunología (AEV)8, en sintonía con las recomendaciones de organismos de reconocido prestigio internacional como los Centros para el Control y Prevención de Enfermedades en los Estados Unidos (CDC)9. No obstante, en Estados Unidos se rebaja la edad del grupo diana hasta los 50 años. Sin embargo, otras Instituciones, como el Canadian Task Force on Preventive Health Care, si considera que hay suficiente evidencia para recomendar la vacunación antigripal en todos los grupos de edad10.
Ningún organismo aconseja que no se administre la vacuna fuera de los grupos señalados cuando lo solicita el paciente. La AEV justifica su posición en una baja eficacia de la vacuna en personas con edades entre 15 y 64 años, que supondría un elevado coste para programas de cobertura a toda la población, lo que apunta la importancia de la evaluación de los aspectos económicos.
En numerosos trabajos se concluye que la ratio coste-beneficio de la vacunación antigripal de los trabajadores sanos sería favorable si se incluyesen los costes derivados de la pérdida de producción2, 11-16, aunque no hay certeza de que la vacunación reduzca de manera significativa los días no productivos por gripe cuando se tienen en cuenta diversos estudios17. En nuestro entorno y bajo una perspectiva empresarial podía estar justificada económicamente la vacunación de población trabajadora18, pero no hay estudios desde una perspectiva social.
Parte de la variabilidad de los resultados de los estudios está justificada por los cambios en la incidencia anual de gripe, y en la diferente cobertura de la vacuna dependiendo de la coincidencia entre las cepas que la constituyen y los virus circulantes.
Además la extrapolación de los resultados de estos estudios a la realidad de nuestro entorno, con unos costes laborales en general más bajos, podría ser engañosa, por lo que se diseñó el presente trabajo, cuyo objetivo es analizar la ratio coste-beneficio de una estrategia de vacunación antigripal global en una población en situación productiva en nuestro país desde una perspectiva social.
Material y Métodos
Este estudio económico adopta una perspectiva social por lo que los costes directos e indirectos serán los que se repercutirían tanto al individuo como al conjunto de la comunidad.
A la ratio entre los ahorros y los costes la denominación índice de retorno IR (término equivalente al anglosajón «return rate» o «return on investment», utilizado en trabajos previos3, 18,19). El IR es el inverso de la ratio coste-beneficio y cuando su valor es superior a 1 indica que la estrategia es beneficiosa en términos económicos para la comunidad, si está alrededor de 1 es indiferente y por debajo se éste valor tiene un coste neto.
A continuación se muestra la ecuación para el cálculo de IR.
Los costes de la intervención vienen dados por los costes directos del proceso (vacunas y personal necesario para su administración y coste del tratamiento de los efectos secundarios) e indirectos (pérdida laboral por la vacunación y por sus efectos secundarios).
Los ahorros producidos, numerador de la ecuación, vienen dados por las complicaciones evitadas (ingresos hospitalarios, visitas al médico), por el coste de la medicación utilizada contra la infección, y por las pérdidas de producción evitadas. La perdida de producción debida a la enfermedad incluye los días de ausencia y los días de productividad parcial.
El modelo no contempla los ahorros futuros debido a la pérdida de vida o de productividad.
En la tabla 1 se muestra el rango de los valores encontrado en la literatura para todas las variables.
Variables clínicas y epidemiológicas.
Las tasas de infección se derivan de las comunicadas por el Centro Nacional de epidemiología para la población general. En los últimos 10 años la tasa de ataque anual de gripe oscila entre los apenas 20 casos por mil habitantes del año 2002 y los más de 97 casos por mil habitantes en 199620.
La disminución del riesgo que ofrece la vacuna en población sana varía de unos trabajos a otros12,13,21, En estudios en los que se encontró una gran coincidencia entre la cepa vacunal y la poblacional la eficacia de la vacuna llegó a cifras del 70% (riesgo relativo de 0,30). En una reciente revisión sistemática sobre la efectividad de la vacuna en personas sanas, que incluía más de 25.000 pacientes, se establecía el riesgo relativo de gripe en población vacunada en 0,7017. Puede que parte de esta variabilidad provenga de diferencias metodológicas en los estudios22, en la definición de caso (serológica o clínica), tipo de población incluida y características estacionales de la epidemia.
La eficacia de la intervención depende desde luego de la cobertura que se alcanza a nivel poblacional. En nuestro país, las coberturas poblacionales sobre grupos de riesgo han oscilado entre 0,63 y 0,68 en las diez últimas campañas7. Sin embargo, la cobertura no tendrá efecto sobre el IR pues actuaría como factor multiplicativo del numerador y el denominador de la fórmula del IR.
Se ha estimado el porcentaje de sujetos previamente sanos que consultan con el médico por un proceso gripal entre un 20 y un 45 % dependiendo de los diferentes entornos sanitarios3,23. Además a entre un 40 y un 80 % de los paciente que visitan al médico (según sea primera o segunda visita) se les prescribe antibióticos15. Asumimos que el 20% del total de los sujetos toma antibióticos y que todos reciben medicación de prescripción o de compra libre.
En cuanto a las hospitalizaciones debidas a la gripe en personas sanas, los valores utilizados en estudios económicos sobre la gripe oscilan entre 4 y 6 hospitalizaciones por diez mil casos24, con una media de 7 días por caso3.
En cuanto a los efectos secundarios de la vacuna y su repercusión sobre los costes, no se ha demostrado que la vacunación tenga más efectos generales sistémicos que la inyección de placebo25, aunque algunos estudios incluyen pérdidas de 1 día de trabajo por cada 100 personas vacunadas, desde una perspectiva conservadora . Nosotros utilizaremos un rango de 0 a 0,5 días perdidos por 100 personas vacunadas debido a efectos secundarios.
No se tendrá en cuenta el exceso de mortalidad por gripe en personas sanas, dado que las pérdidas de productividad por este hecho no tendrán repercusión en el estudio.
Pérdidas de productividad
Para valorar los costes indirectos relacionados con la productividad se adoptó el enfoque del capital humano, de manera que todos los días no productivos se contabilizan como costes (o costes evitados) independientemente de que la productividad (de la empresa o del conjunto de la comunidad) no se vea afectada de la misma manera.
Se ha mencionado en el párrafo anterior la asunción que hacemos en este modelo respecto a las pérdidas laborales por efectos secundarios.
El absentismo laboral debido a la enfermedad también es una variable que oscila de unos estudios a otros . En uno de los trabajos referenciados, diseñado como un ensayo clínico en trabajadores sanos la media de días perdidos era de apenas 1 por persona enferma13. Otros estudios señalan cifras de 2,826, 327 y hasta 4,9 días perdidos28 como media por proceso.
Además deben tenerse en cuenta los días trabajados con unas capacidades mermadas por las personas enfermas de gripe. Los valores extremos tomados están en 0,7 días con una productividad del 50%3 y 5 días con una capacidad productiva también del 50%14. Esto supone entre 0,35 y 2,5 día productivos perdidos por cada trabajador enfermo, aparte de los perdidos por absentismo.
El tiempo de ausencia del trabajo por motivo de la vacunación depende exclusivamente de la localización del lugar de administración de la vacuna. Suponiendo que este fuese el centro de salud y teniendo en cuenta las isocronas de las zonas básicas de salud, éste debe estar a menos de 30 minutos del 90% de la población que se atiende29, por lo que asumimos que pérdida de tiempo laboral por la vacunación oscilará entre 15 y 60 minutos.
Costes
Todos los costes se expresarán en euros constantes 2003, y la conversión se hará con referencia al IPC anual publicado por el Instituto Nacional de Estadística30.
La tabla 2 recoge los valores utilizados en este trabajo.
Para estimar los costes de la vacuna no se ha recurrido al precio sino al coste real comunicado por una Administración concreta para el año 2000, obtenido mediante concurso y actualizado en euros 200331.
El coste de la vacunación (realizada por una enfermera), se ha calculado dividiendo por tres el coste de una consulta de enfermería programada, pues el tiempo empleado viene a ser equivalente y el resultado es congruente con el de otros trabajos2,18. El coste de la visita al médico de familia, el de cada día de ingreso hospitalario y el de la consulta de enfermería se han obtenido de la base de costes sanitarios SOIKOS® versión 2.2 (2005). La estimación con la que se trabaja corresponde a la mediana de los datos publicados en euros constantes 2003.
El coste de la medicación analgésica para la gripe se valora en 6 euros, y el del tratamiento antibiótico en 6,5 euros de acuerdo a lo propuesto por Postma15.
El coste laboral anual neto publicado por el INE para el año 2003 es de 17.880 euros32. El coste /día se obtiene de dividir el total entre los días hábiles del año y representan valores medios de todos los sectores productivos. El concepto de coste salarial incluye todos los gastos retributivos, pero no los de protección social.
Análisis de sensibilidad
La respuesta a la pregunta de investigación vendrá definida por el índice de retorno IR, que expresa cuántos euros se recuperan desde una perspectiva del conjunto de la comunidad por cada euro invertido en la intervención analizada. El IR no tendrá una solución única sino que estará constituido por una nube de puntos resultado de un proceso de simulación.
Cada variable expresada en la tabla 1 tomará 10.000 valores aleatorios correspondientes a una distribución uniforme comprendida entre los extremos superior e inferior de la variable estudiada y el IR será una combinación lineal de éstos mediante la ecuación formula más arriba. Las estimaciones se obtendrán mediante la hoja de cálculo Excel®.
Se presentará la distribución del IR y se analizará gráficamente su valor considerando las variaciones de las variables independientes eficacia vacunal e incidencia anual de gripe.
Resultados
El modelo ofrece un coste medio de 13, 58 euros para cada vacunación (IC 95% 13,54- 13,62 euros). En el 75% de los casos el coste era inferior a 15, 51 euros. Cada caso evitado de gripe, según el modelo supone un ahorro medio de 374,71 euros (IC 95% 372,59- 376,83 euros, mediana 375,40 euros).
En la figura 1 se presentan en forma de diagramas de cajas («boxplot») las distribuciones de los costes de la vacunación y los ahorros por caso evitado.
Cada 1.000 vacunaciones evitarían una media de 29,3 casos de gripe (IC 95% 29,0- 29,5, mediana 27, 6 casos)
Si tomamos valores medios, el coste cada 1.000 vacunaciones sería de 13.581 euros y se evitarían unos gastos de 10.864 euros. El modelo estima un coste medio neto de 2,60 euros por vacunación (IC 95% 2,51-2,70 euros, mediana 3,67 euros).
Por cada 1.000 vacunas administradas se evitarían la pérdida media de 48,7 días laborales (IC 95% 47,5- 49,8) incluyendo absentismo y días de productividad reducida.
El peso de los costes laborales en cada caso evitado oscila entre un 90,0 y un 98,0% (media 96, 4%), mientras que para los costes de vacunación la importancia de los costes laborales oscila entre un 27,0 y un 60,0 % (media 47,35%).
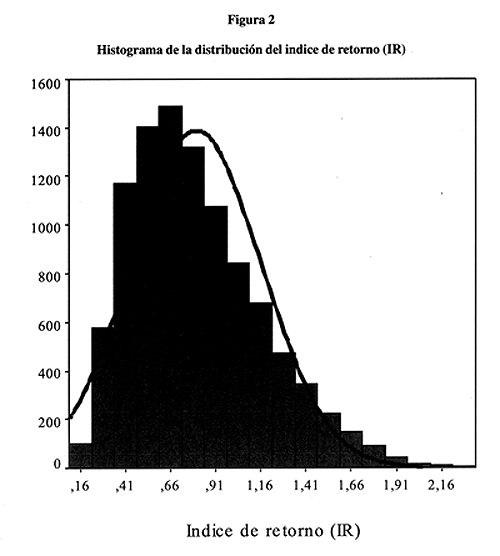
En la figura 2 se presenta la distribución del Indice de retorno (IR) para el modelo. Tiene un valor medio de 0,80 (IC 95% 0,79- 0,81). La distribución presenta una asimetría izquierda, la mediana está en el valor de 0,74 y el recorrido intercuartílico va de 0,53 a 1,02.
Esto quiere decir que aproximadamente en el 75% de los supuestos la intervención supondría un coste neto desde una perspectiva social, mientras que en el 25% restante resultaría en un ahorro neto.
En la figura 3 se presenta la distribución del IR respecto a los valores de incidencia de gripe. Como es de esperar al aumentar la incidencia de la gripe aumenta el IR. Si el modelo se restringe al tercil superior de la distribución de las incidencias gripales estudiadas (incidencia superior a 71,68 casos por mil habitantes) el IR tiene una media de 1,00 (IC 95% 0,99- 1,01). En este caso la mediana del IR sería de 0,96 con un percentil 25 de 0,72 y un percentil 75 de 1,25
También cambia la distribución del IR para un aumento de efectividad de la vacuna (figura 4). Si consideramos solos aquellos casos de alta efectividad (tercil superior, efectividad mayor del 57%) la media del IR es de 1,01 (IC 95% 1,00- 1,03). La mediana sería de 0,97 con un recorrido intercuartílico de 0,72 a 1,27.
Cuando el valor absoluto del producto Incidencia de gripe por efectividad de la vacuna es mayor de 0.036 , esto es, cuando por cada mil casos vacunados se evitan más de 36 casos de gripe el valor medio del IR es mayor de la unidad, es decir, la vacunación tiene beneficios netos inmediatos en términos exclusivamente económicos.
Comentarios
La gripe tiene un gran impacto potencial sobre la productividad de la comunidad, mediada sobre todo por una gran pérdida de horas de trabajo. Sin embargo, en este modelo, la vacunación de población sana en edad productiva solo tendría un resultado económico favorable para situaciones concretas de alta incidencia de gripe y gran coincidencia de las cepas vacunales y circulantes, esto es, con una elevada eficacia vacunal.
Estos resultados difieren de las conclusiones aportadas por otros autores en el ámbito internacional12-16 y nacional18. Sin embargo estos trabajos escogen para sus supuestos basales situaciones de alta incidencia de la gripe y una gran eficacia vacunal. Nichol recoge incidencias de enfermedad de hasta 200 casos por mil habitantes, y una eficacia vacunal de entre un 35 y un 80%2. Postma y cols escogieron una incidencia base de 83-85 casos por mil habitantes con una efectividad vacunal de entre el 70 y el 90%15. En un escenario similar se sitúan Rothberg y Rose2 y Pradas y cols18.
Así Rothberg y Rose en su modelo encuentran que la vacunación evita por término medio 49 casos de gripe por 1.000 vacunados2, Nichol comunica 55 casos evitados en promedio por cada 1.000 vacunados3, y Turner y cols refieren 45 casos evitados por 1.000 vacunados entre 50 y 64 años16, lo que nos sitúa bastante por encima del umbral de las 36 infecciones prevenidas por cada 1.000 casos vacunados, que nos proporcionaría un IR favorable en nuestro caso.
Aunque le efectividad de la vacuna sobre población sin riesgo en algunos ensayos clínicos es superior al 80%13, el análisis combinado de estos resultados reduce ésta a niveles del 30 % en población sana17. La Asociación Española de Vacunología (AEV) rebaja incluso estas cifras proponiendo eficacias vacunales inferiores al 10%8.
En cuanto a la incidencia gripal, los datos comunicados en los últimos años no coinciden con modelos que utilizan valores superiores al 10%. Es posible que la incidencia real de gripe sea incluso menor, debido a que se comunican un número considerable de infecciones respiratorias inespecíficas como gripe sin confirmación serológica8.
En los estudios realizados en otros ámbitos también podrían explicarse las diferencias por unos costes laborales más elevados, lo que se hace más patente en los trabajos más recientes14,16. Si en el presente modelo se incluyesen los costes laborales brutos, que incrementan los costes laborales tomados como referencia en un 34%, la distribución del IR , aunque tendería a desplazarse netamente hacia la derecha, tendría una mediana de 0,84 (datos no mostrados), esto es, aún estaríamos lejos de un beneficio económico claro.
Uno de los factores que tiene mas peso en el modelo propuesto es el de los costes indirectos de la vacunación. Por ejemplo, Pradas no contempla los costes del absentismo por el hecho de vacunarse, pues supone que se realiza en el lugar de trabajo, ni el de las pérdidas laborales por efectos secundarios de la vacunación18. Nosotros creemos imprescindible contemplar esos costes, aunque los hemos reducido al mínimo basados en dos supuestos. La primera condición es que la vacunación en el centro de salud no tenga demora (no hay espera) lo que supone una organización específica para este programa, que implique que las únicas pérdidas de tiempo sean las de los desplazamientos y la propia vacunación. La otra asunción es que las pérdidas laborales por efectos secundarios debidos a vacunación en población trabajadora son muy raros. Sabemos que los efectos secundarios no son superiores a los producidos por una inyección de placebo25, por lo que estimamos que las pérdidas productivas por ellos tienen que ser reducidas. Por otro lado, si estas campañas vacunales se llevasen a cabo en el propio centro de trabajo quizá los costes podrían reducirse y el IR fuese más favorable.
Otro factor sujeto a discusión es la carga que tiene el absentismo laboral en el modelo que presentamos. Los días medios de absentismo y productividad reducida (3 y 2,84 días respectivamente) son más elevados que los manejados en otros trabajos, pues la mayoría en los supuestos basales utilizan valores más cercanos al extremo inferior de nuestro intervalo. Sin embargo, nuestro sistema de protección social, que supone una mínima pérdida para el trabajador en caso de ausencia laboral por enfermedad, puede hacer que este absentismo sea más prolongado que en otros entornos laborales. De hecho Pradas y cols, refieren una duración media de la Incapacidad temporal por gripe de 7 días, mencionando datos del Instituto Laboral de su Comunidad Autónoma18. Los datos ofrecidos por otros autores , aún contemplando cifras más moderadas de absentismo laboral, atribuyen a la vacunación una reducción más marcada del absentismo. Así Nichol comunica una reducción de media de 123 días de absentismo por cada mil vacunados y de 38 días de productividad reducida3, y Rothberg y Rose apuntan que la vacunación evita una media de 93 días perdidos por cada mil vacunados2, frente a nuestros 48, 7 días totales.
El hecho es que con los resultados presentados la vacunación general de la población trabajadora no está justificada desde una perspectiva económica. Pero hay circunstancias que no se han tenido en cuenta. Se despreciaron las posibilidades de muerte por ser altamente improbables en personas sin patología concomitante y por no tener repercusiones sobre los costes actuales. Pero los procesos gripales tienen una repercusión sobre la calidad de vida de quienes los sufren. La «utilidad» del tiempo vivido con síntomas gripales se ha cifrado en 0,62. Si cada proceso tiene una duración media de 7 días, implicaría la pérdida de 2,8 días ajustados por calidad. Con cada 1.000 vacunaciones estaríamos evitando la pérdida de una media de 82,04 días ajustados por calidad, esto es, 0,225 años de vida ajustados por calidad (AVACs) a un coste medio de entre 2.508 y 2.696 euros. Luego el coste neto por AVAC ganado oscilaría entre 11.147 y 11.892 euros, cifras no muy diferentes a las propuestas por Turner y cols (10.766 libras por AVAC, 1,06 AVACs ganados por cada 1.000 vacunaciones)16 o las de Rothberg y Rose (17.000 euros por AVAC ganado con la vacunación)2.
Desde una perspectiva individual la vacunación antigripal también puede ser deseable. Se ha calculado la disposición a pagar por un día libre de síntomas gripales en 15,49 dólares USA de 200114, y aunque este dato no es extrapolable directamente a nuestro entorno, nos indica cierta predisposición individual a asumir algún coste para evitar el proceso infeccioso.
Por otra parte el estudio que presentamos tiene ciertos aspectos discutibles, además de la no inclusión de los costes futuros y de las pérdidas de calidad de vida. Tampoco se han incluido costes de complicaciones raras y no perfectamente establecidas en relación con la vacunación como es el síndrome de Guillain-Barré, ni el coste de lo posibles ingresos en Unidades de críticos. Creemos que el contemplar estas circunstancias supondría hacer más complejo el modelo sin cambiar el signo de los resultados que analizamos.
También cabe preguntarse por la importancia que tiene en el análisis de sensibilidad la elección de distribuciones uniformes para todas las variables en lugar de otras más cercanas a la realidad como las logarítmicas o las normales. El hecho de no conocer la verdadera forma de las distribuciones de los valores estudiados, ni los parámetros que las definirían y la simplicidad de la distribución uniforme nos hicieron decantarnos por ella, aún a sabiendas que mermábamos la precisión de los resultados. El elevado número de casos de la simulación sirve para paliar este problema.
Y la última dificultad con la que nos encontramos en este modelo, y quizás la más relevante, es que no tiene en cuenta el efecto protector de la vacunación, incluso para aquellas personas que no la reciben, al disminuir la capacidad de propagación del virus. Existen modelos matemáticos más o menos complejos que tienen en cuenta esta circunstancia33, pero no lo hacen la mayoría de los que hemos utilizado como referencia.
Conclusión
En definitiva, podríamos afirmar que la vacunación de la población trabajadora sin patología concomitante no supone un ahorro neto de costes salvo en circunstancias concretas de gran prevalencia y coincidencia marcada de las cepas vacunales y circulantes. Pero la valoración global de la estrategia debe contemplar otras realidades como las preferencias de la población y la repercusión de la infección no solo sobre la capacidad productiva sino también sobre el bienestar global.
Agradecimientos
A Pilar García Gómez del Centre de Recerca en Economia i Salut (CRES), Universitat Pompeu Fabra, por la lectura crítica de este trabajo y por sus sugerencias y aportaciones. A Rosario Marazuela Bermejo del Dpto. Médico de AstraZeneca Spain, por su colaboración en la obtención de los datos del modelo.
Bibliografía
1. Treanor JJ. Influenza virus. En: Mandell GL, Bennett JE, Dolin R, editores. Principles and Practice of Infectious Diseases. 6th ed. Philadelphia: Elsevier Churchill Livingstone; 2005. p. 2060-85. [ Links ]
2. Rothberg MB, Rose DN. Vaccination versus treatment of influenza in working adults: a cost-effectiveness analysis. Am J Med. 2005; 118: 68-77. [ Links ]
3. Nichol KL. Cost-benefit analysis of a strategy to vaccinate healthy working adults against influenza. Arch Intern Med 2001;161 :749-59. [ Links ]
4. Vázquez K. Gripe: La Epidemia que vuelve cada año. Rev Esp Econ Salud 2004; 3:303-7. [ Links ]
5. Moscona A. Neuraminidase inhibitors for influenza. N Engl J Med. 2005; 353: 1363-73. [ Links ]
6. van der Wouden JC, Bueving HJ, Poole P. Preventing influenza: An overview of systematic reviews. Respir Med 2005; 99:1341-9. [ Links ]
7. Ministerio de Sanidad y Consumo. Dirección General de Salud Pública. Enfermedades Transmisibles: La Gripe. [consultado el 17/10/2005]. Disponible en: www.msc.es/Diseno/enfermedadesLesiones/enfermedades_transmisibles.htm [ Links ]
8. Asociación Española de Vacunología. Documento de consenso sobre la Gripe, Junio 2005. [consultado el 18/8/2005]. Disponible en: www.aev.es/aev/pdf/confConsGripe.pdf . [ Links ]
9. Harper SA, Fukuda K, Uyeki TM, Cox NJ, Bridges CB; Advisory Committee on Immunization Practices (ACIP), Centers for Disease Control and Prevention (CDC). Prevention and control of influenza. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2005; 54:1-40. [ Links ]
10.- Langley JM, Faughnan ME, and the Canadian Task Force on Preventive Health Care. Prevention of influenza in the general population: recommendation statement from the Canadian Task Force on Preventive Health Care. CMAJ 2004; 171:1169- 70. [ Links ]
11. Postma MJ, Jansema P, van Genugten M LL, Heijnen M-L A, Jager JC, de Jong-van den Berg LTW. Pharmacoeconomics of Influenza Vaccination for Healthy Working Adults: Reviewing the Available Evidence. Drugs, 2002; 62: 1013- 24. [ Links ]
12. Nichol KL, Lind A, Margolis KL, Murdoch M, McFadden R, Hauge M, Magnan S, Drake M. The effectiveness of vaccination against influenza in healthy, working adults. N Engl J Med. 1995; 333: 889-93. [ Links ]
13. Bridges CB, Thompson WW, Meltzer MI, Reeve GR, Talamonti WJ, Cox NJ, et al. Effectiveness and cost-benefit of influenza vaccination of healthy working adults: A randomized controlled trial. JAMA. 2000; 284: 1655-63. [ Links ]
14. Lee PY, Matchar DB, Clements DA, Huber J, Hamilton JD, Peterson ED. Economic analysis of influenza vaccination and antiviral treatment for healthy working adults. Ann Intern Med 2002; 137: 225-31. [ Links ]
15. Postma MJ, Jansema P, Scheijbeler HW, van Genugten ML. Scenarios on costs and savings of influenza treatment and prevention for Dutch healthy working adults. Vaccine 2005 ; 23: 5365-71. [ Links ]
16. Turner DA, Wailoo AJ, Cooper NJ, Sutton AJ, Abrams KR, Nicholson KG. The cost-effectiveness of influenza vaccination of healthy adults 50-64 years of age. Vaccine 2006 ; 24: 1035-43. [ Links ]
17. Demicheli V, Rivetti D, Deeks JJ, Jefferson TO. Vaccines for preventing influenza in healthy adults. The Cochrane Database of Systematic Reviews 2004, Issue 3. Art. No.: CD001269. DOI: 10.1002/14651858.CD001269.pub2. [ Links ]
18. Pradas R, Antoñanzas F, Zoellner Y. Evaluación económica de la vacunación antigripal por los servicios médicos de empresa. Rev Esp Econ Salud 2004; 3: 227- 33. [ Links ]
19. Postma MJ, Baltussen RM, Heijnen ML, de Berg LT, Jager JC. Pharmacoeconomics of influenza vaccination in the elderly: reviewing the available evidence. Drugs Aging 2000; 17: 217-27. [ Links ]
20. INEBase. Salud. Enfermedades de Declaración Obligatoria. [consultado el 15/10/2005]. Disponible en: www.ine.es/inebase/. [ Links ]
21. Edwards KM, Dupont WD, Westrich MK, Plummer WD Jr, Palmer PS, Wright PF. A randomized controlled trial of cold-adapted and inactivated vaccines for the prevention of influenza A disease. J Infect Dis 1994; 169: 68-76. [ Links ]
22. Villari P, Manzoli L, Boccia A. Methodological quality of studies and patient age as major sources of variation in efficacy estimates of influenza vaccination in healthy adults: a meta-analysis. Vaccine. 2004 ; 22: 3475-86. [ Links ]
23. van Genugten ML, Heijnen ML, Jager JC. Pandemic influenza and healthcare demand in the Netherlands: scenario analysis. Emerg Infect Dis. 2003;9: 531-8. [ Links ]
24. Neuzil KM, Reed GW, Mitchel EF Jr, Griffin MR. Influenza-associated morbidity and mortality in young and middle-aged women. JAMA 1999 ; 281: 901-7. [ Links ]
25. Nichol KL, Margolis KL, Lind A, Murdoch M, McFadden R, Hauge M, et al. Side effects associated with influenza vaccination in healthy working adults. A randomized, placebo-controlled trial. Arch Intern Med 1996;156: 1546-50. [ Links ]
26. Keech M, Scott AJ, Ryan PJ. The impact of influenza and influenza-like illness on productivity and healthcare resource utilization in a working population. Occup Med (Lond) 1998; 48: 85-90. [ Links ]
27. Kavet J. A perspective on the significance of pandemic influenza. Am J Public Health 1977; 67:1063-70. [ Links ]
28. Kumpulainen V, Makela M. Influenza vaccination among healthy employees: a cost-benefit analysis. Scand J Infect Dis 1997; 29:181-5. [ Links ]
29. Comunidad de Madrid. Isocronas sanitarias. Estudio de la accesibilidad geográfica a los recursos de la red sanitaria pública en la Comunidad de Madrid. Madrid: Consejería de Salud, 1992. [ Links ]
30. Instituto Nacional de Estadística. Índice de Precios al consumo. [consultado el 18/10/2005]. Disponible en: http://www.ine.es/cgi-bin/certi [ Links ]
31. Conselleria de Sanitat. Dirección General Para La Salud Pública, Nº 63. Prevención y Vigilancia de la Gripe en la Comunidad Valenciana. Temporada 2000-2001. [ Links ]
32. INEBase. Sociedad. Mercado laboral..Encuesta laboral de coste 2003.[consultado el 18/10/2005]. Disponible en: www.ine.es/inebase/. [ Links ]
33. Byrnes GB. A Markov model for sample size calculation and inference in vaccine cost-effectiveness studies. Stat Med 2002; 21: 3249-60. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Jesús Martín Fernández
Centro de Salud San Martin de Valdeiglesias
Cº de la Aliseda s/n.
San Martin de Valdeiglesias
28680 Madrid
E-mail: jmartinefe@hotmail.com