Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.82 no.3 Madrid may./jun. 2008
ORIGINAL BREVE
Participación de las mujeres en los ensayos clínicos según los informes de la Agencia Española de Medicamentos y Productos Sanitarios. 2007
Women participation in clinical trials. A preliminary study in the files of the Spanish Agency for Medicinal Products and Medical Devices
Noa Laguna Goya (1) y Fernando de Andrés Rodríguez-Trelles (2)
(1) División de Farmacología y Evaluación Clínica. Subdirección General de Medicamentos de Uso Humano. Agencia Española de Medicamentos y Productos Sanitarios. Ministerio de Sanidad y Consumo.
(2) Departamento de Farmacología. Facultad de Medicina. Universidad Complutense de Madrid.
Dirección para correspondencia
RESUMEN
Fundamento: la información sobre la participación de hombres y mujeres en los ensayos clínicos que afectan a la población general no parece estar aún suficientemente extendida en el ámbito de la comunidad científica. El objetivo del estudio ha sido la valoración aproximativa de la situación en España acerca del tratamiento de los datos de los ensayos clínicos en el momento de publicación de la Ley de Igualdad.
Métodos: Se revisaron los apartados de diseño, población de estudio, datos demográficos y características básales de los sujetos participantes, resultados y conclusiones del ensayo en los resúmenes de los informes finales de los ensayos clínicos recibidos durante el primer cuatrimestre de 2007 en la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Resultados: De los 25 documentos analizados 5 desagregan datos por edad y sexo, 13 no aportan ningún dato desagregado por sexo ni ninguna conclusión, 3 tampoco expresan los resultados desagregados por sexo pero sí describen por esta variable los acontecimientos adversos graves, y en 4 no se encuentran ni resultados ni conclusiones.
Conclusiones: Sólo el 20% de los resúmenes revisados proporciona datos desagregados por sexo. Esto podría deberse a que no se haya hecho o que no se le haya dado la suficiente importancia como para incluirlo en el resumen, lo que tampoco es satisfactorio. Un estudio más amplio es difícil dada la calidad actual de los resúmenes de los informes finales de ensayos, que es el único documento obligatorio remitir a la AEMPS una vez concluido el ensayo.
Palabras clave: Ensayo clínico. Mujeres. Sesgo de Género.
ABSTRACT
Background: The evaluation of the gender bias in clinical trials is not unanimous. The aim of this study has been the assessment of the current situation in Spain regarding the manipulation of data from clinical trials at the publication of the Law of Equality.
Methods: We have examined the study design, sample population, demographic data and baseline clinical characteristics of participants, results and conclusions of the trial in the summaries of the final reports of clinical trials received in the first four months of 2007 in the Agencia Española de Medicamentos y Productos Sanitarios.
Results: From twenty-five documents analysed, in their results and conclusions: Five subdivide data sets by age and gender, thirteen do not subdivide data by gender nor do they provide a conclusion, three do not subdivide results neither but do describe severe side effect by gender and four others provide no results or conclusions.
Conclusions: Only twenty percent of the reviewed summaries provide data subdivided by gender. This could be due to the fact that it has not been made or that it was not given enough importance to include it in the summary, neither of which is satisfactory. A more detailed study is difficult due to the current quality of the summaries provided of the final reports of the clinical trials, which is the only document that is mandatory to send to the AEMPS once the trial has concluded. We expect that with the publication of the new Law of Equality this situation will improve, given the growing evidence of the relevance of the subdivision by gender.
Key words: Clinical trial. Women. Gender bias.
Introducción
A pesar de que en las últimas dos décadas se ha empezado a introducir información sobre la participación de hombres y mujeres en los ensayos clínicos (EC) que afectan a la población general, esta consideración no parece estar aún suficientemente extendida en el ámbito de la comunidad científica y en muchos casos no es representativa del colectivo mujer1. En este tema se encuentran enfrentadas distintas opiniones, no existiendo una valoración unánime ni en cuanto en la necesidad de evitarlo ni en sus consecuencias2-7.
Tanto la Food and Drug Administration (FDA) en su trabajo Womens Participation in clinical Trials and Gender-Related Labeling8, como la Agencia Europea del Medicamento (EMEA) mediante distintas directrices publicadas en 2006 y 20079,10, concluyen que las mujeres están participando en los (EC) de los nuevos medicamentos de forma proporcional a su peso poblacional. Además la EMEA concluye que los resultados de la revisión (datos del trabajo no disponibles) son contrarios a la necesidad de una guía de la Conferencia Internacional de Armonización (ICH) específica sobre mujeres como población especial en los EC, aunque sí existen sobre la participación en los ensayos clínicos de personas mayores y sobre la población pediátrica.
Sin embargo en 2001 la OMS hizo una serie de propuestas11 sobre políticas sanitarias e investigación que podrían mejorar la situación de inequidad actual incorporando datos sobre el efecto de los medicamentos durante la menstruación o el efecto directo de fármacos sobre las mujeres. Así mismo la ICH recomienda que se debe obtener información de sub-poblaciones como las mujeres y que la selección de sujetos se debe realizar de forma que la población del estudio sea fiel reflejo de la población diana para el nuevo medicamento12,13.
En nuestro país, apoyando estas observaciones de la ICH y la de la OMS, esta tesis se ve reforzada con la publicación de la Ley Orgánica 3/2007 de 22 de marzo, para la igualdad efectiva de mujeres y hombres (en adelante Ley de Igualdad)14.
El Observatorio de Salud de la Mujer refiere que el conocimiento científico en salud actualmente disponible está sesgado respecto al género, lo que supone un factor clave de inequidad y desigualdad entre mujeres y hombres, no sólo en cuanto al conocimiento de los determinantes de la salud sino también en cuanto al acceso a la atención sanitaria y a la calidad de los cuidados y servicios sanitarios15.
La Ley de Igualdad modificó la Ley 14/1986 General de Sanidad, entre otros, en el tratamiento de los datos contenidos en registros, encuestas, estadísticas u otros sistemas de información médica, para permitir el análisis de género incluyendo, siempre que sea posible, su desagregación por sexo14.
La investigación clínica en España referente al género se ha visto apoyada con la publicación de esta Ley de Igualdad, en la que se establece que las Administraciones públicas desarrollarán las siguientes actuaciones: El fomento de la investigación científica que atienda las diferencias entre mujeres y hombres en relación con la protección de su salud, especialmente en lo referido a la accesibilidad y el esfuerzo diagnóstico y terapéutico, tanto en sus aspectos de ensayos clínicos como asistenciales14.
En nuestra legislación anterior el Real Decreto 223/2004 regula los EC con medicamentos16. En esta norma no hay mención expresa al sexo de los sujetos pero establece las funciones de los Comités Éticos de Investigación Clínica (CEIC), entre las que se encuentra la de evaluar los aspectos metodológicos, éticos y legales de los EC. En este sentido los CEIC deben emitir un dictamen sobre la pertinencia del diseño de un EC para obtener conclusiones fundamentadas con el número adecuado de sujetos en relación con el objetivo del estudio y los criterios de selección y retirada de los sujetos del EC, así como la selección equitativa de la muestra17.
Tras la aprobación del EC por el CEIC y la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), éste se lleva a cabo en el centro de investigación y en el plazo de 1 año desde el final del EC el promotor remitirá a la AEMPS y a los CEIC implicados un resumen del informe final sobre sus resultados.
Según el trabajo realizado en el Hospital Miguel Server sobre 101 EC, concluyen que no existían criterios de inclusión según sexo, observando que la participación de hombres y mujeres tenía una relación de 2 a 118.
Según las investigadoras Ruiz Cantero y Pardo los EC de un nuevo fármaco para la osteoartritis incluían más mujeres que hombres. Sin embargo, en el 80 % de los EC no se indicaba la eficacia de este fármaco por sexos; tan sólo en un estudio se informaba de los efectos secundarios distinguiendo entre ambos sexos1.
Los objetivos de este trabajo son describir la frecuencia del registro de la variable sexo de los participantes en alguno de los apartados del resumen informe final del EC y en qué medida los resultados de los EC se presentan como globales o en función del sexo.
Material y métodos
Se realizó un estudio observacional transversal coincidiendo con la publicación de la Ley de Igualdad. Se revisaron todos los resúmenes de los informes finales de los EC recibidos durante el primer cuatrimestre de 2007 en la Subdirección de Medicamentos de Uso Humano de la AEMPS (de 1 de enero de 2007 a 30 de abril de 2007).
La presentación del resumen del informe final del EC es un requisito recogido en el Real Decreto por el que se regulan los EC con medicamentos16. No existe una estandarización del formato de informe final ni del resumen en nuestra legislación, aunque los investigadores pueden seguir para su redactado las recomendaciones de las ICH.
Se examinaron específicamente los apartados en los que se describe la población de estudio y los de resultados y conclusiones del EC. Los primeros se especifican por sus autores como diseño del estudio, población de estudio, datos demográficos o características basales de los sujetos participantes en el EC. La variable estudiada fue el sexo de los sujetos participantes en los EC, y para tener una referencia se recoge también la edad, que es otra variable fisiológica que se espera encontrar descrita.
La frecuencia con la que se explicitan el sexo y la edad se expresa en porcentajes sobre el total de la muestra del tipo de estudio, apartado del resumen, y tema de estudio en el EC.
Resultados
Durante el primer cuatrimestre de 2007 se recibieron 28 resúmenes de informes de los cuales se excluyeron 3 por referirse a patologías exclusivas de un solo sexo (hirsutismo femenino, disfunción eréctil, papilomavirus/cáncer genital femenino). De los 25 informes analizados, 2 correspondían a EC finalizados prematuramente, uno por falta de participantes y en el otro no se especificó el motivo.
Los documentos estudiados, bien el informe final completo bien los resúmenes, eran muy heterogéneos y algunos aportaban muy poca información.
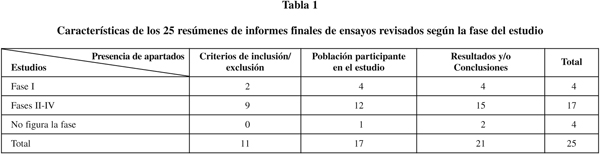
De los informes estudiados 4 fueron clasificados por sus autores como EC clínicos fase I, 3 en fase II, 10 en fase III, 4 en fase IV y en otros 4 el dato no aparecía (tabla 1). En relación con el diseño del estudio 14 EC eran abiertos, 7 doble ciego y en 4 no figuraba el tipo de diseño; 17 aleatorizados, 4 no aleatorizados y en 4 no figuraba esta característica; y con relación al número de centros 15 de los EC eran multicéntricos, 6 unicéntricos y en 4 no figuraba.
Todos los EC fase I estudiados eran EC de bioequivalencia para el registro de nuevos medicamentos genéricos. Los informes de estos EC resultaron ser de los más completos en cuanto a información relativa al sexo del sujeto.
La población incluida eran voluntarios sanos en los EC fase I y en 3 de los 4 se acotaba la edad entre 18 y 35 años. En los EC fase II a IV sólo aparecían los criterios de inclusión/exclusión en 8 de los resúmenes: pacientes ≥ 18 años, en 6 se especificaba que son pacientes de ambos sexos y están excluidas mujeres embarazadas o sin prueba de embarazo negativa, que no utilicen método anticonceptivo eficaz y mujeres en periodo de lactancia (tablas 1 y 2).
En 16 de los 25 documentos (64%) se describe la población participante, la cual oscila desde 5 hasta 3.015 sujetos, siendo el primero un EC unicéntrico con finalización prematura y el más numeroso un EC multicéntrico. De los 16 EC 3 informes describen la variable sexo de los participantes pero no la edad y 2 informes describen la edad y concluyen que los grupos de hombres y mujeres eran similares sin aportar números (tabla 2). En los 14 informes (56%) que recogen la variable sexo, la representación de las mujeres va del 50% en un EC realizado para conocer la eficacia de un antibiótico (fase I) al 16,67% en otro que pretende conocer la eficacia de un inmunosupresor (glomerulonefritis membranosa idiopática). El resto de los porcentajes según el objeto de estudio era: 22% antiviral (VIH), 31,3% antineoplásico (carcinoma medular de tiroides avanzado no resecable), 33% antineoplásico (cáncer colorrectal), 33,9% inmunosupresor, 40% agente desintoxicante para el tratamiento antineoplásico (carcinoma colorrectal metastásico), 40% antiparkinsoniano (fase I), 44,5% analgésico (fase I), 45,8% antiparkinsoniano (parkinson), 47,2% hipocolesterolemiante, 77% antidepresivo (depresión), 81,4% antiinflamatorio (postulosis palmoplantar), 90,9% relajante muscular (síndrome miofascial primario de localización cervicodorsal).
En cuanto a los resultados expuestos y las conclusiones comentadas en los 25 resúmenes revisados de los informes de los EC en 5 de ellos desagregaron los datos por edad y sexo, 13 no aportaron ningún dato ni ninguna conclusión desagregados por sexo, 3 tampoco expresan los resultados desagregados por sexo pero sí lo describen en los acontecimientos adversos graves ocurridos a los pacientes, y en 4 de los documentos no se encuentran esta desagregación ni en los resultados ni en las conclusiones. Concretamente en 20 (80%) de los documentos no existía ninguna información relativa al sexo en resultados y/o conclusiones (tabla 3).
Discusión
En los resúmenes de los informes finales de EC revisados sólo el 20% hace referencia al sexo en resultados y/o conclusiones, aunque sí se da información sobre esta variable en el 44% de los casos en algún apartado del informe. Esto podría ser debido a que hasta ahora no se le haya dado importancia al hecho de que los datos deben desagregarse por sexo, o a que el estudio de las subpoblaciones no mostraba la existencia de diferencias por edad y sexo, o que éstas no alcanzaban significación estadística debido al tamaño de la muestra en función de la incidencia de los hallazgos. Aunque lo que sí se puede concluir es que no ha sido considerado de suficiente interés por el redactor del resumen del informe para mencionarlo.
La calidad de los resúmenes preceptivos que deben enviarse a la AEMPS del informe final del EC es extremadamente variable no proporcionando en algunos casos apenas información de utilidad, pero la legislación sólo exige la existencia de un resumen sin entrar en su calidad.
Los informes de los EC fase I han resultado ser de los más completos en cuanto a información relativa al sexo de los participantes, lo que puede ser por tratarse de protocolos más estándarizados.
La falta de detalles en los documentos estudiados dificulta extraer conclusiones pormenorizadas y pone en cuestión la utilidad en sí de los documentos enviados al finalizar el EC. Por otro lado, el número de resúmenes recibidos parece pequeño respecto al número presumible de ensayos finalizados en ese período de tiempo. En aras de la transparencia en la investigación y para evitar la repetición, sería recomendable que mejorara el cumplimiento de este requisito legal.
Dada la reciente exigencia legal de que los resultados de las investigaciones clínicas se den desagregados por sexo (Ley de Igualdad) es de esperar que la situación cambie en el futuro. Esta ley hace hincapié en que la investigación atienda las diferencias entre hombres y mujeres.
Independientemente de las consideraciones de orden social, es evidente que la desagregación por sexo es importante desde el punto de vista sanitario, ya que no sabemos si al encontrar diferencias entre sexos éstas deberían ser recogidas en la ficha técnica del medicamento o si incluso deberían recomendarse pautas de tratamiento diferentes para hombres y para mujeres.
Consideramos que diferencias eventuales encontradas en los resultados de los EC deben ser estudiadas y posteriormente comentadas en la ficha técnica del medicamento, por ejemplo en uno de los resúmenes revisados se expone que la concentración plasmática del fármaco era mayor en hombres que en mujeres y lo justifica por el menor peso corporal en las mujeres.
Al no haber encontrado los datos desagregados por sexo no podemos extraer conclusiones sobre si la representación es adecuada o no. Sólo tenemos datos de 14 de los 25 documentos finalmente analizados, de éstos en 3 no se especifica la edad y además el reclutamiento de participantes en algunos es en España y en otros internacional, así que no se pueden comparar entre sí. Por ello el problema de fondo no puede ser resuelto con los resúmenes y sería necesario un estudio en mayor profundidad, más difícil de conseguir dado que únicamente es obligatorio enviar un resumen del informe final.
El problema no es sólo el posible sesgo en la evidencia científica generada, sino también de equidad, pues la utilización de muestras integradas exclusiva o mayoritariamente por hombres, que deriva en un sesgo androcéntrico en la selección de los sujetos de los EC de fármacos y tratamientos, hace que los hallazgos sólo puedan ser aplicables a la mitad de la población, estando las mujeres excluidas de los beneficios de la experimentación biomédica15. Más concretamente, el fallo se encontraría en la no visualización de las mujeres en las investigaciones en salud, aunque se hayan incluido en la muestra del estudio, al caer en las siguientes prácticas: No desagregar por sexo ni al recoger la información al cumplimentar las bases de datos por sexo, ni en el análisis de los datos ni en la presentación de los resultados15.
No todo debe dejarse al control legal o a las Autoridades sanitarias y por ello nos sumamos a las recomendaciones de Ruiz-Cantero y Verdú-Delgado en cuanto a que un factor importante para mejorar la generalización de los resultados es que las instituciones financieras valoren la creatividad en la identificación, la incorporación y el mantenimiento de las mujeres en los EC, así como que los editores y evaluadores de revistas científicas, que ya vienen determinando la forma y el contenido de la evidencia científica, incorporen el requisito de presentación de los resultados estratificados por sexos, y/o con un análisis de género19.
En este sentido la OMS propone que se tomen las medidas necesarias, para que las estadísticas relacionadas con la salud y los medicamentos sean analizadas por sexo. Este tipo de datos es totalmente necesario para validar el conocimiento tanto a nivel nacional como internacional y no pueden ser ignorados ni desde su perspectiva científica ni desde el contexto actual de globalización11.
La investigación preliminar o exploratoria hecha sobre resúmenes de informes de EC nos lleva a concluir en la necesidad de hacer una investigación más amplia en los protocolos de los EC y en los resultados presentados en los expedientes de registro de los medicamentos. En función de los resultados de la investigación futura se podían hacer propuestas como recomendaciones a los CEIC, a las Autoridades Sanitarias, sobre la evaluación de la adecuada representación por sexo; pero ahora con estos resultados preliminares solo podemos recordar la exigencia de resultados desagregados por sexo y la importancia de estos.
Agradecimientos
A Dolores Montero Corominas (Subdirección General de Medicamentos de Uso Humano, AEMPS), Mª Antonia Serrano Castro (Área de Ensayos Clínicos de la AEMPS), Emilio Vargas Castrillón (Subdirección General de Medicamentos de Uso Humano, AEMPS) y Alicia Llacer Gil de Ramales (Centro Nacional de Epidemiología, ISCIII).
Bibliografía
1. CORDIS: Servicio de Información Comunitario sobre Investigación y Desarrollo. La representación insuficiente de las mujeres en ensayos clínicos perjudica su atención sanitaria. Bruselas oficina de publicaciones de las Comunidades Europeas.[citado el: 2007-03-08]. Disponible en: http://cordis.europa.eu/fetch?CALLER=ES_NEWS & ACTION=D & DOC=33 & CAT=NEWS & QUERY=1190016248372 & RCN=27270 [ Links ]
2. Lippman A. The Inclusion of Women in Clinical Trials: Are We Asking the Right Questions? Canada Women and Health Protection; 2006. [ Links ]
3. Keitt SK, Wagner CR, Tong C, Marts SA. Understanding the biology of sex and gender differences: using subgroup analysis and statistical design to detect sex differences in clinical trials. Med Gen Med. 2003 Jun 9; 5(2):39. [ Links ]
4. Bartlett C, Doyal L, Ebrahim S, Davey P, Bachmann M, Egger M, Dieppe P. The causes and effects of socio-demografic exclusions from clinical trials. 1: Health Technol Assess. 2005 Oct; 9(38): iii-iv, ix-x, 1-152. [ Links ]
5. Colomer Revuelta C. El sexo de los indicadores y el género de las desigualdades. Rev Esp Salud Pública. 2007; 81: 91-93. [ Links ]
6. Castaño-López E, Plazaola-Castaño J, Bolívar-Muñoz J, Ruiz-Pérez I. Publicaciones sobre mujeres, salud y género en España (1990-2005). Rev Esp Salud Pública. 2006; 80: 705-716. [ Links ]
7. Artazcoz A. Las desigualdades de género en salud en la agenda de salud pública. Gac Sanit. 2004; 18(Supl 2):1-2. [ Links ]
8. Women's Participation in Clinical Trials and Gender-Related Labeling: A Review of New Molecular Entities Approved 1995-1999. FDA. Disponible en: http://www.fda.gov/cder/reports/womens_health/women_clin_trials.htm [ Links ]
9. Agencia Europea de Medicamentos. Directriz EMEA/CHMP/3916/2005-ICH - Gender considerations in the Conduct of Clinical Trials. Bruselas: Agencia Europea de Medicamentos; 2005. [ Links ]
10. Agencia Europea de Medicamentos. Doc. Ref. EMEA/CHMP/EWP/498145/2006. Reflection paper on gender differences in cardiovascular diseases. Bruselas: Agencia Europea de Medicamentos; 2006. [ Links ]
11. Bisilliat J. Introducing the gender perspective in national essential drug programmes. Department of Essential Drugs and Medicines Policy. Ginebra: World Health Organization; 2001. [ Links ]
12. Conferencia Internacional de Armonización. Directriz armonizada tripartito ICH, Structure and Content of Clinical Study Reports. Note for Guidance on Structure and Content of Clinical Study Reports, E3. Current Step 4 versión. 30 Noviembre 1995. [ Links ]
13. Conferencia Internacional de Armonización. Directriz armonizada tripartito ICH, General Considerations for Clinical Trials, Note for Guidance on General Considerations for Clinical Trials, E8. Current Step 4 versión. 17 Julio 1997. [ Links ]
14. Boletín Oficial del Estado. Ley Orgánica 3/2007, de 22 de marzo, para la igualdad efectiva de mujeres y hombres. BOE núm 71 de 23/03/2007. [ Links ]
15. García Calvente MM. Políticas de investigación en salud. Guía de recomendaciones para la incorporación de la perspectiva de género. EASP. Ministerio de Sanidad y Consumo Observatorio de Salud de la Mujer. Disponible en: http://www.msc.es/organizacion/sns/planCalidadSNS/e02_t01.htm [ Links ]
16. Boletín Oficial del Estado. Real Decreto 223/2004, de 6 de febrero, por el que se regulan los ensayos clínicos con medicamentos BOE núm 33 del 07/02/2004. [ Links ]
17. Ministerio de Sanidad y Consumo. Listado con los apartados mínimos e imprescindibles que deben ser evaluados por los Cómites Éticos. Documentos técnicos, difundidos como propuesta, en materia de evaluación de ensayos clínicos por los CEIC. Centro Coordinador de CEIC del Ministerio de Sanidad y Consumo. Disponible en: http://www.msc.es/profesionales/farmacia/ceic/documentosTec.htm [ Links ]
18. Arenere Mendoza M, Cilveti-Sanchez U, Idopie Tomas A., Izuel-Rami M, Navarro Aznarez H, Palomo Palomo P. Influencia del género en investigación clínica. Farm Hosp. 2004; 28 (6):440-4. [ Links ]
19. Ruiz-Cantero MT, Verdú-Delgado M. Sesgo de género en el esfuerzo terapéutico. Gac Sanit. 2004; 18 (Supl 1):118-25. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Noa Laguna Goya
Agencia Española de Medicamentos y Productos Sanitarios.
Parque Empresarial Las Mercedes, Edificio 8
C/ Campezo 1
28022 Madrid
Correo electrónico: nlaguna@agemed.es