Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.82 no.5 Madrid sep./oct. 2008
Malaria en España: aspectos entomológicos y perspectivas de futuro
Malaria in Spain: entomological aspects and future outlook
Rubén Bueno Marí y Ricardo Jiménez Peydró
Laboratorio de Entomología y Control de Plagas. Instituto Cavanilles de Biodiversidad y Biología Evolutiva. Universidad de Valencia.
Dirección para correspondencia
RESUMEN
La malaria fue erradicada de España oficialmente en 1964. Sin embargo, en la actualidad en nuestro país se registran anualmente cientos de casos importados. En este sentido, el estudio del vector se postula de gran importancia para inferir posibles escenarios de transmisión, ya sea de tipo esporádico o regular. Si bien el nivel socio-económico del país no parece secundar una posible reemergencia de la enfermedad a corto o medio plazo, la presencia de poblaciones de anofelinos bien establecidas y gametocitos de plasmodios circulando entre cierto porcentaje de la población humana parecen avalar, con suficiente crédito, el mantenimiento del estado de vigilancia epidemiológica. Además, la globalización de mercados y el emergente proceso de cambio climático, pueden permitir la colonización de nuestro territorio por parte de especies de Anopheles transmisoras de plasmodiosis humana en regiones tropicales y subtropicales. Con el objetivo de profundizar en el conocimiento de la riqueza faunística, distribución espacial y bioecología de los culícidos anofelinos, se llevaron a cabo diversos muestreos larvarios intensivos la Comunidad Valenciana, región con suficiente heterogeneidad hídrica y datos históricos de prevalencia palúdica, como para respaldar su elección. Cinco especies del género Anopheles, con distinta trascendencia en la difusión de la enfermedad, fueron identificadas.
Palabras clave: Malaria. Anopheles. España. Mosquitos. Biodiversidad. Vector. Plasmodium.
ABSTRACT
Malaria was officially eradicated in Spain in 1964. However, at the present time, hundreds of imported cases are registered in our country each year. In this context, the study of the vector is seen to be highly significant in order to infer possible transmission scenarios, whether of a sporadic or a regular nature. Although the socio-economic level of the country does not appear to foreshadow the possible re-emergence of the disease in the short and medium term, the presence of well-established populations of anophelini and plasmodium gametocytes circulating in a certain percentage of the human population does appear to warrant the continuation of the current status of epidemiological surveillance. Moreover, the globalisation of markets and the emerging process of climate change could enable the colonisation of our territory by part of the Anopheles species that transmit human plasmodiosis in tropical and subtropical regions. In order to obtain a more thorough knowledge of the range of fauna, spatial distribution and bioecology of the anopheline Culicoides, a number of intensive larval samplings were taken in the Community of Valencia, a region with sufficient surface water heterogeneity and historical data of malaria prevalence to substantiate the decision to choose it for this study. Five species of the Anopheles genus, with varying degrees of impact in the dissemination of the disease, were identified.
Key words: Malaria. Anopheles. Spain. Mosquitoes. Biodiversity. Insect vector. Plasmodium.
Introducción
La malaria o paludismo es la enfermedad parasitaria más frecuente del mundo. El alto riesgo de contraer esta enfermedad potencialmente mortal en el 40% de la población mundial y los más de 500 millones de personas afectadas anualmente1, son algunas de las razones que sitúan a la malaria entre las mayores preocupaciones a nivel de Salud Pública.
Como en cualquier enfermedad de tipo vectorial, tres son las variables necesarias para comenzar un ciclo de transmisión: el agente causal, el vector y la población humana potencialmente expuesta a los anteriores. Mucho se discutió acerca de la etiología de la malaria por parte de diversos investigadores a lo largo de los siglos XVIII y XIX, a la luz de teorías sobre el origen de la enfermedad tan dispares como el telúrico, vegetal o bacteriano. No fue hasta el año 1880 que el médico militar francés Charles Louis Alphonse Laveran, tras numerosas observaciones, evidenció el origen protozoario de la parasitosis. Sin embargo, debió transcurrir un tiempo hasta que el agente causal pudo ser situado a nivel taxonómico, hecho atribuido a los científicos italianos Ettore Marchiafava y Angelo Celli en 1885, recibiendo el nombre genérico de Plasmodium (Orden Haemosporida, Familia Plasmodiidae). En la actualidad se reconocen cuatro especies parásitas humanas dentro del género Plasmodium:
Plasmodium falciparum (Welch, 1897): es la especie más patógena, causante del 90% de las muertes por malaria y común en áreas tropicales. Requiere una temperatura mínima de 19ºC para poder desarrollarse en el hospedador invertebrado2. En general, todas las especies de plasmodios reducen el tiempo necesario para completar su ciclo en base a incrementos térmicos. Esta afinidad térmica sí es dependiente de las distintas especies, pero todas sucumben a temperaturas sostenidas por encima de 45ºC3. Es el agente causal responsable de las fiebres tercianas malignas.
Plasmodium vivax (Grassi & Feletti 1890): posee el mayor rango de distribución geográfica, ya que puede desarrollarse también en climas templados. Relativamente poco común en África tropical, especialmente en su región más occidental4, debido fundamentalmente a factores inmunológicos de la población humana allí existente5. Actualmente es la única especie presente en los escasos ciclos de transmisión activa en Europa. Junto con P. falciparum, monopoliza el 90% de los casos de plasmodiosis humana diagnosticados anualmente. Por debajo de 15ºC no puede concluir la fase esquizogónica2. Posee una fase quiescente o latente llamada hipnozoíto que se sitúa a nivel hepático humano. Causante de las fiebres tercianas benignas.
Plasmodium ovale (Stephens, 1922): también presenta hipnozoítos. Se localiza en la costa oeste africana, donde parece suplantar a P. vivax. Responsable también de las fiebres tercianas benignas.
Plasmodium malariae (Feletti & Grassi, 1889): especie caracterizada por mostrar baja parasitemia. Presente a nivel tropical del continente africano, tanto en regiones orientales como occidentales. Causante de las fiebres cuartanas.
Respecto al vector, su descubrimiento data de finales del siglo XIX, y debe ser asignado a Ronald Ross (primer investigador que demostró el papel de los mosquitos en la transmisión de la enfermedad en aves) y a Giovanni Batista Grassi (quien confirmó a los mosquitos del género Anopheles (Orden Diptera, Familia Culicidae) como los vectores de la malaria humana). El género Anopheles tiene una distribución prácticamente mundial (figura 1) y alberga alrededor de 70 especies potencialmente transmisoras de la enfermedad. Pueden hallarse poblaciones en un amplio rango de altitudes, desde el nivel del mar hasta los 3.000 metros en condiciones favorables. Su capacidad vectorial no queda restringida únicamente a plasmodios, ya que se conoce bastante bien su papel en la transmisión activa de diversos arbovirus y filarias.
Malaria en España
La lucha antipalúdica fue la primera intervención sanitaria española que se basó en criterios epidemiológicos, es decir, que se planificó en base a los datos de la prevalencia de la enfermedad. Los primeros estudios pormenorizados de la enfermedad en nuestro país datan de principios del siglo pasado. El médico escocés Ian Macdonald, con su trabajo acerca del anofelismo en las minas del Río Tinto en 1900, y los doctores Francisco Huertas y Antonio Mendoza, con un estudio pormenorizado del paludismo y su profilaxis en la provincia de Cáceres en 1901, fueron los pioneros. Un año después, como consecuencia del interés despertado entre los médicos y naturalistas españoles de la época tras la comunicación sobre paludismo del galeno italiano Gustavo Pittaluga en el XIV Congreso Internacional de Medicina celebrado en Madrid, éste se afincó en España y posteriormente fue nombrado jefe del Servicio de Desinfección del Instituto de Higiene Alfonso XIII dirigido por Santiago Ramón y Cajal. Ejemplo evidente del cambio de mentalidad que aportó, eran sus permanentes quejas por la información manejada, ya que él exigía para evaluar la verdadera importancia de la enfermedad datos de morbilidad, y no exclusivamente de mortalidad. Analizó la situación epidemiológica en Valencia, Baleares, Madrid y, con mayor rigor, Cataluña. Precisamente sus estudios en esta última región, debido a su designación como director de los trabajos antipalúdicos de la Mancomunidad de Cataluña en 1915, se postulan vitales para la drástica disminución de sus focos palúdicos hasta prácticamente su desaparición en los años treinta. Posteriormente, en 1920 se le confía la dirección de la Comisión de la Lucha Antipalúdica, ya a nivel estatal, y clasifica las provincias españolas en tres grandes bloques en base a la intensidad del paludismo. Trece años después, Hernández Pacheco con ciertos matices de distribución, corrobora a su colega transalpino y habla de regiones de endemia grave (área extremeña, valle bético y zonas de huerta del sur de Alicante y Murcia), de paludismo intenso (región de los Montes de Toledo y Sierra Morena) y de paludismo leve (litoral mediterráneo y las dos altiplanicies castellanas) (figura 2).
Los principales problemas en la Comunidad Valenciana se situaban en el sur de la provincia de Alicante. A priori esta zona se presenta como extraordinariamente inhóspita para el desarrollo del vector dada la extrema sequedad de su clima. Sin embargo, la existencia de colecciones acuáticas se aseguraba por las condiciones del regadío a inicios del siglo XX8, gracias al aporte hídrico del Río Segura. En concreto, a su paso por la comarca más sureña de la provincia, el Bajo Segura, su concesión de agua permitía a dicha comarca acoger más del 40% de la superficie de regadío de la toda la provincia9, lo que suponía una cifra cercana a las 20.000 hectáreas. Superado el hándicap hídrico y con las condiciones térmicas a favor, el otro factor que declinaba la balanza hacia ciclos intensos de transmisión en esta región tan atípica, era la presencia de una especie de mosquito con una marcada antropofília, Anopheles labranchiae (Falleroni, 1926). Dicha antropofília era patente dado el marcado desequilibrio en la zona entre la elevada endemia de la enfermedad y la baja densidad relativa de anofelinos10.
Las otras provincias valencianas también sufrían episodios de difusión de la enfermedad durante el primer cuarto del siglo XX, si bien éstos eran más puntuales y restringidos. Así, en la provincia de Castellón, la endemia quedaba limitada a mil hectáreas de arrozales y a las vegas del Río Mijares y sus afluentes. En Valencia, las cuencas del Río Palancia (previo a su desembocadura en la ciudad de Sagunto) y del Río Júcar, junto con arrozales próximos a la Albufera, monopolizaban los casos de malaria. Una zona históricamente temida por su posible influencia palúdica era, precisamente, la Albufera. Sin embargo, diversas prospecciones evidenciaron la ausencia de vegetación herbácea en sus márgenes, la presencia de movimientos acuáticos bruscos debido al trasiego de embarcaciones en la zona y una proliferación masiva en ciertas secciones de algas epífitas del género Lemna. Esto se traducía en un hábitat poco favorable para el desarrollo del vector.
Siguiendo el litoral mediterráneo, Almería, Granada y Málaga representaban un cambio drástico. En estas tres provincias el paludismo se relacionaba con fáciles y frecuentes desbordamientos de aguas torrenciales, arroyos o ríos con agua de deshielo, que con las altas temperaturas estivales derivaban en charcos en las llanuras11.
Como consecuencia de la organización de la Lucha Antipalúdica en 1920 y, especialmente, con la creación de la Comisión Central de Paludismo cuatro años después, la endemia se redujo paulatinamente hasta sufrir un severo recrudecimiento como consecuencia de la Guerra Civil. La creación de Dispensarios Antipalúdicos, el estudio cada vez más exhaustivo del vector, y la participación creciente y asesoramiento de entomólogos en materias de saneamiento ambiental, permitieron llegar, a mediados de los años treinta, a la mejor situación epidemiológica del paludismo en la historia reciente del país. Sin embargo, la movilización de tropas militares procedentes de áreas endémicas de la Península o externas (como el Protectorado de Marruecos)12, el debilitamiento socio-económico del país y el sin fin de circunstancias agravantes que toda guerra trae consigo, revertieron el proceso y la malaria volvió a mostrar su poder mortífero e incapacitante durante los siguientes años. En 1943, ante la evidente gravedad sanitaria del país, el gobierno confía la organización y dirección de la Lucha al profesor Clavero Del Campo. El esfuerzo económico de la nación se tradujo en un gran aumento de los Dispensarios y la utilización masiva de insecticidas organoclorados; acciones que consiguieron que España descendiese paulatinamente sus niveles de morbilidad (Figura 3). Pese a ello, los persistentes casos residuales, inclinaron al gobierno del país a firmar un convenio con la Organización Mundial de la Salud (O. M. S.) para potenciar la erradicación definitiva de la enfermedad. Este acuerdo dotó a España de importantes concesiones económicas e instrumentales para emprender el cometido. En 1962 se da por finalizada la última etapa de la campaña, pasando a considerarse el territorio nacional en fase de mantenimiento. Dos años después, tras inspecciones minuciosas por parte de técnicos de la O. M. S., se concede el certificado oficial de erradicación de la enfermedad. No obstante, los paludólogos de la época no dudan en advertir la necesidad de mantener una vigilia permanente; así Clavero indica en 1961 mientras en el mundo exista el paludismo, los países que hayan conseguido la erradicación guardarán una constante vigilancia para descubrir lo antes posible cualquier signo de reaparición de la enfermedad15.
Estatus del vector
En el estudio ecológico y taxonómico de dípteros, en general, y culícidos, en particular, hay un nombre propio en España; Juan Gil Collado. Su gran rigor zoológico y destreza para la identificación específica de los culícidos, le abrieron las puertas de la Comisión Central Antipalúdica en 1925, siendo su primer entomólogo de formación. Llegó a ser considerado el mayor especialista español en mosquitos de la época, y por ello, Pittaluga y, otro protagonista de la lucha antipalúdica, Sadí de Buen, le encargaron estudiar, por primera vez, la riqueza faunística, distribución y biología de los culícidos españoles. Su gran reto fue esclarecer numerosas cuestiones de difícil explicación en referencia a la taxonomía e importancia vectorial de Anopheles maculipennis (Meigen 1818). Su inquietud, y la de muchos otros malariólogos, surge de un suceso concreto: el anofelismo sin paludismo. Las mismas especies y densidades poblacionales similares del vector, no garantizaban de ningún modo patrones similares de transmisión. La diferente latitud geográfica, el nivel socio-económico de la zona y la existencia de animales, fundamentalmente ganado, que desviaban la atención hematofágica de los mosquitos, se postulaban como las razones más plausibles para este hecho. Sin embargo, tuvieron que transcurrir varios años hasta que se desveló que la taxonomía era el auténtico factor subyacente.
De las ocho especies de Anopheles descritas en España en 1930, An. maculipennis era la más importante desde el punto de vista de la enfermedad. No obstante, en algunos lugares era un magnífico transmisor palúdico y en otras su rol vectorial era prácticamente nulo. Por aquel entonces, autores como Roubaud (1928), Van Thiel y Falleroni (1933), comenzaron a seccionarla, hasta el momento indivisible, unidad específica de An. maculipennis, bajo términos tan controvertidos para la época como variedades, razas o biotipos. Sin embargo, la morfología no ofrecía muchas ayudas para su diferenciación. Escasas características morfométricas y cromáticas de adultos, larvas y huevos eran las herramientas utilizadas para discernir entre unidades taxonómicas que demandaban una separación evidente a nivel etológico. Martini, Hacket y Missiroli describieron en 1933 las cinco variedades de An. maculipennis presentes en Europa. De ellas, sólo tres tenían distribución conocida en España. La variedad labranchiae, hallada únicamente en el sur de Alicante y Murcia16, era el transmisor más efectivo de gran parte de la Europa mediterránea, entre otros motivos, por su marcada antropofília y endofília. La variedad atroparvus, era la más distribuida, no sólo en España, sino en toda Europa. A nivel epidemiológico, pese a que era relativamente común y un óptimo transmisor, poseía un carácter preferentemente zoófilo que contrarrestaba, en parte, a los dos anteriores. Sin embargo, en condiciones de elevada densidad poblacional y alrededores con asentamientos humanos, su hospedador podía ser el hombre. De hecho se pensaba que la coincidencia de sus primeras generaciones postinvernales, junto con las recidivas tardías de P. vivax, eran las principales causas del sostenimiento de la endemia palúdica en nuestro país17. Pese a que durante muchos años fue imposible hallar una coexistencia entre estas dos variedades (labranchiae x atroparvus), apoyando así la Teoría de los círculos biogeotípicos de Diemer y Van Thiel (1936) que excluía la posibilidad de su coincidencia en un lugar concreto18, finalmente se consiguió demostrar su cohabitación19. Por último, la variedad maculipennis también presentaba preferencias tróficas hacia animales y su distribución era más frecuente en regiones elevadas que en las costas. Por tanto, su contacto con el hombre y, por ende, su relación con el paludismo, era menor.
Consecuentemente todos los especialistas coincidían que el conocimiento de las especies anofelinas, unas efectivos vectores, otras accidentales y otras sin papel en la transmisión, es fundamental para una activa organización sanitaria20.
En la actualidad la taxonomía nos remite al complejo maculipennis. Se trata de un grupo de especies íntimamente emparentadas y difíciles de distinguir mediante criterios morfológicos, de las que cinco presentan distribución neártica y nueve paleártica (ocho de ellas presentes en Europa y cinco en España)21. De las ocho especies europeas, tres son las de mayor importancia palúdica en la mitad meridional, Anopheles atroparvus (Van Thiel, 1927), abundante en gran parte del continente, An. labranchiae y An. sacharovi (Favre, 1903), de distribución mediterránea occidental y oriental respectivamente. Estas dos últimas especies no son nativas de Europa, y a partir de sus datos actuales de distribución, se postula su origen norteafricano (An. labranchiae) y asiático (An. sacharovi)22 (figura 4).
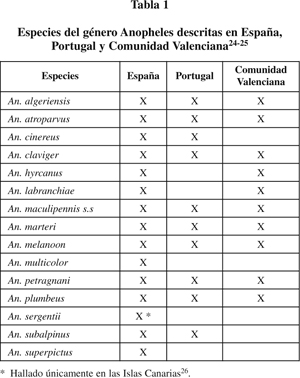
Respecto a las cinco especies del complejo maculipennis descritas en España, únicamente dos pueden adquirir un papel destacado en la difusión de la enfermedad: An. atroparvus y An. labranchiae. No obstante, la ausencia de datos presenciales de An. labranchiae en nuestro país desde hace más de medio siglo, inclina a la comunidad científica a valorar su posible desaparición en nuestro territorio23. Las otras tres especies, An. maculipennis s.s., An. melanoon (Hackett, 1934) y An. subalpinus (Haeckett & Lewis, 1935) presentan un rol palúdico secundario, pudiendo ser vectores únicamente bajo condiciones muy concretas y en áreas muy delimitadas.
Fuera del complejo maculipennis, siguen existiendo especies potencialmente vectores de la malaria. Algunas como An. claviger (Meigen, 1804) y An. superpictus (Grassi, 1989) son incluso vectores primarios en ciertos países asiáticos, pese a que en Europa su papel es secundario. Otras como An. hyrcanus (Pallas, 1771) y An. plumbeus (Stephens, 1828), adquieren una participación más esporádica. (Tabla 1).
Material y métodos
Durante los años 2005, 2006 y 2007, se muestrearon diversas colecciones hídricas a lo largo y ancho de toda la Comunidad Valenciana, con el objetivo de establecer la riqueza específica y densidad larval anofelina. La técnica empleada para la recolección de estados inmaduros de anofelinos fue la conocida como dipping, cuya utilización para dicho fin es ampliamente contrastada27. El método consiste en la introducción de un recipiente denominado dipper, con capacidad de albergar hasta 350 ml del líquido del cual se desee obtener una alícuota. Entre las virtudes de este método, además de múltiples ventajas desde un punto de vista eminentemente técnico del muestreo, está la de permitir la obtención de datos de densidad relativa en términos perfectamente estandarizados y reproducibles28.
Las larvas de Anopheles capturadas se introdujeron en cámaras de cría a una temperatura de 25ºC y humedad relativa del 65%, hasta su maduración hasta el 4º estado larvario, momento en el cual su determinación taxonómica es más sencilla de llevar a cabo. La identificación específica se realizó en base a los criterios taxonómicos de Encinas Grandes (1982)29, Darsie (1997)30 y Schaffner (2001)21.
Resultados: situación actual y perspectivas de futuro
El potencial malariogénico de un área viene determinado por tres factores: receptibilidad, infectibilidad y vulnerabilidad31.
La receptibilidad se estudia a partir de la presencia, densidad y características biológicas de los vectores. Los continuos muestreos han permitido la identificación de cinco especies hasta el momento (figura 5):
An. atroparvus: además de ser el vector palúdico mejor establecido en el continente europeo, también puede inocular arbovirus como el Virus del Oeste del Nilo (VON), el Virus Tahyna o el Virus Batai. Incluso puede verse envuelto en ciclos de transmisión de enfermedades de tipo bacteriano, como Tularemia, o nematodial, como la filariasis canina. Muestra estenogamia y, bajo condiciones favorables, pueden hallarse hembras activas durante los meses invernales.
An. claviger: transmisor de la malaria fundamentalmente en regiones orientales del Mediterráneo32, así como de otros patógenos bacterianos como Borrelia (Enfermedad de Lyme) o Francisella (Tularemia). También se ha demostrado su participación en la mixomatosis33. Presenta eurigamia y autogenia, así como un marcado carácter exófilo y exófago. Hiberna en estado larvario.
An. maculipennis s.s.: papel secundario en la difusión del paludismo. Las hembras sufren diapausa invernal, son preferentemente zoófilas y presentan eurigamia. Portador habitual de numerosos arbovirus de importancia médica y veterinaria.
An. marteri (Senevet & Prunelle, 1927): circunscrito a países mediterráneos ; por sus hábitos exofílicos y zoofílicos no parece revestir importancia en las transmisiones parasitarias al hombre.
An. petragnani (Del Vecchio, 1939): especie de complicada distinción morfológica con An. claviger. De hecho, ambos se incluyen en el complejo claviger34. Presenta estenogamia, autogenia, hibernación larvaria y las hembras exhiben una clara tendencia zoofílica.
La ausencia de datos referidos a uno de los principales vectores, An. labranchiae, no sólo en nuestros muestreos sino también en los de otros investigadores35, puede explicarse debido a la radical disminución de los cultivos de regadío en su escueta área de distribución en nuestro país. La mayoría de larvas de culícidos anofelinos fueron recolectadas en regiones del interior de la Comunidad, siendo márgenes de río remansados y balsas de riego sus principales hábitats. Las áreas de densidad más elevada corresponden a los tramos medios y altos de los ríos Palancia y Mijares, y a las comarcas del norte de la provincia de Alicante.
La infectividad hace referencia a la posibilidad de que se produzca la esporogonia del plasmodio en el interior del mosquito. En este sentido, la genética es claramente influyente, hasta el punto que poblaciones anofelinas de la misma especie, pueden presentar una sensibilidad radicalmente distinta frente a plasmodios de la misma especie pero de diferentes áreas geográficas36. El único vector hallado en nuestra área de estudio con capacidad de sostener el peso de posibles ciclos de transmisión es An. atroparvus. Se ha demostrado que poblaciones europeas de esta especie son capaces de transmitir cepas asiáticas de P. vivax37; pero son refractarias a cepas africanas de P. falciparum38. Sin embargo, algunos estudios han identificado la capacidad de An. atroparvus de generar ooquistes de P. faliciparum39, sin que haya podido ponerse en evidencia que es capaz de completar la esporogonia.
La vulnerabilidad de un lugar se determina por la cantidad de gametocitos de Plasmodium sp. circulantes a la espera de proseguir el ciclo en el hospedador invertebrado, es decir, se basa en la población humana portadora. En este caso el nivel y organización de la Sanidad del país se presentan como dos factores determinantes, ya que la declaración obligatoria de la enfermedad, el aislamiento de los pacientes frente al vector y el tratamiento antiparasitario, pueden disminuir considerablemente la vulnerabilidad palúdica de la nación. El último caso de paludismo autóctono en nuestro país data de mayo de 196140. Desde entonces, los cientos de casos diagnosticados anualmente, proceden, en su mayoría, de inmigrantes o turistas que han viajado a zonas endémicas41; sin olvidar los casos confirmados debidos a transfusiones sanguíneas42, trasiego de jeringuillas entre pacientes drogadictos43 e incluso ciertos episodios de malaria de aeropuerto44. (Tabla 2).
Consideraciones finales
Pese a que diversos autores sitúan el potencial malariogénico de España en niveles muy bajos46, y el nivel socio-económico actual del país así lo corrobora, debemos mantener cierta vigilia al respecto. Si bien el principal vector actual, An. atroparvus, solo podría iniciar a priori ciclos de transmisión que implicaran a las formas benignas (P. vivax y P. ovale), no debemos olvidar que el continuo contacto con cepas exóticas hospedadas en personas procedentes de países con alto riesgo, fundamentalmente inmigrantes y también turistas, puede culminar en la selección y/o adaptación de cepas de P. falciparum capaces de desarrollarse en él o en otros anofelinos. Además, la globalización actual no debe permitirnos obviar un hecho evidente, ya que la proximidad y constante trasiego de personas y materiales con el continente africano, posibilita en gran medida la llegada de potenciales vectores palúdicos a nuestro territorio47. También es cierto que, pese a que la llegada es bastante factible, la colonización o establecimiento puede tener importantes barreras climáticas. Sin embargo, un tema de gran actualidad, el cambio climático, puede crear escenarios favorables para el desarrollo del vector y afectar así a la transmisión y distribución geográfica de la enfermedad48.
Por tanto, podemos recurrir a un término muy utilizado por los paludólogos de la primera mitad del siglo pasado, para definir el estado epidemiológico actual de la enfermedad desde el punto de vista de la transmisión: el anofelismo sin malaria. Este anofelismo debe seguir siendo analizado e investigado, tanto a nivel bioecológico y biogeográfico, como faunístico y parasitológico, con el fin de profundizar en el conocimiento del status del vector y poder crear modelos predictivos de transmisión que dividan el territorio en diferentes áreas en base a su riesgo epidemiológico. Extremar las medidas preventivas fronterizas, concienciar a la población de su papel en la lucha vectorial y continuar con el esfuerzo realizado por la Red Nacional de Vigilancia Epidemiológica, son los otros frentes en los que trabajar para minimizar las probabilidades de reemergencia de la enfermedad.
Bibliografía
1. World Health Organisation. Malaria. Fact sheet Nº 94. May 2007. Disponible en: http://www.who.int/ mediacentre/factsheets/fs094/en/print.html [ Links ]
2. MacDonald G. The epidemiology and control of malaria. London: Oxford University Press; 1957. [ Links ]
3. Garnham PCC. Malaria parasites of man: life-cycles and morphology (excluding ultrastructure). En: Wernsdorfer, W.H. and McGregor, I. Malaria: principles and practice of malariology. Vol. 1. Edinburgh: Churchill Livingstone; 1988 61-96. [ Links ]
4. Mendis K, Sina BJ, Marchesini P, Carter R. The neglected burden of Plasmodium vivax malaria. Am J Trop Med Hyg. 2001; 64: 97-106. [ Links ]
5. Modiano D, Chiucchiuini A, Petrarca V, Sirima BS, Luoni G, Roggero MA., Corradin G, Coluzzi M, Esposito F. Interethnic differences in the humoral response to non-repetitive regions of the Plasmodium falciparum circumsporozoite protein. Am J Trop Med Hyg 1999; 61: 663–667. [ Links ]
6. Kiszewski A, Mellinger A, Spielman A, Malaney P, Sachs SE, Sachs J. Global Index. Representing the Stability of Malaria Transmisión. Am J Trop Med Hyg 2004; 70: 486-498. [ Links ]
7. Hernández Pacheco D, Hernández Pacheco F. Consideraciones acerca del paludismo en España. Rev de Inf Terapéutica 1934. FALTA NÚM DE VOLUMEN 1-16. [ Links ]
8. Canales Martínez G. (ed.), El Bajo Segura. Estructura espacial, demográfica y económica. Alicante: Fundación Cultural CAM, Universidad de Alicante; 1995. [ Links ]
9. Figueras Pacheco F. Provincia de Alicante. En: Geografía General del Reino de Valencia, Carreras y Candi, F. (ed.), Barcelona, Antonio Martín, 1918. [ Links ]
10. Clavero G, Romeo Viamonte JM. El paludismo en las huertas de Murcia y Orihuela. Ensayos de aplicación de los insecticidas modernos D. D. T. y 666, en lucha antipalúdica. Rev San Hig Publ 1948; 22: 199-228. [ Links ]
11. Fernández Astasio B. La erradicación del paludismo en España : aspectos biológicos de la lucha antipalúdica [tesis doctoral]. Universidad Complutense de Madrid; 2004. [ Links ]
12. Garcia Orcoyen J. Aspectos de la sanidad española en el año 1969. Rev San Hig Publ 1970; 74: 3-5. [ Links ]
13. Fernández Maruto JJ. Trascendencia sanitaria y económico-social de la erradicación del paludismo en España. Rev San Hig Publ 1964; 38: 89-117. [ Links ]
14. Rico Avelló C. La epidemia de paludismo de la postguerra. Rev San Hig Publ 1950; 24: 701-737. [ Links ]
15. Clavero G. La erradicación del paludismo en España. Rev San Hig Publ 1961; 35: 265-292. [ Links ]
16. Clavero G, Romeo Viamonte JM. Hallazgo del Anopheles (Myzomyia) multicolor Camboliu en España. Rev San Hig Publ 1946; 20: 1001-1011. [ Links ]
17. Lozano Morales A. El estado hibernante del Anopheles maculipennis atroparvus y su relación con la pausa estacional del paludismo en España. Rev San Hig Publ 1953; 27: 301-325. [ Links ]
18. Gil Collado J. Sobre los biotipos (razas) españoles del Anopheles maculipennis. Rev San Hig Publ 1946; 26: 26-32. [ Links ]
19. Clavero G, Olavaria J. Nota sobre el hallazgo de Anopheles algeriensis Theobald 1903 en Escombreras (Murcia). Coexistencia de las variedades Atroparvus y Labranchiae en dicha localidad. Rev San Hig Publ 1944; 625-628. [ Links ]
20. Lucha antipalúdica [Editorial] Rev San Hig Publ 1950; 24: 211-212. [ Links ]
21. Schaffner F, Angel G, Geoffroy B, Hervy JO, Rhaiem A. The mosquitoes of Europe / Les moustiques d Europe [programa de ordenador]. Montpellier, France: IRD Éditions and EID Méditerranée; 2001. [ Links ]
22. Sallares R. Role of environmental changes in spread of malaria in Europe during the Holocene. Quaternary Internacional. 2006; 150: 21-27. [ Links ]
23. Eritja R, Aranda C, Padros J, Goula M. Revised checklist of the Spanish mosquitoes. Acta Virologica Portuguesa. 1998; 5: 25. [ Links ]
24. Eritja R, Aranda C , Báez C. Culicidae. En: Carles Tolrá, M. Catálogo de los Diptera de España, Portugal y Andorra. Sociedad Entomológica Aragonesa, Zaragoza; 2002.p. 45-47. [ Links ]
25. Banco de datos de Biodiversidad. Conselleria de Medi Ambient, Aigua, Urbanisme i Habitatge, Generalitat Valenciana. Disponibe en: http://bdb.cth.gva.es/ [ Links ]
26. Romeo Viamonte JM. Los anofelinos de la Isla de Gran Canaria. Rev San Hig Publ 1946; 20: 449-455. [ Links ]
27. Service MW. Mosquito Ecology. Field Sampling Methods. 2nd edition, Elsevier Science Publishers Ltd.England; 1993. [ Links ]
28. Ruiz S, Cáceres F. Bases técnicas para el control de mosquitos culícidos en los arrozales de la Comarca de La Janda, Cádiz (SW España). Bol San Veg Plagas 2004; 30: 753-762. [ Links ]
29. Encinas Grandes A. 1982. Taxonomía y biología de los mosquitos del área salmantina (Diptera, Culicidae) [tesis doctoral]. CSIC. Centro de edafología y Biología aplicada. Ed. Universidad de Salamanca. [ Links ]
30. Darsie Jr RF, Samanidou Voyadjoglou, A. Keys for the identification of the mosquitoes of Greece. J Am Mosq Control Assoc 1997; 13 (3): 247-54. [ Links ]
31. Romi R, Sabatinelli G, Majori G. Could malaria reappear in Italy? Emerging Infection Diseases. 2001; 7 (6): 915-919. [ Links ]
32. Russell PF, West LS, Manwell RD, MacDonald G. Practical Malariology. 2nd edition, Oxford University Press, London; 1963. [ Links ]
33. Service MW. A reappraisal of the role of mosquitoes in the transmission of myxomatosis in Britain. Journal of Hygiene 1971; 69: 105-111. [ Links ]
34. Kampen H, Sternberg A, Proft J, Bastian S, Schaffner F, Maier WA., Seitz HM. Polymerase chain reaction–based differentiation of the mosquito sibling species Anopheles claviger s.s. and Anopheles petragnani (Diptera: Culicidae). Am J Trop Med Hyg 2003; 69: 195-199. [ Links ]
35. Blázquez J, Zulueta J. The disappearance of Anopheles labranchiae from Spain. Parassitologia. 1980; 22: 161-163. [ Links ]
36. Frizzi G, Rinaldi A, Bianchi L. Genetic studies on mechanisms influencing the susceptibility of Anopheline mosquitoes to plasmodial infections. Mosquito News. 1975; 35: 505-508. [ Links ]
37. Daskova NG., Rasnicyn SP. Review of data on susceptibility of mosquitos in the USSR to imported strains of malaria parasites. Bull World Health Organ. 1982; 60: 893-7. [ Links ]
38. Ramsdale CD, Coluzzi M. Studies on the infectivity of tropical African strains of Plasmodium falciparum to some southern European vectors of malaria. Parassitologia. 1975; 17: 39-48. [ Links ]
39. Marchant P, Rling W, Van Gemert GJ, Leake CJ, Curtis CF. Could british mosquitoes transmit falciparum malaria? Parassitology Today. 1998; 14: 344-345. [ Links ]
40. Lopez Velez R, Viana A, Pérez Casas C, Martín Aresti J, Turrientes MC., García Camacho A. Clinicoepidemiological Study of Imported Malaria in Travellers and Immigrants to Madrid. J Travel Med. 1999; 6: 81-86. [ Links ]
41. Gascón Brustenga J. Paludismo importado por inmigrantes. An. Sist. Sanit. Navar. 2006; 29: 121-125. [ Links ]
42. Tejero J, Sánchez JA. A propósito de un caso de paludismo por inoculación transfusional Rev Clin Esp 1971; 123: 389-390. [ Links ]
43. González García JJ, et al. An outbreak of Plasmodium vivax malaria among heroin users in Spain. Trans R Soc Trop Med Hyg. 1986;80 (4): 549-52. [ Links ]
44. Blázquez J. Paludismo de aeropuerto en España. Med Clin 1986; 87: 41. [ Links ]
45. Sistema de Notificación Obligatoria, Área de Epidemiología, Direcció General de Salut Pública, Conselleria de Sanitat. Disponible en: http://www.sp.san.gva.es/DgspPortal/docs/epidemiologia/PALUDISM.htm [ Links ]
46. López Vélez R, Molina Moreno R. Cambio climático en España y riesgo de enfermedades infecciosas y parasitarias transmitidas por artrópodos y roedores. Rev Esp Salud Publica 2005; 79: 177-190. [ Links ]
47. López Vélez R, García Camacho A. Malaria, África y viajes: un triángulo de riesgo. Rev Clin Esp. 1998; 198: 494-5. [ Links ]
48. Martens P, Kovats RS, Nijhof S, de Vries P, Livermore, MTJ., Bradley DJ, Cox J, McMichael, AJ. Climate change and future populations at risk of malaria. Global Environmental Change. 1999; 9: 89-107. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Rubén Bueno Marí
Laboratorio de Entomología y Control de Plagas
Instituto Cavanilles de Biodiversidad y Biología Evolutiva
Universidad de Valencia
C/ Polígono La Coma, s/n
46980 Paterna (Valencia)
Correco electrónico: ruben.bueno@uv.es