INTRODUCCION
Las hormonas tiroideas son fundamentales para un desarrollo cerebral normal, siendo el hipotiroidismo congénito (HC) la causa más frecuente de retraso mental que se puede prevenir. El daño cerebral depende directamente del tiempo transcurrido desde el comienzo del hipotiroidismo y el del tratamiento, por lo que aquellos recién nacidos que se detectan e inician tratamiento en los primeros días de vida llegan a alcanzar un cociente intelectual normal o casi normal reduciendo la morbilidad, la mortalidad y las posibles discapacidades asociadas a dicha enfermedad. La detección precoz del HC es de interés principal en Salud Pública y Medicina Preventiva y es por ello que está incluida en los programas de cribado neonatal (PCN). Los primeros programas se iniciaron en 1970 y a lo largo de estas décadas han demostrado su eficacia en la historia natural de la enfermedad contribuyendo en gran medida a la mejora en el diagnóstico. Siguiendo los criterios de la OMS, el objetivo principal de los PCN sería la detección del HC primario, pero actualmente algunas de las estrategias utilizadas van dirigidas no sólo a la detección del primario sino también al HC central y a otras formas moderadas o transitorias secundarias que se pueden beneficiar de un diagnóstico y tratamiento precoz. La contribución de muchos y diferentes estudios publicados en la literatura han puesto de manifiesto la relevancia de los programas de detección del HC en la comunidad, la situación actual tanto a nivel nacional como mundial y que líneas de futuro se deben abordar para la mejora y optimización de la eficiencia.
MATERIAL Y MÉTODOS
Este artículo de revisión se ha realizado mediante una búsqueda bibliográfica desde el inicio de los PCN hasta la actualidad basándose en la selección de estudios y revisiones de la enfermedad y de estudios publicados de diferentes programas de cribado para la detección del HC con resultados relevantes para la comunidad científica. Como fuentes de información se han utilizado:
- Bases de datos bibliográficas: Pubmed, SciELO-España.
- Guías y/o protocolos de sociedades científicas: Sociedad Española de Endocrinología Pediátrica, Sociedad Europea de Endocrinología Pediátrica, Academia Americana de Pediatría.
- Documentos de agencias tecnológicas evaluadoras: Agencia de Evaluación de Tecnologías Sanitarias de Galicia.
- Documentos de organismos oficiales: Organización Mundial de la Salud (OMS), Ministerio de Sanidad, Consumo y Bienestar Social de España.
RESULTADOS Y DISCUSION
En los diferentes estudios y referencias bibliográficas consultadas se ha podido constatar en función de los casos detectados, valor predictivo positivo y prevalencias que la detección precoz del HC ha resultado de una gran eficiencia para el diagnóstico de la enfermedad. A continuación, se exponen las características de la enfermedad, diagnóstico y tratamiento así como la relevancia que tienen los programas de detección del HC, la situación actual tanto a nivel nacional como mundial y desafíos y perspectivas de futuro para la mejora y optimización de la eficiencia asociada a otras formas moderadas del HC.
1. Hipotirodismo congénito
Definición y clasificación. Se define el hipotiroidismo como la situación resultante de una disminución de la actividad biológica de las hormonas tiroideas a nivel tisular, que puede ser por una producción deficiente o por resistencia a su acción en los tejidos diana, alteración de su transporte o de su metabolismo. El hipotiroidismo puede ser congénito o adquirido(1).
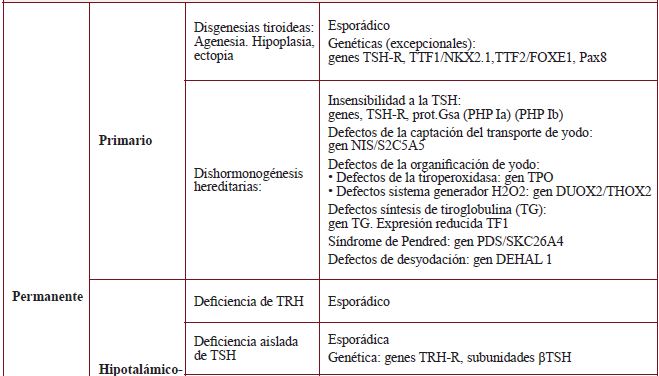
Dependiendo de la localización del agente causal, el HC se clasifica en tres grandes grupos(2):
- Primario o tiroideo: la causa está en la propia glándula tiroidea.
- Hipotálamo-hipofisario o central: el trastorno está localizado en la hipófisis produciéndose un déficit de la hormona estimuladora del tiroides (TSH) (hipotiroidismo secundario) o en el hipotálamo generándose en este caso una disminución de la producción de hormona liberadora de tirotropina (TRH) (hipotiroidismo terciario).
- Periférico: se debe a una resistencia generalizada de los tejidos diana a las hormonas tiroideas.
El HC es la enfermedad endocrinológica más frecuente en pediatría y, a su vez, es la primera causa de retraso mental prevenible, ya que las hormonas tiroideas son esenciales para el desarrollo cerebral, actuando tanto en el periodo prenatal como postnatal. Este hecho, junto con el bajo porcentaje de niños que presentan sintomatología clínica en el periodo neonatal, obliga a su detección sistemática mediante cribado neonatal para poder instaurar el tratamiento lo más pronto posible y evitar así el retraso mental.
Desde el punto de vista evolutivo el HC puede ser permanente o transitorio (tabla 1).
Presentación clínica. Las hormonas tiroideas (T3, T4 y T4 libre) intervienen de forma crítica en el desarrollo del sistema nervioso central, su defecto va a provocar alteraciones en la mielinización, migración y diferenciación neuronal que van a provocar retraso mental y en algunos casos alteraciones neurológicas irreversibles. El tratamiento del HC consiste en reemplazar la deficiencia de hormonas tiroideas (tratamiento hormonal sustitutivo).
El HC primario tiene poca expresividad clínica en el periodo neonatal, puede sospecharse por la presencia de algunos signos y síntomas clínicos como: dificultades respiratorias, cianosis, ictericia persistente, hernia umbilical, letargia, somnolencia, desinterés por la alimentación, llanto ronco, estreñimiento o presencia de una gran fontanela anterior o posterior abierta. En en función de estos y algunos otros signos clínicos más se calcula el índice numérico de Letarte(3) que es poco discriminativo y la mayor parte de los niños hipotiroideos tienen un índice normal. El diagnóstico, basado en datos clínicos, solía producirse después del segundo o tercer mes vida, por lo que a pesar del tratamiento las secuelas eran permanentes.
En el lactante y en la edad escolar, si no ha sido diagnosticado y tratado, aparece un cuadro clínico que consiste en retraso del crecimiento y del desarrollo físico y mental, y alteraciones funcionales. Se manifiesta por talla baja, que se va acentuando, con extremidades cortas, persistiendo las proporciones infantiles, y retraso de la maduración ósea y retraso de la dentición. El retraso intelectual es de intensidad variable, desde déficits cognitivos profundos a trastornos leves del aprendizaje(4).
La exploración por órganos y sistemas puede mostrar signos que son consecuencia de las alteraciones funcionales propias del déficit de hormonas tiroideas, como bradicardia, dificultad respiratoria y estreñimiento. El bocio es un signo característico que puede estar presente en algunas dishormonogénesis y en algunos hipotiroidismos transitorios.
Tratamiento. En el HC neonatal, el daño cerebral depende directamente del tiempo transcurrido desde el comienzo del hipotiroidismo y el inicio del tratamiento, este no debe retrasarse por la realización de las pruebas complementarias de localización diagnóstica de la glándula. El tratamiento debe iniciarse lo antes posible, antes de los quince días de edad es la recomendación del Ministerio de Sanidad en los objetivos de calidad(5).
El fármaco de elección es la hormona sintética levotiroxina (LT4) por vía oral, administrada 30 minutos antes de una toma, cada 24 horas, a dosis de 10-15 μg/kg/día. Las fórmulas magistrales líquidas de LT4 no son estables y las presentaciones en gotas son difíciles de dosificar. La absorción puede reducirse en diversas circunstancias: consumo de algunos alimentos (fórmulas infantiles que contienen soja o semilla de algodón, nueces), procesos digestivos en los cuales se reduce la superficie de absorción (intestino corto, cirrosis hepática), fármacos concomitantes (carbón activado, hidróxido de aluminio, colesteramina, sulfato y gluconato ferroso, propranolol). Otros fármacos como el fenobarbital, la fenitoína, la carbamazepina y la rifampicina aumentan el catabolismo de la tiroxina.
Después de comenzar el tratamiento con LT4 se deben realizar controles clínicos y analíticos frecuentes para su optimización terapéutica. El objetivo del tratamiento es normalizar rápidamente los niveles de T4 libre y TSH. La T4 libre debe permanecer en límites altos de normalidad, evitando tanto hipo como hipertiroidismo subclínico. Las metas bioquímicas del tratamiento con LT4 son: normalizar la concentración de TSH y T4 libre lo antes posible (15 días) y mantener la T4 libre en la mitad superior de los rangos de referencia.
Los tres elementos fundamentales en el tratamiento del HC son: iniciar el tratamiento precozmente, administrar una dosis inicial adecuada en el recién nacido y conseguir un correcto equilibrio terapéutico mediante un riguroso control evolutivo.
El control evolutivo tiene por objeto conseguir un equilibrio terapéutico. Se basa en el control clínico y en la monitorización analítica o control bioquímico. En el control clínico, en cada visita, se buscan signos y síntomas sutiles sugerentes de infradosificación o supradosificación e incluye la somatometría en cada visita y la evaluación de la edad ósea anualmente, ya que la velocidad de crecimiento ha de ser normal y las dosis administradas de LT4 han de proporcionar una progresión adecuada de la edad ósea, evitando retrasos y aceleraciones inadecuadas que puedan repercutir negativamente en la talla final.
El tratamiento debe mantenerse sin interrupción durante los tres primeros años de vida, para asegurar la normofunción tiroidea hasta completar el desarrollo cerebral. A esta edad se puede realizarse la evaluación diagnóstica si no se ha realizado previamente. Los niños con diagnóstico de agenesia tiroidea o tiroides ectópico no necesitan revaluación. Se debe plantear revaluación en HC de tiroides eutópicos en el diagnóstico inicial y aquellos HC de etiología no filiada(1).
2. Cribado neonatal de HC
Justificación del Cribado Neonatal. El cribado neonatal para el HC es totalmente recomendable, con un grado de recomendación A y nivel de evidencia I(6). De acuerdo a los criterios de la OMS sobre el cribado de enfermedades en el periodo neonatal, la prioridad del cribado del HC es detectar el hipotiroidismo primario e iniciar el tratamiento sustitutivo con hormonas tiroideas lo antes posible(7). Su detección precoz es de interés primordial en Salud Pública y Medicina Preventiva y por ello está incluido en los programas de cribado neonatal (PCN).
El objetivo del programa no es solo el HC severo y permanente (objetivo principal), sino también el HC en sus formas moderadas permanentes o transitorias (objetivos secundarios) ya que éstas también se benefician de un diagnóstico y tratamiento precoz.
Los laboratorios de cribado para la detección del HC aseguran la fiabilidad de los resultados mediante la participación en programas de control de calidad externos de ámbito nacional e internacional para cumplir los requisitos de procesado de las muestras, entrenamiento de personal y auditoria de actividad y se someten a evaluaciones de dicha calidad de forma regular. Además disponen de indicadores que permiten monitorizar con cierta periodicidad la calidad del programa a través de datos cuantificables que pueden utilizarse como guía para conocer y analizar su evolución a lo largo del tiempo: calidad de la muestra, doble cribado por resultado dudoso, doble cribado en recién nacidos (RN) prematuros y/o con muy bajo peso, falsos positivos, tiempo de vida a la detección, entre otros.
Las pruebas de cribado neonatal para el HC no son diagnósticas y los pacientes que presenten un resultado positivo requerirán procedimientos diagnósticos posteriores que confirmen o excluyan la enfermedad. Para ello, existen Unidades Clínicas de Diagnóstico constituidas por un equipo multidisciplinar en el que intervienen los especialistas necesarios para el diagnostico, tratamiento y seguimiento adecuados, rápidos e integrales de la enfermedad, así como para la comunicación a las familias donde se pretende que los padres comprendan el beneficio que supone el diagnóstico precoz, aprendan a administrar correctamente la medicación, mantengan una buena adherencia al tratamiento y realicen un adecuado seguimiento el tiempo que dure la enfermedad.
El PCN para el HC garantiza la equidad y universalidad, por lo que la toma de muestras se planifica de forma que alcance una cobertura del 100% de los RN y el tratamiento precoz del 100% de los casos detectados. Además existen Registros Nacionales de los pacientes afectados por esta enfermedad para que, junto con el avance científico, se optimice el diagnóstico y tratamiento integral(8).
Prevalencia del HC. La prevalencia de la enfermedad ha aumentado en los últimos años en todo el mundo. Al inicio de los PCN para el HC hace unos cuarenta años ésta se encontraba entre 1:3.000-4000, sin embargo, en la actualidad se sitúa entre 1:1.400-1:2.800. Se postulan algunos factores que pueden contribuir a este incremento: el mayor riesgo de padecer HC en el RN prematuro, los cuales han aumentado debido a los avances en la neonatología, otra causa puede ser el ajuste de los puntos de corte que favorecen la detección de formas moderadas de esta patología, siendo más acusado el incremento de HC con la glándula tiroidea eutópica, no pudiendo distinguir si la causa es permanente o transitorio en el momento del diagnóstico(9).
El Programa de detección precoz del HC se puso en marcha en España en el año 1978 generalizándose su implantación en la totalidad de las CCAA entre dicho año y 1982. El porcentaje de cobertura fue aumentando progresivamente, alcanzando, según los datos disponibles, el 96,7% en el año 1989 y en la actualidad es prácticamente del 100%. En nuestro país la detección precoz de HC, se lleva a cabo en los 15 centros de cribado mediante la medición de la TSH o TSH+T4 total, de forma generalizada se utiliza para su determinación la inmunofluorescencia a tiempo resuelto.
La tasa de detección es España es variable según de la CCAA de que se trate, va desde 1:887 en la Comunidad Foral de Navarra a 1:3.859 en Extremadura(10).
Estrategias de cribado. Existen varias estrategias para el cribado neonatal del HC dependiendo de qué determinación se realice en primer lugar: TSH, T4 total, o TSH+T4 siendo esta estrategia combinada la ideal según la AAP (Academia Americana de Pediatría, www.aap.org)(11).
El método de determinación primaria de TSH es el que se considera más sensible para la detección del HC primario según la ESPE (Sociedad Europea de Endocrinología Pediátrica, www.eurospe.org) ya que el test de TSH es lo suficientemente sensible para distinguir entre niños normales y niños hipotiroideos. Con esta estrategia la necesidad de repetir la prueba es baja pues la tasa de segundos avisos para nueva muestra es aproximadamente del 0,05%, por lo que por cada caso detectado serán avisados 2 niños por segunda vez. La sensibilidad de los métodos de TSH para el HC primario es del 97,5% y la especificidad del 99%(12).
Estrategia de determinación primaria de TSH. La determinación primaria de TSH es el test más sensible para la detección del HC. Con esta estrategia se detectan la mayor parte de los casos de HC primario, sin embargo, se pueden infradiagnosticar otras anomalías como el HC central (secundario o terciario), la hipotiroxinemia, la deficiencia de tiroglobulina (TBG) y la elevación tardía de TSH que se presenta en los niños prematuros(13).
Los puntos de corte para la TSH en los distintos programas de cribado del HC alrededor del mundo varían de 5 a 20 µUI/mL, valores informados que corresponden a unidades en sangre. La definición de estos valores está basada en el análisis conjunto de variables como el protocolo de cribado (TSH, T4 o ambas), el tipo de muestra recogida (sangre de cordón, sangre de talón), la edad de recogida de la muestra (<48 o ≥48 horas de vida), así como también las características regionales (p.ej. déficit de yodo)(14).
Las técnicas de laboratorio actuales, entre las cuales se incluyen el inmunoensayo enzimático (ELISA), la quimioluminiscencia y el fluoroinmunoensayo, han mejorado notablemente su sensibilidad en los últimos años y han adquirido el potencial para una mejor diferenciación entre los valores normales y anormales de TSH. Como consecuencia directa de este avance en los métodos analíticos, se ha recomendado situar en valores más bajos el límite superior del rango de normalidad de la TSH, de tal forma que con la aplicación de esta medida, se ha reportado un incremento en la incidencia del HC. Se ha demostrado que reduciendo los puntos de corte de 20 µUI/mL a 10 µUI/mL se incrementa significativamente la detección de casos de HC primario leve. Además, la mayoría de estos casos corresponden a HC permanente, hecho que indica que un valor de entre 10-20 µUI/mL en el cribado no es necesariamente predictor de un HC transitorio. El estudio etiológico de estos casos de HC leve demuestra que en su amplia mayoría (alrededor del 70-80%) corresponden a defectos funcionales(15,16).
En España, excepto en 3 CCAA (Pais Vasco, Cantabria y Navarra), la detección precoz del HC primario se lleva a cabo por medición de TSH normalmente a las 48 horas de vida, para evitar el aumento fisiológico inicial de esta hormona. La obtención de muestra de sangre capilar se realiza sobre papel absorbente por punción del talón del RN y la TSH se analiza por inmunofluorescencia a tiempo retardado (DELFIA® o AUTODELFIA®). El punto de corte, por encima del cual existe sospecha de padecer la enfermedad, está establecido por el laboratorio dependiendo del PCN de cada CCAA.
Un resultado de cribado positivo para HC primario se ha de remitir a la Unidad Clínica de Diagnóstico para su confirmación(17) tabla 2.
Estrategia de determinación primaria de T4. Este método consiste en analizar los niveles de T4 como determinación primaria.
Determinación primaria de T4 con ampliación posterior de TSH. Es la estrategia más utilizada fuera del continente europeo, y consiste en la determinación inicial de los niveles de T4 total con medición adicional de niveles de TSH, en aquellos pacientes en que los niveles de T4 total detectada se hayan encontrado por debajo del límite inferior determinado por el laboratorio correspondiente. Con este método, además de detectar hipotiroidismo primario, teóricamente serian también detectables los casos de HC tanto central y las deficiencias de TBG que cursaran con valores bajos de hormona tiroidea, la incidencia de las cuales oscila alrededor de 1:5000-10.000 y 1:50.000 respectivamente. Se estima una tasa de falsos positivos mayor que con la determinación primaria de TSH y confirmación posterior con T4, especialmente en RN de bajo peso y prematuros que pueden presentar hipotiroxinemia transitoria(18).
Determinación primaria de T4 con ampliación de TSH y TGB. Los algoritmos de cribado neonatal de algunos países como Holanda incluyen la determinación inicial primaria de T4 total con el método adicional de la TSH y la TBG en la misma muestra de sangre en aquellos casos en que la T4 total se encuentre por debajo del límite inferior de normalidad establecido por cada laboratorio. Lo que permite este protocolo es calcular la ratio T4 total/TBG como medida indirecta de la concentración de T4 libre, siendo una aproximación fiable y muy sensible y detectar de manera eficaz el HC primario al mismo tiempo que ha supuesto una mejora de la eficacia del diagnóstico de HC central junto con una reducción de los falsos positivos tanto en caso de hipotiroxinemia como de hipertirotropinemia(19,20).
Estrategia de determinación primaria combinada de TSH y T4. Este método se basa en la determinación de TSH y T4 en la muestra de sangre de talón mediante dos técnicas distintas ya que si se utiliza un mismo reactivo con anticuerpos para ambas hormonas disminuye mucho la sensibilidad para ambas.
La T4 total resulta una determinación menos sensible que la de T4 libre para evaluar el hipotiroidismo, debido a que está influenciada por los niveles de TBG y T3, aumentando el número de falsos positivos (deficiencias congénitas de TBG), pero el problema de la determinación de T4 libre radica en la dificultad técnica que tiene su cuantificación, por la necesidad de una mayor cantidad de sangre que la que se puede aislar de la toma obtenida en papel de filtro, lo que condiciona que la muestra del paciente debería ser de suero para poder analizarla. Actualmente la determinación de TSH y T4 libre en la misma muestra de sangre sólo está instaurada en una zona geográfica de Japón por métodos de enzimainmunoensayo adaptados para la T4 libre(21,22).
Aunque no es el objetivo primario del cribado neonatal, con esta estrategia se detecta el HC central (secundario o terciario) que no se puede cribar con el análisis de la TSH aislada, ya que éste se presenta con niveles de TSH disminuidos, inapropiadamente normales o incluso ligeramente elevados. Hay que tener en cuenta, que un resultado de T4 bajo junto con una TSH baja, plantea un diagnóstico diferencial de HC central, deficiencia de TBG o síndrome del enfermo eutiroideo que se dan en prematuros o RN de bajo peso al nacer por inmadurez hipotalámica, pudiendo ser los dos últimos, falsos positivos del cribado y por otro lado la posibilidad de falsos negativos si el límite de decisión de la T4 no está bien establecido(18). También se ha demostrado la utilidad de la determinación conjunta de TSH y T4 para identificar casos de HC central transitorio, como puede ocurrir en casos de madres con situación hipertiroidea durante el embarazo y casos de HC primario con elevación tardía de la TSH, como ocurre en prematuros o neonatos con muy bajo peso al nacer(22).
En España, esta estrategia se aplica en las CCAA de País Vasco, Navarra y Cantabria por ténicas de inmunofluoroensayos para las dos determinaciones. Se realiza la determinación de TSH y T4 total aplicando distintos puntos de corte en función de si se ha de detectar HC primario o central.
Cribado de HC en el mundo. El cribado neonatal para el HC se inició en los años 1970 a nivel mundial y desde entonces, ha sido la prueba gold standard para diagnosticar de manera precoz esta patología consiguiendo reducir significativamente las secuelas neurológicas derivadas de ésta.
Antes de la llegada de los PCN, el HC se diagnosticaba de forma tardía y a través de la clínica. La incidencia de la enfermedad previa a la aplicación del cribado neonatal oscilaba entre 1:7000-1:10.000, aumentando hasta 1:3000-1:4000 tras su instauración y en la actualidad se sitúa entre 1:1400-1:2800.
En Europa la estrategia más utilizada es la determinación primaria de TSH, aunque en Holanda aplican la combinación de TSH+T4+TGB. En cambio, en Norte-America, Australia y Asia la determinación primaria de T4 es la más utilizada, aunque muchos programas de cribado han empezado a reevaluar su estrategia y algunos han modificado su abordaje diagnóstico en base a decidir si su objetivo es detectar casos sólo de HC primario o bien casos de HC primario y otros trastornos tiroideos. Este hecho se debe, en parte, a que el objetivo más importante del cribado neonatal es detectar a niños con HC primario. Actualmente en la mayoría de los países a nivel mundial sólo se detecta el HC por afectación primariamente tiroidea.
En todas las CCAA de España, la detección precoz del HC se lleva a cabo mayormente por medición primaria de TSH, excepto en 3 CCAA (País Vasco, Cantabria y Navarra) que utilizan la estrategia combinada de TSH y T4 para la detección conjunta de HC primario y central figura 1.
DESAFÍOS Y PERSPECTIVAS FUTURAS EN EL CRIBADO DE HC
De entre los desafíos actuales del cribado neonatal del HC están el cribado de neonatos prematuros y de bajo peso, así como el de las formas transitorias.
En los grandes prematuros o de muy bajo peso (<32 semanas gestación; <1.500 g) es frecuente una elevación tardía de la TSH, que puede ocurrir después de algunas semanas de vida. Estos neonatos tienen una probabilidad de tener HC 14 veces mayor que el resto de los recién nacidos, aproximadamente 66% presentan una elevación tardía de la TSH lo que dificulta su detección cuando se analiza únicamente la muestra tomada en la primera semana de vida(23). La elevación tardía de la TSH tiene un origen multifactorial donde la inmadurez del sistema hipotálamo-hipofisario-tiroideo tiene un papel fundamental. Otros factores como una producción disminuida de tiroglobulina, fármacos y eventual deficiencia en iodo, también pueden ser relevantes(24). Este comportamiento también es observado en los neonatos ingresados en unidades de cuidados intensivos, debido a su patología o bien a las drogas utilizadas en su tratamiento. Con el fin de disminuir los falsos negativos asociados a estos grupos de neonatos, la mayoría de los programas recomienda que se proceda a realizar más tomas de muestras durante en el primero mes de vida, siendo variable esta recomendación en función de cada programa(25).
Otra situación que potencialmente puede causar falsos negativos es el cribado de gemelos monocoriónicos. Posiblemente, debido a transferencias de sangre fetal entre los gemelos, el gemelo sano compensa la disfunción tiroidea del gemelo afectado de HC, de manera que presenta niveles normales de TSH en el cribado(26). La solución pasa por hacer una segunda toma de muestra (normalmente a las dos semanas de vida) en los gemelos monocoriónicos. Todavía, hay publicaciones que refieren que la correcta identificación de la placenta solo ocurre en 60% de los embarazos, por lo que se sugiere que se haga una segunda toma de muestra en todos los gemelos del mismo sexo(23,26).
Otro desafío son las formas transitorias de HC primario. Se consideran transitorias las que presentan una deficiencia de T4 con elevación de la TSH que más tarde normaliza, frecuentemente en los primeros meses de vida. Aproximadamente entre el 17% al 40% de los neonatos con cribado positivo para HC son formas transitorias(27). Hay distintas causas para el hipotiroidismo congénito primario transitorio(27,28,29), tabla 3).
Hoy en día se considera que la mayoría de las formas de hipotiroidismo primario transitorio deben ser tratadas, pues pueden producir daños a largo plazo(27).
El objetivo del cribado del HC es la detección del primario, pero este concepto está evolucionado. La detección del HC central es en la actualidad un desafío para los PCN. Esta forma de HC tiene como causa una ineficiente estimulación de una glándula tiroidea normal, debido a una TSH deficitaria, y por lo tanto una producción disminuida de hormonas tiroideas. La producción disminuida de la TSH/TSH funcional es el resultado de enfermedad hipotalámica/pituitaria por un defecto cuantitativo o cualitativo de la producción de TSH. La mayoría de las formas de HC central presentan deficiencias de otras hormonas hipotálamo/pituitaria, pero también pueden ocurrir deficiencias aislada de la TSH. Clínicamente la presentación es heterogénea, pudendo ser moderada o más severa. Estudios recientes demuestran que esta forma de HC no esta tan raro como se pensaba y presenta una incidencia de 1:16400 a 1:21000 en los Paises Bajos(20,30). Esto, juntamente con las ventajas de una detección precoz, ha colocado el HC central en el radar de los PCN, algunos programas ya están incluyendo la determinación de la T4 total simultáneamente con la TSH en todos los neonatos. En España, en estos momentos, se está valorando su inclusión.
CONCLUSIONES
Las referencias bibliográficas publicadas demuestran que los programas de detección de HC son de gran utilidad para la comunidad científica y reflejan el grado de compromiso y sensibilidad hacia este tema. Se constata que, en las últimas décadas, el cribado neonatal del HC se ha consolidado como un ejemplo de éxito en salud pública, eliminando casi por completo las morbilidades asociadas a esta enfermedad.
En el futuro, son necesarias líneas de investigación que aclaren que formas moderadas de HC se benefician de su detección y tratamiento precoz, así como también mejorar la sensibilidad/especificidad en el cribado del hipotiroidismo central.
Cita sugerida: López Galera RM, Castiñeiras Ramos D, Rocha H. Cribado neonatal del hipotiroidismo congénito. Rev Esp Salud Pública. 2021; 95: 26 de enero e202101010.