My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Cuadernos de Medicina Forense
On-line version ISSN 1988-611XPrint version ISSN 1135-7606
Cuad. med. forense vol.17 n.2 Málaga Apr./Jun. 2011
Validación y resultados preliminares del kit de AmpFlSTR® MinifilerTM en el Laboratorio de Genética Forense de la DIJIN, Policía Nacional de Colombia*
Validation and preliminary results of kit AmpFlSTR® MinifilerTM in the Laboratory of Forensic Genetics of DIJIN, National Police Colombia
M.L. Acevedo; O.L. Borda y B.Y. Bocanegra
Bacterióloga. Laboratorio de Genética Forense. Dirección de Investigación Criminal e Interpol (DIJIN). Policía Nacional de Colombia.
*Este trabajo fue financiado por la Dirección de Investigación Criminal e Interpol (DIJIN), Policía Nacional. No se encuentra ningún conflicto de intereses entre sus autores.
Dirección para correspondencia
RESUMEN
El laboratorio de la Dirección de Investigación Criminal e Interpol (DIJIN) de la Policía Nacional implementó la utilización del kit AmpF l STR® MinifilerTM PCR Amplification de AppliedBiosystems con el fin de ayudar en la resolución de casos donde se sospechara una gran fragmentación del ADN.
Metodología: Se evaluaron las alturas de los picos de los controles utilizando dos termocicladores diferentes, dos analizadores genéticos ABI Prism310® y empleando dos volúmenes finales de reacción de PCR. Se evaluó la sensibilidad utilizando muestras de concentraciones entre 0,1 ng/µL hasta 0,006 ng/µL y los datos fueron analizados con el software Genemapper ID v3.2. Se valoró la precisión y la reproducibilidad comparando 10 muestras donde se incluía sangre a diferentes concentraciones, saliva, prendas, evidencias traza, pelo, hueso y diente. Una vez realizada la validación se hicieron pruebas con muestras de 5 casos que habían presentado concentraciones bajas de ADN y amplificaciones parciales utilizando el kit AmpF l STR® Identifiler®.
Resultados y discusión: Se pudo verificar que la concentración ideal para el uso del kit AmpF l STR® MinifilerTM está en un rango entre 0,05 y 0,075 ng/µl de ADN. Se encontró que es posible obtener resultados en muestras con concentraciones de 0,02 ng/µl; cuando la concentración es inferior, los resultados no son reproducibles. En 4 muestras previamente genotipificadas con el kit AmpF l STR® Identifiler®, se amplió el número de marcadores obtenidos en más del 48% con la utilización del kit AmpF l STR® MinifilerTM y se pudo llegar a la probabilidad exigida por la ley colombiana.
Palabras clave: ADN degradado. Mini STRs. Validación. Genética forense.
ABSTRACT
The laboratory of the Bureau of Criminal Investigation and Interpol (DIJIN) of the National Police implemented the use of the kit AMPF l STR®MinifilerTM PCR Amplification of AppliedBiosystems to assist in the resolution of cases where suspected large DNA fragmentation.
Methods: We evaluated the peak heights of the controls using two different thermal cyclers, two ABI Prism 310 genetic analyzers® and using two final volumes of PCR reaction. Sensitivity was assessed using samples ranging from 0.1 ng/mL to 0.006 ng/mL and the data were analyzed using GeneMapper ID v3.2 software. We evaluated the accuracy and reproducibility compared 10 samples which included different concentrations of blood, saliva, brands, trace evidence, hair, bone and tooth. The validation tests were conducted on samples of 5 patients who had presented low concentrations of DNA and partial amplification using AMPF l STR® kit Identifiler®.
Results and discussion: It was noticed that the ideal concentration for the use of AMPF l STR® kit MinifilerTM is in a range between 0.05 and 0.075 ng/ul of DNA. It was found that results can be obtained in samples with concentrations of 0.02 ng/ul, where the concentration is lower, the results are not reproducible. In 4 samples previously genotyped with the kit AMPF l STR® Identifiler®, expanded the number of markers obtained in more than 48% using the kit AMPF l STR® MinifilerTM and are able to reach the probability required by Colombian law.
Key words: Degraded DNA. Mini STRs. Validation. Forensic genetics.
Introducción
Las muestras que se remiten a los laboratorios de genética forense con el fin de realizar análisis tienden a ser de mala calidad por la baja concentración de ADN y/o la fragmentación del mismo, debido a las condiciones ambientales adversas a que son sometidas1. La implementación de técnicas más sensibles que logren encontrar perfiles genéticos en muestras degradadas es mandatorio en los laboratorios modernos. Los mini Short Tandem Repeats (Mini STRs) utilizan primers que están más cerca al núcleo de la repetición, generando amplicones de menor tamaño2. Esto hace que la probabilidad de amplificar un fragmento en el ADN degradado aumente de manera importante.
Con el objetivo de implementar esta nueva tecnología en el laboratorio de Genética Forense de la Dirección de Investigación Criminal e INTERPOL (DIJIN) de la Policía Nacional de Colombia se procedió a validar los parámetros críticos del kit AmpF l STR® MinifilerTM comparándolo con muestras procesadas previamente con el kit AmpF l STR® Identifiler®3.
Material y métodos
Análisis preliminar
Se realizó una evaluación preliminar que incluyó los siguientes parámetros:
– Volumen de amplificación: se procesaron las muestras de control positivo incluido en el kit y T10E0.1 como control negativo, siguiendo las cantidades y el protocolo designados en el manual del kit, utilizando como volumen final 25 µl y modificando el volumen final a 12,5 µl.
– Termociclador: los parámetros de amplificación fueron una incubación inicial a 95oC durante 11 minutos, 30 ciclos utilizando el termociclador 9700 Applied Biosystems y 31 ciclos con el termociclador 2720 Applied Biosystems, que incluyen denaturación a 94oC por 20 segundos, anillamiento a 59oC por 2 minutos y extensión a 72oC por 1 minuto, luego una extensión final durante 45 minutos a 60o C. El número de ciclos utilizado en el termociclador 2720 se aumentó en un ciclo a diferencia de lo sugerido en el kit.
– Analizador genético: se procesaron todas las muestras anteriores realizando corrido electroforético en dos analizadores genéticos ABI Prism310.
Se amplificaron las muestras de control positivo 007 incluido en el kit y T10E0.1 como control negativo, con volumen final 25 µl y 12,5 µl.
Lo anterior con el fin de comparar: 1. Perfiles obtenidos vs. perfiles esperados para todas las muestras analizadas; 2. Valor de altura en unidades de fluorescencia relativa (RFUs) para todos los alelos obtenidos en las muestras analizadas; 3. Comparar los resultados obtenidos a partir de las muestras amplificadas en dos termocicladores diferentes; 4. Resultados de perfiles genéticos y RFUs de todas las muestras corridas en los dos analizadores genéticos ABI Prism 310.
Para evaluar el desempeño del kit AmpF l STR® MinifilerTM se analizaron tres parámetros, teniendo en cuenta que se procesaron con un volumen final de 12,5 µL, en el termociclador 9700, amplificación por duplicado y corrido en dos analizadores genéticos, inyectadas tres veces cada una, 5 segundos cada vez.
Sensibilidad
Fase pre-analítica: se tomó una muestra de ADN conocida (control 007 disponible en el kit), perteneciente a un individuo de sexo masculino previamente tipificado y verificado con los resultados suministrados en el manual del kit AmpF l STR® MinifilerTM, de fábrica se indica su concentración de 0,1 ng/µl. Se prepararon diluciones seriadas entre: 0,006 y 0,10 ng/µl.
Fase analítica: las muestras una vez diluidas fueron amplificadas según lo establecido en las indicaciones del manual del kit, verificando el desempeño de la prueba mediante el uso de los controles establecidos. Todas las muestras se procesaron en dos equipos analizadores genéticos ABI Prism 310, se analizaron con el software Genemapper ID v3.2, con el fin de comparar los resultados obtenidos.
Precisión
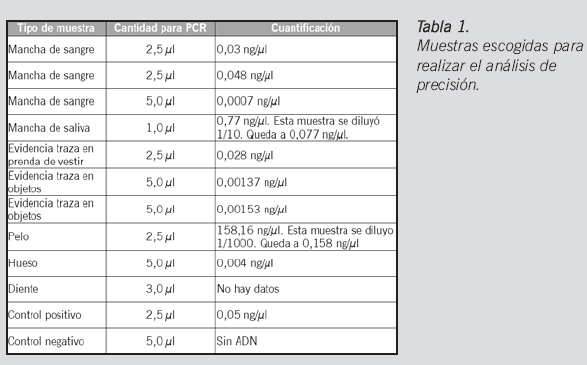
Fase pre-analítica: se tomaron muestras previamente procesadas en el laboratorio, aplicando los métodos de extracción según los tipos de muestra, cuantificados y amplificados usando el kit AmpF l STR® IdentifilerTM. Se incluyeron manchas de sangre, manchas de saliva, muestras de evidencia traza (células epiteliales), pelo, hueso y diente, con diferentes concentraciones; se tomó un volumen total de 12,5 µl para la reacción de PCR (Tabla 1).
Fase analítica: todas las muestras se amplificaron según lo establecido en el manual del kit, en dos amplificaciones diferentes, verificando el desempeño de las pruebas mediante el uso de los controles establecidos.
Reproducibilidad
Fase pre-analítica: se tomaron muestras previamente procesadas en el laboratorio, aplicando los métodos de extracción según el tipo de muestra. Éstas fueron cuantificadas con el kit QuantifilerTM y amplificadas usando el kit AmpF l STR® IdentifilerTM. Se incluyeron manchas de sangre, manchas de saliva, muestras de evidencia traza, pelo, hueso y diente, con diferentes concentraciones según puede verse en la Tabla 1.
Fase analítica: cada una de las muestras fue procesada y analizada según el manual del kit, verificando el desempeño de la prueba mediante el uso de los controles establecidos e inyectadas en los analizadores genéticos tres veces para evaluar la reproducibilidad de los resultados.
Evaluación de muestras analizadas previamente con el kit AmpF l STR® IdentifilerTM y su comparación con el kit AmpF l STR® MinifilerTM
Se tomaron 4 muestras de restos óseos que el laboratorio había genotipificado utilizando el kit AmpF l STR® IdentifilerTM y se tipificaron con el kit Minifiler en las condiciones descritas previamente. Se evaluó el número de sistemas que amplificaron con AmpF l STR® MinifilerTM, el porcentaje de los sistemas que amplificaron por cada kit, los sistemas que amplificaron en Minifiler y no en Identifiler, el porcentaje de sistemas en los que se obtuvo resultado utilizando ambos kits y los resultados finales obtenidos en cada caso.
Resultados
Análisis preliminares y sensibilidad
- Electroforesis en ABI Prism 310 Serie 679, análisis con software Genemapper ID v3.2 (muestra: control positivo).
Para las muestras amplificadas con una concentración 0,025 ng/ul, 0,05 ng/ul y 0,1 ng/ul en el termocliclador 9700 se obtuvieron los resultados esperados. Para las muestras amplificadas con una concentración 0,006 ng/ul y 0,012 ng/ul en el termocliclador 9700 se obtuvieron los resultados esperados, con excepción de los sistemas D21S11 y D16S539 en los cuales se amplificaron productos no deseados y los sistemas D7S820, D21S11, D18S51 y Amelogenina en los cuales se observó perdida alélica. Este hecho sugiere que no se deben procesar muestras con una concentración por debajo de 0,02 ng/ul.
Los alelos de las muestras amplificadas con una concentración 0,025 ng/ul, 0,05 ng/ul y 0,1 ng/ul en el termociclador 9700 presentaron un valor de RFUs superior al exigido para el análisis. Los alelos de las muestras amplificadas con una concentración de 0,025 ng/ul, en los marcadores D21S11 y FGA, mostraron desequilibrio alélico significativo, en el cual el primer alelo supera en altura más del doble al segundo. Los alelos de las muestras amplificadas con una concentración 0,006 ng/ul y 0,012 ng/ul en el termocliclador 9700 presentaron un valor de RFU superior al exigido para el análisis, sin embargo en los STRs D21S11 y D16S539 se observan productos no deseados con valores de RFU altos y los sistemas D7S820, D21S11, D18S51 y Amelogenina en los cuales no se observaron los resultados esperados.
- Electroforesis en ABI Prism 310 Serie 595, análisis con software Genemapper ID v3.2
Los alelos de las muestras amplificadas con una concentración 0,025 ng/ul, 0,05 ng/ul y 0,1 ng/ul en el termociclador 9700 presentaron un valor de RFU superior al exigido para el análisis. Los alelos de las muestras amplificadas con una concentración 0,025 ng/ul, en los marcadores D21S11 y FGA, mostraron desequilibrio alélico significativo, en el cual el primer alelo supera en altura más del doble al segundo. Los alelos de las muestras amplificadas con una concentración 0,006 ng/ul y 0,012 ng/ul mostraron un comportamiento similar al encontrado en el análisis del equipo anterior.
Resultados del análisis de precisión y reproducibilidad
Los resultados para las muestras de evidencias trazas, hueso y diente produjeron un resultado idéntico teniendo en cuenta los obtenidos previamente al amplificarlas con el kit AmpF l STR® IdentifilerTM, los resultados de las dos PCR, realizando la inyección por triplicado y en dos equipos diferentes.
Comparación de muestras analizadas previamente con el kit Identifiler y su resultado con el kit Minifiler
En la Tabla 2 se evidencia como el kit Minifiler, en las 4 muestras, amplificó los 9 sistemas (100%) mientras que el Identifiler en el mejor de los casos amplificó 10 (62.5%). El análisis por Minifiler muestra como en los 4 casos se pudo entregar un resultado concluyente a la autoridad que lo solicitó.
Comparación de los resultados entre los dos kits utilizados
En la Figura 1 se presentan los electroferogramas generados con ambos kits donde se observa la aparición de resultados en varios sistemas al utilizar el kit Minifiler con alturas de pico mucho mayores que las generadas por el kit Identifiler.
Discusión
La casa comercial en su manual del kit Minifiler sugiere para el proceso de amplificación la aplicación de este método en caso de contar con muestras degradadas, inhibidas o de baja concentración; la concentración ideal para su aplicación está en el rango entre 0,05 y 0,075 ng/ul de ADN, lo cual se pudo verificar en los ensayos realizados. Sin embargo, de acuerdo con los análisis realizados es posible obtener un perfil completo con muestras cuya concentración de ADN es de 0,025 ng/µl. En caso de tener muestras con ADN escaso es posible obtener resultados con muestras cuya concentración es de por lo menos 0,02 ng/ul4. Resultados de ADN con muestras cuya concentración es inferior no son reproducibles, por lo tanto no se debe realizar su amplificación. Siempre se deben confirmar los resultados realizando la amplificación por duplicado con el fin de verificar que los alelos sean reproducibles, con valores de RFU de 100 y poder reportarlos en el informe pericial. Además se debe mezclar previamente el ADN con el fin que la muestra sea homogénea y recolectarla utilizando pipetas automáticas calibradas y verificadas, cambiando de punta.
De acuerdo con los resultados obtenidos en esta validación, las muestras procesadas utilizando el kit Comercial Minifiler, bajo las condiciones descritas de concentración, amplificación y análisis, mostraron resultados precisos y reproducibles en el 100% en las muestras analizadas. Sin embargo, si la concentración es inferior o superior a la determinada anteriormente, los resultados varían en algunos alelos.
La comparación entre los resultados de Identifiler y Minifiler en muestras de restos óseos analizados muestra como el kit Minifiler es más eficiente en su rendimiento. En los casos mostrados, llega a resolver el caso en su totalidad obteniendo perfiles más completos5.
Bibliografía
1. Coble MD, Butler JM. Characterization of new miniSTR loci to aid analysis of degraded DNA. J Forensic Sci. 2005;50(1):43-53. [ Links ]
2. Butler JM, Shen Y, McCord BR. The development of reduced size STR amplicons as tools for analysis of degraded DNA. J. Forensic Sci. 2003;48:1054-64. [ Links ]
3. Luce C, Montpetit S, Gangitano D, O´Donnell P. Validation of the AMPFlSTRMiniFiler PCR amplification kit for use in forensic casework. J Forensic Sci. 2009;54(5):1046-54. [ Links ]
4. Hughes-Stamm S, Ashton K, van Daal A. Assessment of DNA degradation and the genotyping success of highly degraded samples. Int J Legal Med. 2010 Apr 24. [Epub ahead of print] [ Links ].
5. Alenizi MA, Goodwin W, Hadi S, Alenizi HH, Altamar KA, Alsikel MS. Concordance between the AmpFlSTRMiniFiler and AmpFlSTRIdentifiler PCR amplification kits in the Kuwaiti population. J Forensic Sci. 2009;54(2):350-2. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Liliana Acevedo.
E-mail: dijin.acrim-genetica@policia.gov.co
Fecha de recepción: 20.DIC.2010
Fecha de aceptación: 19.MAR.2011