My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Cuadernos de Medicina Forense
On-line version ISSN 1988-611XPrint version ISSN 1135-7606
Cuad. med. forense vol.21 n.3-4 Málaga Jul./Dec. 2015
Estudio descriptivo de los factores de contaminación en las tomas forenses de muestras de ADN
Descriptive study of the causes of contamination in forensic sampling of DNA
L. Hombreiro1, F. Serrulla2, J.L. Cascallana2, I. Del Río2, A. Fernández Liste2
1Biólogo. Inspector del Cuerpo Nacional de Policía. Laboratorio ADN de Galicia. A Coruña.
2Médico Forense. Instituto de Medicina Legal de Galicia. Orense.
3Médico Forense. Instituto de Medicina Legal de Galicia. Lugo.
4Médico Forense. Instituto de Medicina Legal de Galicia. Pontevedra.
5Médico Forense. Instituto de Medicina Legal de Galicia. Santiago de Compostela. A Coruña.
Dirección para correspondencia
RESUMEN
La contaminación de las muestras de ADN en el ámbito judicial tiene una enorme trascendencia en todos los procesos, especialmente en los penales. Con el objetivo de conocer los factores que condicionan esta contaminación, así como el grado de la misma, hemos diseñado un trabajo experimental que incluye cuatro equipos diferentes, cada uno de los cuales realiza de tres maneras diferentes la toma (correcta, incorrecta y muy incorrecta). Los resultados del estudio muestran una mínima contaminación por manipulación incorrecta, así como por contaminación residual en las instalaciones de trabajo. Se concluye que aunque los métodos habituales de toma de muestras son seguros, es conveniente siempre asegurarse de que se cumplen los protocolos de toma de muestras y de limpieza de las instalaciones de trabajo.
Palabras clave: ADN. Contaminación. Toma de muestras. Forense.
ABSTRACT
The contamination of DNA samples in forensic context is very important in all kind of trials, specially in penal trials. With the goal to know factors which produce this contamination and degree of its, we are designed an experimental study with four forensic experts and three ways to make this samples collection (correct, incorrect and very incorrect). Results of this study show a minimum contamination in handling and residual contamination too in workplaces. We conclude that although the routine methodology in sample collection could be consider reliable; furthermore it's necessary achieve protocols of samples collection and cleanliness of workplaces.
Key words: DNA. Contamination. Samples collection. Forensic.
Introducción
El altísimo poder de identificación e individualización humana del ADN nuclear ha sido documentado en múltiples estudios, su aplicación es rutinaria en las áreas de la criminalística y la ciencia forense, y en suma, se ha convertido en una prueba pericial de carácter crucial en el proceso penal1.
El aumento de la sensibilidad de las técnicas de análisis ha permitido analizar no sólo tejidos y fluidos corporales humanos, sino también otro tipo de restos biológicos, tales como las células epiteliales depositadas en las evidencias forenses, incluso en la piel humana2. Los kits Multiplex de reacción en cadena de la polimerasa (PCR) comercializados en la actualidad son altamente sensibles incluso para muestras muy escasas de ADN3-6 (las denominadas LCN o Low Copy Number DNA traces).
La superficie de la piel humana contiene aproximadamente dos millones de células, con una tasa de descamación media de 700 células por segundo; este proceso de "pérdida" de células supone la existencia de trazas biológicas o depósitos de células susceptibles de contener ADN en condiciones óptimas para su análisis y con valor identificativo.
La práctica diaria demuestra que los restos biológicos existentes sobre diferentes superficies pueden ser detectados con valor identificativo incluso mucho tiempo después de su depósito. Si bien existe algún estudio publicado sobre los tiempos límite de eficiencia de las trazas epiteliales por contacto, cifrándolos en no más de 2 meses7, la evidencia empírica demuestra que existen múltiples factores que inciden en el resultado positivo o no de los análisis de restos biológicos antiguos, pudiendo obtenerse resultados positivos con valor identificativo en restos epiteliales con antigüedad incluso de años.
Ese aumento de la sensibilidad en las técnicas de análisis ha llevado a la reapertura de múltiples casos no resueltos8, los denominados cold cases, en los que se analizan con técnicas actuales muestras recogidas hace años, incluso décadas, y que en su mayor parte fueron recogidas en contextos muy diferentes a los actuales en cuanto a la metodología de trabajo, las condiciones de asepsia y prevención, y los conocimientos de los investigadores de la escena del crimen sobre los tipos de vestigios biológicos que pudieran estar presentes en las diferentes superficies o sustratos9-12.
Esta recogida de restos biológicos suele ser muy compleja en la casuística forense, debido a la ausencia de control de factores ambientales, la diversidad de superficies de depósito de las células y las manipulaciones previas al propio delito que pudieran haber dejado restos no relacionados con los hechos a investigar.
El estudio y la valoración de la posible contaminación son un punto crucial en el análisis y la interpretación de las trazas biológicas recogidas en la escena de un delito. Dicha contaminación podría incluso encontrarse en cantidades mayores que el propio ADN objeto de búsqueda y estudio.
Abundando en el concepto científico del término "contaminación", y desde una perspectiva teórica, habría que tener en cuenta que cualquier depósito de ADN que no sea relevante para el crimen que se está investigando debería ser considerado como contaminación. Esta contaminación podría haber sido depositada en un momento previo al crimen, en el intervalo entre el crimen y el aseguramiento de la escena, durante el procesado de la escena por el equipo investigador, o en su análisis en el laboratorio.
En relación a los depósitos de ADN o contaminación previa al crimen, es preciso considerar que, bajo circunstancias normales, existe un background de DNA en cualquier superficie de cualquier escenario13-15. Este ADN residual previo al crimen, junto con los posibles depósitos producidos entre el crimen y el aseguramiento de la escena, no pueden ser estrictamente controlados en la práctica real, por lo que se hace imprescindible la aplicación de métodos que detecten y cuantifiquen este tipo de contaminación, al efecto de minimizar su impacto lo más posible. Estos métodos incluyen:
- La realización de estudios para conocer la casuística real de aparición de estos depósitos y su persistencia en el tiempo, sobre todo tipo de superficies y en diferentes condiciones ambientales.
- Desarrollar métodos de recogida de muestras estrictamente dirigidos a las evidencias de interés para la investigación, minimizando la recogida de otro ADN residual.
- Obtener muestras de ADN de referencia de todos los individuos que pudieran estar en contacto de forma usual con las superficies en estudio, para poder realizar una discriminación de sus perfiles genéticos una vez obtenidos los resultados de los análisis.
- Obtener una batería de muestras de la contaminación residual o background de ADN existente en la superficie de estudio, como apoyo a la interpretación de los resultados.
En cuanto a la posible contaminación de la escena del crimen por el personal encargado de la recogida de las muestras, puede ser controlada implementando procedimientos reglados para minimizar este riesgo, considerando que la mayor parte de estas contaminaciones se producen por la manipulación de objetos sin cambio de guantes entre ellos, provocando transferencias de restos biológicos entre superficies de evidencias, y por el mantenimiento de conversaciones sin uso de mascarillas, lo que provoca un riesgo de contaminación muy alto16. Incluso se han descrito contaminaciones durante la realización de autopsias, debido a las transferencias primarias y secundarias de ADN17,18. Como mínimo, las medidas estándar de prevención de la contaminación en el procesado de la escena de un delito por los profesionales encargados de la recogida de evidencias son:
- Restricción total de acceso de los investigadores a la escena del delito, únicamente los imprescindibles para la recogida de las evidencias.
- El uso de barreras para el contacto de los investigadores con las superficies en estudio, tales como guantes, mascarillas, monos de trabajo de plástico, calzas, etc.
- El cambio frecuente de guantes en los intervalos de recogida de evidencias.
- Evitar, en la medida de lo posible, la manipulación de los objetos susceptibles de ser depositarios de restos biológicos de interés.
- El uso de material estéril, siendo preferible el material tratado libre de DNA.
- Disponer de los perfiles genéticos de los investigadores que procesan la escena del crimen, incluidos si es posible en los programas informáticos de interpretación de resultados, al efecto de discriminar posibles contaminaciones o transferencias de ADN.
En relación a la posible contaminación en el laboratorio de análisis, puede tener lugar por contaminación con ADN del personal del laboratorio, por transferencia entre muestras en el laboratorio y por contaminaciones en el material consumible utilizado.
Este tipo de contaminación en el laboratorio suele estar altamente controlada, mediante la implementación de mecanismos de asepsia y limpieza rutinarios, y metodologías de trabajo estrictas que minimizan los riesgos. Los estudios realizados sobre la materia han detectado niveles apreciables y significativos de contaminación en las superficies de trabajo de los laboratorios, en el material no desechable y en los equipos de análisis. De igual forma, se han detectado niveles apreciables de contaminación genética ajena a las muestras en estudio en el material consumible utilizado en el laboratorio19-22. Las metodologías de trabajo que minimizan estos riesgos son:
- Uso de material fungible libre de ADN, no siendo suficiente que dicho material sea estéril.
- Limpieza frecuente de todas las superficies de trabajo del laboratorio.
- Detección de los niveles de contaminación significativos y los lugares de depósito más frecuentes, al efecto de comunicación e información a todo el equipo técnico de analistas, tanto para focalizar más intensamente las labores de limpieza y esterilización como para el trabajo diario de los especialistas, que tendrán especial cuidado en dichos lugares considerados de riesgo.
- Separación de las áreas de trabajo de examen preliminar, extracción de ADN, amplificación y genotipado, siendo de crucial importancia que el producto ya amplificado no se encuentre nunca en contacto con el producto sin amplificar.
- Uso de material específico y exclusivo del área de producto amplificado, tal como batas, bolígrafos, marcadores, material diverso de oficina, etc.
- Introducción de controles específicos de calidad, examinando doblemente las mismas muestras, en tiempos distintos, en lugares distintos y por diferente personal. Los procedimientos de extracción, amplificación y genotipado también deben ser desarrollados doblemente en los controles de calidad.
- Uso en cada analítica de controles negativos y controles de contaminación residual de las superficies de trabajo.
- Discriminación de los perfiles genéticos del personal del laboratorio en el software de interpretación de perfiles genéticos.
Este conjunto de circunstancias obliga a los investigadores de los equipos forenses a realizar la interpretación de las trazas o vestigios biológicos, y los perfiles genéticos derivados de su análisis, desde la asunción de la existencia de contaminación genética residual ajena al crimen. Una muestra tipo mezcla de perfiles genéticos puede contener ADN relacionado con el crimen, ADN del background de la propia escena del crimen y ADN procedente de contaminaciones posteriores a la escena del crimen, siendo por ello extremadamente difícil detectar cuál es el ADN relevante y discriminarlo durante la fase de análisis del resto.
Otro factor a tener en cuenta es la transferencia de ADN primaria y secundaria entre evidencias y vestigios. La transferencia primaria, a través del contacto entre los individuos y los objetos o superficies que son depósitos de ADN, ha sido descrita en múltiples artículos científicos23, teniendo su origen teórico en la célebre teoría de la transferencia de vestigios de Edmond Locard24. La transferencia secundaria o indirecta también ha sido objeto de estudios científicos, demostrándose en la práctica forense que sustanciales niveles de material genético se transfieren de forma secundaria bajo determinadas condiciones25-27, habiendo sido reportada incluso entre muestras biológicas adheridas a tejidos o ropas en soluciones acuosas, al ser lavadas a mano o en máquina28.
En resumen, los equipos forenses encargados de la recogida de evidencias en el escenario de un delito deben de tener en cuenta, como factor de riesgo, la contaminación de las muestras por el propio personal encargado de la recogida, manipulación y embalaje, así como de su análisis, y tienen que considerar igualmente la posible presencia de depósitos residuales de ADN sobre las superficies de trabajo y en el material destinado a la manipulación de las evidencias29.
Esta presencia de restos sobre múltiples superficies, incluso siendo residual, puede provocar fenómenos de contaminación en varios momentos cruciales, fundamentalmente la inspección ocular, la recogida de las muestras y todas las manipulaciones que se llevan a cabo en los laboratorios en las diferentes fases del análisis. Fenómenos tales como el carryover, o transferencia de contaminación residual a los asuntos con los que se trabaja, pueden provocar graves errores de interpretación de los análisis, por lo que es preciso detectar la existencia de restos biológicos ajenos a las muestras estudiadas, estudiar las superficies y lugares de manipulación más habituales por el equipo técnico de recogida de muestras y por el equipo técnico del laboratorio, así como comunicar y difundir los resultados de este control a todos los integrantes de las unidades implicadas, para la implementación de medidas y mecanismos de prevención, asepsia y manipulación adecuados30.
Cualquier factor no controlado y que sea potencialmente contaminante, como el uso de material de recogida o de protección no estéril o de varios usos, así como una metodología de trabajo que no incluya la prevención y la esterilización continua de las herramientas de trabajo, pueden derivar en la contaminación de las evidencias y en la obtención de resultados analíticos con componentes alélicos que no se correspondan exclusivamente con los depósitos celulares que se están estudiando.
Objetivos y diseño experimental
En el presente estudio se pretende evaluar la metodología de recogida, manipulación y embalaje de evidencias por parte de cuatro equipos de médicos forenses del Instituto de Medicina Legal de Galicia, así como la posible presencia de contaminación residual en las superficies y el material de trabajo de dichas unidades. Igualmente pretende evaluar la dificultad o facilidad en la contaminación y en la transferencia de ADN entre muestras o entre donante y muestras. Todos los vestigios biológicos fueron analizados por personal diferente a los equipos forenses, y sin mantener ningún tipo de contacto entre ellos.
Los equipos forenses, pertenecientes a cuatro provincias distintas de Galicia, estuvieron constituidos de la siguiente forma:
- Equipo A (IMELGA, Lugo): tres varones y una mujer.
- Equipo B (IMELGA, Santiago): dos varones.
- Equipo C (IMELGA, Orense): un varón.
- Equipo D (IMELGA, Pontevedra): un varón y una mujer.
Como factor de control de contaminación, no existió presencia física de ninguno de los forenses que participó en el presente estudio en las instalaciones del Laboratorio de Genética Forense que realizó las analíticas e interpretó los resultados, al menos en los 2 años anteriores, lo que permite descartar el background de sus perfiles genéticos en las instalaciones del laboratorio y los posibles carryover que produjesen contaminaciones de las muestras. Dichas contaminaciones por los perfiles genéticos de referencia de los forenses, en caso de existir, tendrían obligatoriamente que proceder del manipulado de las muestras en la fase de recogida.
Para ello, se plantearon tres metodologías de trabajo, que fueron definidas como correcta, incorrecta y muy incorrecta, por parte de cada equipo, incluyendo en el modo correcto la forma de trabajar normal que desarrollan durante su práctica profesional, en el modo incorrecto la ausencia de guantes y mascarillas durante la manipulación de los vestigios y el uso de material sin esterilizar, y en el modo incorrecto, además de lo anterior, se extrema la mala praxis realizando estornudos sobre los vestigios y hablando en su cercanía.
En el estudio se utiliza una matriz amplia de muestras (Tabla 1), incluyendo, entre otras, sangre, epiteliales sobre colillas, epiteliales sobre guantes y esperma sobre tejidos. Este conjunto de muestras es representativo de la práctica profesional habitual, siendo los vestigios más comunes en su recogida. Las muestras de sangre y esperma fueron sometidas a contacto en condiciones de humedad para evaluar la posible transferencia primaria por contacto entre vestigios. Se recogieron también muestras indubitadas de los perfiles genéticos de los miembros de los equipos forenses, a modo de referencia, y también controles de contaminación residual de las superficies de trabajo de los forenses y de su material de oficina de manipulación rutinaria.
Los donantes de las muestras fueron dos varones y una mujer, referidos en cada vestigio, que se denominaron varón donante 1, varón donante 2 y mujer donante 2.
Las muestras fueron remitidas a los equipos forenses embaladas y sin conocimiento por parte de estos de la tipología, naturaleza y otras circunstancias relacionadas.
En el laboratorio, sobre los vestigios se realizaron pruebas preliminares de determinación de origen y especie, previas al proceso de extracción de ADN. En los casos en que fue positiva la determinación de esperma humano, se procedió a la separación de las fracciones haploide y diploide para su estudio separado. Posteriormente se realizó la cuantificación de ADN y el genotipado de las muestras, teniendo como límite primario de detección la cantidad de 150 unidades de fluorescencia (rfu) en el software de análisis de perfiles.
Los resultados se presentan por cada equipo forense, relacionando los tres métodos, los niveles de cuantificación de ADN y los resultados obtenidos y esperados si no existiese contaminación sobre las muestras.
Material y métodos
- La toma de muestras y de evidencias se realizó mediante torundas de algodón estériles impregnadas en agua Mili-Q autoclavada a 150 oC y guantes estériles de un solo uso, y el personal de recogida de las evidencias fue diferente al que realizó la preparación de las muestras, así como la recogida de las evidencias, y a su vez diferente del que realizó la extracción, la purificación y el análisis de DNA, con el objeto de detectar posibles contaminaciones de la muestra, dado que se tienen los datos de la persona que manipuló las evidencias e incluso su perfil genético. Se practicaron pruebas preliminares para determinar la naturaleza de los vestigios, en concreto:
- Sangre: la detección de hemoglobina humana con el kit de inmunocitoquímica Hexagon Obti test, siguiendo el protocolo del fabricante.
- Esperma: en la detección de esperma se utilizaron dos técnicas, una consistente en un estudio de fluorescencia de riboflavinas con luz láser de 495 nanómetros de longitud de onda mediante el instrumental Crimescope Laser Forensic Light Source, y la otra mediante la detección de la proteína p30 con el ensayo de detección del antígeno prostático del kit PSA Rapid test, siguiendo las instrucciones del fabricante.
- Extracción y purificación de ADN: la preparación de ADN para la extracción se realizó mediante maceración a 37 oC durante 24 horas en buffer de extracción con EDTA, TRIDNA base y cloruro sódico (NaCl) más la adición de proteinasa K. Posteriormente se realizó una extracción mediante separación de fases con fenol/cloroformo/alcohol isoamílico y un purificado con columnas de purificación Amicón Ultra 100 (membrana de 100 Angstrom de tamaño de poro), obteniendo volúmenes finales entre 80 y 150 microlitros. En los casos de pruebas preliminares positivas para esperma se practicó extracción diferencial, cuyo procedimiento consistió en, una vez realizada la maceración a 37 oC, centrifugación del macerado recogiendo el sobrenadante para la extracción mediante separación de fases (fracción diploide o primera lisis), y posteriormente se realizó un macerado de 24 horas a 37 oC con la adición del agente reductor dodecil sulfato sódico (SDS) al mismo buffer de extracción, para la rotura de los puentes disulfuro de los espermatozoides. Una vez realizado este macerado, se llevó a cabo la extracción de ADN mediante separación de fases (fracción haploide o segunda lisis).
- Análisis de datos de ADN: una vez cuantificado el ADN mediante PCR en tiempo real y el kit Human Quantifiler de Life Technologies-Applied Biosystems, se realizó la amplificación con el kit Global Filer de Life Technologies-Applied Biosystems en un sistema termociclador GeneAmp 9700 de la misma casa comercial. Los 28 ciclos de replicación contenían 2 microlitros del extracto original diluido para una concentración de 0,1 nanogramos/microlitro.
- Posteriormente se realizó la electroforesis capilar con un parámetro de 5 segundos de inyección mediante un analizador genético 3130 de Life Technologies-Applied Biosystems, siguiendo las recomendaciones y las pautas analíticas del fabricante.
- Por último, la lectura de los perfiles genéticos fue realizada con el software de genotipado GeneMapper, de Life Technologies-Applied Biosystems, para luego ser revisada por el analista.
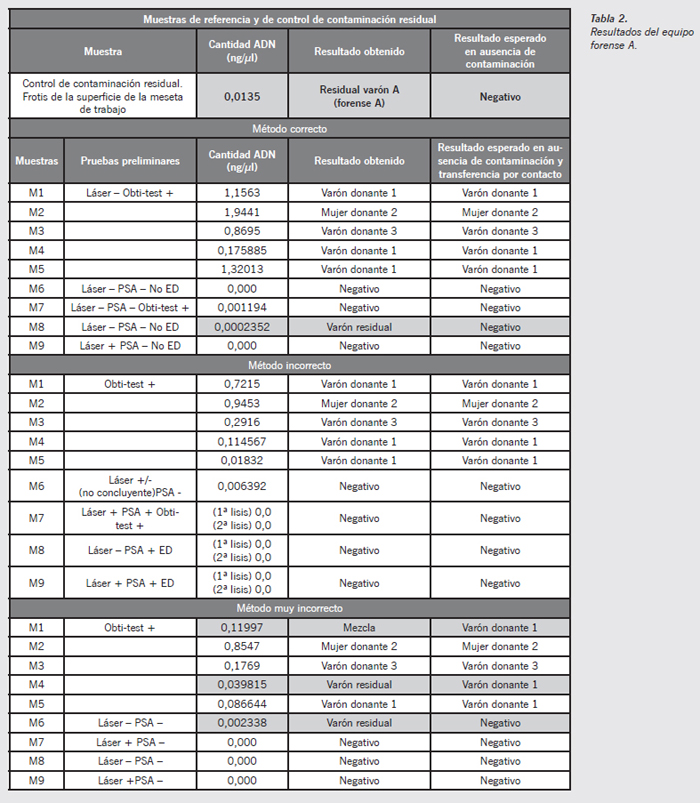
Los resultados se muestran en las Tablas 2 a 5, con la expresión de los valores obtenidos en las pruebas preliminares, los datos de cuantificación de ADN y el resultado del genotipado de la muestra, así como el resultado esperado en caso de no contaminación. Los donantes son codificados como varón donante 1, mujer donante 2 y varón donante 3. Los equipos forenses aportaron al estudio sus indubitadas de referencia, al efecto de cotejo y discriminación de posibles contaminaciones.

Resultados
Análisis electroforético de los resultados no acordes a lo esperado
Equipo forense A
- Muestra de contaminación residual en la mesa de trabajo (Figura 1): pueden observarse picos electroforéticos de escasa altura, que en algún caso pueden superar las 150 rfu. Podrían producir errores de lectura o de interpretación en caso de mezclas, y en el caso de los marcadores de amelogenina (X,Y) llevarían a errores de interpretación, dadas las alturas de los picos alélicos observados (X: 508 rfu; Y: 216 rfu). Es de significar que el perfil observado es coincidente en casi todos los marcadores con el perfil del forense varón A, por lo que existe una clara contaminación residual por transferencia primaria por parte de dicho donante, que forma parte del equipo técnico forense A.
- Muestra M8 método correcto (Figura 2) (esperma sobre tela en contacto primario con otro tejido textil): pueden observarse picos electroforéticos de muy escasa altura, que difícilmente podrían alterar una lectura de perfiles en condiciones normales, pero que es preciso remarcar puesto que los picos observados se corresponden con el donante varón 1 (donante de esperma), lo que indica que se ha producido una transferencia primaria del perfil genético del donante tras las 48 horas de contacto en ausencia de humedad.
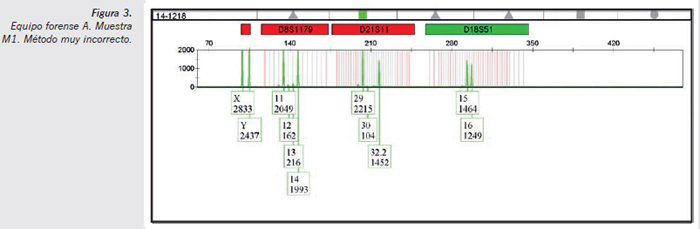
- Muestra M1 método muy incorrecto (Figura 3) (torunda con sangre del donante 1): pueden observarse picos electroforéticos de muy escasa altura, que son coincidentes con el perfil genético del forense varón A (alelos 12 y 13 en el marcador D81179 y pico 30 en marcador D21S11). En este caso, con un método particularmente proclive a la contaminación primaria por manipulación, se observa y detecta dicha contaminación, pero en ningún caso puede llegar a producir una interpretación errónea sobre una muestra de esta tipología. Sangre de un solo donante ofrece un perfil genético único con una alta cantidad de ADN, por lo que cualquier tipo de contaminación residual por transferencia primaria de tipo manipulación no ofrecería ninguna duda en la labor de interpretación del perfil genético.
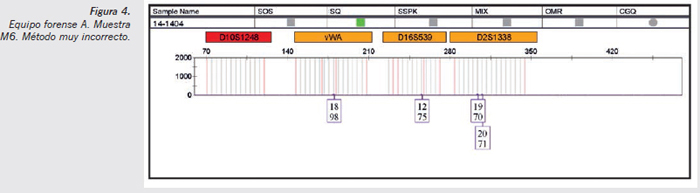
- Muestra M6 método muy incorrecto (Figura 4) (sangre de varón donante 1 en contacto con tejido textil durante 48 horas): pueden observarse picos electroforéticos de muy escasa altura, que con niveles de 150 rfu como umbral de detección no alterarían la interpretación de la muestra. En este caso, es una muestra cuyo resultado esperado sería negativo, y entonces tiene importancia la detección de picos alélicos que son coincidentes con el varón donante 1 (perfil de la sangre), por lo que sí ha existido una transferencia primaria por contacto de ADN.
Equipo forense B
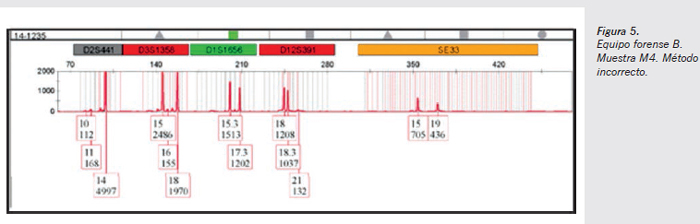
- Muestra M4 método incorrecto (Figura 5) (epiteliales de varón donante 1 sobre guante de látex): tan sólo pueden apreciarse en algunos marcadores (D2S441 y D12391) picos alélicos que no se corresponden con el perfil del varón donante 1. Alguno de dichos picos electroforéticos supera las 150 rfu, es decir, se encuentra por encima del límite de detección, por lo que un método incorrecto sin medidas de precaución permite observar componentes alélicos ajenos a la muestra en estudio, si bien en ningún caso dificultan la interpretación del perfil mayoritario en el caso presentado.
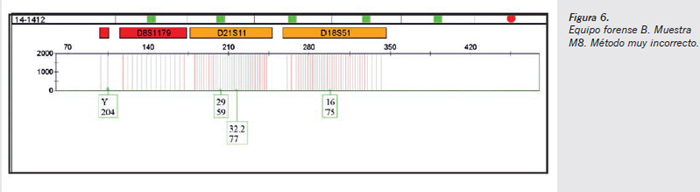
- Muestra M8 método muy incorrecto (Figura 6) (esperma sobre tela en contacto con tejido textil durante 48 horas): los picos electroforéticos observados se corresponden con el perfil genético del varón donante 1 y que serían esperables en caso de existir una transferencia primaria por contacto. La intensidad de los picos medida en rfu es muy baja y se encuentra muy por debajo de los límites de validez aceptables. En el presente caso, no existe ninguna mezcla sobre la que pudiesen suponer un problema en la interpretación, pero no puede descartarse que dicha transferencia primaria no pueda provocar una dificultad en la interpretación de perfiles mezcla, en los cuales los picos electroforéticos ajenos a los perfiles que deberían hallarse podrían ser considerados como componentes alélicos presentes en los vestigios.
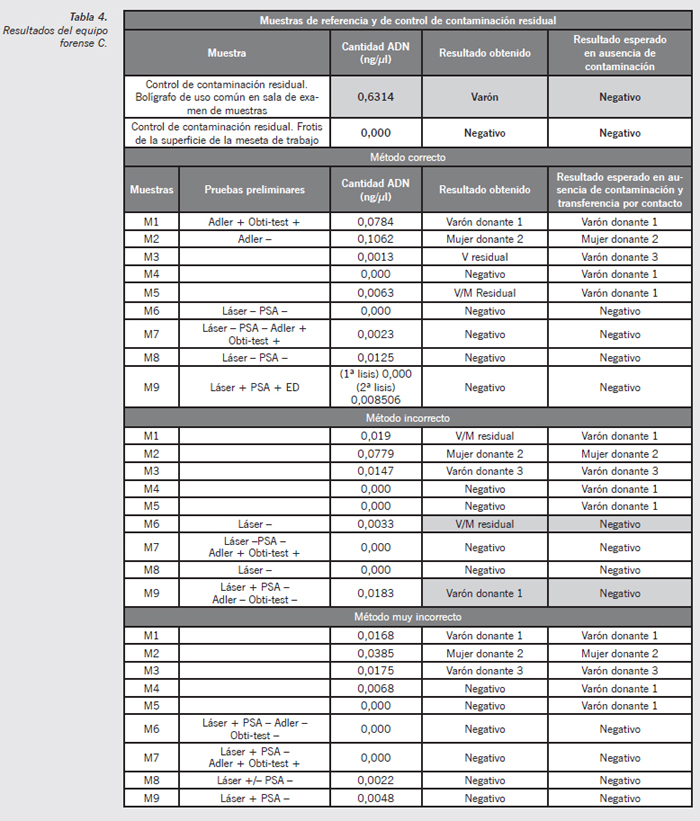
Equipo forense C
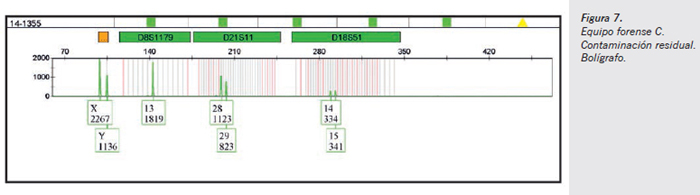
- Muestra de contaminación residual (bolígrafo usado en la mesa de trabajo) (Figura 7): se observa un claro perfil genético que se corresponde con el perfil genético del forense varón C, lo que implica un claro foco de contaminación tipo background en el material usado en la mesa de trabajo y manipulación de las muestras forenses.
- Muestra M6 método incorrecto (Figura 8): si bien se observa una mínima contaminación residual en algunos marcadores, esta se debe a la transferencia por contacto entre los vestigios, puesto que se corresponden los picos alélicos observados con el perfil genético del donante varón 1. No se aprecia ningún componente alélico procedente de otro donante, aun siendo el método incorrecto.
- Muestra M9 método incorrecto (Figura 9): en esta muestra se pretende estudiar la posible transferencia por contacto del esperma del donante varón 1 a otro tejido textil en condiciones de alta humedad durante 48 horas. Puede apreciarse claramente la transferencia, siendo el perfil observado coincidente con el perfil del donante varón 1.
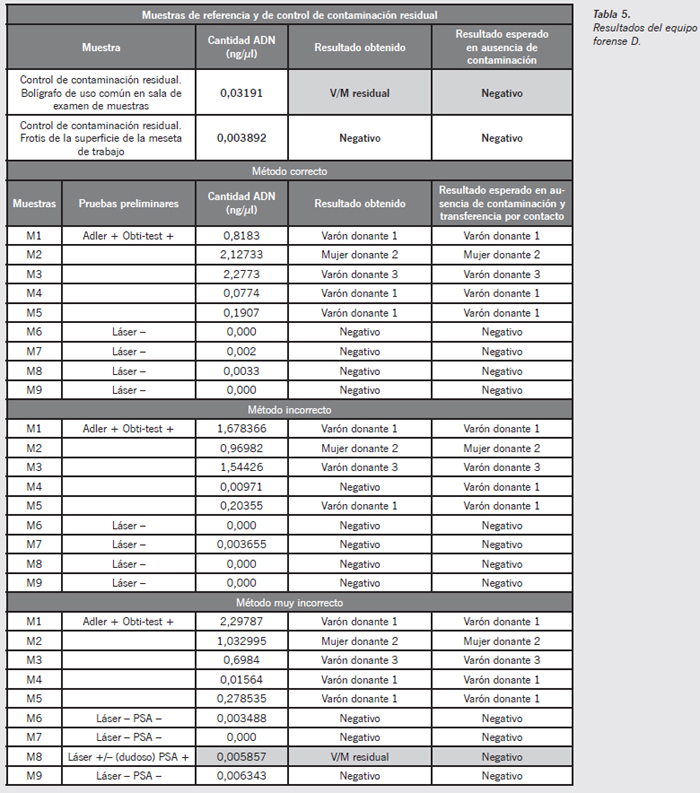
Equipo forense D
- Muestra de contaminación residual (Figura 10) (bolígrafo utilizado en el área de manipulación de las muestras): puede apreciarse la existencia de picos electroforéticos de escasa altura, pero que pudieran provocar dificultades en la interpretación de perfiles complejos de muestras LCN o perfiles mezcla. Los picos alélicos observados son coincidentes con el perfil genético de la forense mujer D. Esto supone un foco de contaminación en el área de manipulación de las muestras.
- Muestra M8 método muy incorrecto (Figura 11) (esperma sobre tejido de tela en contacto con otro tejido textil durante 48 horas): si bien existe una transferencia por contacto primario, los picos alélicos son de muy escasa calidad y no producirían errores en la interpretación de perfiles genéticos únicos. En caso de mezclas o de perfiles LCN sí podría darse alguna dificultad de interpretación.
Discusión y conclusiones
En los últimos años son múltiples los estudios científicos realizados acerca de los depósitos de ADN sobre diferentes superficies que pudiesen encontrarse previamente a la comisión de un delito, así como los depósitos transferidos por contaminaciones primarias y secundarias del propio personal que procesa la escena del crimen y de los analistas de los laboratorios de genética forense. En todos ellos se ha comprobado empíricamente de manera reiterada que cantidades importantes de ADN ajenas al hecho delictivo pueden encontrarse en la escena del delito y en los vestigios recogidos, lo que implica, por un lado, la adopción de metodologías de trabajo estrictas que prevengan o minimicen en lo posible la recogida de este componente genético, y por otro, el conocimiento por parte de los investigadores forenses de los puntos de contaminación más frecuentes.
En el área del análisis en los laboratorios, un entrenamiento adecuado puede permitir realizar interpretaciones correctas en casos de muestras complejas por su escaso nivel de ADN, o bien en caso de mezclas de perfiles genéticos.
El presente estudio tenía por objeto comprobar si la metodología de trabajo en la recogida y la manipulación de las muestras de cuatro equipos forenses podía generar algún tipo de contaminación en un conjunto de muestras cuya principal característica era la procedencia de un solo donante y la alta cantidad de depósito de ADN que en ellas había. Además de la metodología considerada correcta a juicio de cada equipo forense, se implementaron otras dos incorrectas con las que se pretendía forzar la aparición de contaminaciones por transferencia directa o indirecta, y de esa forma conocer el grado de facilidad con que podría ocurrir un fenómeno de este tipo sin que fuese detectado.
Por otra parte, se pretendía comprobar la existencia de background residual de ADN en las salas de trabajo de los equipos forenses y en el material utilizado durante las labores de manipulación y etiquetado de las muestras, y los rangos de cantidad de ADN en los que se encontraba dicha contaminación, así como su posible interferencia en la interpretación de los perfiles genéticos.
En lo referente al contacto entre prendas en condiciones de alta humedad y la posible transferencia de fluidos, concretamente esperma y sangre, los datos de las pruebas preliminares fueron positivos, indicando la presencia de sangre y esperma, en concreto de hemoglobina y proteína p30, por lo que en las 48 horas de contacto en alta humedad sí ocurrieron fenómenos de transferencia por contacto primario. Estos depósitos aportaron resultados de cuantificación y de amplificación de ADN negativos, que en algún caso pudieron transferir muy escasa cantidad de ADN, que nunca interferiría la interpretación clara del perfil del donante. Así pues, la transferencia de fluido en condiciones de alta humedad es factible, si bien no puede afirmarse que suponga una contaminación segura del tejido de depósito y mucho menos en condiciones de lograr una identificación genética o una dificultad en la interpretación de los resultados.
El estudio de los electroferogramas permite detectar picos alélicos con alturas superiores a 150 rfu, lo que implica que en caso de muestras complejas con escasa cantidad de ADN, tanto de perfiles individuales como de mezclas, podrían alterar gravemente el resultado observado y conducir a errores en la interpretación de los perfiles. Este punto resulta de crucial importancia para los analistas de los laboratorios de genética forense cuando trabajan con muestras en condiciones LCN, puesto que deben realizar interpretaciones de los resultados desde una perspectiva estrictamente conservadora y siempre en el contexto de la posible contaminación de las muestras. La interpretación de este tipo de muestras LCN y su presentación ante los tribunales de justicia es quizás uno de los puntos más controvertidos de los sistemas forenses de análisis de ADN en la actualidad, lo que exige una alta capacitación técnica por parte de los expertos analistas.
En lo referente a la mala praxis en el manipulado de las muestras y la posible contaminación por el personal de los equipos forenses, no puede apreciarse una contaminación genética del personal que manipula las muestras, ni de tipo primario por contacto durante las labores de manipulado ni por background residual de su propio ADN en las salas de trabajo. Incluso con la metodología de trabajo muy incorrecta, en la que no se incluyen medidas de prevención y se fuerza la ocurrencia de la contaminación, no han podido apreciarse de forma significativa picos alélicos que pudiesen haber dificultado la interpretación de los perfiles genéticos.
La presencia de ADN detectado y amplificado no ha aportado contribuyentes ajenos a lo esperado en cantidades apreciables; todos los picos alélicos ajenos podrían ser descartados sin dificultad como artefactos, por lo que puede concluirse que resulta difícil obtener una contaminación residual por mala praxis en muestras de la tipología empleada en la matriz del presente trabajo.
El tercer punto de estudio se centraba en el análisis de muestras del material de trabajo propio de las instalaciones de cada unidad de manipulación de evidencias. En este caso sí se ha apreciado la existencia de cantidades residuales de ADN en el material de oficina (bolígrafos) y en las mesetas de trabajo de los equipos forenses que han participado, observando en alguno de los casos altas o muy altas cantidades de ADN que suponen focos de contaminación por transferencia directa con altísima probabilidad.
Se trata de circunstancias puntuales y con cantidades que demuestran la existencia de background residual de ADN, que deberían ser conocidas por los miembros de los equipos forenses.
Sólo en uno de los casos, concretamente en la muestra M1 con método muy incorrecto del equipo forense A, se detectó una transferencia de componentes alélicos del forense varón A hacia la muestra, sangre humana en soporte de torunda de algodón, si bien las cantidades eran tan escasas que nunca dificultarían la lectura del perfil mayoritario, pero sí obligarían a los analistas a informar sobre la presencia de una mezcla forense cuando la muestra era claramente sangre. En el resto de los resultados no se detectaron contaminaciones de ADN de las muestras en estudio con los perfiles genéticos de los manipuladores.
Puede concluirse que la contaminación de muestras o evidencias por mala praxis o contacto por manipulación indebida es altamente improbable en el abanico de muestras utilizado, con grandes cantidades de ADN y con perfiles individualizados. De igual forma, debemos concluir que la contaminación residual existente en las instalaciones de trabajo y en el material de oficina utilizado de las unidades manipuladores de las evidencias es muy escasa, y en ningún caso ha afectado a ninguna analítica ni ha interferido ningún análisis, si bien es de crucial importancia conocer su existencia y los puntos de depósito habituales, a los efectos de controlar su limpieza y esterilización, así como el conocimiento de estos depósitos por parte del personal técnico.
A modo de conclusión del estudio, resulta muy importante para los investigadores implicados en el procesado, la manipulación y el análisis de los vestigios de la escena de un delito implementar las siguientes rutinas:
- Metodología de prevención de manipulación de la escena del delito.
- Toma de muestras de background residual de ADN en la escena del delito, a modo de controles negativos para los análisis y su interpretación.
- Toma de muestras de background residual de las salas de trabajo y manipulado de muestras en los institutos de medicina legal y en los laboratorios de análisis genético, así como del material utilizado, a modo de controles negativos para los análisis y su interpretación.
- Toma de muestras de referencia de los perfiles genéticos de todo el equipo de técnicos que trabajen en contacto con las muestras y también en contacto con las salas o material de trabajo, incluyendo los servicios de limpieza y mantenimiento de las mismas.
- Introducción de los perfiles genéticos de referencia en las bases de datos de ADN en calidad de equipo técnico, al objeto de poder discriminar contaminaciones que no pudieran ser detectadas en ninguna de las fases previas.
- Metodologías de manipulado de las muestras y de análisis correctas, extremando las medidas de prevención y asepsia, minimizando las posibles transferencias primarias y secundarias.
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Raymond JJ, van Oorschot RA, Walsh SJ, Roux C. Trace DNA analysis: do you know what your neighbor is doing? A multi-jurisdictional survey. Forensic Sci Int Genet. 2008;2:19-28. [ Links ]
2. Wickenheiser, RA. Trace DNA: a review, discussion of theory, and application of the transfer of trace quantities of DNA through skin contact. J Forensic Sci. 2002;47(3):442-50. [ Links ]
3. McCartney C. LCN DNA: proof beyond reasonable doubt? Nat Rev Genet. 2009;9:325. [ Links ]
4. Budowle B, Eisenberg AJ, Van Daal A. Low copy number has yet to achieve general acceptance. Forensic Sci Int Genet Suppl Ser. 2009;2:551-2. [ Links ]
5. Gill P, Whitaker J, Flaxman C, Brown N, Buckleton J. An investigation of the rigor of interpretation rules for STRs derived from less tan 100 pg of DNA. Forensic Sci Int. 2000;112:17-40. [ Links ]
6. Whitaker JP, Cotton EA, Gill P. A comparison of the characteristics of profiles produced with the AmpFISTR SGM Plus multiplex system for both standard and low copy number (LCN) STR DNA analysis. Forensic Sci Int. 2001;123:215-23. [ Links ]
7. Raymond JJ, van Oorschot RA, Gunn PR, Walsh SJ, Roux C. Trace evidence characteristics of DNA: a preliminary investigation of the persistence of DNA at crime scenes. Forensic Sci Int Genet. 2009;4(1):26-33. [ Links ]
8. Using DNA to solve cold cases. Modern forensics can aid your investigation. Law Officer. 2008; Jul 11. [ Links ]
9. Raymond J, Roux C, Du Pasquier E, Sutton J, Lennard C. The effect of common fingerprint detection techniques on the DNA typing of fingerprints deposited on different surfaces. J Forensic Ident. 2004;54:22-44. [ Links ]
10. Van Oorschot RAH, Phelan DG, Furlong S, Scarfo GM, Holding NL, Cummins MJ. Are you collecting all the available DNA from touched objects? Int Congress Ser. 2003;1239:803-7. [ Links ]
11. Van Oorschot RAH, Weston R, Jones MK. Retrieval of DNA from touched objects. Proceedings of the 14th International Symposium on the Forensic Sciences of Australian and New Zealand Forensic Science Society. Adelaide: Oct 12-16, 1998. [ Links ]
12. Prinz M, Schiffner L, Sebestyen JA, Bajda E, Tamariz J, Shaler RC, et al. Maximization of STR DNA typing success for touched objects. Int Congress Ser. 2006;1288:651-3. [ Links ]
13. Gill P. Application of low copy number DNA profiling. Croat Med J. 2001;42:229-32. [ Links ]
14. Toothman MH, Kester KM, Champagne J, Cruz TD, Street Ws, Brown BL. Characterisation of human DNA in environmental samples. Forensic Sci Int. 2008;178:7-15. [ Links ]
15. Cook O, Dixon L. The prevalence of mixed DNA profiles in fingernail samples taken from individuals in the general population. Forensic Sci Int Genet. 2007;1:62-8. [ Links ]
16. Rutty GN, Hopwood A, Tucker V. The effectiveness of protective clothing in the reduction of potential DNA contamination of the scene crime. Int J Leg Med. 2003;117:170-4. [ Links ]
17. Rutty GN. Human DNA contamination of mortuaries: does it matter? Journal Pathol. 2000;190:410-1. [ Links ]
18. Schwark T, Poetsch M, Preusse-Prange A, Kamphausen T, von Wurmb-Schwark N. Phantoms in the mortuary - DNA transfer during autopsies. Forensic Sci Int. 2012;216:121-6. [ Links ]
19. Hunter P. Anything you touch may be used against you. Embo Rep. 2010;11:424-7. [ Links ]
20. Time Magazine Online. Germany's phantom serial killer: a DNA blunder. 2009. Disponible en: http://www.time.com/time/world/article/0,8599,1888126,00.html. [ Links ]
21. Sullivan K, Johnson P, Rowlands D, Allen H. New developments and challenges in the use of the UK database: addressing the issue of contaminated consumables. Forensic Sci Int. 2004;146(Suppl):S175-6. [ Links ]
22. Poy AL, Van Oorschot RAH. Trace DNA presence, origin and transfer within a forensic biology laboratory and its potential effect on casework. J Forensic Ident. 2006;56:558-76. [ Links ]
23. Van Oorschot RAH, Jones MK. DNA fingerprints from fingerprints. Nature. 1997;387:767. [ Links ]
24. Locard E. The analysis of dust traces. Part I. Am J Polit Scie. 1930;1:276-98. [ Links ]
25. Lowe A, Murray C, Whitaker J, Tully G, Gill P. The propensity of individuals to deposit DNA and secondary transfer of low level DNA from individuals to inert surfaces. Forensic Sci Int. 2002;129:25-34. [ Links ]
26. Wiegand P, Heimbold C, Klein R, Immel U, Stiller D, Klintschar M. Transfer of biological stains from different surfaces. Int J Legal Med. 2011;125(5):727-31. [ Links ]
27. Goray M, Eken E, Mitchell RJ, van Oorschot RA. Secondary DNA transfer of biological substances under varying test conditions. Forensic Sci Int Genet. 2010;4:62-7. [ Links ]
28. Kamphausen T, Fandel SB, Gutmann JS, Bajanowski T, Poetsch M. Everything clean? Transfer of DNA traces between textiles in the washtub. Int J Legal Med. 2015;129:709-14. [ Links ]
29. Meakin G, Jamieson A. DNA transfer: review and implications for casework. Forensic Sci Int Genet. 2013;7:434-43. [ Links ]
30. Van Oorschot RA, Ballantyne KN, Mitchell RJ. Forensic trace DNA: a review. Investig Genet. 2010;1:14. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Luis Hombreiro
E-mail: j31977@gmail.com
Fecha de recepción: 03.NOV.2015
Fecha de aceptación: 20.NOV.2015