Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.28 no.2 Pamplona may./ago. 2005
REVISIONES
El ensayo de micronúcleos como medida de inestabilidad genética inducida por agentes genotóxicos
The cytogenetic assay as a measure of genetic instability induced by genotoxic agents
M. Zalacain1, L. Sierrasesúmaga2, A. Patiño1
| RESUMEN La integridad genética de la población humana se encuentra comprometida por la gran actividad industrial; por lo que es importante determinar qué se conoce como un nivel aceptable de daño genético y realizar ensayos de genotoxicidad de manera rutinaria en poblaciones de riesgo. Los micronúcleos son cuerpos citoplasmáticos de naturaleza nuclear, se corresponden con material genético no incorporado correctamente a las células hijas durante la división celular, reflejan aberraciones cromosómicas y se originan por roturas cromosómicas, por errores durante la replicación y posterior división celular del ADN y/o por la exposición a agentes genotóxicas. Existen factores capaces de influir o modificar el número de micronúcleos presentes en una célula (edad, género, vitaminas, tratamientos médicos, exposición diaria a agentes genotóxicos, etc.). Palabras clave. Micronúcleos. Aberraciones cromosómicas. Agentes genotóxicos. Inestabilidad genética. | ABSTRACT Human genetic integrity is compromised by the intense industrial activity, which emphasizes the importance to determine an acceptable genetic damage level and to carry out routine genotoxicity assays in the populations at risk. Key words. Micronuclei. Chromosomal aberrations. Genotoxic agenets. Genetic instability. |
| 1. Laboratorio de Pediatría. Universidad de Navarra. Pamplona. 2. Departamento de Pediatría. Clínica Universitaria de Navarra. Pamplona. Este trabajo ha sido parcialmente financiado por una ayuda concedida por la Fundación Echébano. Aceptado para su publicación el 25 de mayo de 2005 | Correspondencia: Marta Zalacain Díez Laboratorio de Pediatría Edificio Los Castaños Universidad de Navarra Irunlarrea, s/n 31080 Pamplona Tfno.: 948 425600 Ext: 6304 Fax: 948 425649 E-mail: mzaldie@alumni.unav.es |
INTRODUCCIÓN
En las últimas décadas, la integridad genética de la población humana se ha visto comprometida por la gran actividad industrial, que provoca la exposición a productos químicos y agentes genotóxicos. Además, existen otros factores capaces de influir en la integridad cromosómica tales como el estilo de vida, los cambios climáticos (debido al progresivo debilitamiento de la capa de ozono), los tratamientos médicos, algunos polimorfismos genéticos, etc. Es importante, por todo ello, determinar qué se conoce como un nivel aceptable de daño genético en una población concreta, realizar ensayos de genotoxicidad de manera rutinaria y monitorizar aquellos individuos que, por su ocupación laboral o estilo de vida, se encuentran más expuestos o con mayor riesgo de sufrir alteraciones capaces de modificar su estabilidad genética1. Con esta finalidad se desarrolló el ensayo citogenético de micronúcleos, capaz de detectar indirectamente rotura o pérdida cromosómica y que actualmente se encuentra en gran auge dada su utilización en líneas de investigación sobre mutagénesis, para conocer in vitro el efecto genotóxico de nuevos agentes químicos tanto a nivel ambiental con nuevos plaguicidas y pesticidas, como en el ámbito sanitario con la utilización de nuevas drogas citostáticas en los tratamientos antitumorales2.
En el caso concreto de los compuestos tóxicos del tabaco, su capacidad carcinogénica depende fundamentalmente de la activación de los componentes neutros de la fase particulada por enzimas halladas en múltiples tejidos, siendo los compuestos más importantes los benzopirenos y dibenzoantracenos. Una vez activadas, estas moléculas tóxicas por sí mismas o alguno de sus metabolitos reactivos forman uniones covalentes de alta afinidad con el material genético, dando lugar a la formación de aductos3-5.
Las enzimas implicadas en el metabolismo y detoxificación de los compuestos tóxicos se clasifican en enzimas de fase I o de fase II. Como resultado de las diversas reacciones de oxidación catalizadas por las enzimas de la fase I, muchos productos son transformados en intermediarios de naturaleza electrofílica muy reactivos capaces de atacar rápidamente a moléculas celulares nucleofílicas, como proteínas y ácidos nucleicos (Fig. 1). Estas sustancias de naturaleza electrofílica también pueden proceder de procesos endógenos como la respiración o la inflamación. Existen varios sistemas de detoxificación y eliminación que participan en la protección frente a estos agentes tóxicos, uno de los más eficientes en la eliminación de electrófilos es el del glutation reducido (GSH) y glutation transferasa (GST)6. En la actualidad se sabe que la variabilidad genética en las enzimas de estas superfamilias está implicada en la susceptibilidad individual a sufrir diferentes tipos de tumores.
Una medida de inestabilidad genética inducida por compuestos genotóxicos, además de la presencia de mutaciones en genes diana asociados con el hábito fumador, es el incremento en la formación de micronúcleos, visibles fácilmente en cultivos celulares humanos.
MÉTODO DE MEDIDA DE INESTABILIDAD GENÉTICA: ENSAYO DE MICRONÚCLEOS
Durante la división celular el material genético (ADN) contenido en el núcleo celular se replica y divide equitativamente dando lugar a dos células hijas idénticas; este proceso puede producirse de manera errónea debido a errores durante la replicación y posterior división del ADN, a roturas cromosómicas y al efecto de la radiación y de sustancias genotóxicas, produciéndose pérdida cromosómica y haciendo que el reparto del material genético no sea equitativo. Cuando esto ocurre, el material genético que se desprende y que, por tanto, queda excluido y no se incorpora correctamente al núcleo de la célula hija, origina un nuevo núcleo de menor tamaño que el primario denominado micronúcleo (MN), visible fácilmente al microscopio óptico7. El material genético desprendido puede derivar de cromosomas enteros o, más frecuentemente, de fragmentos cromosómicos acéntricos que quedan excluidos de los núcleos de las nuevas células durante anafase mitótica.
El uso de la técnica del recuento de MN como medida de daño cromosómico sobre cultivos de linfocitos humanos fue propuesta por primera vez por Countryman y Heddle en 1976, cuyo único requisito era la elección de tipos celulares con gran actividad mitótica8. Más tarde, en 1985, el ensayo de genotoxicidad fue mejorado por Fenech y Morley, consiguiendo frenar el proceso de división celular cuando la célula sólo hubiese sufrido una división mitótica, para ello desarrollaron la técnica del bloqueo de la citocinesis (CBMN: cytokinesis-block micronucleus) cuyo fundamento es la utilización de un agente químico denominado citocalasina-B cuya función es impedir la citocinesis celular (Fig. 2)9.
La citocalasina-B es una molécula aislada del hongo Helminthosporum dematoideum, que inhibe la polimerización de actina, impidiendo la citocinesis al imposibilitar la creación del anillo contráctil, constituido por microfilamentos de actina y miosina, necesario para la partición celular en telofase mitótica. Esta molécula no afecta a las fibras del huso ni a la división del núcleo, por lo que origina células binucleadas y que han sufrido una sola división1,10.
El año 1999 fue crucial para el ensayo de MN, ya que la técnica fue validada a nivel mundial y considerada como un biomarcador efectivo de daño en el ADN. Para la validación se creó un programa internacional de micronúcleos humanos (HUMN: HUman MicroNucleus Project), diseñado por Michael Fenech y Stefano Bonassi con el fin de recopilar las frecuencias basales de MN obtenidas en diferentes laboratorios y poblaciones del mundo [http://ehs.sph.berkeley.edu/holland/humn/]. El principal objetivo consistió en identificar las fuentes y niveles de variabilidad capaces de influir en la frecuencia basal de micronúcleos en linfocitos humanos, comparar las distintas técnicas utilizadas para definir un protocolo estándar y realizar así un estudio prospectivo por parte de todos los laboratorios implicados e incluso intentar establecer una asociación entre la frecuencia de MN y enfermedades como el cáncer7,11.
Metodología del ensayo de micronúcleos
El protocolo básico para el recuento de MN en sangre periférica consiste en el aislamiento de los linfocitos mediante una centrifugación en gradiente. Se realiza el recuento celular y siembra de 0,5x106 células/mL, que crecen en suspensión en medio de cultivo RPMI 1.640 suplementado con suero fetal bovino, penicilina/estreptomicina y con fitohemaglutinina y se incuban durante 44 horas en estufa a 37ºC y 5% CO2 para favorecer la proliferación celular (Fig. 3). La muestra de inicio también puede ser sangre total, células exfoliadas de la mucosa oral o cualquier otro tipo celular con actividad mitótica con algunas variaciones en el protocolo. Posteriormente y tras 44 horas, el cultivo celular se somete a la acción de la citocalasina-B. Una vez bloqueada la mitosis y unas 72 horas tras la siembra (28 horas tras el bloqueo) se lleva a cabo el cosechado celular que consiste en someter a las células a un choque hipotónico favoreciendo que se hinchen los citoplasmas por un proceso osmótico donde la concentración de iones del medio es menor que la que la del interior de la célula. Se fijan las células con una solución fresca de metanol: ácido acético glacial (6:1 ó 24:1), se tiñen las preparaciones con Giemsa durante 5 a 10 min y se visualizan al microscopio óptico. El recuento de MN se debe realizar sobre 1.000 células binucleadas por cultivo e individuo.
Criterios de selección
Se han descrito criterios de selección para reconocer tanto las células en las que se va a realizar el recuento, como criterios para seleccionar los MN que presenten las características necesarias para ser reconocidos como tales y que el recuento realizado sea fiable y objetivo10,12.
Los criterios de selección de las células binucleadas (BN) y de los MN se recogen en detalle en http://ehs.sph.berkeley.edu/holland/humn/projects/lymphocytes/variability y de forma resumida en la tabla 1.
Aunque en teoría los linfocitos en cultivo se dividan de forma sincronizada, en la práctica no ocurre de forma idéntica en todas las células del cultivo, de manera que se pueden encontrar en un mismo cultivo celular células mono, bi y multinucleadas, células en vías de apoptosis y necrosis (Fig. 4).
Por ello es necesario conocer también las características de células en vías de apoptosis y necrosis para que sean eliminadas del recuento, ya que sólo deben incluirse las células viables. Las células en vías de apoptosis se caracterizan por presentar cromatina condensada, que en etapas tempranas de apoptosis puede manifestarse como cromatina marginal y que más tarde, conforme avanza el proceso apoptótico, culmina en la fragmentación del material nuclear, quedando éste disperso en el citoplasma y reflejándose en una tinción más oscura con respecto a la habitual. En el caso de fenómenos necróticos, las células que los sufren muestran citoplasmas pálidos, presencia de vacuolas que se localizan principalmente en el citoplasma, daño evidente en la membrana citoplasmática con núcleos intactos en etapas tempranas de necrosis; en cambio las células en estados avanzados del proceso necrótico muestran pérdida del citoplasma y daño irregular en la membrana nuclear con sólo una parte de la estructura nuclear intacta. Las condiciones óptimas en un ensayo de MN requieren un porcentaje de células binucleadas entre 35-60% sobre 500 células viables10.
Factores de variabilidad
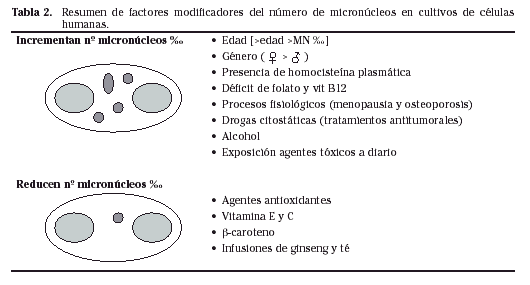
Existen diversos factores que pueden influir en la frecuencia basal de MN; la edad ha sido ampliamente estudiada, relacionándose mayor edad con mayor índice de MN11,13,14. En el caso del análisis del género, las mujeres presentan una frecuencia basal superior a la de los hombres y el número de MN incrementa cuando se superan los 35 años de edad. La presencia de homocisteína en plasma, el déficit de folato y vitamina B12 conducen a un incremento de la frecuencia basal de MN1,7,15(Tabla 2).
En el caso de las mujeres, la entrada en la menopausia y el posible desarrollo de osteoporosis se relacionan con un mayor índice de MN16. Otros estudios relacionan un descenso del número de MN al suplementar la dieta con agentes antioxidantes como la vitamina E, vitamina C, β-caroteno, ginseng e incluso infusiones de té17-19.
Utilidad del ensayo de micronúcleos como medida de inestabilidad genética
Diversos estudios se han centrado en el estudio de las drogas citostáticas utilizadas en los protocolos antitumorales en pacientes con cáncer, cuya acción está dirigida a frenar la proliferación celular. La exposición reiterada a agentes citostáticos puede causar efectos adversos tales como mutaciones, inmunotoxicidad y cáncer debido a que pueden inducir daños genéticos y alterar los mecanismos de división en células que se multiplican rápidamente. El resultado de estos trabajos demostró que los complejos químicos utilizados incrementan de modo significativo el número de MN13,20.
También se ha demostrado que trabajadores de las zonas hospitalarias o de fábricas cuya labor diaria les hace estar sometidos a la exposición de agentes tóxicos, presentan una mayor frecuencia de MN13,21-23. El ensayo de MN también ha sido aplicado para conocer el efecto de determinados pesticidas y plaguicidas, productos químicos considerados de riesgo para los seres vivos; existen estudios tanto con ratones como con humanos donde se demuestra el efecto potenciador de estos productos sobre el índice de MN24,25.
Con respecto al efecto de los metabólitos tóxicos del tabaco medido mediante el ensayo de MN existe una gran controversia, ya que varios trabajos han demostrado que el hábito fumador no se veía reflejado en la frecuencia de MN frente a grupos controles no fumadores14,22,26. Al contrario, varias publicaciones han detectado diferencias entre grupos de fumadores y no fumadores: en un estudio realizado en personas expuestas a bajas dosis de radiación por su actividad laboral se observaron frecuencias de MN significativamente incrementadas en el grupo de personas expuestas a radiación que fumaban frente a los no fumadores expuestos23.
En otro estudio se observó un ligero aumento en el número de MN del grupo fumador frente al no fumador y una clara asociación entre años de consumo de tabaco e incremento de la frecuencia de MN27. En el mismo año se realizó otro estudio donde concluyeron que la frecuencia de células micronucleadas en el grupo de fumadores era 70% más alta que el observado en el grupo de no fumadores28. El mismo resultado fue observado por otros autores quienes concluyeron que el consumo de alcohol sumado al hecho de ser fumador activo incrementaba significativamente el número de MN y además, el consumo de té disminuía el número de MN producidos por el hábito fumador29.
Dos estudios en años consecutivos volvieron a demostrar el incremento de la frecuencia de MN en los grupos fumadores siendo el índice de MN 25% mayor que el de los grupos no fumadores30,31.
En un último estudio, en el que intervinieron las 24 bases de datos implicadas en el proyecto HUMN, se ratificó la gran controversia y disparidad de los resultados con respecto al hábito fumador y su implicación en la formación de MN.
La mayoría de los laboratorios demostraron que no existían diferencias entre el grupo de fumadores y no fumadores; un único laboratorio encontró diferencias significativas entre ambos grupos y otros dos relacionaron el hecho de ser fumador con una disminución significativa en la frecuencia de MN. Por último, la conclusión extraída por la mayoría de laboratorios fue que los fumadores habituales que consumían 30 o más cigarros/día y que no estaban expuestos a ningún otro agente tóxico externo manifestaban un incremento significativo en el número de MN; un estudio más reciente obtuvo las mismas conclusiones siendo el corte de consumo de tabaco 20 cigarros/día32-34. En la actualidad, la aplicación de técnicas de hibridación in situ con fluorescencia (FISH) permite la identificación del origen de los MN, permitiendo determinar con precisión el efecto clastogénico y/o aneugénico de cualquier agente genotóxico35.
CONCLUSIONES
El ensayo de MN es una alternativa al test de aberraciones cromosómicas convencional, en el que se analizan las alteraciones presentes en metafases mitóticas y permite detectar aberraciones cromosómicas que responden a alteraciones de tipo estructural (efecto clastogénico) o alteraciones numéricas (efecto aneugénico) del agente en estudio.
Además, con el ensayo de MN se consigue36-39:
a)Reducir la dificultad a la hora de realizar el recuento.
b)Mejorar la sensibilidad del ensayo, ya que los MN sólo se cuentan en células que han completado una división nuclear.
c)Incrementar la potencia estadística de los estudios al analizar miles de células en lugar de cientos de ellas.
d)Reducir el coste del ensayo.
El ensayo de MN es, por tanto, un ensayo práctico, universalmente validado y accesible tecnológicamente, útil para evaluar la inestabilidad genética inducida por agentes genotóxicos.
BIBLIOGRAFÍA
1.Fenech M. The cytokinesis-block micronucleus technique: a detailed description of the method and its application to genotoxicity studies in human populations. Mutat Res 1993; 285: 35-44 [ Links ]
2.Kirsch-Volders M, Fenech M. Inclusion of micronuclei in non-divided mononuclear lymphocytes and necrosis/apoptosis may provide a more comprehensive cytokinesis block micronucleus assay for biomonitoring purposes. Mutagenesis 2001; 16: 51-58 [ Links ]
3.Hainaut P, Pfeifer GP. Patterns of p53 G>T transversions in lung cancers reflect the primary mutagenic signature of DNA-damage by tobacco smoke. Carcinogenesis 2001; 22: 367-374 [ Links ]
4.Hussain SP, Amstad P, Raja K, Sawyer M, Hofseth L, Shields PG et al. Mutability of p53 hotspot codons to benzo(a)pyrene diol epoxide (BPDE) and the frequency of p53 mutations in nontumorous human lung. Cancer Res 2001; 61: 6350-6355 [ Links ]
5.Matter B, Wang G, Jones R, Tretyakova N. Formation of diastereomeric benzo[a]pyrene diol epoxide-guanine adducts in p53 gene-derived DNA sequences. Chem Res Toxicol 2004; 17: 731-741. [ Links ]
6.Hayashi S, Watanabe J, Kawajiri K. High susceptibility to lung cancer analyzed in terms of combined genotypes of P450IA1 and Mu-class glutathione S-transferase genes. Jpn J Cancer Res 1992; 83: 866-870 [ Links ]
7.Fenech M, Holland N, Chang WP, Zeiger E, Bonassi S. The HUman MicroNucleus ProjectAn international collaborative study on the use of the micronucleus technique for measuring DNA damage in humans. Mutat Res 1999; 428: 271-283 [ Links ]
8.Countryman PI, Heddle JA. The production of micronuclei from chromosome aberrations in irradiated cultures of human lymphocytes. Mutat Res 1976; 41: 321-332 [ Links ]
9.Fenech M, Morley AA. Measurement of micronuclei in lymphocytes. Mutat Res 1985; 147: 29-36 [ Links ]
10.Fenech M. The in vitro micronucleus technique. Mutat Res 2000; 455: 81-95 [ Links ]
11.Bonassi S, Fenech M, Lando C, Lin YP, Ceppi M, Chang WP et al. HUman MicroNucleus project: international database comparison for results with the cytokinesis-block micronucleus assay in human lymphocytes: I. Effect of laboratory protocol, scoring criteria, and host factors on the frequency of micronuclei. Environ Mol Mutagen 2001; 37: 31-45 [ Links ]
12.Fenech M, Chang WP, Kirsch-Volders M, Holland N, Bonassi S, Zeiger E. HUman MicronNucleus project. HUMN project: detailed description of the scoring criteria for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures. Mutat Res 2003; 534: 65-75 [ Links ]
13.Migliore L, Guidotti P, Favre C, Nardi M, Sessa MR, Brunori E. Micronuclei in lymphocytes of young patients under antileukemic therapy. Mutat Res 1991; 263: 243-248 [ Links ]
14.Bukvic N, Gentile M, Susca F, Fanelli M, Serio G, Buonadonna L et al. Sex chromosome loss, micronuclei, sister chromatid exchange and aging: a study including 16 centenarians. Mutat Res 2001; 498: 159-167 [ Links ]
15.Fenech M, Crott JW. Micronuclei, nucleoplasmic bridges and nuclear buds induced in folic acid deficient human lymphocytes-evidence for breakage-fusion-bridge cycles in the cytokinesis-block micronucleus assay. Mutat Res 2002; 504: 131-136 [ Links ]
16.Landi S, Iazzolino E, Barale R. Are baseline frequencies of SCEs, CAs, and MN in human lymphocytes related to hematological values? Mutat Res 2000; 469: 159-166 [ Links ]
17.Xue KX, Wang S, Ma GJ, Zhou P, Wu PQ, Zhang RF et al. Micronucleus formation in peripheral-blood lymphocytes from smokers and the influence of alcohol- and tea-drinking habits. Int J Cancer 1992; 50: 702-705 [ Links ]
18.Lee BM, Lee SK, Kim HS. Inhibition of oxidative DNA damage, 8-OHdG, and carbonyl contents in smokers treated with antioxidants (vitamin E, vitamin C, beta-carotene and red ginseng). Cancer Lett 1998; 132: 219-227 [ Links ]
19.Lee TK, Allison RR, OBrien KF, Khazanie PG, Johnke RM, Brown R et al. Ginseng reduces the micronuclei yield in lymphocytes after irradiation. Mutat Res 2004; 557: 75-84 [ Links ]
20.Jagetia GC, Jayakrishnan A, Fernandes D, Vidyasagar MS. Evaluation of micronuclei frequency in the cultured peripheral blood lymphocytes of cancer patients before and after radiation treatment. Mutat Res 2001; 491: 9-16 [ Links ]
21.Yager JW, Sorsa M, Selvin S. Micronuclei in cytokinesis-blocked lymphocytes as an index of occupational exposure to alkylating cytostatic drugs. IARC Sci Publ 1988; 89: 213-216 [ Links ]
22.Bolognesi C, Perrone E, Landini E. Micronucleus monitoring of a floriculturist population from western Liguria, Italy. Mutagenesis 2002; 17: 391-397 [ Links ]
23.Maffei F, Angelini S, Forti GC, Lodi V, Violante FS, Mattioli S et al. Micronuclei frequencies in hospital workers occupationally exposed to low levels of ionizing radiation: influence of smoking status and other factors. Mutagenesis 2002; 17: 405-409 [ Links ]
24.Lucero L, Pastor S, Suárez S, Durbán R, Gómez C, Parrón T et al. Cytogenetic biomonitoring of Spanish greenhouse workers exposed to pesticides: micronuclei analysis in peripheral blood lymphocytes and buccal epithelial cells. Mutat Res 2000; 464: 255-262 [ Links ]
25.Siu WH, Mak E, Cao J, De Luca-Abbott SB, Richardson BJ, Lam PK. Micronucleus induction in gill cells of green-lipped mussels (Perna viridis) exposed to mixtures of polycyclic aromatic hydrocarbons and chlorinated pesticides. Environ Toxicol Chem 2004; 23: 1317-1325. [ Links ]
26.Barale R, Chelotti L, Davini T, Del Ry S, Andreassi MG, Ballardin M et al. Sister chromatid exchange and micronucleus frequency in human lymphocytes of 1,650 subjects in an Italian population: II. Contribution of sex, age, and lifestyle. Environ Mol Mutagen 1998; 31: 228-242 [ Links ]
27.Au WW, Walker DM, Ward JB Jr, Whorton E, Legator MS, Singh V. Factors contributing to chromosome damage in lymphocytes of cigarette smokers. Mutat Res 1991; 260: 137-144 [ Links ]
28.Tomanin R, Ballarin C, Nardini B, Mastrangelo G, Sarto F. Influence of smoking habit on the frequency of micronuclei in human lymphocytes by the cytokinesis block method. Mutagenesis 1991; 6: 123-126 [ Links ]
29.Xue KX, Wang S, Ma GJ, Zhou P, Wu PQ, Zhang RF et al. Micronucleus formation in peripheral-blood lymphocytes from smokers and the influence of alcohol- and tea-drinking habits. Int J Cancer 1992; 50: 702-705 [ Links ]
30.Ganguly BB. Cell division, chromosomal damage and micronucleus formation in peripheral lymphocytes of healthy donors: related to donors age. Mutat Res 1993; 295: 135-148 [ Links ]
31.Di Giorgio C, De Meo MP, Laget M, Guiraud H, Botta A, Dumenil G. The micronucleus assay in human lymphocytes: screening for interindividual variability and application to biomonitoring. Carcinogenesis 1994; 15: 313-317 [ Links ]
32.Bonassi S, Neri M, Lando C, Ceppi M, Lin YP, Chang WP et al. Effect of smoking habit on the frequency of micronuclei in human lymphocytes: results from the Human MicroNucleus project. Mutat Res 2003; 543: 155-166 [ Links ]
33.Wu PA, Loh CH, Hsieh LL, Liu TY, Chen CJ, Liou SH. Clastogenic effect for cigarette smoking but not areca quid chewing as measured by micronuclei in exfoliated buccal mucosal cells. Mutat Res 2004; 562: 27-38 [ Links ]
34.De la Chica RA, Ribas I, Giraldo J, Egozcue J, Fuster C. Chromosomal instability in amniocytes from fetuses of mothers who smoke. JAMA 2005; 293: 1212-1222 [ Links ]
35.Kirsch-Volders M, Vanhauwaert A, De Boeck M, Decordier I. Importance of detecting numerical versus structural chromosome aberrations. Mutat Res 2002; 504: 137-148 [ Links ]
36.Marzin D. The position of the in vitro micronucleus test within the battery of screening for genotoxic potential determination and the regulatory guidelines. Mutat Res 1997; 392: 175-181 [ Links ]
37.Serrano-García L, Montero-Montoya R. Micronuclei and chromatid buds are the result of related genotoxic events. Environ Mol Mutagen 2001; 38: 38-45 [ Links ]
38.Garriott ML, Phelps JB, Hoffman WP. A protocol for the in vitro micronucleus test. I. Contributions to the development of a protocol suitable for regulatory submissions from an examination of 16 chemicals with different mechanisms of action and different levels of activity. Mutat Res 2002; 517: 123-134 [ Links ]
39.Norppa H, Falck GC. What do human micronuclei contain? Mutagenesis 2003; 18: 221-233. [ Links ]