Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.29 supl.2 Pamplona may./ago. 2006
Trasplante de progenitores hemopoyéticos
Transplant of hemopoietic progenitors
J. J. Rifón
Servicio de Hematología y Área de Terapia Celular. Clínica Universitaria de Navarra. Pamplona.
Dirección para correspondencia
RESUMEN
En la segunda mitad del siglo XX el trasplante de progenitores hemopoyéticos ha pasado de ser un tratamiento desesperado con una alta incidencia de complicaciones que implicaba una elevada mortalidad, a ser un tratamiento curativo para miles de pacientes con neoplasias hematológicas y otras enfermedades. Desde entonces se han ampliado los conocimientos sobre las células madre hemopoyéticas, la sangre periférica ha sustituido a la médula ósea como fuente de progenitores, la sangre de cordón se ha establecido como fuente viable de progenitores, la realización de trasplantes no emparentados es una realidad para muchos pacientes. La mejora en los regímenes de acondicionamiento y la introducción de los regímenes no mieloablativos han disminuido las recaídas. Las nuevas técnicas diagnósticas y los nuevos tratamientos antimicrobianos han disminuido las complicaciones infecciosas y su mortalidad. Se han desarrollado los conocimientos en determinación de enfermedad mínima residual y el efecto antitumoral de los linfocitos del donante lo que ha permitido ampliar las indicaciones. Además, los nuevos conocimientos en la inmunobiología del trasplante han mejorado por un lado las opciones de controlar una de las principales complicaciones como es la enfermedad injerto contra huésped, y por otro un mejor aprovechamiento del efecto inmunoterápico del trasplante.
Palabras clave. Trasplante hematopoyético. Enfermedad injerto contra huésped. Efecto injerto contra tumor.ABSTRACT
In the second half of the XX century, the transplant of hemopoietic progenitors ceased to be a desperate treatment with a high incidence of complications implying a high mortality, and became a curative treatment for thousands of patients with hematological neoplasias and other diseases. Since then understanding of the hemopoietic stem cells has increased, peripheral blood has replaced bone marrow as a source of progenitors, cord blood has been established as a viable source of progenitors and the realisation of unrelated transplants is a reality for many patients. The improvement of conditioning regimes and the introduction of new non-myeloablative treatments have reduced relapses. The new diagnostic techniques and the new anti-microbial treatments have reduced infectious complications and their mortality. There has been an advance in knowledge in determining minimal residual disease and the anti-tumour effect of the lymphocytes of the donor, which has made it possible to widen the indications. Besides, new understanding of the immunobiology of the transplant has, on the one hand, improved the options for controlling one of the principal complications, the graft-versus-host disease, and, on the other, a better use is made of the immunotherapeutic effect of the transplant.
Key words. Hemopoietic transplant. Graft versus host disease. Graft versus tumor effect.
Introducción
El sistema hematopoyético es un órgano líquido, formado por una jerarquía de células, que tienen la capacidad de regenerar las células de origen linfoide y mieloide del organismo. Inicialmente el trasplante de células progenitoras hematopoyéticas fue concebido para rescatar la aplasia secundaria a dosis subletales de radioterapia y posteriormente para tratar leucemias después de un tratamiento intensivo con quimio y radioterapia.
El trasplante de progenitores hemopoyéticos (TPH) es una técnica terapéutica utilizada para regenerar el tejido hemopoyético cuya función es insuficiente, bien por una enfermedad primaria de la médula ósea o por haber recibido un tratamiento quimio y/o radioterápico intensivo. Los motivos, por tanto, para realizar un TPH serían la existencia de una enfermedad primaria del sistema hemopoyético (inmunodeficiencia, anemia aplásica, enfermedades congénitas,...) o la presencia de una enfermedad tumoral que sea curable con dosis muy altas de quimio/radioterapia, tratamiento que necesita rescate de la función hemopoyética.Historia
A finales del siglo pasado Brown-Sequard planteó la posibilidad de reconstituir la producción de células sanguíneas en casos de anemia con la administración de bazo, crudo o cocido, de animales. Tras el conocimiento de la función del tejido hematopoyético se planteó la sustitución directa de éste, así en 1939 se intentó la recuperación de la función hemopoyética en una paciente afectada de anemia aplásica secundaria al tratamiento con sales de oro, mediante la infusión de células de la sangre de un hermano. No fue hasta los años 50, que se confirmó la posibilidad real del trasplante hemopoyético, cuando se consiguió reconstituir la hematopoyesis en ratones sometidos a una dosis letal de irradiación, mediante la administración intravenosa de células hemopoyéticas de otro ratón1,2. Con este fundamento se llevó a cabo en 1957 el primer intento de trasplante hemopoyético en humanos, realizado a 6 trabajadores de una central nuclear de Yugoslavia que recibieron accidentalmente una dosis letal de irradiación3. Éste y otros intentos iniciales de trasplante fueron un fracaso hasta que se comprobó la importancia de la similitud de los antígenos de histocompatibilidad entre donante y receptor. A finales de los años 60 se empezaron a conseguir algunos resultados alentadores al ir mejorando las condiciones de los pacientes a los que se realizaba el trasplante, ya que previamente sólo se trasplantaban pacientes con enfermedad resistente o en fases muy avanzadas. Donnall Thomas es considerado el pionero del trasplante clínico y por ello recibió el premio Nobel en 1992; en 1957 publicó los primeros trasplantes en pacientes con leucemia aguda terminal, pero los pacientes fallecieron por fallo del injerto o progresión de la enfermedad, salvo uno que recibió un trasplante de un hermano gemelo y que tuvo una remisión de tres meses de duración4. En 1977, Thomas y su grupo5 publicaron una serie de 100 pacientes con leucemia aguda avanzada, tratados con irradiación corporal total y ciclofosfamida, que recibieron un trasplante alogénico de un hermano HLA idéntico, algunos de estos pacientes se curaron de su enfermedad. A partir de este momento comienza la expansión del trasplante hemopoyético, cuyas indicaciones se van ampliando y cuyos resultados van mejorando. Todo esto debido a una serie de avances que se van sucediendo en el tiempo de forma constante, en la tabla 1 se mencionan los logros más importantes.
Tipos de TPH
El trasplante hemopoyético exige como requisito imprescindible la obtención de células progenitoras que puedan regenerar la función medular tras ser trasplantadas a un paciente al que se ha suprimido su médula ósea. Los trasplantes se clasifican en varios tipos según el donante y según la fuente de células progenitoras. Tipos de trasplante según el donante: a)Trasplante singénico. Es el realizado entre hermanos gemelos univitelinos. Dada la total identidad antigénica no existirán problemas inmunológicos, ni rechazo ni enfermedad injerto contra huésped. Sin embargo, es un tipo de trasplante excepcional ya que es muy poco frecuente que un paciente tenga un hermano gemelo univitelino. b)Trasplante alogénico. Es el realizado entre dos individuos con diferencias genéticas, pero con la mayor identidad posible en los antígenos del sistema HLA. Existen varias posibilidades dentro del TPH alogénico:– Hermanos HLA idénticos: con total identidad en los HLA de clase I y clase II. Es la mejor situación, pero sólo un 25-30% de los pacientes tienen un hermano totalmente idéntico.
– Hermanos u otros familiares no totalmente idénticos: con disparidad en 1 ó 2 locus. Existe un aumento de complicaciones por mayor incidencia de EICH. – Donantes haploidénticos: comparten un haplotipo del HLA con el paciente, generalmente son el padre o la madre. Tienen un riesgo mucho mayor de EICH por lo que se realizan con depleción de linfocitos T como profilaxis. – Donantes no emparentados: obtenidos a partir de los diversos registros internacionales de donantes de médula ósea, tienen que ser idénticos en todos los locus del HLA y aún así tienen mayor riesgo de complicaciones.
El trasplante alogénico fue posible gracias a la identificación y descripción del sistema HLA, el complejo mayor de histocompatibilidad6. Los genes del HLA se encuentran en el cromosoma 6 y se heredan como haplotipos, de forma que la probabilidad de ser HLA idénticos de 2 hermanos es del 25%, incluyendo otros familiares o disparidades menores se considera posible encontrar un donante familiar compatible en un tercio de los pacientes. En las últimas décadas se están utilizando cada vez más donantes no familiares, actualmente hay más de 10 millones de donantes voluntarios en los registros, y es posible encontrar un donante para la mayoría de los pacientes7. También se ha mejorado en los trasplantes de donantes parcialmente compatibles, como los trasplantes haploidénticos, generalmente con células de uno de los padres o hijos del paciente, y que explota un mecanismo de alorreactividad antitumoral diferente, el efecto de las células NK (natural killer). Se ha demostrado que cuando hay diferencia en los receptores de inhibición del efecto NK (KIRs) se estimula la alorreactividad NK, que facilita el injerto y reduce la incidencia de EICH y, al menos en el caso de la leucemia mieloide aguda, reduce las recaídas8.
c)Autotrasplante. Consiste en extraer y conservar células progenitoras del propio paciente, que le serán reinfundidas tras haberle sometido a tratamiento erradicativo de su enfermedad. Tiene el riesgo de que con el injerto se pueden reinfundir células tumorales contaminantes y no se puede emplear en pacientes con enfermedades primarias de la médula ósea. A diferencia del alotrasplante no tiene el inconveniente de la enfermedad injerto contra huésped, pero tampoco tiene la ventaja del efecto injerto contra tumor. Aunque se inició casi en paralelo al trasplante alogénico9, los primeros resultados frenaron su desarrollo hasta la mejoría de los tratamientos de quimioterapia, siendo actualmente el tratamiento de elección en algunas neoplasias hematológicas.
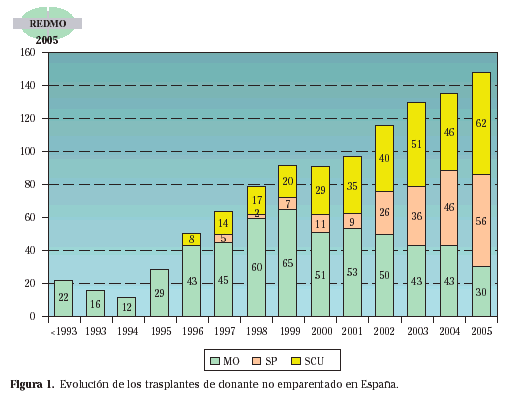
Tipos de trasplante según la fuente de progenitores: a)Médula ósea. Es la fuente original de las células progenitoras hematopoyéticas y la única utilizada durante mucho tiempo, pero cuya utilización está disminuyendo progresivamente al ser sustituida por la obtención de progenitores a partir de sangre periférica. La extracción se realiza en quirófano bajo anestesia general o epidural. Se practica una incisión de 2-3 cm sobre ambas crestas ilíacas posteriores y a través de ellas se punciona el hueso con un trócar especial y se aspira la médula con una jeringa. Generalmente se extraen entre 10 y 20 ml de médula por Kg. La cantidad total a extraer se calcula por el contaje celular que se realiza durante la extracción con el fin de obtener un número de células predeterminado, que normalmente es de 3 x 108 células/Kg de peso del paciente. b)Sangre periférica. En la sangre periférica en condiciones normales existe una mínima cantidad de células madre hematopoyéticas circulantes, que aumentan durante la fase de recuperación de una aplasia inducida por quimioterapia o tras la administración de diversos factores de crecimiento hemopoyético, el más utilizado es el G-CSF (Factor de crecimiento de colonias de granulocitos). Una vez conseguido el aumento de células progenitoras circulantes, se somete al paciente a sesiones de aféresis para obtener la fracción de células mononucleadas, en la que se encuentran las células CD34+ que son las utilizadas como referencia para el trasplante, recogiéndose entre 2 y 5 x 106 células CD34+/Kg de peso. La ventaja fundamental es que la recuperación hematológica es más rápida que con médula ósea y esto disminuye las complicaciones y los tiempos de hospitalización10. Es la fuente más utilizada en la actualidad; prácticamente todos los autotrasplantes se realizan con progenitores de sangre periférica, y aunque durante mucho tiempo se dudó de su utilidad en el trasplante alogénico, por el temor de que la mucho mayor dosis de linfocitos T del donante en las aféresis podría incrementar mucho el riesgo de EICH y las complicaciones del trasplante, diversos estudios randomizados han demostrado que los resultados son similares o mejores en la mayoría de los casos11. c)Cordón umbilical. Las células progenitoras hemopoyéticas obtenidas a partir de la sangre del cordón umbilical se utilizan desde el año 1988 para trasplantes alogénicos de donantes no emparentados12. La sangre de cordón umbilical es rica en progenitores hemopoyéticos, pero su volumen es limitado, lo que hace que el número total de células madre sea pequeño y la recuperación inmunohematológica lenta. Inicialmente se usó sólo en niños, por la menor dosis celular necesaria, pero actualmente se está utilizando con éxito en pacientes adultos13. Se obtiene por punción de la vena umbilical una vez producido el alumbramiento y recogiendo la sangre directamente en una bolsa con anticoagulante. La mejoría en los sistemas de recogida y el aumento del número de unidades almacenadas hace que el número de trasplantes realizados a partir de sangre de cordón umbilical aumente cada año. En la figura 1 se representa la evolución de este tipo de trasplantes en España.
Indicaciones del trasplante Hemopoyético
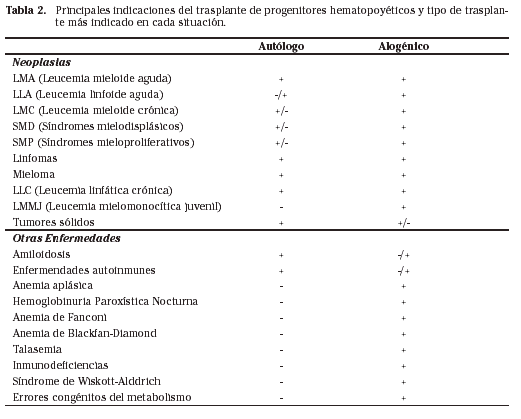
En la actualidad el trasplante hemopoyético es un tratamiento establecido en una serie de enfermedades hematológicas en las que se utiliza de forma habitual bien como tratamiento de primera línea o como tratamiento alternativo tras el fracaso de la terapia convencional. Existe otra serie de situaciones en las que la indicación del trasplante es clara, pero todavía no se ha demostrado una eficacia superior a otros tratamientos menos agresivos y costosos, por ello se considera que en estos casos el trasplante debe realizarse en el contexto de ensayos clínicos que permitan llegar a conclusiones respecto a su utilidad. Por último, en una serie de procesos el trasplante hemopoyético constituye un tratamiento experimental y sólo el tiempo y estudios prospectivos adecuados nos dirán si la indicación es correcta y en que momento se debe realizar el procedimiento. En la tabla 2 se resumen las indicaciones de trasplante hematopoyético, con referencia al tipo de trasplante (autólogo o alogénico) indicado en cada patología. Al final de este capítulo se comentarán algunos resultados del trasplante en indicaciones concretas.
Técnica del TPH
Requerimientos Paciente con una enfermedad en la que esté indicado, con una situación clínica aceptable y no mayor de 60-65 años (TPH alogénico) o 65-70 años (TPH autólogo). Aunque la edad ha sido una limitación importante para la utilización del trasplante alogénico, actualmente, si se realizan acondicionamientos con dosis reducidas la edad del trasplante alogénico, se ha ampliado hasta los 65 años. La segunda condición indispensable es tener suficientes células progenitoras hemopoyéticas obtenidas a partir de una de las fuentes mencionadas. Tratamiento de acondicionamiento Cumple 2 funciones: tratar de eliminar toda la enfermedad cuando se trata de una neoplasia y permitir que injerten las células hemopoyéticas trasplantadas al suprimir la médula y el sistema inmunitario del paciente. El tratamiento estándar desde los años 80 ha sido la asociación de irradiación corporal total (ICT) con dosis altas de ciclofosfamida. En 1983 se introdujo un régimen que incluía sólo quimioterapia, sustituyendo la ICT por busulfán a dosis altas14. Posteriormente se han ido modificando los regímenes de acondicionamiento, incluyendo nuevos fármacos y nuevas combinaciones en un intento de mejorar la eficacia antitumoral sin incrementar la toxicidad. En los últimos años se ha desarrollado con éxito una modalidad de trasplante que utilizan tratamientos de acondicionamiento de intensidad reducida (también llamados trasplantes no mieloablativos o mini-trasplantes15); estos trasplantes se basan en los efectos que los linfocitos T del donante tienen frente al tumor y su objetivo es lograr suficiente inmunosupresión del paciente para que no rechace el injerto, pero sin tratar de erradicar toda la enfermedad, confiando en que el efecto injerto contra tumor sea el responsable de su curación. Tienen la ventaja de su menor toxicidad inmediata, lo que permite realizarlos en personas de edad más avanzada o con enfermedades concomitantes que contraindicarían un trasplante convencional.
Complicaciones
Las complicaciones del TPH pueden ser muchas y muy variadas, dependiendo de múltiples factores entre los que hay que destacar:– Tipo de TPH: tienen más complicaciones los alotrasplantes que los autotrasplantes.
– Enfermedad de base: más problemas las enfermedades neoplásicas. – Situación de la enfermedad: peor cuanto más avanzada esté. – Tratamiento de acondicionamiento: según intensidad y esquemas empleados. – Edad y condición física del paciente.
Sólo comentaremos brevemente las complicaciones más importantes o más características del trasplante de progenitores hemopoyéticos, resaltando los avances realizados en los últimos años para disminuir su morbi-mortalidad.
En líneas generales las complicaciones del TPH se clasifican atendiendo al periodo de presentación, considerándose tres fases:1. Fase de acondicionamiento y aplasia medular. Dura aproximadamente unas 3 semanas (10-12 días si se utilizan progenitores de sangre periférica o hasta 4 semanas si se usa sangre de cordón umbilical) que es el tiempo que tarda en recuperarse la función medular. Las complicaciones incluyen las directamente derivadas del tratamiento de acondicionamiento y las producidas por la situación de aplasia.
2. Fase postrasplante inmediata. Esta fase incluye el periodo comprendido entre la recuperación de la función medular y los 3 meses postrasplante y se caracteriza fundamentalmente por dos tipos de complicaciones:– Infecciones
– Enfermedad injerto contra huésped3. Fase tardía. Es la que va desde los 3 meses postrasplante hasta el año, que es cuando se reconstituye el sistema inmunitario del paciente.
Complicaciones derivadas del acondicionamiento
Dependen del tipo de acondicionamiento y su intensidad, y son las siguientes:– Toxicidad gastrointestinal: mucositis, esofagitis, gastroenteritis, pancreatitis,... sobre todo por la radioterapia, aunque también la producen la mayoría de los citostáticos a dosis altas.
– Toxicidad pulmonar: neumonitis, fibrosis pulmonar, por radioterapia, BCNU, busulfán... – Toxicidad cardiaca: miocardiopatía por ciclofosfamida, adriamicina,... – Toxicidad neurológica: Ara-C, busulfán,... – Toxicidad hepática: enfermedad veno-oclusiva por busulfán, BCNU,... – Toxicidad urológica: cistitis hemorrágica por ciclofosfamida,...
La mucositis es un problema muy frecuente y que causa molestias importantes a los pacientes. La afectación orofaríngea provoca dolor, dificultadad para la alimentación, infecciones secundarias, etc. La afectación gastrointestinal causa náuseas, vómitos, diarrea, dolor y hemorragias. Ambas pueden requerir medidas de soporte importantes como uso de analgésicos potentes y nutrición parenteral. Hasta hace poco no se conocía ninguna medida eficaz para disminuir su incidencia y gravedad, pero el uso de factor recombinante de crecimiento de queratinocitos (KGF) disminuye la incidencia y severidad de la mucositis de pacientes sometidos a autotrasplante16, por lo que está recomendado en los pacientes sometidos a regímenes de acondicionamiento más mucotóxicos.
El síndrome de obstrucción sinusoidal tradicionalmente llamado enfermedad veno-oclusiva hepática, es un cuadro clínico caracterizado por hepatomegalia dolorosa, ictericia y retención de líquidos17. Está producido por daño endotelial de sinusoide hepático. Es más frecuente tras el trasplante alogénico y tras determinados acondicionamientos, sobre todo los que incluyen irradiación corporal total, ciclofosfamida y busulfán. Su incidencia se ve claramente disminuida si se usan regímenes no mieloablativos y también se ha demostrado recientemente que la utilización del busulfán a dosis ajustadas condiciona una menor incidencia de este cuadro18, la nueva presentación en forma endovenosa del busulfán, en lugar de la forma oral tradicional, ha mejorado la biodisponibilidad y probablemente mejorado la toxicidad19. Complicaciones derivadas de la aplasia Son las debidas a la falta de células sanguíneas hasta la recuperación hematopoyética, fundamentalmente anemia, hemorragias e infecciones. La anemia es corregida mediante la transfusión de concentrados de hematíes, en algunas situaciones se puede usar eritropoyetina para acelerar la recuperación de la serie roja. Las hemorragias pueden constituir un problema muy grave, por ello debe ser evitadas en la medida de lo posible, utilizando transfusiones profilácticas de plaquetas. El uso de sangre periférica como fuente de progenitores acorta de forma importante la recuperación plaquetar y disminuye los requerimientos transfusionales. Todos los productos celulares sanguíneos que se transfundan deben ser previamente irradiados para evitar la enfermedad injerto contra huésped postransfusional, que es ocasionada por los linfocitos que contiene el producto transfundido. Infecciones Constituyen la complicación más importante durante este primer periodo, causando la mayor parte de las muertes que se producen en la fase temprana del TPH. Son la consecuencia de la neutropenia y del daño a las barreras mucosa y cutánea producida por el tratamiento de acondicionamiento y medidas invasivas como la colocación de catéteres endovenosos, además influye la inmunodeficiencia ocasionada por la enfermedad de base y el uso de inmunosupresores en los trasplantes alogénicos. Las infecciones son generalmente ocasionadas por gérmenes oportunistas, aunque los agentes causales pueden ser muchos:– Bacterias: sobre todo Gram - como pseudomona, klebsiella, E. coli,... aunque cada vez son más frecuentes las infecciones por Gram positivos como estafilococo, estreptococo y otros, debido a la profilaxis antibiótica (selectiva frente a Gram negativos y al uso de catéteres venosos permanentes.
– Virus: sobre todo Herpes simple. – Hongos: Cándida y Aspergillus – Protozoos: Pneumocystis jirovecii.
La localización de las infecciones también es muy variable, siendo frecuentes la fiebre sin foco infeccioso, las infecciones de piel y mucosas, las infecciones pulmonares, gastrointestinales,...
Profilaxis y tratamiento de las infecciones Durante la fase de aplasia el paciente debe estar sometido a medidas de aislamiento estrictas para disminuir el riesgo de infecciones. Estas medidas incluyen: habitación individual esterilizada con control del aire (flujo laminar, presión positiva con filtros de alta eficiencia), medidas de aislamiento invertido para las visitas (bata, mascarilla, calzas,..), alimentación descontaminada (estéril, baja en bacterias). La medida individual que mayor eficacia ha demostrado en la prevención de complicaciones infecciosas es el lavado adecuado de manos. Además se utilizan antibióticos profilácticos:– Antibacterianos: para descontaminar el tubo digestivo, protegen sobre todo de las infecciones por Gram -. Actualmente se utilizan quinolonas: norfloxacino, ciprofloxacino, levofloxacino.
– Antifúngicos: nistatina oral para evitar las infecciones de mucosa oral, fluconazol para evitar las infecciones sistémicas, que ha demostrado en estudios randomizados que disminuye la incidencia de infecciones fúngicas invasivas y la mortalidad en los pacientes sometidos a trasplante alogénico20. Sin embargo, el fluconazol previene fundamentalmente infecciones por candida spp., por lo que hongos filamentosos tan importantes en el trasplante como el Aspergillus, quedarían sin cubrir, e incluso se está viendo un aumento en la incidencia de infecciones por este patógeno. Recientemente se han incorporado nuevos antifúngicos más eficaces frente a aspergillus y que pueden tener un importante papel en la prevención de infecciones fúngicas21. – Antivirales: aciclovir en pacientes con serología positiva para VHS con el fin de evitar las frecuentes recidivas. Ganciclovir y gammaglobulina hiperinmune para evitar infecciones por citomegalovirus en determinados pacientes de alto riesgo, también deben usarse productos sanguíneos CMV negativos en aquellos trasplante donde el paciente y el receptor sean CMV negativos. – Antiprotozoarios: cotrimoxazol para prevenir el Pneumocystis irovecii.
Una medida importante para disminuir la mortalidad por infecciones es el tratamiento precoz de las mismas, por lo que ante la aparición de fiebre aún en ausencia de foco infeccioso se debe empezar tratamiento antibiótico de amplio espectro.
Otro aspecto muy importante en el que se ha avanzado en los últimos años, es el diagnóstico precoz de las complicaciones infecciosas. La enfermedad por citomegalovirus, sobre todo la neumonitis, que era una importante causa de mortalidad en el trasplante, hasta el 15%, prácticamente no causa muertes en la actualidad gracias a la detección y tratamiento precoz de la infección mediante determinación de antígenos específicos por técnicas inmunocitoquímicas o moleculares22. También ha mejorado la capacidad diagnóstica en las infecciones por aspergillus, tanto por la mejoría de las técnicas de imagen (TAC de alta resolución) como por la posibilidad de detección temprana de antígenos de aspergillus circulantes (antígeno galactomanano)23. Estos avances, junto con la aparición de antibióticos más eficaces, han contribuido a disminuir la mortalidad y han permitido la realización de trasplantes con donantes menos idóneos y en pacientes de más edad.
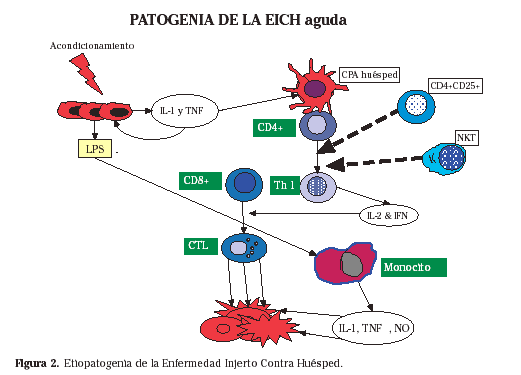
Fallo del injerto Aunque cada vez es menos frecuente, en algunos pacientes no se recupera la hemopoyesis tras el trasplante (fallo primario) o se pierde tras un periodo de recuperación inicial (fallo secundario). Es más frecuente en pacientes con anemia aplásica previamente hipertransfundidos y cuando se emplea eliminación de linfocitos T como profilaxis de enfermedad injerto contra huésped. Se puede tratar con factores de crecimiento hemopoyético (G-CSF o GM-CSF) sobre todo si es tras un trasplante autólogo pero en caso del alogénico puede requerir un segundo trasplante. Enfermedad injerto contra huésped aguda La enfermedad injerto contra huésped aguda (EICH) es una complicación específica del trasplante de progenitores hemopoyéticos, y constituye uno de los mayores problemas del mismo. Está producida por los linfocitos T del donante tras su activación en varias fases (Fig. 2). Las células dendríticas del receptor presentan aloantígenos en el contexto del sistema HLA, a los linfocitos T helper del donante, que se activan y liberan IL-2, que a su vez activan linfocitos T citotóxicos. Éstos son los responsables del daño sobre las células del receptor que expresan antígenos HLA de clase I. Este mecanismo está reforzado por el daño tisular que produce el tratamiento de acondicionamiento, sobre todo en la mucosa digestiva, que libera antígenos celulares y lipopolisacárido (LPS). También intervienen las células NK y los macrófagos que participan en la reacción liberando citocinas. Los linfocitos T activados liberan también Interferón-g, que aumenta la expresión de antígenos HLA de clase II, lo que aumenta el estímulo a linfocitos T y NK24.
Clínicamente se manifiesta por daño tisular que afecta fundamentalmente a 3 órganos diana25:
– Piel: produce un cuadro eritematoso que suele comenzar por las palmas de las manos y las plantas de los pies pero que puede extenderse por todo el cuerpo, produciendo una eritrodermia generalizada, con aparición incluso de ampollas.
– Hígado: produce una ictericia obstructiva, con importante aumento de la bilirrubina y discreto aumento de transaminasas. – Intestino: aparición de diarreas acuosas.
De acuerdo con la severidad de afectación de cada uno de estos órganos diana se clasifica en estadios (0 a IV), considerándose severa cuando hay un grado III-IV.
La incidencia de EICH es variable dependiendo de diversos factores, siendo el fundamental la disparidad HLA entre el donante y el receptor. También influyen la edad, donante mujer a un receptor varón, la seropositividad a algunos herpes virus, ciertos alelos HLA y diversos factores genéticos aún por dilucidar completamente.Un factor muy importante es la profilaxis, que se realiza con inmunosupresores o eliminación de los linfocitos T de las células del donante. La pauta clásica es la combinación de ciclosporina A y metotrexato, aunque existen diferentes esquemas según el tipo de acondicionamiento, el grado de identidad genética entre donante y receptor, el tipo de enfermedad,...
Tratamiento A pesar de las medidas profilácticas la EICH se presenta en aproximadamente un 30% de pacientes que requerirán tratamiento para controlarla. El tratamiento inicial se realiza con corticoides a dosis altas (prednisona 2 mg/Kg/día) y cuando estos fallan con anticuerpos monoclonales anti-linfocitos T (OKT3) o anti-receptor de la IL-2. A pesar de los avances realizados, la enfermedad injerto contra huésped continúa siendo una causa importante de mortalidad en los trasplantes alogénicos. Enfermedad injerto contra huésped crónica Ocurre en el 30-40% de los pacientes. La EICH crónica produce también una afectación multiorgánica que se parece a una colagenosis. Los órganos fundamentalmente afectados son también la piel, el hígado y el tubo digestivo. En la piel provoca despigmentación, eritema y esclerodermia que pueden llegar a producir contracturas articulares por fibrosis. En el hígado provoca una hepatitis crónica con aumento predominante de fosfatasa alcalina y bilirrubina normal o ligeramente aumentada. Sobre el tubo digestivo puede provocar mucositis oral con sequedad de mucosas y esofagitis y también un síndrome de diarrea crónica con malabsorción. Otros órganos que se pueden afectar son los pulmones, produciéndose enfermedad obstructiva crónica; los ojos, con sequedad de mucosa conjuntival,... La EICH crónica se clasifica en localizada y extensa. La forma localizada incluye afectación focal de la piel y/o afectación hepática, mientras que la forma extensa incluye afectación generalizada de la piel o afectación localizada de la piel más hepatitis crónica agresiva y afectación de otro órgano. El tratamiento inicial se realiza también con corticoides, la reintroducción de la ciclosporina si ya se había retirado y la asociación de otros inmunosupresores si no hay respuesta. También se ha utilizando, con cierto éxito en formas extensas, la talidomida. Recientemente se han obtenido buenos resultados en algunos casos con la fotoféresis extracorpórea, que es un tratamiento inmunomodulador que consiste en irradiar con rayos UVA parte de los linfocitos del paciente, que son separados mediante un aparato de aféresis. En general, los tratamientos consiguen controlarla, pero en formas extensas que no responden a los distintos tratamientos puede producirse la muerte del paciente por deterioro progresivo e infecciones intercurrentes.Futuro del trasplante Hemopoyético. Efecto injerto contra tumor
Las células del donante, que pueden producir enfermedad injerto contra huésped, también producen un efecto antitumoral. Este efecto puede ser muy importante para erradicar la enfermedad neoplásica26. La primera comprobación de este efecto se produjo al observar que los paciente que presentaban EICH aguda o crónica tenían una menor probabilidad de recaída e incluso una mayor supervivencia, a pesar de tener más complicaciones27. Además este efecto se constató directamente al comprobar que en pacientes que recaían tras un trasplante alogénico, era posible conseguir una nueva remisión infundiendo linfocitos del mismo donante28. Estos datos han sentado las bases para la realización de trasplantes de progenitores hemopoyéticos con tratamientos de acondicionamiento no mieloablativos29 (es decir, con dosis bajas de quimioterapia que no producen aplasia medular) con resultados similares a los trasplantes convencionales. La ventaja de los trasplantes no mieloablativos (también llamados minitrasplantes) es que tienen menor toxicidad y se pueden emplear en pacientes de más edad o en peor condición física, lo que ha permitido ampliar las indicaciones del trasplante alogénico. Un inconveniente es que su eficacia se basa únicamente en el efecto de los linfocitos del donante frente al tumor del paciente (inmunoterapia), y este efecto tarda un tiempo en producirse (necesita de la reconstitución del sistema inmune del donante en el paciente). Por esto los minitrasplantes son más eficaces en las enfermedades de crecimiento más lento (síndromes mieloproliferativos crónicos, SMD, Leucemia linfática crónica, linfomas de bajo grado, mieloma,...). En el caso de enfermedades más agresivas como las leucemias agudas o linfomas de alto grado es importante conseguir una buena remisión antes del trasplante para que este resulte eficaz. El trasplante ideal sería aquel que dirigiera el efecto inmune del donante contra las células tumorales del paciente, evitando al mismo tiempo que se produjera una enfermedad injerto contra huésped. Aunque este objetivo aún está lejos, existen actualmente una multitud de posibilidades para abordar la separación definitiva entre la enfermedad injerto contra huésped del efecto injerto contra tumor. Entre las más destacadas figurarían la eliminación selectiva de linfocitos T30, la utilización de células T reguladoras que controlasen la EICH31 o células inmunomoduladoras como las mesenquimales32, bloqueo de moléculas co-estimuladoras de la activación de linfocitos T33, la estimulación de respuestas inmunes antígeno específicas enfocadas sólo al tumor, aprovechando por ejemplo las disparidad en antígenos menores de histocompatibilidad34, o eliminación selectiva de linfocitos alorreactivos aprovechando marcadores específicos de activación35 o, inhibiendo alguno de los mecanismos moleculares por los que se activan los linfocitos36.Resultados del trasplante de progenitores hematopoyéticos
El pronóstico de los trasplantes varía en función del tipo y situación de la enfermedad al trasplante, como se reflejaba en la tabla 2, las enfermedades tratadas son muchas y la situación en que los pacientes llegan al trasplante es también diversa; en la tabla 3 se resumen los resultados de algunos ejemplos representativos de enfermedades que se tratan habitualmente con trasplante.
Otros factores que influyen en los resultados del trasplante son la edad, la situación funcional del paciente, el tipo y la fuente de trasplante, la disparidad HLA entre donante y receptor, etc.
– Leucemia aguda con factores de mal pronóstico. El trasplante alogénico en primera remisión completa es el tratamiento de elección, superior a otras alternativas37.
– Linfoma no Hodgkin agresivo en primera recaída. El trasplante autólogo es, desde hace años, el tratamiento de elección, superior a la quimioterapia convencional38. – Mieloma múltiple. El autotrasplante se considera tratamiento habitual en los pacientes que pueden tolerarlo, y aunque no cura la enfermedad mejora significativamente la supervivencia39. Es posible que algunos pacientes se beneficien de un doble trasplante autólogo, y sin embargo, todavía está por decidir el papel del trasplante alogénico que podría beneficiar a pacientes de peor pronóstico. – Está claro que el trasplante cura a pacientes con diversas enfermedades congénitas como las inmunodeficiencias severas, síndrome de Wiskott-Aldrich, talasemias, anemia de Fanconi. – En tumores sólidos se sabe que el autotrasplante mejora los resultados de la quimioterapia convencional en algunos casos, pero debido a la ausencia de estudios bien realizados o como consecuencia de las múltiples alternativas terapéuticas que van surgiendo, no está definido el papel del trasplante y por tanto se debe realizar en el contexto de ensayos clínicos. El trasplante alogénico ha sido muy poco empleado en tumores, aunque algunos resultados positivos40 hacen que sea un tema para explorar. – Enfermedades autoinmunes. Se han observado remisiones duraderas en algunos pacientes tras trasplante autólogo en esclerosis múltiple, lupus eritematoso, artritis reumatoide, citopenias autoinmunes, etc. Sin embargo, no parece una opción curativa ya que las recaídas son muy frecuentes. El alotrasplante podría ser un tratamiento curativo, pero debido a su alta toxicidad actual no ha sido explorado adecuadamente41.
Bibliografía
1. Jacobson LO, Simmons EL, Marks EK, Eldredge JH. Recovery from radiation injury. Science 1951; 113: 510-511. [ Links ]
2. Lorenz E, Uphoff D, Reid TR, Shelton E. Modification of irradiation injury in mice and guinea pigs by bone marrow injections. J Natl Cancer Inst 1951; 12: 197-201. [ Links ]
3. Andrews GA. Criticality accidents in Vinca, Yugoslavia, and Oak Ridge, Tennessee. Am J Roentgenol Radium Ther Nucl Med 1965; 93: 56-74. [ Links ]
4. Thomas ED, Lochte HL Jr, Lu WC, Ferrebee JW. Intravenous infusion of bone marrow in patients receiving radiation and chemotherapy. N Engl J Med 1957; 257 :491-496. [ Links ]
5. Thomas ED, Buckner CD, Banaji M, Clift RA, Fefer A, Flournoy N et al. One hundred patients with acute leukemia treated by chemotherapy, total body irradiation, and allogeneic marrow transplantation. Blood 1977; 49: 511-533. [ Links ]
6. Dausset J, Brecy H. Identical nature of the leucocyte antigens detectable in monozygotic twins by means of immuno iso-leucoagglutinins. Nature 1957; 180: 1430. [ Links ]
7. Beatty PG, Hansen JA, Longton GM, Thomas ED, Sander JE, Martin PJ et al. Marrow transplantation from HLA-matched unrelated donors for treatment of hematologic malignancies. Transplantation 1991; 51 :443-447. [ Links ]
8. Ruggeri L, Capanni M, Urbani E, Perruccio K, Shlomchik WD, Tosti A et al. Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants. Science 2002; 295: 2097-2100. [ Links ]
9. McGovern JJ Jr, Russel PS, Atkins L, Webster EW. Treatment of terminal leukemic relapse by total-body irradiation and intravenous infusion of stored autologous bone marrow obtained during remission. N Engl J Med 1959; 260: 675-683. [ Links ]
10. Bensinger WI, Martin PJ, Storer B, Clift R, Forman SJ, Negrin R et al. Transplantation of bone marrow as compared with peripheral- blood cells from HLA-identical relatives in patients with hematologic cancers. N Engl J Med 2001; 344: 175-181. [ Links ]
11. Schmitz N, Bacigalupo A, Hasenclever D, Nagler A, Gluckman E, Clark P et al. Allogeneic bone marrow transplantation vs filgrastim-mobilised peripheral blood progenitor cell transplantation in patients with early leukaemia: first results of a randomised multi-centre trial of the European Group for Blood and Marrow Transplantation. Bone Marrow Transplant 1998; 21: 995-1003. [ Links ]
12. Gluckman E, broxmeyer HA, Auerbach AD, Friedman HS, Douglas GW, Devergie A et al. Hematopoietic reconstitution in a patient with Fanconis anemia by means of umbilical-cord blood from an HLA-identical sibling. N Eng J Med 1989; 321: 1174-1178. [ Links ]
13. Ballen KB. New trends in umbilical cord blood transplantation. Blood 2005; 105: 3786-3792. [ Links ]
14. Santos GW, Tutschka PJ, Brookmeyer R, Saral R, Beschorner WE, Bias WB et al. Marrow transplantation for acute nonlymphocytic leukemia after treatment with busulfan and cyclophosphamide regimen. N Eng J Med 1983; 309: 1347-1353. [ Links ]
15. Slavin S, Nagler A, Naparstek E, Kapelushnik Y, Aker M, Cividalli G et al. Nonmyeloablative stem cell transplantation and cell therapy as an alternative to conventional bone marrow transplantation with lethal cytoreduction for the treatment of malignant and nonmalignant hematologic diseases. Blood 1998; 91: 756-763. [ Links ]
16. Spielberger R, Stiff P, Bensinger W, Gentile T, Weisdorf D, Kewalramani T et al. Palifermin for oral mucositis after intensive therapy for hematologic cancers. N Eng J Med 2004; 351: 2590-2598. [ Links ]
17. Bearman SI. The syndrome of hepatic veno-occlusive disease after marrow transplantation. Blood 1995; 85: 3005-3020. [ Links ]
18. Bornhauser M, Storer B, Slattery JT, Appelbaum FR, Deeg HJ, Hansen J et al. Conditioning with fludarabine and targeted busulfan for transplantation of allogeneic hematopoietic stem cells. Blood 2003; 102: 820-826. [ Links ]
19. Lee JH, Choi SJ, Lee JH, Kim SE, Park CJ, Chi HS et al. Decreased incidence of hepatic veno-occlusive disease and fewer hemostatic derangements associated with intravenous busulfan vs oral busulfan in adults conditioned with busulfan + cyclophosphamide for allogeneic bone marrow transplantation. Ann Hematol 2005; 84: 321-330. [ Links ]
20. Slavin MA, Osborne B, Adams R, Levenstein MJ, Schoch HG, Feldman AR et al. Efficacy and safety of fluconazole prophylaxis for fungal infections after marrow transplantation- a prospective, randomized, double-blind study. J Infect Dis 1995; 171: 1545-1552. [ Links ]
21. Patterson TF. Advances and challenges in management of invasive mycoses. Lancet 2005; 366: 1013-1025. [ Links ]
22. Stocchi R, Ward KN, Fanin R, Baccarani M, Apperley JF. Management of human cytomegalovirus infection and disease after allogeneic bone marrow transplantation. Haematologica 1999; 84: 81-89. [ Links ]
23. Rovira M, Jimenez M, De la Bellacasa JP, Mensa J, Rafel M, Ortega M et al. Detection of Aspergillus galactomannan by enzyme immunosorbant assay in recipients of allogeneic hematopoietic stem cell transplantation: a prospective study. Transplantation 2004; 77: 1260-1264. [ Links ]
24. Ferrara JLM, Deeg HJ. Graft-versus-host disease (review). N Eng J Med 1991; 324: 667-674. [ Links ]
25. Ringden O, Deeg HJ. Clinical spectrum of graft-versus-host disease. En: Ferrara JLM, Deeg HJ, Burakoff S, editors. Graft vs Host Disease. Second Edition. New York; Marcel Dekker, Inc., 1996: 525-559. [ Links ]
26. Appelbaum FR. Haematopoietic cell transplantation as immunotherapy. Nature 2001; 411: 385-389. [ Links ]
27. Horowitz MM, Gale RP, Sondel PM, Goldman JM, Kersey J, Kolb HJ et al. Graft-versus-leukemia reactions after bone marrow transplantation. Blood 1990; 75: 555-562. [ Links ]
28. Kolb HJ, Mittermüller J, Clemm CH, Holler G, Ledderose G, Brehm G et al. Donor leukocyte transfusions for treatment of recurrent chronic myelogenous leukemia in marrow transplant patients. Blood 1990; 76: 2462-2465. [ Links ]
29. McSweeney PA, Niederwieser D, Shizuru JA, Sandmaier BM, Molina AJ, Maloney DG et al. Hematopoietic cell transplantation in older patients with hematologic malignancies: replacing high-dose cytotoxic therapy with graft-versus-tumor effects. Blood 2001; 97: 3390-3400. [ Links ]
30. Soiffer RJ, Alyea EP, Hochberg E, Wu C, Camming C, Parikh B et al. Randomized trial of CD8+ T-cell depletion in the prevention of graft-versus-host disease associated with donor lymphocyte infusion. Biol Blood Marrow Transplant 2002; 8: 625-632. [ Links ]
31. Edinger M, Hoffmann P, Ermann J, Drago K, Fathman CG, Strober S et al. CD4+CD25+ regulatory T cells preserve graft-versus-tumor activity while inhibiting graft-versus-host disease after bone marrow transplantation. Nat Med 2003; 9: 1144-1150. [ Links ]
32. Le Blanc K, Rasmusson I, Sundberg B, Götherström C, Hassan M, Uzunel M et al. Treatment of severe acute graft-versus-host disease with third party haploidentical mesenchymal stem cells. Lancet 2004; 363: 1439-1441. [ Links ]
33. Guinan EC, Boussiotis VA, Neuberg D, Brennan LL, Hirano N, Nadler LM et al. Transplantation of anergic histoincompatible bone marrow allografts. N Engl J Med 1999; 340: 1704-1714. [ Links ]
34. Falkenburg JH, van de Corput L, Marijt EW, Willemze R. Minor histocompatibility antigens in human stem cell transplantation. Exp Hematol 2003; 31: 743-751. [ Links ]
35. Foster AE, Marangolo M, Sartor MM, Alexander SI, Hu M, Bradstock KF et al. Human CD62L-memory T cells are less responsive to alloantigen stimulation than CD62L+ naive T cells: potential for adoptive immunotherapy and allodepletion. Blood 2004; 104: 2403-2409. [ Links ]
36. Blanco B, Perez-Simon JA, Sanchez-Abarca LI, Carvajal-Vergara X, Mateos J, Vidriales B et al. Bortezomib induces selective depletion of alloreactive T lymphocytes and decreases the production of Th1 cytokines. Blood 2006; 107: 3575-3583. [ Links ]
37. Cassileth PA, Harrington DP, Appelbaum FR, Lazarus HM, Rowe JM, Paietta E et al. Chemotherapy compared with autologous or allogeneic bone marrow transplantation in the management of acute myeloid leukemia in first remission. N Engl J Med 1998; 339: 1649-1656. [ Links ]
38. Philip T, Guglielmi C, Hagenbeek A, Somers R, Van der Lelie H, Bron D et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkins lymphoma. N Engl J Med 1995; 333: 1540-1545. [ Links ]
39. Attal M, Harousseau J-L, Stoppa A-M, Sotto JJ, Fuzibet JG, Rossi JF et al., for the Intergroupe Francais Du Myelome. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. N Engl J Med 1996; 335: 91-97. [ Links ]
40. Childs R, Chernoff A, Contentin N, Bahceci E, Schrump D, Leitman S et al. Regression of metastatic renal-cell carcinoma after nonmyeloablative allogeneic peripheral-blood stem-cell transplantation. N Engl J Med 2000;343: 750-758. [ Links ]
41. Sikes M, Nikolic B. Treatment of sever autoimmune disease by stem cell transplantation. Nature 2005; 435: 620-627. [ Links ]
José Juan Rifón Roca
Servicio de Hematología y
Area de Terapia Celular
Clínica Universitaria de Navarra
Avda. Pío XII, 36
31008 Pamplona
Tfno. 948 296397
Fax: 948 296500
E-mail: jrifon@unav.es