My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Anales del Sistema Sanitario de Navarra
Print version ISSN 1137-6627
Anales Sis San Navarra vol.29 n.3 Pamplona Sep./Dec. 2006
ARTÍCULOS ORIGINALES
Modulación de la fisiología gastrointestinal mediante cepas probióticas de Lactobacillus casei y Bifidobacterium bifidum
Modulation of gastrointestinal physiology through probiotic strains of Lactobacillus casei and Bifidobacterium bifidum
J. Barrenetxe1, P. Aranguren1, A. Grijalba2, J.M. Martínez-Peñuela3, F. Marzo1y E. Urdaneta1
1. Laboratorio de Fisiología y Nutrición. Dpto. de Ciencias del Medio Natural. Universidad Pública de Navarra. Pamplona.
2. Servicio de Bioquímica. Hospital de Navarra. Pamplona.
3. Servicio de Anatomía Patológica. Hospital de Navarra. Pamplona.
Este Proyecto de Investigación ha sido financiado con la Beca Ortiz de Landázuri del Departamento de Salud del Gobierno de Navarra.
Dirección para correspondencia
RESUMEN
En el contexto de la alimentación y la promoción de la salud se sitúan los productos denominados alimentos funcionales que tienen diversos efectos beneficiosos en el organismo, además de los meramente nutricionales. Dentro de estos alimentos funcionales, entre otros, podemos distinguir entre compuestos probióticos y prebióticos. Los microorganismos más utilizados en alimentos probióticos pertenecen a los géneros Lactobacillus y Bifidobacterium.
En el presente trabajo se ha estudiado el efecto de dietas suplementadas con Lactobacillus casei o Bifidobacterium bifidum en el desarrollo animal y en especial sobre la función intestinal, centrada en su actividad immunitaria, digestiva y absortiva de animales en crecimiento.
Las cepas bacterianas utilizadas modifican la actividad del intestino delgado de los ratones sanos, afectando significativamente a su actividad enzimática (sacarasa, maltasa y aminopeptidasa) y a la captación de nutrientes (galactosa y glicilsarcosina), así como a la actividad inmune intestinal (mayor número de placas de Peyer). Sin embargo, estos efectos no parecen perturbar el desarrollo de los animales en crecimiento ya que no se aprecian diferencias significativas en su peso corporal ni en sus parámetros sanguíneos.
Estos resultados ponen de manifiesto los posibles efectos beneficiosos en la fisiología intestinal y contribuyen al conocimiento de los posibles mecanismos de acción de los probióticos, que se pudieran utilizar en el tratamiento preventivo de diferentes patologías relacionadas con el aparato digestivo.
Palabras clave. Cepas probióticas. Intestino. SGLT1. PEPT1.
ABSTRACT
The products called functional foods, which besides being merely nutritional have different beneficial effects on the organism, are situated in the context of diet and health promotion. Amongst these functional foods we can distinguish, amongst others, between probiotic and prebiotic compounds. The micro-organisms most widely used in probiotic foods belong to the Lactobacillus and Bifidobacteriumtypes.
In this article we have studied the effect of diets supplemented with Lactobacillus casei or Bifidobacterium bifidum on animal development and especially on the intestinal function, centred on their immune, digestive and absorptive activity in growing animals.
The bacteria strains used modify the activity of the small intestine of healthy mice, significantly affecting their enzymatic activity (sucrase, maltase and aminopeptidase) and the collection of nutrients (galactose and glycilsarcosine), as well as the intestinal immune activity (higher number of Peyers patches). However, these effects do not appear to disturb the development of the growing animals since no significant differences are appreciated in their body weight or in their blood parameters.
These results make clear the possible beneficial effects on intestinal physiology and contribute to the understanding of the possible mechanisms of action of the probiotics, which could be employed in the preventive treatment of different pathologies related to the digestive apparatus.
Key words. Prebiotic strains. Intestine. SGLT1. PEPT1.
Introducción
En la sociedad occidental actual, debido a las mayores expectativas de vida, existe un interés creciente por la salud y por todos aquellos factores que puedan afectarla. Uno de los temas que suscita mayor preocupación es el de la alimentación y su repercusión sobre la salud1,2. Ello ha generado el nuevo concepto, de alimento funcional definido como aquel que contiene determinados componentes, que tiene efectos beneficiosos sobre una o más funciones del organismo, ayudando a mejorar el estado de bienestar y contribuyendo a la disminución del riesgo de enfermedades, además de sus propios efectos nutricionales.
El prototipo de consumidor actual no renuncia a los alimentos de acceso fácil y cómodo, sino que además demanda una serie de cualidades asociadas a los productos frescos y naturales, sin transformación o poco modificados industrialmente. Para ello exige unos requisitos higiénicos (seguridad e inocuidad), nutricionales (reducido contenido energético y aporte adecuado de nutrientes), organolépticos (apariencia, textura, sabor y olor gratificantes) y algún efecto saludable o beneficioso (International Food Information Council Foundation). Además, el consumo de la llamada dieta mediterránea, cuyos principales componentes son las legumbres, verduras, frutas y productos lácteos fermentados, sin olvidar otros como son, aceite de oliva, vino tinto y pescados, basada en una alimentación y estilo de vida saludable, ha demostrado sus beneficios sobre enfermedades crónicas del mundo occidental, en especial sobre determinados tipos de cáncer y enfermedades cardiovasculares3. Es así que la comunidad científica estima, de forma general, que las ventajas y beneficios de la dieta mediterránea radican en su contenido nutricional, en particular por la presencia de los componentes prebióticos y/o probióticos.
Actualmente, se está reconsiderando a la microbiota intestinal como un factor activo en la salud y en la enfermedad humana, tal y como se concluye en recientes revisiones bibliográficas realizadas sobre diversas situaciones fisiológicas y patológicas4-7. Por otro lado, se están proponiendo por parte de la comunidad científica nuevos paradigmas que permiten relacionar los nutrientes, el sistema inmunitario y el cáncer 8,9 o la dieta y los antimutágenos10. Sin lugar a dudas, desde el punto de vista epidemiológico, el cáncer del aparato digestivo presenta una especial incidencia en la sociedad occidental por su incremento progresivo en las últimas décadas. Sirva como referencia, la tasa media europea en 1998 del cáncer de colon y recto fue de 32,7-53,4 por 100.000 habitantes respectivamente11, con una supervivencia inferior del 50% a los 5 años (Estudio EUROCARE-3). En el caso particular de España, en el año 2000, el cáncer de colon supuso casi el 3% de toda la mortalidad en ambos sexos.
Los productos denominados alimentos funcionales son parte importante en el contexto de la alimentación y la promoción de la salud12. Éstos no sólo se consideran de interés para mantener la salud, sino incluso para prevenir y aliviar determinadas enfermedades13-17. Sin embargo, el uso de algunos microorganismos probióticos, reconocidos como seguros, puede tener efectos negativos en sujetos inmunodeprimidos18. Los microorganismos más utilizados como probióticos pertenecen a los géneros Lactobacillus y Bifidobacterium19, conocidos como bacterias ácido lácticas. El grupo de Lactobacillus lo constituyen tres grupos20: L. casei (L. casei, L . paracasei, L. rhamnosus y L. zeae), L. acidophilus (L. acidophilus, L. crispatus, L. johnsonii, y L. gasseri) y L. fermentum (L. fermentum y L. reuteri).
Se ha fundamentado y admitido el uso de los probióticos para aliviar algunas de la enfermedades intestinales antes mencionadas21,22. Es así que L. gasseri y L. casei poseen cierta capacidad inmunorreguladora, por su acción sobre los linfocitos B23-25 y los macrófagos26. Se ha demostrado que la flora comensal del intestino afecta la expresión de PPARg y que ésta está modificada en pacientes con colitis ulcerosa27. Por otra parte, el empleo de Bifidobacterium bifidum, ha demostrado que inhibe in vitro el crecimiento de células HT-29 y HCT-11628.
Los estudios científicos ponen de manifiesto que es necesario conocer el comportamiento y los posibles mecanismos de acción de los probióticos en sujetos sanos. Es por lo tanto de gran interés el investigar los posibles efectos beneficiosos y/o perjudiciales que pueden tener estos microorganismos en el organismo antes de recomendar su uso como tratamiento terapéutico y/o preventivo en diferentes condiciones patológicas relacionadas con el tracto gastrointestinal.
Por ello, el objetivo del presente trabajo es estudiar si la ingesta de dietas suplementadas con cada uno de estos probióticos (L. casei o B. bifidum) afecta al desarrollo animal y sobre todo a la función intestinal, concretamente inmunitaria, digestiva y absortiva. Estos resultados serán determinantes para poder posteriormente utilizar estos microorganismos como terapia en diversas situaciones patológicas.
Material y Métodos
Obtención y crecimiento de las cepas bacterianas
Las cepas de Lactobacillus casei utilizadas en el presente trabajo han sido aisladas a partir de kéfir en el laboratorio de lactología de la Universidad Pública de Navarra29. Por otro lado, las cepas de Bifidobacterium bifidum se han obtenido de la Colección Española de Cultivos Tipo CECT-870. Ambas cepas se han hecho crecer en leche previamente autoclavada (Skim milk, DIFCO) y se han cultivado durante 24 horas en condiciones aerobias y 37ºC para Lactobacillus y durante 72 horas, en condiciones anaerobias (5% C02) y 39ºC para Bifidobacterium, hasta alcanzar ambas dos una concentración de 108 ufc/ml.
Animales y dietas
Ratones Swiss (Charles River Laboratory Animals, Barcelona) de 28 días y 20 g de peso corporal inicial se distribuyeron al azar en cada uno de los tres grupos experimentales (n = 30-20): control (C), Bifidobacterium bifidum (B) y Lactobacillus casei (L). Se colocaron en jaulas (n = 5) en una habitación a temperatura (22 ± 2ÞC) y humedad constantes y fotoperiodo controlado de 12 h de luz y 12 h de oscuridad.
Los tres grupos experimentales fueron alimentados durante cuatro semanas con una dieta comercial que cubre los requerimientos nutricionales mínimos para el correcto desarrollo de los animales en crecimiento (AIN-93). Los factores probióticos en estudio (Lactobacillus casei y Bifidobacterium bifidum) se administraron a los grupos correspondientes a una concentración de 108 ufc/ml disueltos en leche, por lo que al grupo control también se le administró la misma cantidad de leche pero sin bacterias.
El peso corporal de los animales se registró semanalmente. Al término del periodo experimental los animales fueron anestesiados y sacrificados por decapitación. Se recogió la sangre para las posteriores determinaciones séricas y se extrajeron y pesaron diferentes órganos. El intestino delgado se recogió, se limpió con suero salino frío y tras contar en cada uno de los fragmentos el número de placas de Peyer presente, se congeló a -80 C para el posterior aislamiento de las vesículas de membrana de borde en cepillo (VMBC), en las cuales se realizaron las determinaciones de la actividad enzimática intestinal, así como los ensayos de captación de D-galactosa y glicilsarcosina. Una pequeña porción de colon (1 cm) se recogió para ser fijado y procesado para el análisis histológico.
El comité de Ética y Experimentación animal de la Universidad Pública de Navarra revisó y aprobó este protocolo y el método de sacrificio de los animales de acuerdo con el Canadian Council on Animal Care (1993).
Análisis histológico
Las muestras de colon recogidas para el estudio histológico fueron fijadas inmediatamente en formalina al 4% durante 24 h. A continuación se deshidrataron y tras su inclusión en parafina, se cortaron en piezas de 5 mm y tiñeron en hematoxilina-eosina para su posterior análisis microscópico.
Obtención de las VMBC de intestino de ratón
Las VMBC se obtuvieron a partir de un fragmento de yeyuno de cada uno de los ratones de los diferentes grupos experimentales, siguiendo el método descrito por Shirazi-Beechey30.
La mucosa se resuspendió en un medio que contenía manitol 100 mM y ácido N-2-hidroxietilpiperazine-N-2-etanosulfonico (HEPES) 2 mM a pH 7,1 con Tris-hidroximetil-aminometano. La suspensión se homogeneizó en un homogeneizador Potter-Elvehjem (Braun, Melsungen, Germany) a 3.000 rpm a 4 ºC durante 1 min. A continuación, se añadió MgCl2 hasta una concentración final de 10 mM, y la mezcla se incubó durante 20 min en frío y agitación continua. Posteriormente se centrifugó a 2.000 x g durante 15 min, y el sobrenadante se recogió y centrifugó at 27.000 x g durante 30 min. El pellet así obtenido se resuspendió en un medio formado por manitol 100 mM, sulfato de magnesio 0,1 mM, y HEPES 2 mM a pH 7,4 con Tris.
Finalmente, la mezcla se centrifugó a 27.000 x g durante 30 min y el pellet se resuspendió en un medio que contenía manitol 300 mM, sulfato de magnesio 0,1 mM, y HEPES 10 mM a pH 7,4 con Tris.
Una muestra de la suspensión así obtenida se utilizó para la determinación mediante Bradford de la cantidad de proteína presente y la medida de la actividad sacarasa (E.C.3.2.1.48), con el fin de comprobar su enriquecimiento en membrana apical que resultó ser de 5 veces en comparación con el homogenado inicial.
Actividad enzimática
Para cada uno de los grupos experimentales se descongelaron y unificaron varias alícuotas de VMBC y cada uno de los ensayos enzimáticos se realizó por triplicado. Las actividades sacarasa (E.C. 3.2.1.48) y maltasa (E.C. 3.2.1.20) se determinaron según el método descrito por Dahlqvist31. Tras la incubación con el sustrato correspondiente durante 30 min, la glucosa liberada en cada caso se determinó con la ayuda del Kit A-510 de Sigma.
También se determinó la actividad aminopeptidasa N (E.C. 3.4.11.2) utilizando L-Gly-Pro-b-naftilamida como sustrato32.
Estudios de captación de sustrato
Se midió la captación de azúcar (D-galactosa) y de un dipéptido (glicilsarcosina) en VMBC mediante una versión ligeramente modificada de técnica de filtración rápida desarrollada por Hopfer33. Cada uno de los ensayos para cada grupo experimental se realizó por triplicado.
La captación de D-galactosa se determinó a 37 ºC en presencia de un gradiente de sodio. El medio de incubación utilizado a pH 7,4 estaba compuesto por 0,1 mM D-galactosa, 100 mM NaSCN, 100 mM manitol, 0,1 mM MgSO4, 10 mM HEPES, y el sustrato radioactivo utilizado como trazador (1mCi/mL de D-[1-14C] galactosa; Amersham Radiochemical Centre, UK).
La captación de glicilsarcosina se determinó a 27 ºC en un medio a pH 5,5 compuesto por 1 mM glicilsarcosina, 280 mM manitol, 0,1 mM MgSO4, 1 mM MES, y el sustrato radioactivo utilizado como trazador (10 mCi/mL of[1-3H] glicilsarcosina; Moravek Biochemicals, Inc., Brea, CA, U.S.A.). En los tiempos determinados, la incubación se detuvo añadiendo solución stop fría (150 mM KSCN, 0,25 mM florricina, y 10 mM HEPES a pH 7,4 para los ensayos de captación de D-galactosa y 210 mM KCl y 2 mM HEPES a pH 7,5 para los ensayos de captación del dipéptido). A continuación se hace pasar la suspensión por un filtro de nitrato de celulosa (0,45 mm, 25-mm diámetro, Sartorius, Edgewood, NY, USA) que se lava dos veces en solución fría y se disuelve en líquido de centelleo (HiSafe 3) para posteriormente medir su radioactividad en un contador ß.
Análisis de la expresión proteica por Western blot
Se midió mediante Western blot la expresión de los transportadores PEPT1 y SGLT1 en las VMBC de los diferentes grupos experimentales. Las muestras se diluyeron en un medio compuesto por 50 mM Tris-HCl, pH 6,8, 2% SDS, 10% glycerol, 5% 2-mercaptoetanol,y 0,05% de azul de bromofenol. Tras hervirlas durante tres minutos se cargaron (50 µg) en un gel de poliacrilamida al 12% y se separaron mediante electroforesis durante 60 min. A continuación las proteínas así separadas se transfirieron a una membrana de nitrocelulosa (Hybond P., Amersham–Pharmacia Biotech, Barcelona) mediante electroforesis a 250 mA/100 V y 4 ºC durante 2 h.
Las membranas se bloquearon a temperatura ambiente durante 90 min en medio salino Tris (100 mM Tris-HCl, pH 7,5, 0,9% NaCl) que contenía leche desnatada en polvo al 6%. Ambos transportadores se detectaron mediante la incubación de las membranas durante toda la noche a 4 ºC con los anticuerpos anti-PEPT1 de rata donado por el Dr. Smith (University of Michigan, MI, USA), y anti-SGLT1 de conejo (Chemicon) a una dilución de 1:500. Tras sucesivos lavados en medio salino Tris que contiene Tween al 0,1%, las membranas se incubaron con el anticuerpo secundario (P0488, Dako Diagnostics, Barcelona) a una dilución 1:35.000 durante una hora a temperatura ambiente. Finalmente las proteínas inmunorreactivas se visualizaron mediante quimioluminiscencia (Pierce Super Signal West Dura, Pierce Biotechnology, Rockford, IL, U.S.A.) y las bandas se cuantificaron mediante densitometría a través del programa Quantity One, version 4.5 (Bio-Rad).
Análisis estadístico
Los resultados se expresan como el valor de la media ± ESM. Para el análisis estadístico se utilizó el programa SPSS (versión 12.0) y se aplicó el test de Kruskal Wallis con las correspondientes comparaciones a posteriori. Las diferencias entre los grupos se consideraron estadísticamente significativas cuando la p<0,05.
Resultados
Desarrollo de los animales
La inclusión de ambas cepas probióticas en la dieta habitual de los animales no altera el peso corporal de los mismos indicando que no ejerce ningún efecto perjudicial en el desarrollo de estos animales. Además tampoco se observaron diferencias en los parámetros sanguíneos medidos ni en el peso de los diferentes órganos extraídos (yeyuno, hígado, bazo, páncreas y colon).
Por lo tanto podemos deducir que la ingesta de Lactobacillus casei y Bifidobacterium bifidum no modifica el crecimiento y desarrollo normal de estos animales ni tampoco su estado metabólico.
Morfología del intestino
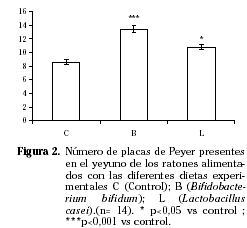
Se observaron diferencias en cuanto a la morfología del colon entre los diferentes grupos experimentales. Los grupos B y L, visualmente parecen poseer un mayor número de infiltrados linfocitarios (Fig. 1). Por otro lado, en el yeyuno, también se aprecia una mayor presencia de placas de Peyer (Fig. 2), siendo significativamente mayor (p<0,01) en el grupo alimentado con Lactobacillus y todavía mayor en el grupo alimentado con Bifidobacterium (p<0,001) que en el grupo control.
Estos hechos indican que ambas cepas podrían ejercer un efecto activador del sistema inmune intestinal.
Captación de nutrientes y actividad enzimática en VMBC
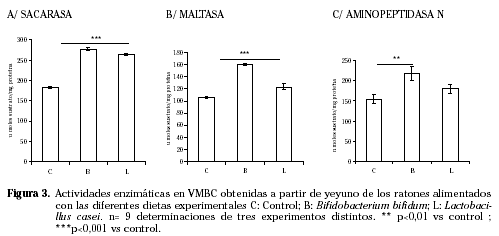
Se analizó el efecto de las dietas suplementadas sobre la fisiología intestinal de estos animales. Según se muestra en la figura 3 en todos los ensayos de actividad enzimática realizados (sacarasa, maltasa y aminopeptidasa N) estas actividades aparecen aumentadas. En el caso de las actividades maltasa y aminopeptidasa N este aumento es más claro en el grupo alimentado con Bifidobacterium que en el alimentado con Lactobacillus.
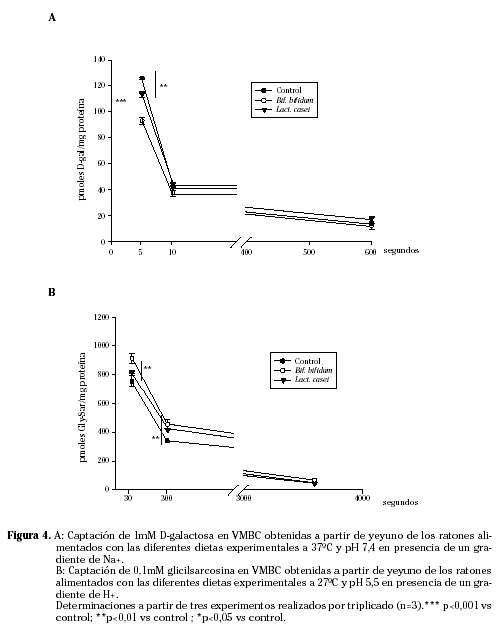
Por otro lado, las gráficas de captación de sustrato muestran que la presencia de bacterias en la dieta de estos animales disminuye la captación de D-galactosa mientras que aumenta la de glicilsarcosina (Fig. 4). Este efecto es apreciable únicamente cuando la absorción del nutriente está mediada por el transportador correspondiente localizado en la membrana apical del enterocito, es decir a tiempos cortos y en presencia de un gradiente de Na+ o H+ en cada caso. En periodos más largos de incubación (10 min y 60 min, respectivamente), tanto el azúcar como el dipéptido atraviesan la membrana apical por un proceso de difusión que no se ve alterado por la presencia de ninguna de las cepas bacterianas en la dieta.
Análisis de la expresión de SGLT1 y PEPT1 por Western blot
Con el fin de comprobar si estos efectos observados en la captación de nutrientes estaban relacionados con cambios en la expresión de los transportadores implicados en la misma, se analizó la expresión del transportador de azúcares dependiente de sodio SGLT1 así como del transportador de dipéptidos PEPT1 en la membrana apical de los enterocitos mediante Western blot.
La figura 5 muestra un claro aumento de la expresión del transportador PEPT1 en los grupos B y L respecto al grupo control. Por lo tanto, parece que el aumento en la captación de glicilsarcosina observado, podría deberse a un aumento en la expresión del transportador responsable de dicha absorción.
La expresión de SGLT1 en ambos grupos suplementados con las bacterias también aparece aumentada respecto al control. En este caso este aumento en la expresión viene acompañado de una disminución en la captación de galactosa anteriormente comentada. Este hecho podría explicarse por una pérdida de afinidad del transportador por su sustrato debida a la presencia de las cepas bacterianas en el epitelio intestinal.
Discusión
En los últimos años numerosas investigaciones han analizado el papel de los microorganismos probióticos (bacterias acidolácticas y levaduras) en el desarrollo de diferentes enfermedades crónicas (cáncer, alergias ) comprobando que tienen un efecto beneficioso en la prevención de las mismas34,35.
Sin embargo, poco se conoce sobre los efectos que este tipo de organismos desempeñan en individuos sanos y su posible uso como agentes preventivos y/o terapéuticos. Por ello, es necesario analizar sus efectos en individuos sanos, y así poder recomendarlos con base científica como terapia preventiva, conociendo con exactitud sus dosis más efectivas y los posibles efectos secundarios que pudieran tener.
En el presente trabajo se ha analizado el efecto de dos cepas probióticas (bacterias acidolácticas) de uso habitual en la industria alimentaria (Lactobacillus casei y Bifidobacterium bifidum) en el desarrollo y la fisiología intestinal de animales sanos. La barrera intestinal es la responsable de regular la entrada de nutrientes y diversas sustancias al organismo que van a afectar el estado nutricional del individuo, cuyo correcto mantenimiento es de vital importancia a la hora de prevenir el desarrollo de diversas enfermedades.
La elección de la concentración de bacterias utilizada en este estudio así como la duración del periodo experimental se ha basado en estudios científicos previos36,37.
El desarrollo normal de los animales y su estado metabólico no parecen verse afectados por la inclusión en la dieta de ambas cepas bacterianas sugiriendo que podrían utilizarse a las dosis analizadas como suplemento dietético38.
Sin embargo, tanto la morfología intestinal como la actividad del intestino delgado (actividad enzimática y absorción de nutrientes), sí se ve afectada por el consumo de ambas cepas. Al parecer éstas podrían activar el sistema inmune intestinal, dado que se aprecia un mayor número de placas de Peyer en el yeyuno de estos animales y una mayor presencia de infiltrados linfocitarios en su colon. Este hecho coincide con el posible efecto inmunomodulador de los microorganismos probióticos descrito en la literatura39,40.
En cuanto a la fisiología intestinal se aprecia una actividad enzimática aumentada por la ingesta de ambas bacterias, tanto de las enzimas implicadas en la digestión de azúcares (sacarasa y maltasa) como de péptidos (aminopeptidasa N). Sin embargo mientras que la absorción del dipéptido glicilsarcosina está aumentada en los grupos B y L respecto a su control la absorción de D-galactosa se ve disminuida. Estas diferencias observadas en los estudios de captación de nutrientes podrían deberse a un efecto de ambas cepas sobre los niveles de expresión de los respectivos transportadores implicados en cada uno de los procesos absortivos. Para comprobar este hipótesis se ha medido por Western blot la expresión del transportador de azúcares dependiente de Na+, SGLT1 así como del transportador de dipéptidos dependiente de Na+/H+ PEPT1. En estos análisis se han observado cambios en los niveles de expresión de ambas proteínas por la ingesta de las cepas bacterianas, apreciándose un claro aumento de la presencia de ambos transportadores en la membrana apical de los enterocitos.
La expresión de ambos transportadores es sensible a la dieta41-43, así una mayor expresión de los mismos podría deberse a una mayor presencia de sus respectivos sustratos en la luz intestinal. Este hecho podría deberse, a su vez, a una mayor capacidad digestiva del intestino por un aumento de su actividad enzimática, según se ha descrito anteriormente.
Estos resultados coinciden con trabajos de otros autores que también han observado una mayor actividad enzimática en el yeyuno de ratas alimentadas con una mezcla de prebióticos y probióticos44. Por otro lado, otros autores, en estudios in vitro realizados en células de adenocarcinoma de colon humano Caco-2, observaron un efecto activador de la captación de glicilsarcosina tras incubación con Lactobacillus casei36.
Sin embargo, la expresión aumentada de SGLT1 coincide con una menor captación de D-galactosa sugiriendo que el transportador podría ver alterada su afinidad por el sustrato y por lo tanto introducir una menor cantidad del mismo en el enterocito. Esta pérdida de afinidad podría ser debida a alteraciones en el proceso de inserción de la proteína en la membrana apical provocada por la presencia de las cepas bacterianas o de alguno de sus metabolitos. Es conocido que la ingesta de probióticos modifica la mucosa intestinal según estudios realizados en humanos45 y en animales46,47. Por lo tanto, este hecho podría afectar a los mecanismos de inserción de los diferentes transportadores presentes en la misma alterando a su vez su función48.
En conclusión, parece que ambas cepas bacterianas modifican la actividad del intestino delgado en animales sanos, aumentando su actividad inmune y enzimática, y alterando la captación de nutrientes. Estos hechos no perjudican el desarrollo normal de estos animales ya que no se observan diferencias ni en los parámetros bioquímicos analizados ni en su peso corporal.
En este sentido, este estudio contribuye a recomendar con seguridad el uso de estas cepas en animales sanos y apunta hacia un papel beneficioso de las mismas en aquellas enfermedades que afecten al tracto gastrointestinal.
Bibliografía
1. Warner, M. Marketing fortified food to those leery of drugs. 2005; The New York Times. 28th December 2005. [ Links ]
2.Rodríguez, A. Las despensas se transforman en farmacias. El Mundo del siglo XXI, 7 de enero de 2006. [ Links ]
3. EPIC. European Prospective Investigation into Cancer and Nutrition. Eur J Clin Nutr 2005; 59: 1387-1396. [ Links ]
4.Guarner F. and Malagelada JR. Gut flora in health and disease. Lancet 2003; 360: 512-519. [ Links ]
5.Saarela M, Lähteenmäki, L, Crittenden R, Salminen S, Mattila-Sandholm T. Gut bacteria and health foods - The European perspective. Int J Food Microbiol 2002; 78: 99-117. [ Links ]
6.Shanahan F. The host-microbe interface within the gut. Best Practice & Res Clin Gastroenterol 2002; 16: 915-931. [ Links ]
7. Tlaskalová-Hogenová H, S×te×pánkováa R, Hudcovic T, Tu×cková L, Cukrowska B, Lodinová-Z×ádníková R et al. Commensal bacteria (normal microflora), mucosal immunity and chronic inflammatory and autoimmune diseases. Immunology Letters 200; 93: 97-108. [ Links ]
8.Bengmarjk S. Immunonutrition: Role of biosurfactants, fiber, and probiotic bacteria. Nutrition 1998; 14: 585-594. [ Links ]
9.Philpott M, Ferguson LR. Immunonutrition and cancer. Mut Res 2004; 551: 29-42. [ Links ]
10.Ferguson LR, Philpott M, Karunasinghe N. Dietary cancer and prevention using antimutagens. Toxicology 2004; 198: 147-159. [ Links ]
11. López-Abente G, Pollán M, Aragonés N, Pérez B, Hernández V, Lope V, Suárez B. Situación del cáncer en España: incidencia. An Sist Sanit Navar 2004; 27: 165-173. [ Links ]
12.Kwak NS, Jukes DJ. Functional foods. Part 1: the development of a regulatory concept. Food Control 2001; 12: 99-107. [ Links ]
13.Salminen S, Ouwehand AC, Isolauri E. Clinical applications of probiotic bacteria. Intern Dairy J 1998; 8: 563-572. [ Links ]
14.Hirayama K, Rafter J. The role of probiotic bacteria in cancer prevention. Microbes Infect 2000; 2: 681-686. [ Links ]
15. Kopp-Hoolihan, L. Prophylactic and therapeutic uses of probiotics: a review. J Am Diet Assoc 2001; 1012: 229-241. [ Links ]
16.Marteau P, Seksik P, Jian R. Probiotics and health: new facts and ideas. Curr Opin Biotechnol 2002; 13: 486-489. [ Links ]
17.Kaur IP, Chopra K, Saini A. Probiotics: potential pharmaceutical applications. Eur J Pharmac Sci 2002; 15: 1-9. [ Links ]
18.Wagner RD, Balish E. Potential hazards of probiotic bacteria for immunodeficient patients. Bull Inst Pasteur 1998; 96: 165-170. [ Links ]
19.Herman M, Ménard S. Probiotic microrganisms:how they affect intestinal pathophysiology. Cellular and Molecular Life Sciences 2002; 59: 1151-1165. [ Links ]
20.Klein G, Pack A, Bonaparte Ch, Reuter G. Taxonomy and physiology of probiotic lactic acid bacteria. Int J Food Microbiol 1998; 41:103-125. [ Links ]
21.Rafter J. Probiotics and colon cancer. Best Practice & Research Clinical Gastroenterology 2003; 17: 849-859. [ Links ]
22.Shanahan F. Probiotics in inflammatory bowel disease. Gut 2001; 48: 609. [ Links ]
23.Kirjavainen PV, El-Nezami HS, Salminen SJ, Ahogas JT, Wright PFA. The effect of orally administred viable probiotic and dairy lactobacilli on mouse lymphocyte proliferation. FEMS Immunol Med Microbiol 1999; 26: 131-135. [ Links ]
24.Kitazawa H, Ueha S, Shihoko Itoh S, Watanabe H, Konno K, Kawai Y et al. AT oligonucleotides inducing B lymphocyte activation exist in probiotic Lactobacillus gasseri. Int J Food Microbiol 2001; 65: 149-162. [ Links ]
25.Lee JW, Shin JG, Kim E, Kang H, Yim IB, Kim J et al. Immunomodulatory and antitumor effects in vivo by the cytoplasmatic fraction of Lactobacillus casei and Bifidobacterium longum. J Vet Sci 2004 5; 41-48. [ Links ]
26.Kitazawa H, Ino T, Kawai Y, Itoh T, Saito T. A novel immunostimulating aspect of Lactobacillus gasseri: induction of Gasserokine as chemoattractants for macrophages. Int J Food Microbiol 2002; 77: 29-38. [ Links ]
27.Dubuquoy L, Jansson EA, Deeb S, Rakotobe S, Karoui M, Colombel JF. Impaired expression of peroxisome proliferactor-activated receptor gamma in ulcerative colitis. Gastroenterology 2003; 124: 1538-1542. [ Links ]
28.You HJ, Oh DK, Ji GE. Anticancerogenic effect of a novel chiroinositol-containing polysaccharide from Bifidobacterium BGN4. FEMS Microbiol Lett 2004; 240: 131-136. [ Links ]
29.Irigoyen A, Arana I, Castiella M, Torre P, Ibáñez FC. Microbiological, physicochemical and sensory characteristics of kefir during storage. Food Chem 2005; 90: 613-620. [ Links ]
30. Shirazy-Beechey SP, Davies AG, Tebbut K, Dyer J, Ellis A, Taylor CJ et al. Preparation and properties of brush border membrane vesicles from human small intestine. Gastroenterol 1990; 98: 676-685. [ Links ]
31. Dahlqvist, A. Method for assay of intestinal disaccharidases. Annal Biochem 1964; 7: 18-25. [ Links ]
32.Andria G, Cucchiara S, De Vizia B, De Ritis G, Masaka G, Aurichio S. Brush border and cytosol peptidase activities of human small intestine n normal subjects and celiac patients. Pediatr Res 1980; 14: 812-818. [ Links ]
33.Hopfer U, Sigrist-Nelson K, Perotto J, Murer H. Intestinal sugar transport: studies with isolated plasma membranes. Ann NY Acad Sci 1975; 264: 414-427. [ Links ]
34.Ezendan J, van Loveren H. Probiotics: immunomodulation and evaluation of safety and efficacy. Nutr Rev 2006; 64: 1-14. [ Links ]
35.Mc Garr SE, Ridlon JM and Hylemon PB. Diet, anaerobic bacterial metabolism and colon cancer: a review of the literature. J Clin Gastroenterol 2005; 39: 98-109. [ Links ]
36.Neudeck BL, Loeb JM, Faith NG. Lactobacillus casei alters hPEPT1-mediated glycylsarcosine uptake in Caco-2 cells. J Nutr 2004; 134: 1120-1123. [ Links ]
37.Roller M, Rechkemmer G, Watzl B. Prebiotic inulin enriched with oligofructose in combination with the probiotics Lactobacillus rhamnosus and Bifidobacterium lactis modulates intestinal immune functions in rats. J Nutr 2004; 134: 153-156. [ Links ]
38.Lin DC. Probiotics as functional foods. Nutr Clin Pract 2003; 18: 497-506. [ Links ]
39.Yasui H, Ohwzki M. Enhancement of immune response in Peyers patch cells cultured with Bifidobacterium breve. J Dairy Sci 1991; 74: 1187-1195. [ Links ]
40.Commane DM, Shortt CT, Silvi S, Cresci A, Hughes RM, Rowland IR. Effects of fermentation products of pro- and prebiotics on transepithelial resistance in an invitro model of the colon. Nutr Cancer 2005; 51: 102-109. [ Links ]
41.Shiraga T, Miyamoto K, Tanaka H, Yamamoto H, Taketani Y, Morita K. Cellular and molecular mechanisms of dietary regulation on rat intestinal H+/Peptide transporter PepT1. Gastroenterology 1999; 116: 354-362. [ Links ]
42.Adibi SA Regulation of the intestinal oligopeptide transporter (Pept-1) in health and disease. Am J Physiol Gastrointest Liver Physiol 2003; 285: G779-G788. [ Links ]
43.Ferraris RP. Dietary and developmental regulation of intestinal sugar transport. Biochem J 2001; 360: 265-276. [ Links ]
44.Yang SC, Chen JY, Shang HF, Cheng TY, Tsou SC, Chen JR. Effect of synbiotics on intestinal microflora and digestive enzyme activities in rats. World J Gastroenterol 2005; 11: 7413-7417. [ Links ]
45.Demirer S, Aydintug S, Aslim B, Kepenecki I, Sengul N, Evirgen O et al. Effects of probiotics on radiation-induced intestinal injury in rats. Nutrition 2006; 22: 179-186. [ Links ]
46.Dock DB, Aguilar-Nascimento JE, Latorraca MQ. Probiotics enhance the recovery of gut atrophy in experimental malnutrition. Biocell 2004; 28: 143-150. [ Links ]
47.Smirnov A, Perez R, Amit-Romach E, Sklan D, Uni Z. Mucin dynamics and microbial populations in chicken small intestine are changed by dietary probiotic and antibiotic growth promoter supplementation. J Nutr 2005; 135: 187-192. [ Links ]
48.Barrenetxe J, Aranguren P, Grijalba A, Martínez-Peñuela JM, Marzo F, Urdaneta E. Effect of dietary quercetin and sphingomyelin on intestinal nutrient absorption and animal growth. Br J Nutr 2006; 95: 455-461. [ Links ]
![]() Dirección para correspondencia
Dirección para correspondencia
Dra. Elena Urdaneta
Dpto. Ciencias del Medio Natural
Universidad Pública de Navarra
Campus Arrosadía s/n
31006 Pamplona
Tfno. 948 168470
Fax: 948 168930
Correo electrónico: elena.urdaneta@unavarra.es