My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Anales del Sistema Sanitario de Navarra
Print version ISSN 1137-6627
Anales Sis San Navarra vol.30 n.2 Pamplona May./Aug. 2007
NOTAS CLÍNICAS
Fiebre, derrame pleural y lesión osteolítica en paciente con infección por VIH
Fever, pleural effusion and osteolytic lesion in a patient with HIV infection
J.I. Aláez1, J. Repáraz2, J. Castiello2, J. Úriz2, M. Barber3, J. Sola2
1. Servicio Medicina Interna. Hospital Universitario de Salamanca. Salamanca.
2. Servicio de Enfermedades Infecciosas. Hospital de Navarra. Pamplona.
3. Servicio de Cuidados Intensivos. Hospital de Navarra. Pamplona.
Dirección para correspondencia
RESUMEN
Presentamos el caso de una paciente de 28 años que consultó por fiebre de hasta 40,8ºC, dolor pleurítico en costado derecho y aparición de una masa dolorosa en la extremidad inferior izquierda de cuatro días de evolución. Mediante tomografía axial computerizada (TAC) se objetivó la existencia de una condensación en el lóbulo medio del pulmón derecho con derrame pleural asociado y patrón miliar bilateral. El estudio ecográfico de la extremidad inferior izquierda mostró una masa de partes blandas de aspecto quístico con destrucción de la cortical del peroné y destrucción ósea. La resonancia magnética confirmó la presencia de osteomielitis en el peroné izquierdo y de un absceso de partes blandas asociado. En el material obtenido por punción del citado absceso así como en tres muestras de esputo se aisló Mycobacterium tuberculosis, estableciéndose el diagnóstico de tuberculosis diseminada con afectación pulmonar miliar, osteomielitis peronea y absceso tuberculoso de partes blandas. Se inició tratamiento antituberculoso (rifampicina, isoniacida y pirazinamida) seguido, dos semanas después, de tratamiento antirretroviral (AZT, 3TC y NVP). La paciente desarrolló un cuadro de erupción cutánea generalizada que desapareció tras la sustitución de la rifampicina por etambutol. Ante la persistencia de la masa de partes blandas, tras cinco semanas de tratamiento antituberculoso se procedió al drenaje quirúrgico del absceso. La evolución posterior fue favorable, permaneciendo la paciente asintomática al mes de ser dada de alta.
Palabras clave. Tuberculosis. HIV. Osteomielitis. Absceso. Tratamiento.
ABSTRACT
We present the case of a 28 year old patient who came for consultation on a fever of up to 40.8º C, pleuritic pain on the right side and the appearance of a painful mass in the lower left extremity of four days evolution. Computerised axial tomography (CAT) showed the existence of a condensation in the middle lobe of the right lung with associated pleural effusion and bilateral miliary pattern. The echographic study of the lower left extremity showed a mass of soft parts with a cystic aspect with destruction of the cortical of the fibula and osseous destruction. Magnetic resonance confirmed the presence of osteomyelitis in the left fibula and of an abscess; Mycobacterium tuberculosis was also isolated in three samples of sputum that led to a diagnosis of disseminated tuberculosis with miliary lung affectation, peroneous osteomyelitis and tuberculous abscess of the soft parts. Anti-tuberculosis treatment was started (riphampicine, isoniacide and pirazinamide) followed, two weeks later, with antiretroviral treatment (AZT, 3TC and NVP). The patient developed a clinical picture of generalised cutaneous eruption that disappeared following the replacement of the riphampicine by etambutol. Due to the persistence of the mass of soft parts following five weeks of anti-tuberculosis treatment, we proceeded to surgical draining of the abscess. The subsequent evolution was favourable, with the patient remaining asymptomatic one month after hospital discharge.
Key words. Tuberculosis. Osteomyelitis. Abscess. Treatment.
Introducción
La incidencia de tuberculosis (TBC) es mucho mayor en pacientes con infección por VIH que en la población general1. Su localización más frecuente es la pulmonar, pero hasta el 20% de los pacientes tienen afectación extrapulmonar, principalmente a nivel osteoarticular, gastrointestinal y del sistema nervioso central. La TBC osteoarticular supone el 10% de las afecciones extrapulmonares2. Su forma de presentación más común es la espondilodiscitis (50%), seguida de la artritis de grandes articulaciones extra-axiales (30%), la osteomielitis (15%) y la tenosinovitis (3%)3.
El curso clínico de la osteomielitis tuberculosa suele ser insidioso, lo que a menudo retrasa el diagnóstico durante meses o incluso años. Predominan el dolor y la inflamación local, sin obtenerse respuesta al tratamiento analgésico y antibiótico convencional.
Las técnicas de imagen son poco sensibles y específicas en las fases precoces, mostrando lesiones osteolíticas indistinguibles de las producidas por otros agentes infecciosos más comunes4. La confirmación diagnóstica se establece mediante el aislamiento de Mycobacterium tuberculosis a partir de muestras obtenidas por punción o biopsia de los tejidos afectados5.
A pesar de la elevada incidencia de la enfermedad tuberculosa en pacientes con infección VIH, la osteomielitistis tuberculosa extravertebral sigue siendo una entidad infrecuente6. Su respuesta al tratamiento antituberculoso convencional suele ser satisfactoria, y sólo rara vez es preciso el desbridamiento quirúrgico7.
La etiología tuberculosa debe sospecharse en pacientes procedentes de áreas con alta prevalencia de TBC que presenten lesiones óseas destructivas, sobre todo si se asocian a abscesos de partes blandas8.
Caso Clínico
Mujer de 28 años, con infección por VIH no tratada previamente, natural de Ecuador y residente en España desde un mes antes del inicio de los síntomas. Consultó el 14 de octubre de 2006 por un cuadro de cuatro días de evolución consistente en fiebre de hasta 40,8ºC, dolor pleurítico en hemitórax derecho, tos irritativa y aparición de una masa dolorosa en el tercio medio de la extremidad inferior izquierda.
En la exploración destacó una caquexia importante, con un peso de 38 kg (IMC 16,4 Kg/m2), temperatura de 37,4ºC, saturación basal de oxígeno de 97%, abolición del murmullo vesicular en el tercio inferior del hemitórax derecho y dolor a la presión en la región externa del tercio medio de la pierna izquierda, donde se palpaba una masa fluctuante y caliente de 7x4 cm. Como datos analíticos más relevantes cabe reseñar los siguientes: hemoglobina 8,9 g/dL; leucocitos 2.700 µL (neutrófilos 1.500; linfocitos 600); plaquetas 374.000/µL; VSG 127 mm/1ª hora; proteína C reactiva 19 mg/L; glucosa 88 mg/dL; urea 26 mg/dL y creatinina 0,9 mg/dL. El recuento de linfocitos CD4 fue de 137/µL y la carga viral VIH de 278.000 copias/mL.
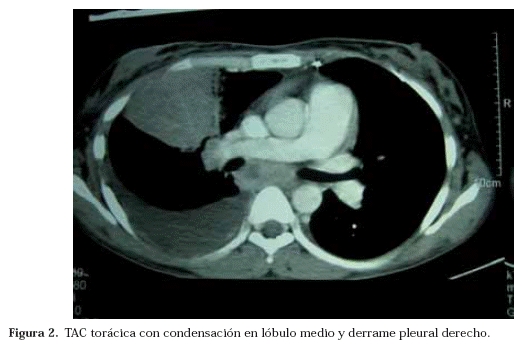
En la radiografía de tórax se apreció un derrame pleural derecho acompañado de una condensación en el campo medio homolateral (Fig. 1). La TAC torácica mostró adenopatías hiliares y mediastínicas, junto con una atelectasia del lóbulo medio, un derrame pleural derecho de moderada cuantía y un patrón nodulillar bilateral (Fig. 2). La radiografía simple de la pierna izquierda evidenció una lesión lítica en la diáfisis del peroné con destrucción cortical, medular, interrupción perióstica y presencia de una masa de partes blandas contigua a la lesión ósea (Fig. 3). Mediante el estudio ecográfico de la citada masa se comprobó su aspecto quístico y la existencia de tabiques en su interior. La resonancia magnética confirmó el diagnóstico radiológico de osteomielitis del tercio medio peróneo con rotura de la cortical y absceso de partes blandas adyacentes (Fig.4).
Se realizó una punción aspirativa de la masa de la extremidad inferior izquierda obteniéndose un material de aspecto purulento que se remitió al Servicio de Microbiología. La tinción de Ziehl-Neelsen y la detección de RNA específico de Mycobacterium tuberculosis (MTD-Gen Probe) realizadas sobre dicho material y sobre tres muestras de esputo obtenidas previamente resultaron positivas. La cepa de Mycobacterum tuberculosis aislada en cultivo a partir de las citadas muestras resultó sensible a la totalidad de agentes antituberculosos de primera línea. El líquido pleural obtenido por toracocentesis fue un exudado con niveles elevados de adenosina desaminasa (47,4 U/L) y tinción de Ziehl-Neelsen y cultivo negativos. No se realizó detección de RNA de Mycobacterium tuberculosis en líquido pleural. Los cultivos bacterianos convencionales de todas las muestras comentadas y los hemocultivos fueron negativos.
Con fecha 24 de octubre de 2006 se inició tratamiento antituberculoso con rifampicina, isoniazida y pirazinamida, y, quince días más tarde, tratamiento antirretroviral con Tenofovir + 3TC + Nevirapina. El 19 de noviembre la paciente presentó una erupción cutánea generalizada e intensamente pruriginosa que desapareció en 48 horas tras la retirada de la rifampicina y su sustitución por etambutol. El 30 de noviembre, ante la persistencia de la fiebre y de la masa fluctuante a nivel de la extremidad inferior izquierda, se practicó el drenaje quirúrgico del absceso. A partir de ese momento la curva térmica se modificó, despareciendo la fiebre por completo con la adición de prednisona al esquema terapéutico. La evolución posterior fue favorable, procediéndose al alta tras sesenta días de ingreso hospitalario.
En la primera revisión ambulatoria, realizada el 12 de enero de 2007, la paciente permanecía afebril, había ganado 7 kilos de peso y cumplía correctamente la totalidad del tratamiento con buena tolerancia clínica. En la radiografía de tórax se apreciaba la desaparición casi completa de las lesiones preexistentes, persistiendo únicamente un mínimo infiltrado paracardíaco derecho de aspecto residual. El recuento de linfocitos CD4 fue de 119/µL y la carga viral VIH indetectable (<40 copias/ml).
Discusión
La incidencia de TBC en pacientes infectados por el VIH es entre 35 y 500 veces superior a la observada en la población general1. Aunque la localización más frecuente es la pulmonar, una quinta parte de los pacientes tiene afectación extrapulmonar, principalmente a nivel osteoarticular, gastrointestinal y del sistema nervioso central. La TBC osteoarticular constituye el 10% de las TBC extrapulmonares2. Su forma de presentación más común es la espondilodiscitis (50%), seguida de la artritis de grandes articulaciones extra-axiales (30%), la osteomielitis (15%) y la tenosinovitis (3%)3.
La osteomielitis tuberculosa puede localizarse en cualquier hueso, si bien afecta con mayor frecuencia a los huesos largos. Suele ser monostótica3, y en más del 50% de los casos existe un antecedente traumático local8. La llegada de Mycobacterium tuberculosis al tejido óseo se produce por vía hematógena, afectando a la cavidad medular y produciendo una gran necrosis de la cortical. En fases más avanzadas se forman abscesos fríos que afectan a las partes blandas vecinas y que pueden llegar a fistulizar al exterior. Sólo en la mitad de los casos llega a localizarse el foco primario, siendo los principales el pulmonar (30%) y el genitourinario (20%)8,9.
A diferencia de lo ocurrido en nuestra paciente, el curso clínico de la osteomielitis tuberculosa suele ser insidioso, lo que puede retrasar el diagnóstico durante largos períodos de tiempo. En general, predominan los síntomas locales sobre los sistémicos, sin que se obtenga respuesta al tratamiento analgésico y antibiótico convencional.
En cuanto al diagnóstico, las técnicas de imagen son poco sensibles y específicas en los estadios iniciales de la enfermedad, mostrando más tarde lesiones osteolíticas indistinguibles de las producidas por otros agentes infecciosos más comunes10. La gammagrafía con Tc99, aunque más sensible que la radiología convencional, es inespecífica. El diagnóstico microbiológico se establece mediante el aislamiento de Mycobacterium tuberculosis a partir de muestras obtenidas por punción o biopsia de los tejidos afectados4. El rendimiento de los hemocultivos para micobacterias es inferior al 20%5. En el caso que aquí presentamos, el aislamiento simultáneo de Mycobacterium tuberculosis a partir de dos localizaciones no contiguas (tracto respiratorio y absceso de extremidad inferior) y la presencia de un patrón miliar en la radiografía de tórax permitieron deducir la existencia de un mecanismo de diseminación hematógena, aunque no se practicaron hemocultivos específicos para micobacterias que pudieran confirmarlo.
El diagnóstico diferencial de la osteomielitis tuberculosa debe realizarse con osteomielitis infecciosas e infecciones de partes blandas de otra naturaleza (bacterias convencionales, angiomatosis bacilar y osteomielitis fúngica), así como con lesiones tumorales primarias o metastásicas. A pesar de la elevada incidencia de enfermedad tuberculosa en pacientes con infección por VIH, la osteomielitis tuberculosa extravertebral sigue siendo una entidad infrecuente6. Con todo, su presencia debe sospecharse en pacientes procedentes de áreas con alta prevalencia de TBC que presenten lesiones óseas destructivas, especialmente si, como en el caso de nuestra paciente, se asocian a abscesos de partes blandas.
El tratamiento de la osteomielitis tuberculosa es el habitual de la TBC pulmonar (rifampicina + isoniacida + piracinamida durante dos meses, seguido de rifampicina + isoniacida durante cuatro meses más), aunque hay autores que recomiendan prolongarlo hasta un total de 9-12 meses. La respuesta suele ser satisfactoria, y sólo si existen abscesos de gran tamaño (como el que presentaba nuestra paciente) puede llegar a ser necesario el desbridamiento quirúrgico7. Por otra parte, si bien es cierto que el tratamiento médico debe iniciarse con cuatro fármacos en pacientes originarios de países con alta prevalencia de resistencia primaria a los agentes antituberculosos de primera línea, el hecho es que ninguno de los enfermos procedentes de Sudamérica tratados de tuberculosis en nuestro servicio durante el bienio 2005-2006 presentó resistencia primaria a alguno de dichos fármacos.
La administración simultánea de rifampicina y agentes antirretrovirales puede plantear diversos problemas. El primero y más importante consiste en la interacción farmacológica que se establece entre la rifampicina y los inhibidores de la proteasa (IP) del VIH, interacción que puede reducir los niveles plasmáticos del fármaco antirretroviral hasta valores subterapéuticos y, al mismo tiempo, incrementar peligrosamente los de la rifampicina hasta márgenes tóxicos. Por esta razón, la administración concomitante de rifampicina e IP se considera formalmente contraindicada. No ocurre lo mismo con los inhibidores de la transcriptasa inversa del VIH no análogos de nucleósidos (efavirenz y nevirapina), cuya interacción con la rifampicina no es lo suficientemente intensa como para contraindicar su administración conjunta11. En el caso de nuestra paciente (que presentó un episodio depresivo durante el ingreso) se optó por la nevirapina con objeto de evitar los efectos de neurotoxicidad central propios del efavirenz.
Finalmente, un problema adicional de la coadministración de rifampicina y nevirapina deriva del hecho de que ambos fármacos pueden dar lugar a reacciones de hipersensibilidad clínicamente similares. La paciente que presentamos desarrolló una de tales reacciones, que por sus características y momento de aparición se atribuyó a la rifampicina. La sustitución de ésta por etambutol se siguió de la rápida desaparición de la erupción cutánea, y la paciente continuó tomando nevirapina sin que surgieran nuevas complicaciones.
Bibliografía
1. Bureau NJ, Cardinal E. Imaging of musculoskeletal and spinal infection. Radiol Clin North Am 2001; 39: 343-355. [ Links ]
2. Rieder HL, Snider DE Jr, Cauten GM. Extrapulmonary tuberculosis in the United States: Am Rev Respir Dis 1990; 141: 347-351.
3. Soler R, Rodríguez E, Remuninan C, Santos M. MRI of musculoskeletal extraspinal tuberculosis. J Comput Assit Tomograr 2001; 25: 177-183.
4. Plate AM, Boyle BA. Musculoskeletal manifestations of HIV infection. AIDS Read 2003; 13: 62-72.
5. Inchaurraga I, Herrejón A, Plaza P, Blanquer R. Tuberculosis miliar, ganglionar, pancreática y costal. Presentación clínica y revisión bibliográfica. An Med Interna (Madrid) 2001; 18: 483-485.
6. Huth RG, Acebo R, Matthew EB. Osteitis cystica tuberculosa multiplex in a patient infectec with human inmunodeficiency virus. Clin Infect Dis 1994; 18: 260-261.
7. Chang JH, Kim SK, Lee WY. Diagnostics issues in tuberculosis of the ribs with a review of sugically proven cases. Respiratology 1994; 4: 249-253.
8. Pertuiset E, Beaudreull J, Horusitzky A, Liote F, Kemiche F, Richer J et al. Nonsurgical treatment of osteoarticular tuberculosis. A retrospective study in 143 adults. Rev Rhum Engl Ed 1999; 66: 24-28.
9. Vallejo Jg, Ong LT, Starke JR. Tuberculous osteomuelitis of the long bones in children. Pedriatr Infect Dis J 1995; 14: 542-546.
10. Griffith JF, Kumta SM, Leung PC, Cheng JC, Chow LT, Metereweli C. Imaging of musculoskeletal tuberculosis: a nem look at an old disease. Clin Orthop 2002; 398: 32-39.
11. Tuset M, López Cortés LF, Escobar I, Ribera E, Peralta FG. Interacciones que pueden comprometer la respuesta al tratamiento antirretroviral. Enferm Infecc Microbiol Clin 2006; 24; 19-28.
![]() Dirección para correspondencia:
Dirección para correspondencia:
José Ignacio Aláez Cruz
E-mail: Julio.sola.boneta@cfnavarra.es
Aceptado para su publicación el 2 de marzo de 2007.