Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.32 supl.3 Pamplona 2009
Fisiopatología y técnicas de registro de los movimientos oculares
Physiopathology and recording techniques of ocular movements
L. Gila1, A. Villanueva2, R. Cabeza2
1. Servicio de Neurofisiología Clínica. Hospital Virgen del Camino. Pamplona.
2. Departamento de Ingeniería Eléctrica y Electrónica. Escuela Técnica Superior de Ingenieros Industriales y de Telecomunicación. Universidad Pública de Navarra. Pamplona.
Dirección para correspondencia
RESUMEN
En el control de la motilidad ocular intervienen varios sistemas funcionales. Los reflejos vestíbulo-oculares y optocinéticos son respuestas automáticas para compensar los movimientos de la cabeza y del entorno visual y poder estabilizar la imagen retiniana sobre un determinado punto de fijación. Los movimientos sacádicos son rápidos desplazamientos de la fijación de un punto a otro del campo visual. Los movimientos de persecución lenta consisten en el seguimiento de estímulos móviles con la mirada. Finalmente, existen movimientos involuntarios de muy escasa amplitud que se producen durante el mantenimiento de la fijación. Cada modalidad funcional de movimiento depende de circuitos neuronales específicos que trabajan coordinadamente para codificar la contracción de los músculos oculomotores correspondiente a la posición adecuada en cada momento. Estos sistemas neuronales pueden verse alterados por múltiples procesos neurológicos de diferente naturaleza y localización dando lugar a una variada gama de trastornos oculomotores. Se revisan los aspectos más destacados de la fisiopatología y de los sistemas de registro de los movimientos oculares.
Palabras clave. Movimientos oculares. Sacadas. Seguimiento ocular. Espiga presacádica. Supresión sacádica.
ABSTRACT
A number of functional systems are involved in the control of eye movements. The vestibulo-ocular and optokinetic reflexes are automatic responses that compensate for the movements of the head and those of the visual environment in order to stabilize the retinal image on a given fixation point. The saccadic movements are quick displacements of fixation from one to another point in the visual field. The smooth pursuit movements consist in the gaze following a moving target. Finally, there are some involuntary movements of very small amplitude during fixation maintenance. Each functional modality of movement depends on specific neuronal circuits that work in a coordinated manner for encoding the contraction of the oculomotor muscles to reach an adequate position at every moment. These neuronal systems can be altered by many neurological processes of different kinds and localizations, causing a broad variety of oculomotor disturbances. The most salient aspects of the physiopathology and the recording systems of eye movements are reviewed.
Key words. Eye movements. Saccades. Eye tracking. Presaccadic spike. Saccadic suppression.
Introducción
Los sistemas neuronales implicados en la mirada, el equilibrio y la postura actúan para estabilizar el cuerpo y, junto con la visión, para proveer información sobre el entorno espacial. Los seis músculos extraoculares de cada ojo son los efectores de los movimientos de los globos oculares. Los impulsos nerviosos que controlan su contracción llegan a través de los nervios craneales tercero, cuarto y sexto cuyos núcleos se encuentran en el mesencéfalo y la protuberancia. En las motoneuronas de estos núcleos converge la información elaborada por múltiples circuitos neuronales del sistema nervioso central para codificar el grado de contracción de cada músculo en cada momento1. La musculatura intrínseca del ojo, controlada por el sistema nervioso autónomo, regula automáticamente el diámetro pupilar y la curvatura del cristalino para que los rayos luminosos del entorno puedan configurar una imagen enfocada sobre la retina. La actividad de la musculatura intrínseca (acomodación), del sistema visual (visión) y de la motilidad ocular (mirada) debe coordinarse y retroalimentarse constantemente para que tenga lugar la normal experiencia perceptiva visual.
Tipos de movimientos oculares
En el sistema oculomotor puede definirse una serie de modalidades funcionales con diferentes cometidos. Se distinguen tres tipos principales de movimientos oculares (MOs)2,3:
1. Movimientos automáticos de compensación de los movimientos de la cabeza (reflejos vestíbulo-oculares) y del entorno visual (reflejos optocinéticos) para estabilizar la imagen retiniana y posibilitar la fijación voluntaria de la mirada en un determinado punto.
2. Movimientos voluntarios para desplazar la fijación de un punto a otro del campo visual (movimientos de refijación, sacádicos, sacadas) y para perseguir con la mirada objetos móviles (movimientos de seguimiento y de vergencia).
3. Micromovimientos asociados a la fijación ocular: temblor, microsacadas y derivas.
Reflejos vestíbulo-oculares
Los movimientos de la cabeza son captados por los receptores de aceleración angular de los canales semicirculares del laberinto posterior, que emiten señales rápidamente (con un tiempo de latencia de unos 16 ms) para generar movimientos oculares que contrarrestan el desplazamiento de la cabeza asegurando la estabilidad de la imagen en la retina.
Reflejo optocinético
Permite que fijemos la mirada en un punto del campo visual, que ocupa la visión central, aunque los estímulos visuales del campo periférico estén en movimiento. El sistema optocinético asiste al sistema vestibular en los desplazamientos cefálicos de velocidad constante.
Movimientos sacádicos o de refijación
Son desplazamientos rápidos de los ojos entre dos puntos de fijación. El rastreo visual de una escena se produce mediante una sucesión de movimientos sacádicos (MSs) y las correspondientes fijaciones entre ellos. Los MSs pueden ser ejecutados voluntariamente y autoinducidos (no provocados por la aparición de un estímulo específico) o en respuesta a estímulos visuales. La mayoría de estos últimos se realizan para dirigir la mirada hacia el nuevo estímulo (prosacadas) pero también pueden alejarse de él (antisacadas). Existen MSs involuntarios como respuestas reflejas de orientación desencadenadas por la aparición súbita de un estímulo en la periferia del campo visual, y los MOs del sueño REM. En conjunto, una persona normal realiza más de 200.000 movimientos sacádicos a lo largo del día. Los movimientos sacádicos pueden caracterizarse por una serie de parámetros (Tabla 1)2,4,5.
Movimientos de seguimiento o persecución lenta
Son movimientos voluntarios conjugados de ambos ojos para mantener estabilizada la imagen foveal de estímulos que se desplazan lentamente por el campo visual. Su velocidad se adapta a la del objeto, siempre que no supere los 45o/s.
Movimientos de vergencia
Son movimientos de persecución en los que los ojos siguen direcciones opuestas. Permiten una adecuada alineación binocular en relación con la distancia del punto de fijación para proyectar la imagen sobre la retina de los dos ojos y obtener una única imagen fusionada. En los movimientos de convergencia los ojos se dirigen hacia la línea media para enfocar objetos cercanos mientras que en los movimientos de divergencia sucede lo contrario. En ambos se pueden alcanzar velocidades de unos 10o/s y amplitudes de 15o.
Fijación ocular
Cuando fijamos la mirada en un punto determinado, la imagen procedente del mismo incide en la zona de mayor resolución espacial de la retina, es decir, sobre la fóvea. Pero durante la fijación los ojos no permanecen totalmente inmóviles, por el contrario, realizan constantes movimientos involuntarios (e independientes para cada ojo) de pequeña amplitud (inferior a 1o). Inmovilizando completamente el ojo durante la fijación se esperaba que la agudeza visual aumentara al evitar la borrosidad debida a los pequeños movimientos oculares. Sin embargo en tales circunstancias se comprobó que la percepción de la imagen desaparecía6. Este fenómeno de desvanecimiento (fading), debido a la saturación de los fotorreceptores, es evitado por los micromovimientos oculares durante la fijación (Tabla 1)7.
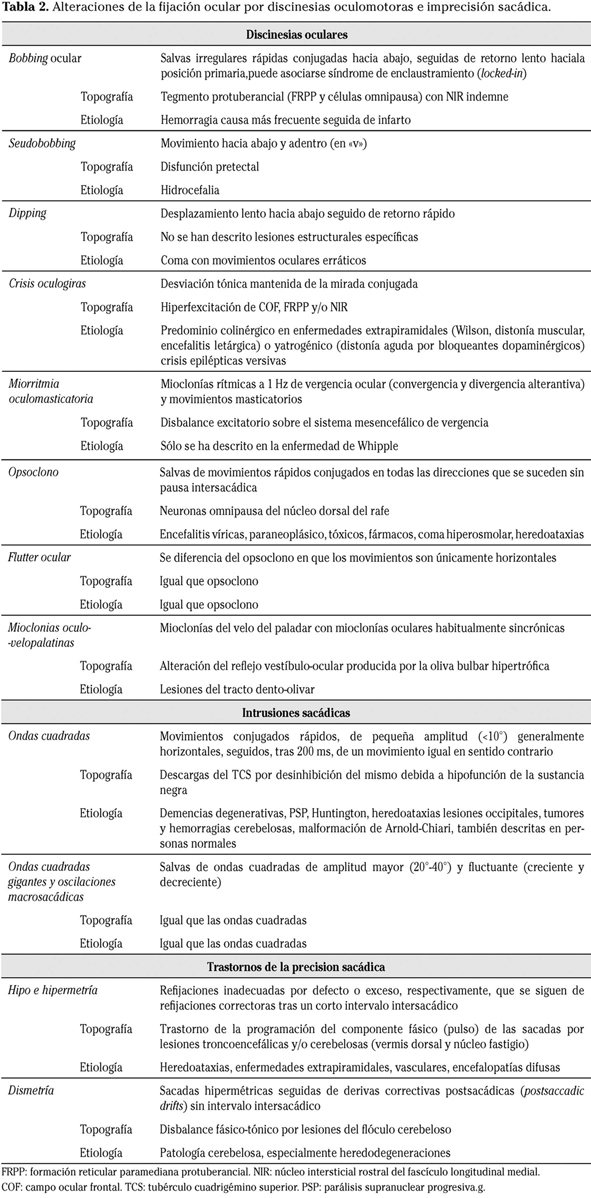
Alteraciones de los movimientos oculares
Los distintos tipos de MOs dependen de circuitos neuronales específicos cuya patología se expresa por diferentes trastornos oculomotores. A continuación se describen las principales alteraciones de cada sistema, si bien no es posible una perfecta sistematización anatomoclínica.
Sistema vestíbulo-ocular
La información sobre el movimiento de la cabeza llega de los canales semicirculares por el nervio estatoacústico a los núcleos vestibulares. Éstos se conectan con los núcleos de los nervios oculomotores ipsi y contralaterales mediante fibras que discurren por la cintilla longitudinal posterior o fascículo longitudinal medial (FLM). Los núcleos vestibulares también establecen conexiones con otras estructuras relacionadas con los movimientos sacádicos y de persecución, como son la formación reticular protuberancial paramediana (FRPP), el núcleo intersticial rostral (NIR) del FLM en la formación reticular mesencefálica y el lóbulo flóculo-nodular del cerebelo. En la FRPP se integran las señales que controlan los movimientos conjugados horizontales y en el NIR se organizan los movimientos verticales.1
El estado de este sistema puede explorarse clínicamente mediante el reflejo oculocefálico, que consiste en realizar un movimiento pasivo de giro de la cabeza (horizontal o vertical) observando la posición de los globos oculares. En condiciones normales los ojos deben mantener la posición de partida, es decir, deben realizar un movimiento relativo opuesto al giro cefálico. En pacientes conscientes la exploración selectiva de los reflejos vestíbulo-oculares (RVO) se realiza mediante registros electrooculográficos en un sillón rotatorio con los ojos cerrados. La verificación de los RVO es fundamental para determinar la naturaleza supranuclear de los déficits oculomotores, como ocurre en la parálisis supranuclear progresiva (PSP), que provoca acusadas alteraciones oculomotoras, pero con RVO normales.
Para estudiar los RVO se han utilizado multitud de protocolos utilizando sillones rotatorios y dispositivos análogos. Hoy se dispone de sistemas electrónicos e informatizados que permiten controlar los parámetros del estímulo y registrar con alta precisión las respuestas oculares. Analizando parámetros como la ganancia (cociente entre la velocidad del movimiento ocular y la velocidad de rotación de la cabeza) y la fase (relación temporal entre el inicio del movimiento cefálico y el inicio del movimiento ocular) y comparando las respuestas de ambos lados, pueden definirse patrones de afectación periférica y central, uni o bilateral del sistema vestibular8,9.
En las pruebas rotatorias, las respuestas normales consisten en la aparición de un movimiento oscilatorio asimétrico de los ojos denominado nistagmo. No existe una definición del nistagmo universalmente aceptada, siendo tal vez la menos discutida la de Megighian, puramente fenomenológica sin presuponer características específicas ni mecanismos de producción: «el nistagmo es un movimiento repetitivo e involuntario de los ojos»10. La aplicación de estímulos laberínticos, como en el sillón rotatorio o en las pruebas calóricas, provoca un desequilibrio en el estado funcional del sistema vestibular de uno y otro lado. La actividad tónica asimétrica de los núcleos vestibulares sobre los núcleos oculomotores correspondientes provoca un desplazamiento lento de los ojos contralateral al laberinto relativamente hiperfuncionante, que es corregido por un movimiento voluntario rápido de refijación (una sacada) en sentido contrario. Esta alternancia de movimientos lentos y rápidos configura el nistagmo fisiológico en estas condiciones.
En condiciones patológicas que provocan disfunción del sistema vestibular o sus conexiones pueden aparecer diferentes tipos de nistagmo. Según la dirección del movimiento (horizontal, vertical, rotatorio, retractorio o de convergencia), la relación con la mirada y la postura (espontáneo, posicional, inducido por la fijación en distintas posiciones de la mirada), junto con su amplitud, velocidad, regularidad y otras características clínicas, se han definido numerosas modalidades de nistagmo. La estimación de las dimensiones de los movimientos nistágmicos puede optimizarse con determinadas técnicas instrumentales10. La más extendida de ellas es la electronistagmografía, que es una aplicación de la electrooculografía (EOG) para registrar la variación en el tiempo de la orientación del dipolo eléctrico que forman los globos oculares11. Técnicas recientes, como la videonistagmografía, incluyen sistemas de filmación y software de análisis de imágenes9. En el electronistagmograma se miden parámetros como la amplitud y frecuencia de las sacudidas nistágmicas y la velocidad angular de la fase lenta. Estos parámetros junto con una valoración cualitativa sobre la regularidad del registro sirven para caracterizar el nistagmo, diferenciarlo de otras discinesias oculares (opsoclono, ondas cuadradas, etc.) y orientar el diagnóstico topográfico hacia la existencia de lesiones vestibulares periféricas o centrales (bulbares, pontinas, mesencefálicas), cerebelosas o hemisféricas congénitas o adquiridas12.
Sistema optocinético
La mayor parte de las aferencias de la retina periférica que sirven a los reflejos optocinéticos, se separan del tracto óptico antes del cuerpo geniculado lateral para llegar al núcleo del tracto óptico en la región pretectal. Las neuronas de este núcleo, que responden a estímulos visuales móviles, proyectan al núcleo vestibular medial (punto de convergencia entre los sistemas optocinético y vestibuloocular). Además de este circuito, existe un componente cortical que incluye el cortex estriado, el área temporal media (encrucijada témporo-parieto-occipital) y el área temporal medial superior (área 39 de Brodman). Las lesiones de estas zonas provocan alteraciones o abolición de los reflejos optocinéticos, asociadas generalmente con alteraciones de los movimientos de persecución13,14.
El nistagmo optocinético se puede inducir presentando un estímulo visual periódico (un patrón repetido) como un tambor giratorio o una cinta con franjas blancas y negras suficientemente amplias para estimular la retina periférica15. Se pide al paciente que intente contar el número de franjas para que fije la vista en la imagen móvil. La respuesta oculomotora normal consiste en un desplazamiento ocular lento en el sentido del movimiento de las franjas con sucesivas refijaciones intercaladas en sentido contrario. Estos movimientos (fase rápida del nistagmo optocinético) dependen del sistema sacádico. La frecuencia del nistagmo es variable, aunque con movimientos rápidos del estímulo puede alcanzar los 5 Hz. La cuantificación por EOG de la respuesta optocinética incluye la ganancia de la fase lenta del nistagmo (cociente entre la velocidad angular del desplazamiento de la imagen y la velocidad angular de la fase lenta), amplitud, frecuencia y velocidad de los movimientos de refijación.
Movimientos sacádicos
La mayoría de los MSs se realizan para desplazar la mirada desde un punto de interés a otro punto situado fuera del campo de visión central. Antes de ejecutar la sacada, el estímulo presente en el punto periférico no es percibido con detalle, sólo se tiene conciencia de su situación. La información espacial y la atención son fundamentales para orientar la sacada, y estas funciones cognitivas se integran en el cortex parietal posterior (área 7)16. Una vez establecida la fijación en el nuevo punto, entran en juego los mecanismos de la visión central en la corteza estriada y las áreas asociativas visuales occipitotemporales para realizar el análisis visual detallado (forma, color, etc.) del objeto allí presente.
La corteza parietal posterior envía conexiones excitadoras al tubérculo cuadrigémino superior (TCS). Su lesión induce aumento de la latencia de las sacadas e imprecisión en la localización del objetivo. Los pacientes con síndrome de Balint (producido generalmente por lesiones bilaterales de la corteza parietal posterior) realizan pocos MSs, como si no pudieran desplazar el foco de su atención desde la fóvea, por lo que sólo pueden percibir un único objeto de su campo visual en cada momento; además muestran marcadas alteraciones del seguimiento visual y ataxia óptica (dificultad para guiar los movimientos de la mano con la vista)17.
La programación motora de los MSs tiene lugar en tres áreas frontales: el campo ocular frontal (COF) en al área 8, el campo ocular suplementario (parte más rostral del área motora suplementaria) y la corteza prefrontal dorsolateral. El COF y la corteza prefrontal controlan el TCS mediante conexiones directas y a través del núcleo caudado y la sustancia negra, esta última con efecto inhibidor sobre el TCS18. Por otra parte, el COF también proyecta a las formaciones reticulares pontina (FRPP) y mesencefálica (NIR), donde las órdenes oculomotoras son codificadas para organizar los componentes horizontales y verticales de los MSs. Estos centros reticulares premotores junto con otros núcleos como el núcleo vestibular medial, el núcleo prepósito del hipogloso y el flóculo cerebeloso, intervienen también en la elaboración de los movimientos de persecución y en la fijación. Desde estos centros subcorticales las señales codificadas para determinar la posición y velocidad de los ojos llegan a los núcleos oculomotores ipsi y contralaterales a través del FLM.
La estimulación eléctrica del COF y las descargas epilépticas de dicha zona cortical provocan sacudidas de los ojos en sentido contralateral. Las lesiones del COF causan paresia de la mirada horizontal contralateral generalmente transitoria. Igualmente, las lesiones del TCS también producen alteración transitoria de los MSs porque permanece intacta la proyección desde el COF al tronco encefálico. En monos, la lesión bilateral conjunta del COF y del TCS causa la abolición permanente de los MSs. Este modelo animal es similar a la apraxia oculomotora congénita, un raro trastorno caracterizado por la abolición de los MOs sacádicos y de persecución con conservación del reflejo oculocefálico19.
Las lesiones de la corteza prefrontal (sistema inhibidor fronto-nígrico) producen un estado de desinhibición de las respuestas del TCS a señales parietales de atención sobre los estímulos visuales. Esto se manifiesta por la sucesión de frecuentes sacadas de latencia corta (express) y por dificultad para suprimir las sacadas no deseadas frente a estímulos visuales, como se evidencia explorando movimientos antisacádicos: solicitando al paciente que ejecute un movimiento ocular de alejamiento con respecto al estímulo presentado20.
Movimientos de persecución lenta
Mediante el sistema de persecución lenta los ojos igualan la velocidad de un determinado objetivo móvil. Las neuronas que controlan la velocidad ocular en la persecución se localizan en el núcleo vestibular medial y en el núcleo prepósito del hipogloso, que reciben proyecciones del flóculo cerebeloso y conectan con los núcleos oculomotores. Las neuronas de la FRPP también intervienen en los movimientos de persecución y reciben señales procedentes del vermis cerebeloso. A estas áreas llegan órdenes de la corteza cerebral a través del núcleo dorsolateral pontino. Las áreas corticales implicadas incluyen el área visual temporal media (encrucijada témporo-parieto-occipital y área temporal medial superior) y el COF. Las áreas temporales, que reciben proyecciones del cortex estriado, proporcionan información sensitiva para guiar los movimientos de persecución, pero la iniciación del movimiento depende del COF16,21.
La lesión de cualquiera de las estructuras relacionadas (corticales, cerebelosas o troncoencefálicas) altera la ejecución de los movimientos de persecución, mostrando retraso en su inicio y menor velocidad que el estímulo (ganancia disminuida), teniendo que incorporar pequeños MSs de aproximación17,22,23. Suelen coexistir alteraciones de las respuestas optocinéticas, cuyas vías cerebrales comparten con las del sistema de seguimiento visual. La EOG puede cuantificar con exactitud la ganancia de persecución o cociente entre la velocidad angular del estímulo visual y la de los ojos. Los sedantes, el alcohol, la fatiga y la edad avanzada también disminuyen la eficiencia de estos movimientos, apareciendo persecución sacadizada, con velocidades superiores a 45o/s24.
Fijación ocular
Varios núcleos neuronales del tronco cerebral intervienen en la elaboración de los movimientos voluntarios y en el mantenimiento de la fijación. La FRPP y el NIR contienen interneuronas excitadores con patrones específicos de descarga (células en ráfaga fásicas y células tónicas). En el núcleo dorsal del rafe hay neuronas inhibidoras de las neuronas en ráfaga (células omnipausa) y en la parte rostral del TCS hay neuronas relacionadas con la fijación que inhiben al TCS al tiempo que excitan a las neuronas omnipausa protuberanciales. Las neuronas inhibitorias impiden los MOs no deseados y su disfunción provoca inestabilidad de la fijación (como en los nistagmos congénitos), aparición de movimientos discinéticos que interfieren con la fijación e imprecisiones en la ejecución sacádica (Tabla 2)19.
Trastornos oculomotores en enfermedades difusas o multifocales del sistema nervioso central
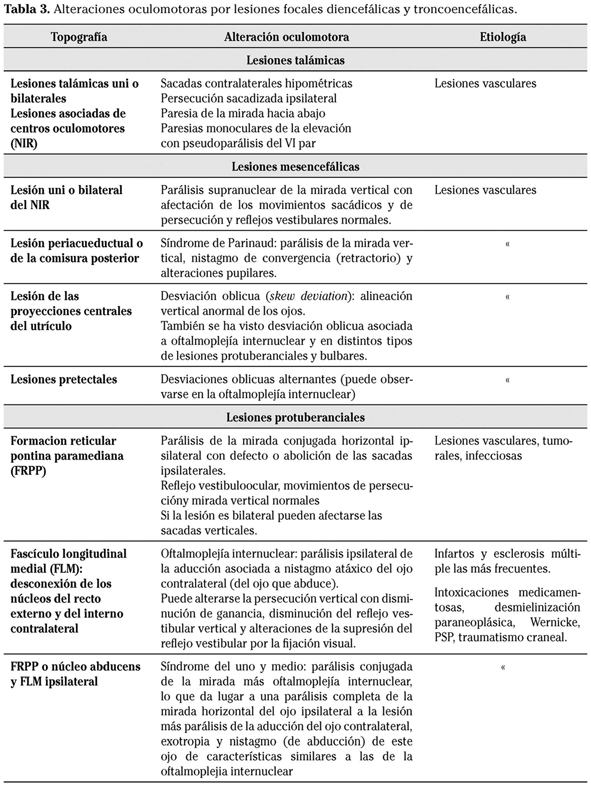
En los apartados precedentes se ha seguido una sistemática fisiopatológica, haciendo referencia a los distintos sistemas oculomotores, las áreas y conexiones neuronales relacionados y los trastornos derivados de la lesión de dichas estructuras17. En la Tabla 3 se completa este repaso topográfico con los trastornos producidos por lesiones focales troncoencefálicas y diencefálicas19. A continuación nos referiremos a distintas entidades que producen afectación difusa o multifocal del sistema nervioso central y que cursan con diversos tipos de alteraciones oculomotoras.
Entre la patología extrapiramidal destaca la PSP, paradigma de oftalmoparesia supranuclear, con liberación de los reflejos oculocefálicos, RVO y optocinéticos. Los MSs (verticales sobre todo) son lentos e hipométricos, la realización de antisacadas es deficiente (expresión de la afectación prefrontal) y la persecución muestra ganancia disminuida e intrusiones de pequeñas sacadas correctivas (persecución sacadizada o rueda dentada ocular). La fijación ocular es inestable con presencia de ondas cuadradas y frecuentes sacadas express. La degeneración corticobasal (otra taupatía, como la PSP) cursa con anomalías oculomotoras similares, aunque presenta algún rasgo distintivo como el marcado aumento de la latencia de los MSs, relacionado con la afectación del cortex parietal posterior en esta enfermedad. En la corea de Huntington pueden observarse trastornos supranucleares similares a la PSP pero menos acusados. En la enfermedad de Parkinson la anomalía más característica es el aumento de latencia de los MSs; en fases avanzadas puede observarse alteraciones de la persecución y ondas cuadradas25,26.
En la ataxia de Friedreich y demás heredodegeneraciones espinocerebelosas y atrofias multisistémicas, la afectación del núcleo dentado es prácticamente constante, lo que se manifiesta por frecuentes alteraciones oculomotoras de tipo cerebeloso como dismetrías, ondas cuadradas, aumento de la ganancia de los RVO y nistagmos cerebelosos (nistagmo de rebote, nistagmo posicional). A estas anomalías se suman alteraciones sacádicas y de la persecución de intensidad variable y discinesias, como el opsoclonus, frecuente en la atrofia dentato-rubro-pálido-luysiana.
Otros muchos procesos de naturaleza carencial, metabólica adquirida o congénita (enfermedad de Gaucher, Nieman-Pick), mitocondrial (Kearns-Sayre, Leigh), priónica, farmacológica (anticomiciales, psicofármacos) o tóxica (talio, litio, tolueno) pueden cursar con alteraciones oculomotoras diversas19,27,28. Particularmente frecuentes y características son las que acompañan a la encefalopatía de Wernicke (similares a las de la enfermedad de Leigh) que incluyen nistagmo, parálisis del sexto par y de la mirada horizontal y oftalmoplejía internuclear29.
Trastornos oculomotores en patología psiquiátrica
La patología psiquiátrica merece especial consideración por su significación histórica y por las destacadas contribuciones a la investigación de los MOs producidas en ese ámbito. En 1908, Diefendorf y Dodge publicaron los primeros registros de MOs realizados con técnicas fotográficas en enfermos neuropsiquiátricos (manía, depresión, demencia precoz, epilepsia). Estos autores definieron parámetros como velocidad y tiempo de reacción (latencia) y propusieron la tipificación de los MOs que manejamos actualmente (sacádicos, persecución, reflejos compensatorios). Pese a lo prometedor de sus resultados y quizá por la compleja metodológica requerida, prácticamente no se realizaron nuevos estudios en este terreno hasta 65 años después. Sin embargo, a partir de entonces y hasta nuestros días, la investigación de los MOs en Psiquiatría se han desarrollado enormemente, organizándose dos líneas bien diferenciadas según el tipo de movimiento (sacádico o persecución lenta) al que se dedican30.
La demostración de dificultades para ejecutar antisacadas y para inhibir sacadas reflejas no deseadas inducidas por estímulos visuales en pacientes epilépticos sometidos a resecciones frontales31 condujo a investigar estos fenómenos en la esquizofrenia32, en la que se asume la existencia de un disfunción del córtex prefrontal dorsolateral (donde se han documentado diversas alteraciones neuropatológicas) y sus conexiones con el cuerpo estriado, relacionándose los síntomas positivos de la enfermedad con un desequilibrio hiperdopaminérgico a dicho nivel33. En consonancia con estos trastornos se han descrito alteraciones antisacádicas, si bien no son específicas de la esquizofrenia, apareciendo también en el trastorno bipolar, depresión y en el déficit de atención-hiperactividad30,34. En pacientes esquizofrénicos y familiares de primer grado35, así como en el trastorno esquizoafectivo, también se han descrito alteraciones de la latencia y la precisión de los MSs dirigidos a un estímulo (prosacádicos) y de los movimientos de persecución, con retraso en el inicio y lentificación e intrusiones sacádicas en el curso de los mismos36. Las alteraciones oculomotoras se consideran un marcador biológico de esquizofrenia aplicable a la detección precoz de personas con riesgo de desarrollar la enfermedad37.
Los paradigmas de estudio desarrollados se han aplicado no sólo a las enfermedades psiquiátricas sino también a la investigación neuropsicológica y farmacológica, constituyendo las medidas oculomotoras un biomarcador para evaluar la influencia de los fármacos en las funciones cognitivas (volición, memoria de trabajo, inhibición, predicción, etc.)5,27.
Técnicas de registro de los movimientos oculares
Las primeras aproximaciones a la fisiología de los MOs se realizaron en la segunda mitad del siglo XIX mediante observación directa y con espejos. Los avances en la fotografía posibilitaron los primeros registros a principios del siglo XX (Dodge, Cline, Diefendorf) mediante un fotocronógrafo. El sistema consistía en la impresión del reflejo luminoso corneal con una cámara dotada de lentes de aumento sobre una película deslizante con control de su velocidad de desplazamiento. Para mejorar los registros se introdujeron algunas modificaciones invasivas, como la colocación en el ojo de gotas reflectantes o de finos espejos en forma de ventosa30.
Para aplicaciones médicas las técnicas más desarrollados han sido las electrofisiológicas (la EOG en particular) basadas en las propiedades bioeléctricas del ojo. En el globo ocular existe una diferencia de potencial de alrededor de 1 mV entre la córnea (positiva), en el polo anterior, y el epitelio pigmentario de la retina (negativa), en el polo posterior10. Esta diferencia de potencial permite considerar al ojo como un dipolo y representarlo como un vector sobre su eje anteroposterior. El campo eléctrico generado por este dipolo puede registrarse mediante electrodos colocados alrededor de la órbita. La magnitud del potencial generado por el dipolo y su polaridad en un determinado momento dependen del ángulo que forme con respecto a los electrodos, lo cual permite correlacionar las variaciones del potencial (del voltaje) con los MOs, con buena resolución temporal (Fig. 1)11.
Una modalidad de la EOG es la electronistagmografía, para el estudio específico de los nistagmos y de los RVO mediante la combinación del registro oculográfico con la aplicación de estímulos vestibulares mediante sillones giratorios u otros dispositivos10. Todos los métodos de estudio de los MOs, sea con EOG o con otros sistemas, implican el análisis de la relación entre distintos parámetros de los MOs y otras variables como la latencia entre la aparición de un estímulo y el inicio de un movimiento sacádico o antisacádico. Por lo tanto, el oculograma siempre se combina con algún tipo de estimulación o de registro. Las modalidades más recientes incluyen protocolos de estimulación magnética transcraneal38 y obtención de imágenes de las áreas cerebrales relacionadas con las funciones visuales y oculomotoras mediante resonancia magnética funcional13,39.
Además de una buena resolución temporal, como ofrece la EOG, otras técnicas brindan una mayor definición espacial, determinando la trayectoria de los MOs y también cefálicos. Tal es el caso de la técnica de bobina escleral en campo magnético (scleral search coil) que se basa en la interacción de un campo magnético con una bobina situada sobre la esclerótica mediante una lente de contacto y que genera señales eléctricas que traducen las posiciones ocular y cefálica40,41.
Por otra parte, los métodos videooculográficos permiten realizar registros sin elementos invasivos y con relativa libertad de movimientos de la cabeza, pudiendo realizar registros durante diversas actividades. El método más sencillo es la filmación directa del ojo con una videocámara y el análisis posterior de las posiciones y trayectorias oculares utilizando la reflexión luminosa corneal o la técnica de Purkinje. Esta última, muy utilizada en estudios sobre lectura, se basa en la diferencia de posición del reflejo luminoso en los medios de refracción ocular (entre la imagen reflejada en la superficie externa de la córnea y la de la superficie interna del cristalino).
El enorme desarrollo que han tenido los sistemas informáticos en las últimas décadas, tanto en recursos hardware como software, hace posible el procesamiento de imágenes complejas en tiempo real. Los sistemas actuales de monitorización o rastreo de los MOs (eye tracking o gaze tracking)42 permiten captar con videocámaras el movimiento ocular con una resolución espacial de 0,2o y frecuencias de muestreo de 1 kHz utilizando la diferencia de distancias entre el punto de reflexión de la luz infrarroja (proporcionada por diodos LEDs emisores de infrarrojos) sobre el limbo corneal y el punto central de reflexión retiniana a través de la apertura pupilar43,44. Los primeros sistemas requerían inmovilización de la cabeza y calibración de las posiciones oculares. Después se diseñaron dispositivos fijados a la cabeza y actualmente se están desarrollando sistemas estereoscópicos utilizando dos cámaras y con algoritmos basados en redes neuronales artificiales45 con el objetivo de obviar la necesidad de calibración. Tal nivel de versatilidad está ampliando sustancialmente el campo de aplicación de los registros de MOs. Además de las aplicaciones al diagnóstico neuro-oftalmológico y a la investigación psicofísica de procesos cognitivos, el funcionamiento de los sistemas de eye tracking en tiempo real hace posible su utilización como interface con ordenadores o máquinas (de especial interés para personas discapacitadas)46, para la adaptación individualizada de lentes progresivas mediante el análisis de las zonas de visión preferencial o para monitorizar los MOs durante la conducción de vehículos47.
El Departamento de Ingeniería Eléctrica y Electrónica de la Universidad Pública de Navarra ha contribuido a la investigación y desarrollo tecnológico de los sistemas de eye tracking en aspectos como modelado geométrico de la orientación pupilar48, formulación de algoritmos robustos de seguimiento ocular49, optimización de la calibración50,51 y aplicaciones en discapacidades52.
Potenciales presacádicos
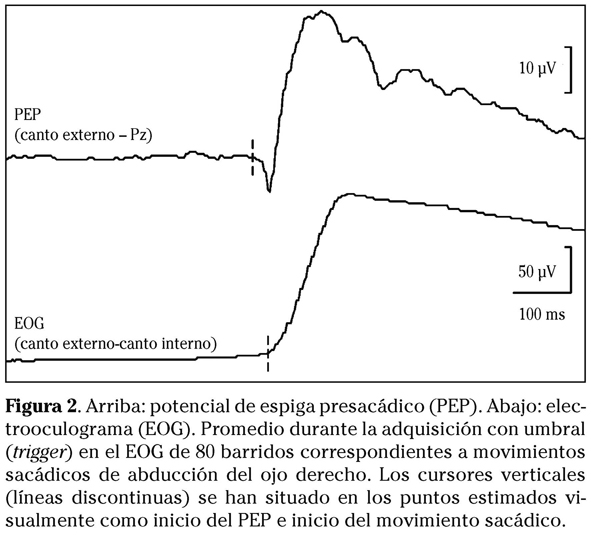
La actividad bioeléctrica de las áreas cerebrales implicadas en los MSs, que tiene lugar antes del inicio de los mismos (potenciales presacádicos), puede extraerse de la señal EEG registrando con un electrodo activo en el canto externo del ojo y un electrodo de referencia en línea media parietal (Pz). Simultáneamente debe registrarse el electrooculograma para determinar el inicio de los movimientos. Para visualizar los potenciales presacádicos es necesario promediar la actividad EEG que precede a un cierto número de sacadas (promediación retrógrada). Con esta metodología se obtienen tres potenciales: un potencial premotor negativo (PMN), un potencial promotor positivo (PMP) y el llamado potencial de espiga presacádico (PEP)53.
El PMN (promotor negativity), que precede al movimiento sacádico en 800-1000 ms, corresponde a la actividad de la corteza parietal parietal posterior (área 7 de Brodman), relacionada con la atención y preparación del movimiento (potencial preparatorio, readiness potential o bereitschaftspotential) y tiene las mismas características que los potenciales premovimiento de las extremidades. El PMN aparece cuando las sacadas se ejecutan voluntariamente, no en las que se desencadenan de forma refleja. Tampoco aparece antes de los MSs del sueño REM. El PMP (promotor positivity) aparece de 100 a 250 ms antes del inicio de la sacada y se corresponde con la formulación del plan motor en el COF (área 8)54. El PEP (Fig. 2), que aparece hasta 20 ms antes de la sacada, representa la actividad de las unidades motoras de los músculos extraoculares, principalmente de las fibras musculares55. Este último es el potencial más reproducible de los tres, aún así, los parámetros estudiados (como la amplitud del PEP o latencia entre los respectivos inicios del PEP y del movimiento sacádico) muestran un amplio rango de variación56. Parte de esa variabilidad depende de la definición de los puntos de referencia para las mediciones y de los algoritmos de premediación57. Nosotros hemos realizado un estudio preliminar de este problema utilizando procedimientos automáticos para establecer estos puntos de referencia offline, con resultados prometedores58. Minimizando la variabilidad podrían delimitarse rangos de normalidad más estrechos, lo que favorecería su aplicación al estudio de patologías oculomotoras de origen neuromuscular, escasamente desarrollado hasta ahora59.
Supresion sacádica
El estudio de las relaciones entre percepción visual y motilidad ocular ha generado gran cantidad de experimentación y de especulación teórica. Un fenómeno bien conocido en el medio clínico es la degradación del potencial evocado visual que ocurre cuando el paciente no mantiene la fijación en el punto central del patrón reversible (pattern reversal) en la pantalla de estimulación (Fig. 3)60. Probablemente el defecto en el enfoque, con el consiguiente deterioro de la imagen retiniana, sea el factor que más influya en la caída del potencial visual, pero no el único.
En el siglo XIX se observó que durante la lectura los ojos no realizan movimientos continuos suaves a lo largo de las líneas del texto sino rápidos saltos sacádicos y fijaciones intercaladas. Para obtener la natural experiencia de continuidad perceptiva sin interferencias por imágenes distorsionadas durante los MOs, ya entonces Von Helmholtz, Holtz y otros psicofísicos postularon la existencia de una interrupción de la percepción visual o, en la interpretación de Holtz, «una momentánea anestesia visual central» durante las sacadas1. Una sencilla prueba como es la imposibilidad de observar el movimiento de nuestros propios ojos en un espejo, permite comprobar el fenómeno de supresión sacádica.
Aunque persiste la controversia sobre la intervención de mecanismos retinianos y centrales en la supresión, se han aportado abundantes evidencias experimentales de la existencia de una atenuación perceptiva que tiene lugar entre 20-60 ms antes y 160-200 ms después del inicio del movimiento sacádico61. Esto se ha documentado con diferentes paradigmas psicofísicos62,63 y neurofisiológicos64,65 en humanos y en monos, así como en estudios recientes de resonancia magnética funcional66 que permiten analizar las áreas cerebrales implicadas. En general son métodos complejos, aplicables en el ámbito de la investigación. Es esperable que los nuevos sistemas de eye tracking permitan simplificar los protocolos de estudio y faciliten la incorporación a la práctica clínica del análisis de la supresión sacádica, la conducta exploratoria visual y las habilidades visuoespaciales en diferentes patologías.
Bibliografía
1. Goldberg ME. The gaze control. En: Kandel ER, Schwartz JH, Jessell TM, editores. Principles of neural science. 4th ed. Nueva York: McGraw-Hill 2000: 782-800. [ Links ]
2. Carpenter RHS. Eye movements. Londres: Macmillan 1991. [ Links ]
3. Pons AM, Martínez FM. Fundamentos de visión binocular. Valencia: Universidad de Valencia 2004. [ Links ]
4. Young LR, Sheena D. Eye-movement measurement techniques. Am Psychol 1975; 30: 315-330. [ Links ]
5. Smyrnis N. Metric issues in the study of eye movements in psychiatry. Brain Cogn 2008; 68: 341-358. [ Links ]
6. Tulunay-Keesey U. Fading of stabilized retinal images. J Opt Soc Am 1982; 72: 440-447. [ Links ]
7. Martínez-Conde S, Macknik SL, Troncoso XG, Dyar TA. Microsaccades counteract visual fading during fixation. Neuron 2006; 49: 297-305. [ Links ]
8. Wuyts FL, Furman J, Vanspauwen R, Van de Heyning P. Vestibular function testing. Curr Opin Neurol 2007; 20: 19-24. [ Links ]
9. Pérez N. Análisis tridimensional del reflejo vestíbulo-oculomotor calórico y rotatorio en población normal y efectos del envejecimiento. An Sist Sanit Navar 2002; 25: 357-359. [ Links ]
10. Bartual J, Pérez N. El sistema vestibular y sus alteraciones. Masson, Barcelona, 1998. [ Links ]
11. Brown M, Marmor M, Vaegan, Zrenner E, Brigell M, Bach M. ISCEV. ISCEV standard for clinical electro-oculography (EOG) 2006. Doc Ophthalmol 2006; 113: 205-212. [ Links ]
12. Lavin PJM. Trastornos de los movimientos oculares: diplopía, nistagmo y otras oscilaciones oculares. En: Bradley WG, Daroff RB, Fenichel GM, Jankovic J, editores. Neurología Clínica. 4a ed. Madrid: Elsevier España 2004: 199-216. [ Links ]
13. Konen CS, Kleiser R, Seitz RJ, Bremmer F. An fMRI study of optokinetic nystagmus and smooth-pursuit eye movements in humans. Acta Otolaryngol Suppl 1994; 511: 131-134. [ Links ]
14. Lavin PJM, Donahue SP. Neurooftalmología: sistema motor ocular. En: Bradley WG, Daroff RB, Fenichel GM, Jankovic J, editores. Neurología Clínica. 4a ed. Madrid: Elsevier España 2004: 697-722. [ Links ]
15. Dell´Osso LF, Daroff RB. Características y técnicas de registro de los movimientos oculares. En: Glasser JS, editor. Neurooftalmología. Barcelona: Salvat 1982: 181-194. [ Links ]
16. Pierrot-Deseilligny C. Circuits oculomoteurs céntraux. Rev Neurol 1985; 141: 349-370. [ Links ]
17. Pierrot-Deseilligny C. Saccade and smooth-pursuit impairment after cerebral hemispheric lesions. Eur Neurol 1994; 34: 121-134. [ Links ]
18. McDowell JE, Dyckman KA, Austin BP, Clementz BA. Neurophysiology and neuroanatomy of reflexive and volitional saccades: evidence from studies of humans. Brain Cogn 2008; 68: 255-270. [ Links ]
19. Miquel F. Trastornos supranucleares de la motilidad ocular. En: Codina A, editor. Tratado de Neurología. Madrid: ELA 1994: 748-745. [ Links ]
20. Goldman-Rakic PS, Selemon LD. Functional and anatomical aspects of prefrontal pathology in schizophrenia. Schizophr Bull 1997; 23: 437-458. [ Links ]
21. Lencer R, Trillenberg P. Neurophysiology and neuroanatomy of smooth pursuit in humans. Brain Cogn 2008; 68: 219-228. [ Links ]
22. Lekwuwa GU, Barnes GR. Cerebral control of eye movements I. The relationship between cerebral lesion sites and smooth pursuit deficits. Brain 1996; 119: 473-90. [ Links ]
23. Sharpe JA. Neurophysiology and neuroanatomy of smooth pursuit: Lesion studies. Brain Cogn 2008; 68: 241-254. [ Links ]
24. Kanayama R, Nakamura T, Sano R, Ohki M, Okuyama T, Kimura Y, Koike Y. Effect of aging on smooth pursuit eye movement. Exp Brain Res 2005; 165: 203-216. [ Links ]
25. Stell R, Bronstein AM. Eye movements abnormalities in extrapyramidal disease. En: Marsden CD, Fahn S, editores. Moviment disorders. 3rd ed. Oxford: Butterworth-Heinemann, 1994: 88-113. [ Links ]
26. Junqué C, Roig C, Vendrell P, Grau JM, Bruna O. Relación entre las alteraciones visoespaciales y los parámetros oculomotores en la enfermedad de parkinson. Psicothema 2000; 12: 187-191. [ Links ]
27. Reilly JL, Lencer R, Bishop JR, Keedy S, Sweeney JA. Pharmacological treatment effects on eye movement control. Brain Cogn 2008; 68: 415-435. [ Links ]
28. Andonegui J. Manifestaciones oculares de las enfermedades sistémicas. An Sist Sanit Navar 2008; 31 (Supl. 3): 7-11. [ Links ]
29. Squirrell D, Shipman T, Rennie I. Wernicke encephalopathy. Arch Ophthalmol 2004; 122: 418-419. [ Links ]
30. Klein C, Ettinger U. A hundred years of eye movement research in psychiatry. Brain Cogn 2008; 68: 215-218. [ Links ]
31. Guitton D, Buchtel HA, Douglas RM. Frontal lobe lesions in man cause difficulties in suppressing reflexive glances and in generating goal-directed saccades. Exp Brain Res 1985; 58: 455-472. [ Links ]
32. Weinberger DR, Berman KF, Zec RF. Physiologic Dysfunction of Dorsolateral Prefrontal Cortex in Schizophrenia I. Regional cerebral blood flow evidence. Archives of General Psychiatry 1986; 43: 114-124. [ Links ]
33. Freedman R. Schizofrenia. N Eng J Med 2003; 349: 1738-1749. [ Links ]
34. Gooding DC, Basso MA. The tell-tale tasks: A review of saccadic research in psychiatric patient populations. Brain Cogn 2008; 68: 371-390. [ Links ]
35. Calkins ME, Iacono WG, Ones DS. Eye movement dysfunction in first-degree relatives of patients with schizophrenia: a meta-analytic evaluation of candidate endophenotypes. Brain Cogn 2008; 68: 436-461. [ Links ]
36. O´Driscoll GA, Callahan BL. Smooth pursuit in schizophrenia: a meta-analytic review of research since 1993. Brain Cogn 2008; 68: 359-370. [ Links ]
37. Keshavan MS, Diwadkar VA, Montrose DM, Rajarethinam R, Sweeney JA. Premorbid indicators and risk for schizophrenia: a selective review and update. Schizophr Res 2005; 79: 45-57. [ Links ]
38. Müri RM, Nyffeler T. Neurophysiology and neuroanatomy of reflexive and volitional saccades as revealed by lesion studies with neurological patients and transcranial magnetic stimulation (TMS). Brain Cogn 2008; 68: 284-292. [ Links ]
39. Kimmig H, Greenlee MW, Huethe F, Mergner T. MR-Eyetracker: a new method for eye movement recording in functional magnetic resonance imaging. Exp Brain Res 1999; 126: 443-449 [ Links ]
40. Bremen P, Van der Willigen RF, Van Opstal AJ. Applying double magnetic induction to measure two-dimensional head-unrestrained gaze shifts in human subjects. J Neurophysiol 2007; 98: 3759-3769. [ Links ]
41. Boleas-Aguirre M, Migliaccio AA, Carey JP Registro del reflejo vestibulooculomotor con la técnica de la bobina corneal en campo magnético (scleral search coil). Revisión de afecciones vestibulares periféricas. Acta Otorrinolaringol Esp 2007; 58: 321-326. [ Links ]
42. Villanueva A, Cabeza R. Models for gaze tracking systems. Journal on Image and Video Processing 2007; Article ID 23570. [ Links ]
43. Villanueva A, Cabeza R. Evaluation of corneal refraction in a model of a gaze tracking system. IEEE Trans Biomed Eng 2008; 55: 2812-2822. [ Links ]
44. Duchowsky AT. Eye tracking methodology. Springer Verlag, Berlín, 2003. [ Links ]
45. Zhiwei Z, Qiang J. Robust real-time eye detection and tracking under variable lighting conditions and various face orientations. Computer Vision and Image Understanding 2005; 98: 124-154. [ Links ]
46. Jacob R, Karn K. Eye tracking in human-computer interaction and usability research. Elsevier Science, Oxford, 2003. [ Links ]
47. Qiang J, Zhiwei Z, Peilin L. Real time non-intrusive monitoring and prediction of driver fatigue. IEEE Transactions on Vehicular Technology 2004; 53: 1052-1068. [ Links ]
48. Villanueva A, Cabeza R, Porta S. Eye tracking: pupil orientation geometrical modeling. Image and Vision Computing 2006; 24: 663-667. [ Links ]
49. Goñi S, Echeto J, Villanueva A, Cabeza R. Robust algorithm for pupil-glint vector detection in a video-oculography eyetracking system. Proceedings of the 17th International Conference on Pattern Recognition (ICPR´04) 2004; 4: 941-944. [ Links ]
50. Villanueva A, Cabeza R. A novel gaze estimation system with one calibration point. IEEE Trans Syst Man Cybern B Cybern 2008; 38: 1123-1138. [ Links ]
51. Cerrolaza, Villanueva A, Cabeza R. Taxonomic study of polynomial regressions applied to the calibration of video-oculographic systems. Proceedings of the 2008 symposium on eye tracking research and applications 2008: 259-266. [ Links ]
52. Blanco Y, Villanueva A, Cabeza R. Síntesis visual del habla. An Sist Sanit Navar 2000; 23: 41-66. [ Links ]
53. Brooks-Eidelberg BA, Adler G. A frontal cortical potential associated with saccades in humans. Exp Brain Res 1992; 89: 441-416. [ Links ]
54. Thickbroom GW, Mastaglia FL. Cerebral events preceding self-paced and visually triggered saccades. A study of presaccadic potentials. Electroencephalogr Clin Neurophysiol 1985; 62: 277-289. [ Links ]
55. Riemslag FC, Van der Heijde GL, Van Dongen MM, Ottenhoff F. On the origin of the presaccadic spike potential. Electroencephalogr Clin Neurophysiol 1988; 70: 281-287. [ Links ]
56. Boylan C, Doig HR. Presaccadic spike potential to horizontal eye movements. Electroencephalogr Clin Neurophysiol 1988; 70: 559-562. [ Links ]
57. Shan Y, Moster ML, Roemer RA. The effects of time point alignment on the amplitude of averaged orbital presaccadic spike potential (SP). Electroencephalogr Clin Neurophysiol 1995; 95: 475-477. [ Links ]
58. Castle MM, Villanueva A, Cabeza A, Gila L. Variabilidad del potencial de espiga presacádico. Análisis preliminar. Rev Neurol 2008; 47: 551-552. [ Links ]
59. Boylan C, Doig HR. Presaccadic spike potential with congenital lateral rectus palsy. Electroencephalogr Clin Neurophysiol 1989; 73: 264-267. [ Links ]
60. Saarinen J. Shifts of visual attention at fixation and away from fixation. Vision Res 1993; 33: 1113-1117. [ Links ]
61. Michael JA, Stark L. Electrophysiological correlates of saccadic suppression. Exp Neurol 1967; 17: 233-246 [ Links ]
62. Mitrani, L, Yakimoff, N, Mateeff ST. Saccadic suppression in the presence of structured background. Vision Res 1973; 13: 517-521. [ Links ]
63. Volkmann FC. Human visual suppression. Vision Res 1986; 26: 1401-1416. [ Links ]
64. Duffy FH, Lombroso CT. Electrophysiological evidence for visual suppression prior to the onset of a voluntary saccadic eye movement. Nature 1968; 218: 1074-1075. [ Links ]
65. Chase R, Kalil RE. Suppression of visual evoked responses to flashes and pattern shifts during voluntary saccades. Vision Res 1972; 12: 215-220. [ Links ]
66. Vallines I, Greenlee MW. Saccadic suppression of retinotopically localized blood oxygen level-dependent responses in human primary visual area V1. J Neurosci 2006; 26: 5965-5969. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Luis Gila Useros
Servicio de Neurofisiología Clínica
Hospital Virgen del Camino
Irunlarrea, 4
31008 Pamplona
Tfno. 848429475
Fax 848429924
E-mail: lgilause@cfnavarra.es