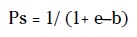INTRODUCCIÓN
El paciente con traumatismo grave (PTG) es aquel que presenta lesiones graves y con frecuencia múltiples, debido a un evento traumático, con un alto riesgo de morir o de desarrollar una discapacidad, y puede incluir una o varias lesiones en la cabeza, el cuello, la columna vertebral, el pecho, las extremidades, el abdomen, la pelvis y la piel 1.
En el mundo, el traumatismo grave es la primera causa de mortalidad y discapacidad en menores de 35 años2. Por todo ello, han sido múltiples los esfuerzos para tratar de definir su pronóstico desde el momento en que se produce 3)(4)(5. Con el transcurso de los años se han creado varias escalas, para describir la gravedad de las lesiones, las alteraciones fisiológicas que se producen, así como para evaluar sistemas de atención al PTG 6.
El traumatismo grave sigue teniendo hoy día importantes consecuencias para las víctimas ya que presenta una alta tasa de mortalidad y secuelas importantes para los supervivientes 7. La variación observada en la mortalidad y la morbilidad a largo plazo entre los diferentes centros y países podría reflejar diferencias en la calidad de la atención al paciente traumatizado, diferente gravedad de la lesión y/o características individuales de los pacientes de las poblaciones en estudio. Por ello es importante generar instrumentos que permitan homogeneizar su evaluación, manejo y pronóstico vital. Los índices de severidad en trauma son una serie de escalas para evaluar las alteraciones anatómicas, fisiológicas y probabilidad de supervivencia 3)(5)(8.
Las escalas usadas para la evaluación del trauma grave deben ser precisas, fiables y reproducibles. Si una escala cumple con estos requisitos puede desempeñar las siguientes funciones:
Utilidad en triaje pre e intrahospitalario: sirven para determinar el nivel de atención al que debe ser remitido el paciente de acuerdo a la gravedad de su lesión y a los recursos disponibles en los diferentes niveles de atención.
Valoración de la evolución del PTG, determinando los momentos críticos en su atención y tratamiento.
Predicción de la morbilidad: algunos índices pueden determinar con certeza la posibilidad de aparición de complicaciones.
Recogida de datos en un registro de PTG, que son la base para la realización de estudios de investigación.
Evaluación de la calidad de los servicios, teniendo en cuenta factores como la calidad de la atención médica, la estancia hospitalaria y los costes de la atención.
Evaluación de los resultados. Muchas escalas son capaces de determinar la probabilidad de muerte o de supervivencia.
En resumen, las escalas de gravedad del trauma grave ayudan en la toma de decisiones relacionadas con los cuidados de los pacientes, tanto a nivel prehospitalario como hospitalario.
La plétora de escalas para los PTG 9)(10)(11 indica que hay necesidad de un sistema universal, un objetivo muy difícil de lograr, ya que es complicado resumir la gravedad de diferentes lesiones de un paciente utilizando un parámetro numérico. Y se vuelve aún más complejo, si se le añade la tarea de predecir diferentes resultados en diferentes poblaciones.
El objetivo de este artículo de revisión es exponer las escalas más frecuentes para los PTG, su uso y evaluar cuáles ofrecen una mejor predicción de resultados después de un trauma.
METODOLOGÍA
Esta revisión se ha realizado mediante el motor de búsqueda PubMed de la base MEDLINE con los términos relacionados a continuación y que debían aparecer en el título o abstract. Se han recogido asimismo artículos de revisión (excepto en la última búsqueda) de los últimos 10 años y referidos a humanos.
Se accedió a 139 artículos de los que seleccionaron 83, siendo utilizados para la revisión 46.
EVOLUCIÓN DE LAS ESCALAS EN TRAUMA
Escalas anatómicas
La Abbreviated Injury Scale (AIS) fue diseñada a principios de la década de los 70 por la Asociación para el Avance de la Medicina de Tráfico (Association for Advancemente of Automotive Medicine, AAAM) y la Sociedad Americana de Ingenieros de la Automoción para favorecer la investigación multidisciplinar entre ingenieros, médicos y expertos en salud pública, para la prevención de las lesiones por causas externas.
Pretendían crear un sistema útil tanto para clasificar las lesiones desde un punto de vista de localización anatómica y tipo de lesión, como para clasificarlas desde el punto de vista de la gravedad. De este propósito surgió la primera versión de la escala, cuyo formato ha ido evolucionando. La versión AIS de 1985 se convirtió en un código alfanumérico de 7 dígitos donde los 6 primeros caracterizan el tipo y localización de la lesión y el 7º dígito (colocado detrás de un punto) indica la gravedad de la misma. Este formato ha permanecido intacto hasta la última versión de la escala, el AIS 2005 y su actualización de 2008. La novedad del AIS 2005 consiste en introducir la posibilidad de expandir el código hasta un total de 15 dígitos. Estos 8 dígitos opcionales se colocan tras el dígito de la gravedad y sirven para recoger información sobre la localización de las circunstancias en que se produjo la misma.
Las críticas del AIS se centran en que la probabilidad de muerte para un mismo nivel de AIS no es la misma según la región corporal y esto se debe a que el carácter ordinal de la escala obliga a incluir en la misma categoría lesiones que tienen una cierta diferencia en gravedad. Si bien la mayor limitación es que al ser el AIS un valor para cada lesión, y al ser los lesionados por accidente de tráfico a menudo politraumatizados, este sistema de clasificación no ofrece soluciones sobre la forma de medir la gravedad de las lesiones en un individuo en su conjunto4. Con todas sus ventajas y desventajas, lo cierto es que la AIS es aún en estos momentos, la clasificación más divulgada a nivel mundial en la investigación para la prevención de lesiones por accidentes de tráfico y, más específicamente, en la investigación biomecánica.
Debido a la limitación mencionada anteriormente, Baker y col en 1974 desarrollaron el Injury Severity Score (ISS) que es utilizado como una medida estándar para medir gravedad de los pacientes aunque se le han descrito algunas limitaciones como infravalorar las lesiones que se producen en la misma región anatómica ya que únicamente considera la mayor. Por ello Osler y col desarrollaron la escala New Injury Severity Score (NISS) que coge las tres mayores lesiones independientemente de la región anatómica en la que se localicen y que demostró mejor capacidad de predicción de la mortalidad que ISS 8.
Champion y col presentaron la escala Anatomic Profile (AP) que considera todas las lesiones AIS > 2 dividiendo el cuerpo en 4 regiones. Las puntuaciones se combinan mediante un modelo de distancia euclidiana y de esta forma se pueden estimar las probabilidades de supervivencia mediante múltiples regresiones logísticas. Ha demostrado ligera mejoría respecto al ISS en la predicción de resultados a expensas un cálculo más complejo y por este motivo no se suele utilizar 12.
Escalas fisiológicas
La escala de coma de Glasgow (G) fue desarrollada en 1974 por Tesdale y Jannet 13. Se calcula sumando la puntuación de la mejor respuesta motora, la mejor respuesta verbal y la mejor respuesta ocular. Su valor va de 3 (peor) a 15 (mejor). Es un instrumento de uso universal para la evaluación de traumatismo craneoencefálico (TCE), valorando su severidad inicial y evolutiva. Dado su poder pronóstico forma parte de muchas escalas de supervivencia 14.
Basado en un consenso y para evaluar la calidad de atención al PTG se introdujo la escala Trauma Score (TS) y posteriormente Revised Trauma Score (RTS) 15. Su versión para el triaje, Triage-RTS (T-RTS) es la escala más utilizada en el ámbito prehospitalario. Estas escalas integran la escala de coma de Glasgow, la tensión arterial sistólica y la frecuencia respiratoria.
Grominacan introdujo la escala Circulation, Respiration, Abdominal/Thoracic, Motor, Speech (CRAMS) que demostró su eficacia en triaje para evaluar victimas en masa en desastres naturales o conflictos armados pero es poco eficaz a la hora de dar información sobre supervivencia o mortalidad 16. Koehler y col propusieron el Prehospital Index (PI) en 1986 que demostró ser instrumento de triaje en escenarios de catástrofe pero algunos estudios señalan limitaciones como el sobretriaje y una sensibilidad baja para identificar a los PTG 17.
Introducido por Knaus, Acute Physiology And Chronic Health Evaluation (APACHE) es una escala que permite cuantificar la gravedad de la enfermedad en función de la probabilidad de morir durante su ingreso en la Unidad de Cuidados Intensivos (UCI). Se han desarrollado 3 versiones de esta escala sin embargo no han demostrado buen rendimiento respecto a los PTG y además para su aplicación necesita de estudios de validación en los PTG18.
Escalas mixtas
El componente fisiológico representa el componente dinámico tras el trauma e influye de manera significativa en el pronóstico de PTG. Este hecho conllevó al desarrollo del modelo Trauma and Injury Severity Score (TRISS) derivado de Major Trauma Outcome Study (MTOS) y combina parámetros anatómicos como el ISS y fisiológicos como el RTS. Es la herramienta más utilizada para el ajuste de los resultados y para mejorar la atención a los PTG permite la evaluación comparativa de los resultados de los sistemas regionales de atención al trauma (benchmarking), sin embargo se le han descrito muchas limitaciones a lo largo de los años 19.
Para corregir las limitaciones de TRISS, Champion y col en 1990 desarrollaron A Severity Characterization of Trauma (ASCOT) basado en AP que ofrece una descripción anatómica más detallada de las lesiones, mejorando ligeramente la capacidad predictiva respecto al modelo TRISS y a expensas de una mayor complejidad de cálculo, motivo por el que ha caído en desuso 20.
Otras escalas
Osler y col y Rutledge y col presentaron International Classification Of Diseases Injury Severity Score (ICISS) basado en ICD-9CM (International Classification of Disease, Ninth Clinical Modification) 21 que consiste en calcular el riesgo de supervivencia para cada código ICD-9CM. Algunos estudios han sugerido que la ICISS supera a TRISS en las predicciones de resultado de interés (por ejemplo, la duración de la estancia hospitalaria, los gastos del hospital). A pesar de la aparente ventaja de la ICISS necesita estudios de validación externa para poder generalizar su uso.
Harborview Assessment of Risk of Mortality (HARM) 22 fue introducido en 2000 por Al West y col que igual que ICISS está basado en ICD-9CM. Demostró mejoría respecto a TRISS e ICISS en la predicción de mortalidad intrahospitalaria sin contar con datos fisiológicos del PTG, lo cual ha supuesto un gran obstáculo para su uso.
En 2001 Rixen y col desarrollaron una escala en el registro de trauma DGU® (TR-DGU) de sociedad alemana de trauma (Deutsche Gellschaft für Unfallchirurigie, DGU) en el que integró la primera vez valores de laboratorio como el exceso de bases y tiempo parcial de tromboplastina debido a la influencia demostrada de ambas variables en el pronóstico de los PTG 23. Lefering desarrolló Revised Injury Severity Classification (RISC) en el mismo registro, que mejoraba significativamente la predicción de los resultados respecto a las escalas existentes, sin embargo, necesitaba de 10 variables del PTG para su cálculo, por lo que enseguida se dieron cuenta del problema de valores perdidos de sus variables 24.
Otra escala denominada Base Excess Injury Severity Scale (BISS) fue desarrollada en 2004 por Krozen y col 25 que permite predecir la supervivencia de los PTG en forma igual o superior al modelo TRISS.
En 2010 fue introducida la escala denominada MGAP que combina, Mecanismo lesional (M), G, A (Age) y Presión arterial sistólica (P) 26 y que predecía la mortalidad hospitalaria mejor que las escalas anatómicas existentes. Posteriormente Kondo y col demostraron que eliminando el mecanismo lesional denominándose así GAP, la escala era más sencilla en su cálculo e igual de fiable 27.
Para corregir las limitaciones de RISC, Lefering y col publicaron en 2014 el modelo RISC II que es el modelo actual utilizado por TR-DGU para evaluar los resultados en los PTG 23.
Clasificación de las escalas para el paciente con traumatismo grave
Las escalas se pueden clasificar según el criterio utilizado por las mismas en escalas anatómicas, fisiológicas, bioquímicas y mixtas.
Índices fisiológicos
Aportan información sobre la repercusión fisiológica que tiene el traumatismo sobre los parámetros de constantes vitales del PTG. Miden parámetros vitales como el pulso, la presión arterial, la frecuencia respiratoria y nivel de consciencia.
Escala RTS y T-RTS
Champion y col calcularon los coeficientes de sus variables G, P y frecuencia respiratoria (FR) utilizando datos de MTOS en el que se determinó con la regresión logística cuánto influye cada variable en la mortalidad14. Los coeficientes calculados de cada una de sus variables son: RTS = 0,9368 G + 0,7326 P + 0,2908 FR. Esto pone de manifiesto la importancia del coma para predecir la evolución de los pacientes, dado el coeficiente asignado a la variable G. Su valor va de 0 (peor) a 7,84 (mejor); si RTS < 4 la posibilidad de supervivencia es del 50%. Diferentes estudios han utilizado el RTS como herramienta de predicción de resultados de los PTG 15.
Su versión para el triaje T-RTS, se calcula sumando los valores codificados de sus variables como se muestra en la Tabla 1 y su valor va de 0 (peor) a 12 (mejor). Presenta el mejor punto de corte para determinar un PTG con una alta especificidad (verdaderos negativos) aproximadamente 90% y una baja sensibilidad (verdaderos positivos) con 58-90% 4. Un T-RTS<11 por consenso es indicación de traslado inmediato a un centro de atención al PTG 14. La mayor desventaja de T-RTS y RTS es que tanto la G como FR componentes de ambas escalas pueden modificarse por consumo de tóxicos o fármacos y / o intubación orotraqueal 28.
Tabla 1 Variables de las escalas: T-RTS, MGAP y GAP
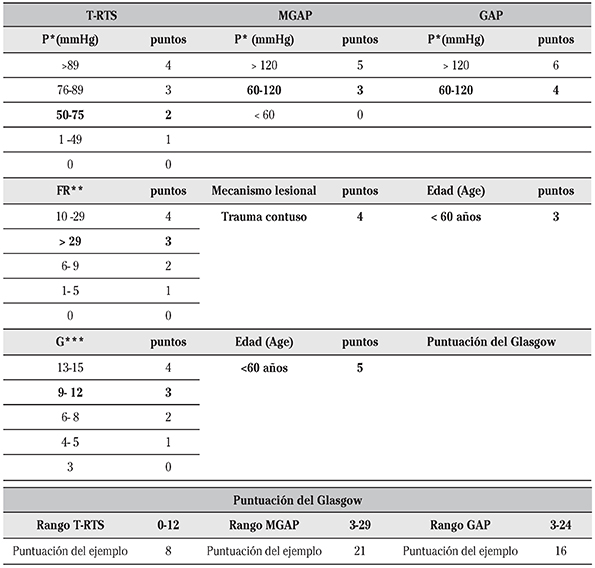
T- RTS= Triage-Revised Trauma Score, MGAP= Mecanismo lesional, Escala de coma de Glasgow, Age (edad en inglés), Presión arterial sistólica, GAP= Escala de coma de Glasgow, Age (edad en inglés), Presión arterial sistólica.
P*= Presión Arterial Sistólica, FR**=Frecuencia Respiratoria, G***= escala de coma de Glasgow.
Ejemplo: Una persona con 59 años de edad, que ha sufrido un traumatismo contuso, con 70 mm Hg de P*, 35 de FR* y 9 puntos de Glasgow presenta los siguientes valores en las diferentes escalas: T-RTS: 8; MGAP: 21 y GAP 16.
Escala MGAP y GAP
Sartorius y col demostraron que la escala MGAP tenía un cálculo más sencillo y su interpretación era más fácil que la escala T-RTS y RTS en términos de sensibilidad y especificidad 26. Posteriormente Kondo y col informaron de que la FR componente de T-RTS y RTS era menos fiable que otros factores de las escalas ya que depende de la edad y mecanismo lesional 27.
El cálculo de ambas escalas se realiza sumando los valores codificados de sus variables como se demuestra en la Tabla 1. Además ambas se han clasificado en función de su riesgo de mortalidad 26)(27; riesgo bajo (MGAP = 23-29; GAP = 19-24), riesgo intermedio (MGAP = 18-22; GAP = 11-18), y riesgo alto (MGAP < 18; GAP < 11).
Ambas escalas han demostrado sus ventajas en la predicción de mortalidad a nivel hospitalario y especialmente a nivel prehospitalario sobre otras escalas existentes como T-RTS y RTS aunque no han demostrado mejor predicción de resultados que el modelo TRISS 29)(30)(31.
Índices anatómicos
Considerados el componente estático en un PTG, son utilizados en la identificación y localización de la lesión anatómica con la consecuente tarea de clasificar la severidad de esas lesiones.
Escala AIS
Con aproximadamente 2.000 entradas puntúa las lesiones de forma individual y los clasifica de AIS 1 (Leve) al AIS 6 (Mortal).
Escala ISS
Existe una correlación entre la escala AIS y la mortalidad de los PTG pero ésta no es directa debido a que algunas lesiones con máximo AIS 5 presentaban menor mortalidad que lesiones con un máximo AIS 4. Esto se debía a que había lesiones en otras regiones que aunque inicialmente no era una amenaza para la vida influían en la mortalidad del paciente8. La escala ISS corrigió esta limitación considerando lesiones múltiples en un mismo paciente.
El índice ISS es una escala ordinal y se calcula sumando el cuadrado de las tres lesiones con puntuación AIS más altas de tres regiones corporales diferentes (Tabla 2). Estas regiones, 6 en total, son las siguientes: cabeza y cuello incluye columna cervical, cara, tórax incluye diafragma y columna dorsal, abdomen incluye columna lumbar, extremidades incluye anillo pélvico y por último lesiones externas (abrasiones, quemaduras, etc). El rango de puntuación es de 1 a 75, un AIS de grado 6 en una región corporal aporta automáticamente 75 puntos ya que es una lesión fatal 5.
Tabla 2 Un ejemplo de cálculo de la severidad de las lesiones de un paciente con traumatismo grave según ISS y NISS

AIS: Abbreviated Injury Scale, ISS: Injury Severity Score, NISS: New Injury Severity Score. Un paciente con traumatismo grave tiene las siguientes lesiones, el cálculo de la escala ISS y NISS serán los siguientes: ISS: 9+9+4=22; NISS: 9+9+9=27
Esta escala permite clasificar los traumatismos en función de su gravedad 32. En el estudio MTOS, paciente con ISS>15 se ha asociado con una mortalidad de al menos 10% 14, hecho confirmado por otros estudios. Una desventaja importante de esta escala es que cuando existe más de una lesión en la misma localización corporal, solo puntúa a la lesión más grave 8.
Escala NISS
Es la suma del cuadrado de las tres lesiones con puntuación AIS más altas de las regiones corporales (Tabla 2), independientemente de la región anatómica 8.
Debido a la similitud que presentan en el cálculo las dos escalas ISS y NISS se han realizado varios estudios para su comparación demostrando que el NISS es mejor predictor de mortalidad, fracaso multiorgánico (FMO) y estancia hospitalaria que el ISS 33)(34.
Índices metabólicos
Actualmente disponemos de dos parámetros bioquímicos: lactato y déficit de bases (DB), fácilmente medibles en un servicio de Urgencias y que son un reflejo de estados de hipoperfusión tisular que pueda presentar un PTG, ya que son muy sensibles como indicadores de pérdida sanguínea. Una de sus grandes ventajas es que, ni el alcohol ni las sustancias psicoactivas (cocaína, metanfetaminas, etc.), muy comunes en los PTG, afectan a la precisión del lactato y del DB 35.
Lactato
Es un biomarcador utilizado principalmente en trauma y sepsis. En el primer escenario está asociado a una respuesta por hipoxia tisular debido a la acumulación de su precursor, piruvato. Al contrario, en sepsis, existe una disfunción de la enzima piruvato deshidrogenasa, encargada de convertir el piruvato en acetil-CoA, lo que conduce a un incremento en los niveles de lactato en presencia de oxígeno36. El incremento se ha correlacionado con mayor mortalidad en varios tipos de shock, pero además, la facilidad o dificultad para normalizar este parámetro durante la reanimación, se correlaciona estrechamente con la supervivencia, y el FMO 37.
Déficit de base
Es un indicador objetivo del estado ácido-base del paciente e indirectamente traduce la perfusión tisular. Puede verse alterado aún con pH normal y su rango normal es de -2 a +2. Tiene buena correlación con el pronóstico del paciente y puede usarse como predictor de la necesidad de transfusión y del riesgo de complicaciones 25.
Escala TRISS
Está considerado el estándar internacional de los resultados en pacientes traumáticos para comparar poblaciones. Es un modelo estadístico de regresión logística para calcular la probabilidad de supervivencia (PS) basado en el mecanismo lesional (contuso o penetrante), anatomía de la lesión (ISS), parámetros fisiológicos (RTS) y edad del paciente como variable dicotómica 14.
La fórmula matemática es:
Donde e es el logaritmo neperiano y b = b0 +b1 (RTS)+ b2 (ISS) + b3 (índice de edad)
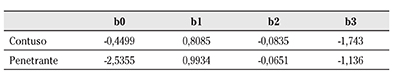
Los coeficientes derivados del estudio MTOS14 para el cálculo del modelo TRISS se señalan a continuación:
El índice de edad si < 54 años = 0, si > 54 años = 1.
TRISS cuenta con las limitaciones de ISS y RTS ya que ambas variables están integradas en su modelo. Además en su modelo de regresión logística no tiene en cuenta la comorbilidad previa que es un importante predictor de resultados en PTG 38 y considera la edad como variable dicotómica 14 obviando así la compleja relación entre la mortalidad y edad en los PTG. Por otro lado, dado que el modelo matemático se obtiene tomando como referencia la base de datos del MTOS americana, podría no ser fiable su aplicación a otras poblaciones diferentes en cuanto a demografía u organización del sistema sanitario de emergencias.
Escala BISS
El BISS es un modelo estadístico análogo al TRISS, pero reemplazando las alteraciones fisiológicas reflejadas por el RTS por el delta DB. Contiene edad, ISS y delta DB que es la diferencia absoluta entre el déficit de bases hallado y su rango normal (-2 a 2); tanto alcalosis como acidosis se correlacionan con la mortalidad 25.
b = b0 +b1 (delta déficit base)+ b2 (ISS) + b3 (edad) donde la edad, ISS y delta déficit base son variables continuas. Los coeficientes son: b0 (5.58), b1 (-0.096), b2 (-0.082) y b3 (-0.046) 25. Los estudios han demostrado correlación significativa entre delta DB y otras escalas de trauma de tal forma que un delta DB alto se correlacionaba con RTS más bajo, ISS más alto y menor probabilidad de supervivencia 25.
Escala RISC II
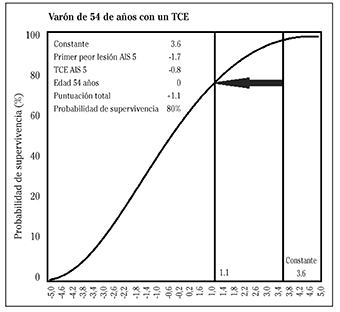
Esta escala contiene 13 variables que influyen en el pronóstico de los PTG y su mayor ventaja reside en la solución aportada para las variables que presentaban valores perdidos ya que les asigna un valor 0 y así no cambia el pronóstico del PTG. Con este modelo se puede estimar el pronóstico de todo PTG si al menos tiene las dos variables imprescindibles; edad y gravedad de la lesión medida por la escala AIS 23. La descripción de las variables de RISC II y sus correspondientes coeficientes publicados por Lefering y col 23 se muestran en la Tabla 3. Un ejemplo de su cálculo se demuestra en la Figura 1.
Tabla 3 Descripción de las variables de RISC II con sus correspondientes coeficientes
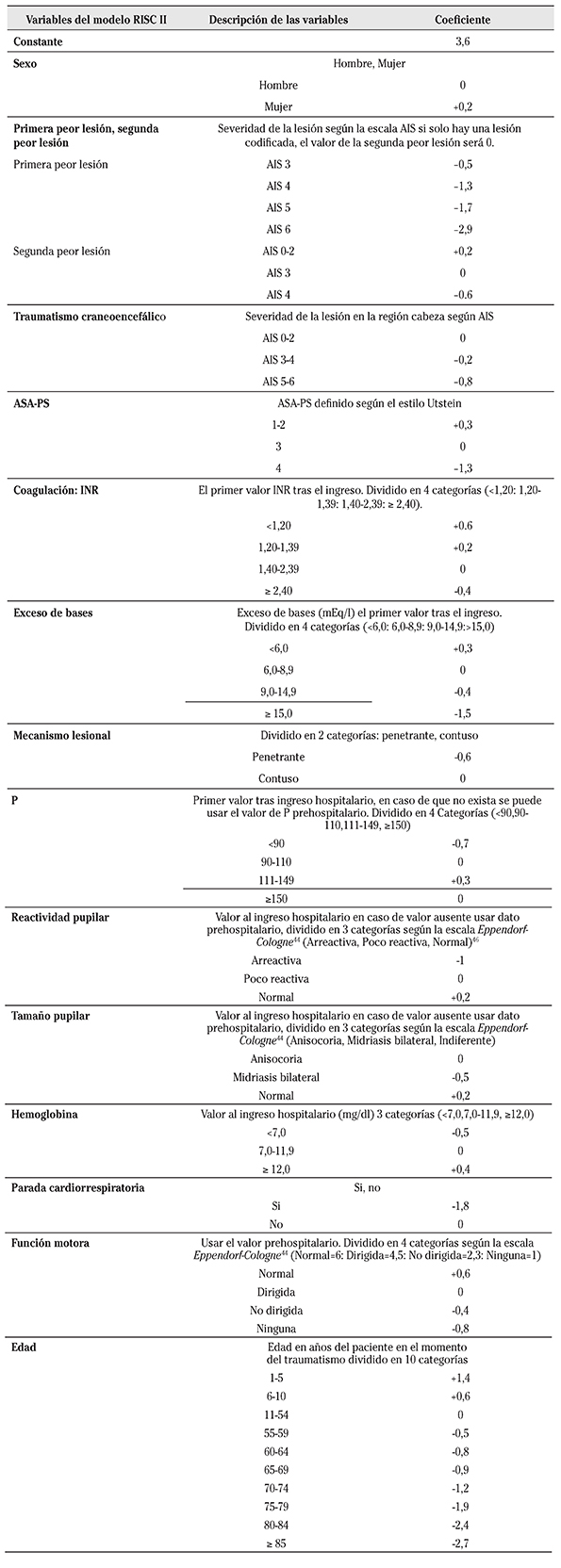
AIS, Abbreviated injury Scale, INR, International Normalized Ratio, P, Presión arterial sistólica, ASA-PS, American Society of Anesthesiologists Physical Status
DISCUSIÓN
Las escalas que incluyen parámetros anatómicos no pueden calcularse hasta que no se completa el proceso diagnóstico y tampoco pueden medirse en la escena del accidente. La descripción de la lesión debe ser lo suficientemente correcta para reflejar su verdadera gravedad ya que combinaciones de diversas lesiones en diferentes regiones anatómicas pueden llevar al mismo valor de ISS y sin embargo tener muy diferentes riesgos de mortalidad.
Además, la escala ISS valora a todas las regiones del cuerpo por igual, obviando la importancia de TCE en la mortalidad de un PTG y por tanto infravalorándolas. Así, un ISS de 9 por TCE no tiene igual significación y mortalidad que un ISS de 9 por una lesión de las extremidades. La mortalidad no es estrictamente una función creciente de la ISS. La tasa de mortalidad para una ISS de 16 puede ser mayor que la tasa de mortalidad para una ISS de 17 debido a las diferentes combinaciones de las puntuaciones de AIS que componen cada uno 39. NISS ofrece ventajas respecto al ISS en que tiene en cuenta las lesiones independientemente de su localización anatómica aunque infraestima igual que el ISS la mortalidad relacionada con el TCE. Ello se debe a las limitaciones de la escala AIS en la que están basados ambas escalas (ISS y NISS).
La escala ISS también se ha utilizado para predecir el FMO, causa más frecuente de mortalidad hospitalaria tardía aunque NISS ha demostrado ser superior a ISS en ese aspecto 34. La inadecuada resucitación de un PTG en shock puede conducir a un incremento del riesgo de sufrir esta complicación, debido a hipoperfusión tisular. El lactato y DB han demostrado que, aún sin signos clínicos de shock, las alteraciones en sus cifras indican estados de hipoperfusión tisular. Además el tiempo necesariopara normalizar ambas variables se ha correlacionado estrechamente con el FMO y mortalidad de los PTG 37. No se ha podido demostrar que cifras iniciales de lactato, tengan un valor predictivo de mortalidad 40 mientras que los valores alterados iniciales de DB se han relacionado con mayor mortalidad, mayor tiempo de ingreso hospitalario en UCI, mayor necesidad de transfusión, coagulopatía, insuficiencia renal aguda y FMO 41.Por otro lado el componente fisiológico si se puede calcular tanto en la escena del evento traumático como en el Servicio de Urgencias para clasificar a los pacientes en función de su gravedad y decidir así la consecuente actuación. Sartorius y col y Kondo y col han señalado limitaciones de FR componente de T-RTS y RTS 26)(27. La escala GAP y MGAP ambas con un cálculo sencillo, ofrecen mejores resultados que las escalas prexistentes tanto a nivel hospitalario como prehospitalario 30)(31. Aunque se ha de señalar que para una correcta valoración de G se necesita estar mínimamente habituado a ella y al igual que la FR su valor puede estar alterado por tóxicos y en pacientes intubados.
El método TRISS es considerado el Gold Standard para evaluación de resultados y a pesar de sus limitaciones ha sido adaptado por muchos registros de trauma como por ejemplo el modelo desarrollado por Belzunegui y col en 2013 en el registro de trauma grave de Navarra 42. El cálculo del modelo BISS es similar al de modelo TRISS pero al incluir el delta DB es más objetivo y debido a ello algunos estudios han informado que su poder predictivo es mejor que el TRISS 25. Su mayor desventaja es la pérdida de valores de déficit de bases en la mayoría de los registros de trauma 43.
El modelo RISC II ofrece ciertas ventajas respecto a todos los modelos predictivos desarrollados anteriormente. La FR por su limitado poder predictivo es sustituida por la variable parada cardiorrespiratoria en el modelo RISC II 23. Incluye variables de laboratorio como exceso de bases, INR y hemoglobina dada su influencia en el pronóstico de los PTG. Para medir la severidad de las lesiones RISC II incluye las 2 lesiones con la puntuación más alta según AIS ya que ello no sólo mejora la capacidad de predicción del modelo sino que además permite separar lesiones múltiples de lesiones únicas 23. Dada la alta prevalencia e influencia de TCE en la morbi-mortalidad de los PTG, RISC II contiene una categoría separada para TCE cuya severidad también es medida por la escala AIS. Igual que el TRISS clasifica por mecanismo de trauma (contuso o penetrante) y además incluye la comorbilidad previa medida por American Society of Anesthesiologists Physical Status (ASA-PS) y divide la edad en 10 grupos para la identificación de los pacientes basado en su pronóstico 23.
RISC II incluye la P y el componente motor de la escala G 44 ya que ha demostrado predecir mejor el pronóstico que la escala en sí. Otras variables como reactividad pupilar y tamaño pupilar también se han incluido en RISC II dada su influencia en el pronóstico de PTG 44. En el estudio original el modelo RISC II ha demostrado ventaja respecto a escalas existentes sin embargo necesita de validación externa para su uso generalizado 23.
La fortaleza de una escala para valorar un PTG depende mucho de la población bajo estudio. Un modelo desarrollado en una población siempre predirá mejor los resultados en esa misma población que otro desarrollado en otra población 45. La diferencia en las características básicas de la población y el sistema de atención a los PTG puede alterar resultados de los modelos predictivos, por tanto la validación externa de los modelos para evaluar los resultados se debe hacer en una población similar de la que se derivó el modelo original.
En resumen, es difícil predecir el pronóstico del PTG con sólo una escala anatómica, fisiológica o metabólica, sin contar con la edad, las enfermedades crónicas existentes y la disposición genética, ya que influyen en la mortalidad de estos pacientes. Quizás al algoritmo definido por Osler y col 46 para definir una escala ideal habría que añadirle las alteraciones bioquímicas y la gravedad de la lesión anatómica según la región corporal tras el traumatismo grave y entonces sería:
Escala ideal para el PTG=severidad de la lesión anatómica según la región corporal + alteraciones fisiológicas por el trauma+ alteraciones bioquímica + reserva fisiológica del paciente.
En la actualidad existe una gran variedad de escalas anatómicas, fisiológicas o combinadas para la valoración del paciente traumatizado, cada una de ellas con ventajas e inconvenientes. Las escalas anatómicas requieren de exploraciones complementarias (como la Tomografía Axial Computarizada), no disponible en el ámbito extrahospitalario y de tiempo para su clasificación y puntuación por lo que son poco utilizadas en la atención inicial. Las escalas fisiológicas se han mostrado fiables en la predicción de la mortalidad con base a la repercusión en diferentes parámetros (tensión arterial, frecuencia respiratoria, nivel de conciencia...) medibles desde el primer momento de la asistencia al paciente y sin necesidad de aparataje lo cual las hace muy útiles en el ámbito prehospitalario. Las escalas combinadas suelen ser las más completas y más fiables, lo que al mismo tiempo las hace más complejas en su aplicación y pueden ser muy útiles en la evaluación de los sistemas de emergencias y su comparación entre ellos.
La decisión de la escala más adecuada está por tanto influida por el objetivo que persigamos. Si se trata de clasificar accidentados “in situ” posiblemente tendremos que utilizar T-RTS o GAP. Si queremos conocer la probabilidad de fallecer de un paciente en la Unidad de Cuidados Intensivos podemos utilizar escalas mixtas como TRISS o RISC II al igual que si queremos ver si nuestro sistema de Emergencias en la práctica tiene mayor o menor mortalidad que el estándar americano en el caso del TRISS o Alemán en el caso del RISC II.
Periódicamente aparecen nuevas escalas o mejoras en las existentes para valoración del traumatizado grave. Aunque tal y como se ha visto ya existen escalas que incorporan la mayoría de las variables que influyen en el pronóstico, todavía faltan estudios de validación para un uso general de las mismas. Hasta que esto pueda llevarse a cabo, debemos usar las escalas existentes conociendo sus limitaciones.
La investigación actual y futura determinará la verdadera aplicabilidad y utilidad de las escalas en trauma, así como su capacidad para permitir la toma de decisiones en el paciente individual.