INTRODUCCIÓN
Las enfermedades infecciosas han sido desde hace siglos una importante causa de mortalidad. Un reciente estudio epidemiológico observó un incremento de su prevalencia en la última década, así como un perfil de pacientes de mayor edad, comorbilidad y gravedad expresada fundamentalmente por un incremento de pacientes con criterios de sepsis 1. Sin embargo, no se reflejaron grandes cambios en lo referente al esquema de prescripción de antibióticos. Se estima que, a nivel global, en torno a dos terceras partes de los pacientes con infección reciben tratamiento antibiótico y, en el caso de España, un 35% de los pacientes hospitalizados 2. No obstante, el tratamiento no siempre es el apropiado ni el adecuado. Desde el punto de vista terminológico se entiende como tratamiento apropiado aquel que es activo frente al patógeno causante de la infección. El tratamiento adecuado hace referencia no solo a si éste es apropiado, sino a su correcta dosificación, duración, y vía de administración, siguiendo las recomendaciones de tratamiento vigentes. Existen estudios que han comprobado que el uso de antimicrobianos es inadecuado hasta en el 50% de los casos 3. Este aspecto es relevante ya que dicha inadecuación se ha correlacionado con un peor pronóstico en el paciente infectado, una mayor estancia hospitalaria, un mayor coste económico, un incremento de ingresos en unidades de cuidados intensivos (UCI) y una mayor selección de microorganismos resistentes 2)(4. El pronóstico del paciente séptico está marcado por el tiempo hasta la instauración de la antibioterapia 5 y por la prescripción adecuada desde el primer momento de atención 6. En pacientes con disfunción orgánica y shock séptico el retraso en el inicio del tratamiento antimicrobiano se correlaciona con una mayor mortalidad 5. En pacientes sin sepsis un tratamiento inapropiado conlleva un aumento de la estancia media, lo cual incrementará el gasto sanitario 4.
A pesar de los grandes avances en lo referente a los procesos diagnósticos, la monitorización y la antibioterapia 7)(8, existen situaciones en las que el tratamiento antibiótico puede fracasar. La literatura actual pone de manifiesto un vacío en esta área de conocimiento, especialmente en lo que se refiere a las causas que lo pueden provocar. Este aspecto es de vital importancia en áreas como los servicios de urgencias (SU), los cuales suponen el principal lugar de entrada de los pacientes con infecciones agudas graves como es el caso de la sepsis.
El presente estudio tiene como objetivo revisar los factores relacionados con el paciente, los microorganismos y los fármacos que pueden asociarse al fracaso clínico con el fin de mejorar la prescripción antibiótica empírica de los médicos responsables de la primera atención de los pacientes con un proceso infeccioso agudo.
METODOLOGÍA
Para la realización del presente trabajo se conformó un grupo de médicos pertenecientes a una misma área sanitaria de la Comunidad de Madrid en el que había representación de varias especialidades médicas (Medicina Interna, Geriatría, Microbiología y Urgencias) para que pudieran aportar un prisma diferenciado de la problemática.
El proceso de elaboración del manuscrito se llevó a cabo en diferentes fases: 1) búsqueda bibliográfica mediante las bases de datos de Medline y Web of Science con el término adecuación de antibiótico en el título e infección o sepsis o shock séptico en el tema (“(adequacy AND antibiotic) AND (infection OR infectious OR sepsis OR septic shock”), identificando 9 y 22 trabajos respectivamente, siendo finalmente seleccionados 16 tras eliminar duplicidades y trabajos relacionados con la profilaxis antibiótica; 2) lectura de los trabajos encontrados por parte de los diferentes especialistas de cara a establecer unos puntos claves que deberían ser tratados en el manuscrito; 3) discusión en una reunión presencial donde se consensuaron las recomendaciones sobre cada uno de los puntos clave previamente determinados; 4) elaboración del documento por parte de un representante del grupo, con la posterior corrección y aprobación del manuscrito por parte del resto de los participantes.
ASPECTOS MICROBIOLÓGICOS
Espectro antimicrobiano
La mayoría de los tratamientos iniciales se instauran de manera empírica y basándose en el modelo de infección y los patógenos claves asociados a éste (Tabla 1). Una de las causas de fracaso terapéutico radica en los errores en el diagnóstico del foco a tratar o bien en su desconocimiento. En este sentido, se ha demostrado que pacientes con infección y sin un foco infeccioso definido se asocian a un peor pronóstico 9. Las dificultades para el diagnóstico del foco infeccioso son especialmente marcadas en pacientes de edad avanzada y en aquellos inmunodeprimidos. En estos perfiles de población los signos y síntomas clínicos pueden ser escasos retrasando el diagnóstico y dificultando la determinación del foco infeccioso y la detección de situaciones de riesgo vital como la sepsis 10.
Tabla 1 Principales microorganismos involucrados en las infecciones comunitarias más frecuentes

* Microorganismos considerados como “patógenos clave” que deben tener siempre cobertura.
** Patógenos que se aíslan en función de los factores de riesgo del paciente.
Tabla 2 Factores de riesgo para microorganismos con resistencia antimicrobiana
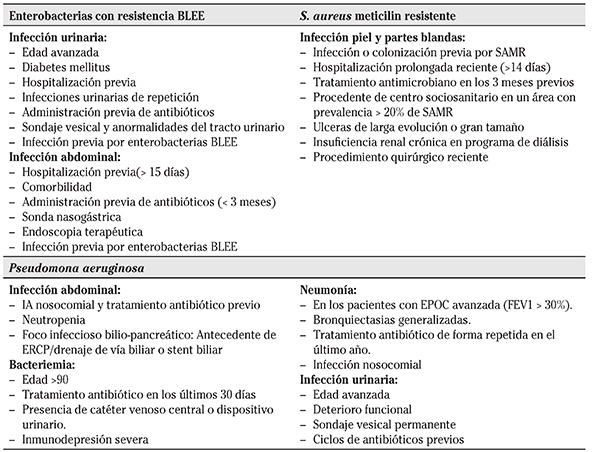
BLEE: betalactamasas de espectro extendido; SAMR: Staphylococcus aureus meticilin resistente; IA: infección intraabdominal; ERCP: colangiopancreatografía endoscópica retrógrada; EPOC: enfermedad pulmonar obstructiva crónica
Otro error frecuente es dirigir la cobertura antimicrobiana exclusivamente frente al patógeno clave para el modelo de infección diagnosticado, sin tener en cuenta la gravedad y los factores de riesgo individuales para la infección por patógenos multirresistentes (MR), o incluso por microorganismos menos habituales. Debemos tener en cuenta que la mortalidad se ve incrementada en las infecciones ocasionadas por MR 11. Desde este punto de vista, la presencia de factores de riesgo basados en el perfil del paciente, el uso de antibioterapia previa, la instrumentalización y la medicación inmunosupresora son fundamentales para la sospecha de infección por microorganismos resistentes (Tabla 2) 12)(13)(14.
No obstante, con frecuencia se comete el error de emplear un antimicrobiano con un espectro mayor del necesario. Esta práctica tiene consecuencias sobre el nicho ecológico al incrementar la presión antibiótica y la selección de resistencias. Así ocurre con el empleo sistemático de piperacilina-tazobactam en el manejo de la infección abdominal comunitaria en pacientes sin factores de selección de flora 14. Del mismo modo, el uso de cloxacilina frente a S. aureus meticilin sensible es más eficaz que otras pautas pese a su limitado espectro 15.
Además, es preciso conocer el patrón de resistencias locales para los microorganismos sospechados como agentes etiológicos de la infección a tratar. Como norma general, a la hora de seleccionar el antibiótico, sería óptimo considerar que éste tenga unas tasas de resistencia en nuestro medio menor del 10% 16. El uso de pautas cortas de tratamiento contribuye a la reducción de la exposición al antibiótico lo que puede limitar el incremento de resistencias a antimicrobianos, disminuir los costes económicos y mejorar la adherencia del paciente al tratamiento. Una estrategia empleada frecuentemente con la intención de evitar resistencias es el desescalamiento, que consiste en cambiar el tratamiento empírico inicial realizado con un antibiótico de amplio espectro por otro dirigido específicamente contra el patógeno cuando éste ha sido identificado, lo que además permite reducir efectos secundarios, sobreinfecciones y el gasto sanitario 16.
Por tanto, para evitar el tratamiento inapropiado la recomendación sería realizar un adecuado diagnóstico del foco infeccioso, conocer los microorganismos más prevalentemente asociados a éste, valorar la posibilidad de infección por microorganismos menos habituales o MR, considerando el perfil del paciente y la gravedad del proceso, y por último conocer el patrón de resistencias locales.
Erradicación microbiológica
La erradicación microbiológica es otro aspecto de importancia a la hora de valorar las causas del fracaso al tratamiento antibiótico. Las exacerbaciones repetidas en el paciente con enfermedad pulmonar obstructiva crónica (EPOC) son un ejemplo de ello. En estos pacientes los tratamientos más erradicadores alargan el intervalo libre de exacerbaciones, contribuyendo a la mejoría sintomática y a un mejor control de la enfermedad, preservando el volumen forzado espiratorio en el primer segundo (FEV1) y con él su pronóstico. Además, una menor presión antibiótica sobre el nicho ecológico, consecuencia de un menor número de ciclos antimicrobianos, depara una menor selección de cepas resistentes 11)(12.
La potencia bactericida se define en función del número de logaritmos de la microbiota bacteriana existente en el foco que el antibiótico es capaz de eliminar en un determinado tiempo. El empleo de antimicrobianos de menor potencia bactericida puede condicionar una menor reducción del inóculo bacteriano y alargar el periodo de comorbilidad. Esto se traduce en un incremento de la estancia hospitalaria, una mayor probabilidad de descompensación de las comorbilidades, aparición de infecciones nosocomiales y en definitiva el fracaso del tratamiento 16. En los pacientes más graves se suelen emplear antibióticos de mayor potencia, como carbapenémicos frente a gramnegativos o lipopéptidos frente a grampositivos 16)(17.
Si bien es cierto que un metaanálisis reciente no revela diferencias sustanciales en el manejo clínico de los grandes procesos infecciosos entre antibióticos bactericidas y bacteriostáticos 17, los antibióticos bacteriostáticos suelen ser más lentos en la reducción logarítmica que los bactericidas, pudiendo alargar el periodo de comorbilidad y contribuyendo al fracaso terapéutico. Por ejemplo, la daptomicina es más potente que vancomicina o linezolid, este último bacteriostático 18. Ertapenem es más potente que piperacilina-tazobactam, aunque de espectro más reducido y ambos más potentes que tigeciclina, que es bacteriostática 19. Por otro lado, la utilización de antibióticos potentes nos ayudar a reducir el tiempo hasta la estabilización clínica del paciente y puede permitir la derivación precoz a unidades de hospitalización domiciliara. Esta estrategia contribuye a disminuir la estancia hospitalaria y la saturación de urgencias, lo que ayuda a la sostenibilidad del sistema 20)(21)(22.
Por tanto, la recomendación sería seleccionar el antibiótico no solo en función de su actividad in vitro, sino también en función de su capacidad erradicadora (potencia), aunque la decisión puede estar condicionada por el perfil del paciente y el foco infeccioso.
ASPECTOS FARMACOLÓGICOS
Farmacodinamia y farmacocinética (Pk/Pd)
Los antibióticos se pueden clasificar en función de su perfil farmacodinámico (Pd) (Figura 1). Así, la eficacia de los aminoglucósidos dependerá en mayor medida del pico de concentración sérica máxima (Cmax) obtenida sobre la concentración mínima inhibitoria (CMI) del microorganismo (Cmax/CMI) 23. De ahí que se prefieran las dosis únicas diarias frente a otros regímenes posológicos. Por el contrario, la actividad de los betalactámicos se va a ver más influenciada por el tiempo en que las concentraciones séricas se mantienen por encima de la CMI (T>CMI). Concentraciones 3 o 4 veces por encima de la CMI durante el 40-50% del intervalo entre las dosis del antibiótico serían óptimas 23. Por ejemplo, la posología de amoxicilina-clavulánico de 875/125 mg cada 8 horas mantendría frente a neumococo una concentración por encima de la CMI tan solo en el 34% del tiempo entre dosis. Sin embargo, la dosis de 2000 mg/125 mg cada 12h lo conseguiría durante un 49% del tiempo entre dosis 24. Cefditoren frente a H influenzae consigue a dosis de 200 mg cada 12 horas permanecer por encima de la CMI un 50% del tiempo entre dosis. Sin embargo, frente a S pneumoniae en neumonía adquirida en la comunidad precisa de dosis de 400 mg cada 12 horas para permanecer por encima de la CMI un 50% del tiempo entre dosis 16)(23)(25.
Por último, existe otro tipo de fármacos, como son las fluorquinolonas, azitromicina, y vancomicina que se rigen por el parámetro de área bajo la curva (ABC) superior a la sensibilidad del microorganismo que se estima para 24 horas (ABC24/CMI), donde no solo influye la concentración sino también el tiempo sobre la CMI 23. Por ejemplo, moxifloxacino obtiene un mayor ABC24/CMI que levofloxacino en dosis única diaria, que se podría corregir incrementando la frecuencia de este último a cada 12 horas 26. Cocientes inferiores a 125 frente a bacilos gramnegativos, 65 frente a Staphylococcus spp. o 30 frente a S pneumoniae podrían deparar fracasos terapéuticos26.
El conocimiento del volumen de distribución del fármaco (Vd) es fundamental para evitar el fracaso terapéutico 27. Además, la presencia de concentraciones subóptimas en el foco de infección puede favorecer la selección de cepas resistentes 23. Entre los fármacos de Vd alto destacan los macrólidos, las oxazolidinonas, las glicilciclinas y las fluorquinolonas 27. Éstas suelen ser de naturaleza liposoluble y presentan alta capacidad para difundir a tejidos, aunque alcanzan concentraciones más bajas en el compartimento intravascular. Por otro lado, entre los fármacos de Vd bajo destacan los betalactámicos, aminoglucósidos y glucopéptidos. Éstos mantienen concentraciones más altas a nivel intravascular, difundiendo en menor medida a tejidos 27. Uno de los errores a la hora de la elección del antibiótico es emplear antimicrobianos de bajo Vd en situaciones de alto volumen extracelular como en pacientes edematosos, en situaciones de shock séptico, hipoalbuminemia u obesidad. Además, en situaciones de mala difusión del fármaco como en la neumonía necrotizante o los abscesos abdominales, es preferible el uso de antimicrobianos de alto Vd para una adecuada penetración tisular. Por el contrario, en casos de bacteriemia se podría optar por antibióticos de bajo Vd que mantengan mayores concentraciones de fármaco en el compartimento intravascular 28.
Por tanto, la recomendación sería que se deben conocer los parámetros Pk/Pd de los antibióticos, ya que son de gran utilidad para decidir la posología y predecir el éxito terapéutico.
Interacciones medicamentosas
Cada vez son más habituales los pacientes polimedicados, por lo que a la hora de iniciar la prescripción se debe considerar las posibles interacciones del antimicrobiano con el tratamiento habitual del paciente 29. Para esto debemos conocer su farmacocinética y considerar la situación del paciente respecto a su función renal y hepática. A este respecto, debemos conocer el estrecho margen terapéutico de vancomicina o aminoglucósidos, el efecto como inductor metabólico de rifampicina, o el efecto inhibidor enzimático de macrólidos o quinolonas, así como evitar la administración conjunta de fármacos con alta unión a proteínas y tener especial precaución con fármacos de comercialización reciente 29.
Por tanto, la recomendación sería valorar con cautela las posibles interacciones farmacológicas antes de seleccionar el antimicrobiano y su posología.
Errores en la terapia secuencial
El error en la elección del tratamiento oral durante la terapia secuencial puede ser causa del fracaso del tratamiento y del retorno precoz a los servicios de urgencias 30. Aunque la vía intravenosa suele ser de elección en situaciones graves, ésta no debería prolongarse más de lo necesario, ya que aumentan las probabilidades de complicaciones asociadas a esta vía como las flebitis o la bacteriemia 28. Por otra parte, a menudo obliga a una estancia hospitalaria más prolongada lo que expone al paciente a una mayor probabilidad de contraer infecciones nosocomiales 16. El paso de un antibiótico parenteral a vía oral, bien sea el mismo fármaco o bien un equivalente terapéutico, presenta ventajas en lo referente a la comodidad del paciente y la reducción de la estancia hospitalaria. La terapia secuencial debe realizarse precozmente cuando se ha alcanzado la fase de estabilización clínica siempre que exista tolerancia oral 16.
En la terapia secuencial podemos utilizar el mismo tratamiento empleado inicialmente por vía intravenosa. Si no existe formulación oral, usaremos antibióticos equivalentes respecto a su espectro y actividad bacteriostática o bactericida y que consigan unos niveles efectivos en el foco de infección. Por tanto, el tratamiento secuencial no implica que deba realizarse obligatoriamente con la formulación oral del antimicrobiano que se ha empleado por vía parenteral.
La mayor parte de los estudios publicados se centran en el empleo de quinolonas y cefalosporinas, comparando la eficacia de los tratamientos secuenciales frente a la terapia intravenosa convencional31. Dependiendo del modelo de infección y del patógeno causal elegiremos uno u otro antibiótico oral dentro de la misma familia. Así, en el caso de la neumonía neumococica cefditoren sería más óptimo que cefixima o ceftibuteno por su superior actividad antineumococica in vitro y mejor que cefuroxima por su mejor biodisponibilidad y perfil Pk/Pd en el tracto respiratorio 31. Otros antibióticos que han demostrado su eficacia en la terapia secuencial de la neumonía son el levofloxacino y amoxicilina-clavulánico. En las infecciones urinarias puede emplearse antibióticos como cefditoren, amoxicilina-clavulánico, o cefixima. Sin embargo, en un estudio sobre infecciones de orina comunitarias no complicadas cefditoren mostró una mayor actividad frente a enterobacterias que ampicilina, amoxicilina-clavulánico, cefuroxima, ciprofloxacino, levofloxacino y cotrimoxazol 32. Por último, indicar que no hay indicación clínica para realizar terapia secuencial en las infecciones en las que la penetración tisular del antibiótico pueda ser limitada.
Para evitar el fracaso en la instauración del tratamiento secuencial, la selección del antimicrobiano con formulación oral debería realizarse dependiendo de la posible etiología esperable (microorganismo causal), los patrones de sensibilidades y resistencias locales, las características PK/PD de cada familia y cada antibiótico, las situaciones epidemiológicas y las características particulares del paciente (edad, comorbilidad, contraindicaciones, historial alérgico, etc.).
ASPECTOS DEL PACIENTE
Estratificación del riesgo
Una de las causas del fracaso terapéutico está relacionada con la deficiente detección de situaciones de gravedad y riesgo vital, lo que puede retrasar el inicio del tratamiento. En pacientes con shock séptico cada hora que se retrasa la administración del antibiótico se incrementa la mortalidad un 7,6% 5. El problema fundamental radica en que la detección se basa en la respuesta inflamatoria del paciente a la infección. Esta respuesta por parte del huésped puede ser limitada en los pacientes inmunodeprimidos o ancianos dificultando su identificación y una buena estratificación del riesgo de malos resultados.
En las últimas décadas la comunidad científica ha hecho el esfuerzo por definir los criterios de sepsis con el fin de mejorar la capacidad para su detección e iniciar precozmente las medidas terapéuticas 33. Recientemente se ha publicado un nuevo consenso que define la sepsis como la situación de disfunción orgánica de amenaza vital ocasionada por una respuesta no regulada del huésped a la infección, determinada por una puntuación mayor o igual a 2 en la escala de SOFA (Sequential Organ Failure Assessment) y establece como sistema de rápida identificación el deterioro de la presión arterial sistólica, la alteración del estado mental y la taquipnea 33.
Además, en los últimos años, los biomarcadores de respuesta inflamatoria e infección están adquiriendo relevancia como herramientas de utilidad en la estratificación pronóstica. El lactato, como marcador de hipoxia tisular, permite valorar de forma precoz la gravedad. Sus valores por encima de 2 mmol/L se han correlacionado con un incremento de la mortalidad independientemente de la presencia de shock 34. La procalcitonina (PCT) se ha correlacionado en múltiples estudios con la gravedad de la infección, la presencia de sepsis y el shock 35)(36. Julián-Jiménez y col 37 comunicaron que concentraciones de PCT superiores a 2 ng/ml se asociaban con una mayor gravedad clínica, una mayor mortalidad a corto plazo, una mayor tasa de ingresos, de hemocultivos positivos y de estancia hospitalaria. La presencia de bacteriemia también se ha correlacionado con una mayor mortalidad, así como con una mayor probabilidad de desarrollar sepsis 38)(28. En ese sentido, se han publicado diferentes modelos de predicción de bacteriemia en los que concentraciones altas de PCT, se han asociado significativamente a ésta 39.
Ni las escalas clínicas ni los biomarcadores nos ofrecen de manera aislada la suficiente sensibilidad para detectar a todos los pacientes en riesgo de malos resultados. Por tanto, la recomendación sería que debemos optimizar las estrategias para la estratificación de gravedad, empleando tanto escalas clínicas como biomarcadores para aumentar nuestra capacidad predictiva.
Perfil clínico del paciente
Las características del paciente van a influir en el desenlace del proceso infeccioso y pueden condicionar el fracaso terapéutico. Existe una clara evidencia de que el envejecimiento se relaciona con un marcado aumento en la incidencia de infecciones graves y sepsis 40. Los pacientes ancianos sépticos tienden a fallecer más precozmente durante el ingreso y los supervivientes requieren con mayor frecuencia rehabilitación o cuidados sanitarios crónicos 10)(41.
La mortalidad de los pacientes dependerá también de otros factores como la comorbilidad, la polifarmacia, las interacciones medicamentosas y los factores sociales 10. Desde hace años se ha utilizado el índice de comorbilidad de Charlson como una escala con validez pronóstica para la valoración de la comorbilidad, considerándose un índice mayor de 2 como un factor de riesgo de mortalidad 42. En un estudio reciente realizado en pacientes ancianos que acudían al servicio de Urgencias por un proceso infeccioso se obtuvieron tres variables predictoras de mortalidad que incluían la alteración del nivel de conciencia, la taquipnea y la comorbilidad grave (índice de Charlson >2 puntos) como factores independientes de mal pronóstico 43.
Por último, resaltar que también se ha relacionado con la mortalidad a largo plazo la dependencia funcional, la discapacidad y la necesidad de institucionalización 44. En un reciente consenso sobre el manejo de la neumonía en el paciente anciano se describió el concepto de anciano frágil y se estableció como uno de los aspectos a valorar en la selección de la antibioterapia empírica, debido a que se ha descrito una mayor incidencia de neumonía por enterobacterias y anaerobios en pacientes con mala situación funcional 45.
Por tanto, la recomendación sería que en aquellos pacientes con mayor riesgo de peores resultados (comorbilidad, inmunosupresión, senectud) debemos plantearnos si es preciso ser más agresivo desde el punto de vista diagnóstico o terapéutico. La utilización de antimicrobianos de mayor potencia puede condicionar una disminución del tiempo de estado durante la infección haciendo más sencillo el control de las comorbilidades del paciente.
Adherencia al tratamiento
Los problemas de adherencia al tratamiento son frecuentes en la población general y suponen una causa de fracaso del tratamiento. Esto es especialmente frecuente en pacientes con patologías crónicas que requieren a menudo de múltiples tratamientos simultáneos 46. Un error frecuente es el abandono de la medicación cuando el paciente comienza a sentirse mejor, la fiebre remite y los síntomas mejoran. Existen estudios que documentan el hecho de que pautas basadas en regímenes de tres dosis diarias presentan con mayor frecuencia problemas de adherencia, siendo la toma de la tarde la que más frecuentemente se olvida 47. La Figura 2 pone de manifiesto la relación entre la adherencia y el número de dosis diaria. Por ese motivo es preferible el uso de regímenes basados en posologías de una o dos veces al día frente a la de tres veces al día, aunque algunos autores advierten que las consecuencias que puede tener el olvido de una dosis en pautas de dosis única diaria son más acusadas que en las de dos veces al día. Además, se recomienda el uso de pautas antibióticas con una duración lo más corta posible con el fin de reducir los problemas de adherencia y los efectos secundarios 47)(48.

Figura 2 Adherencia al tratamiento antibiótico. Porcentaje de pacientes que tomaron la medicación adecuadamente en función del número de dosis diarias. (Gráfico adaptado de Llor C y col 47).
Los efectos adversos asociados a los antimicrobianos ocasionan con frecuencia la discontinuidad de la antibioterapia. Suponen el 20% de las visitas a los servicios de urgencias por toxicidad farmacológica y en los pacientes hospitalizados son el grupo terapéutico que más efectos adversos presenta 13)(29. Estos son más frecuentes en el paciente anciano como consecuencia de una mayor comorbilidad, polifarmacia, y modificaciones fisiológicas asociadas al envejecimiento 10)(13.
Por tanto, la recomendación sería valorar la prescripción de antibióticos con pautas posológicas que faciliten el cumplimiento terapéutico.
Control del foco infeccioso
La falta de control del foco infeccioso es uno de los aspectos más importantes a valorar en pacientes que presentan fracaso terapéutico. Se define como el conjunto de procedimientos destinados a eliminar el foco de infección, controlar los factores que promueven su perpetuación y corregir las alteraciones anatómicas con el fin de restaurar una normal funcionalidad fisiológica 49. Es importante conocer que algunos antibióticos como los betalactámicos se ven afectados por el efecto del inóculo. Un mayor inóculo bacteriano incrementa la CMI global de forma que disminuye el tiempo en el que la concentración sérica del fármaco se encuentra por encima de la CMI, lo cual incrementa la probabilidad de fracaso del tratamiento 27. Un absceso es una zona avascular con una gran concentración bacteriana en su interior donde no sólo va a influir el efecto inóculo, sino también la dificultad en la difusión del antibiótico al interior de la colección. Además, en el interior del absceso las condiciones de acidez, osmolaridad, y el incremento de la actividad enzimática pueden llegar a inactivar el fármaco. Del mismo modo, la presencia de dosis subóptimas del antibiótico en el foco incrementa la probabilidad de selección de resistencias y supone una causa de persistencia o recidiva de la infección. Por lo general se recomienda el drenaje de un absceso de más de 5 cm de diámetro y en cualquier caso la administración de dosis altas de antibioterapia. A pesar de que el control del foco a menudo requiere intervención quirúrgica, se considera que en casos seleccionados, con colecciones bien localizadas y accesibles podrían ser drenados percutáneamente 50)(51.
Por tanto, la recomendación sería que el control del foco infeccioso mediante cirugía o radiología invasiva puede ser imprescindible para la buena evolución del proceso ya que en ocasiones la actividad del antibiótico en el lugar de la infección es insuficiente.
El presente trabajo tiene una serie de limitaciones. En primer lugar, se incluyen estudios muy heterogéneos, tanto desde el punto de vista de la población de estudio, la gravedad del proceso clínico, el modelo de infección o los objetivos de los trabajos. No existe literatura que específicamente aborde las causas del fracaso, más allá del problema de las resistencias a los antimicrobianos, haciendo referencia la mayoría de los trabajos únicamente a sus consecuencias. No existen ensayos clínicos aleatorizados que aborden esta problemática, por lo que las conclusiones que se extraen provienen de estudios mayoritariamente observacionales y la experiencia clínica de los expertos. Ninguno de los estudios aborda todos los puntos aquí tratados de manera conjunta. Por último, la abundante literatura existente en patología infecciosa nos hizo optar por concretar la búsqueda utilizando el término a estudio en el título, lo que podría condicionar la pérdida de información importante.
Existen diversas circunstancias que pueden provocar el fracaso al tratamiento en el paciente infectado. Para minimizar este riesgo es preciso llevar a cabo las siguientes acciones: 1) establecer un diagnóstico preciso del foco infeccioso, evaluando los factores de riesgo para que el paciente presente infección por microorganismos menos habituales o multirresistentes, con el fin de evitar la instauración de un antibiótico inapropiado; 2) estratificar adecuadamente la gravedad con el fin de administrar tratamientos precoces y bactericidas; 3) conocer los parámetros Pk/Pd de los antibióticos para optimizar la posología y evaluar las interacciones farmacológicas; 4) administrar una antibiótico de espectro y potencia similar al utilizado por vía intravenosa cuando se realiza terapia secuencial, evaluando las características del paciente en la toma de decisión para minimizar el riesgo de mala adherencia; y 5) evaluar la necesidad de un adecuado control del foco infeccioso mediante cirugía o radiología invasiva.















