Introducción
El virus respiratorio sincitial (VRS) es la principal causa de ingreso por proceso respiratorio de vías bajas en niños menores de 2 años de países desarrollados. En países de clima templado tiene un curso estacional anual con máxima incidencia entre los meses de octubre a marzo1.
Se han descrito 2 subgrupos de VRS, el A y el B, que circulan simultáneamente. La secuencia aminoacídica de las proteínas de ambos subgrupos difiere sobre todo en la glicoproteína G de superficie, capaz de inducir, junto con la proteína F, la producción de anticuerpos neutralizantes. La variabilidad antigénica y genética de la proteína G determina los distintos genotipos circulantes que causan brotes anuales, y después son reemplazados por otros, evadiendo la respuesta inmune del huésped2. La identificación del subgrupo no suele realizarse de rutina en la práctica asistencial ya que no conlleva diferencias en el manejo clínico de los casos; aunque sí que podría tener implicaciones prácticas para el desarrollo de una vacuna. Los estudios que han comparado la gravedad clínica de ambos subgrupos del VRS han aportado resultados contradictorios3)(4)(5.
El principal cuadro clínico en menores de 2 años es la bronquiolitis aguda, de las que el 80% están causadas por el VRS6. Actualmente no existe un tratamiento antiviral eficaz, y no se dispone de una vacuna comercializada7.
El test de detección de antígeno VRS (RADT) es rápido, sencillo y barato, aunque la prueba de referencia es la detección de genoma viral mediante la transcripción reversa-reacción en cadena de la polimerasa (RT-PCR)8. El diagnóstico microbiológico del VRS en niños es útil para decidir medidas de aislamiento oportunas que eviten la transmisión nosocomial,9 y para la toma de decisiones clínicas que disminuyan el número de pruebas diagnósticas10 y eviten tratamientos antibióticos innecesarios11.
Los objetivos de este estudio fueron comparar las características epidemiológicas, clínicas y de gravedad de la infección por VRS-A y VRS-B en niños menores de 5 años ingresados, y evaluar la sensibilidad del test de detección rápida (RADT) en comparación con la RT-PCR para la detección del VRS-A y VRS-B.
Material y métodos
Se realizó un estudio retrospectivo, observacional entre el 1 de octubre de 2013 y el 15 de marzo de 2014 en el Complejo Hospitalario de Navarra, que es el centro de referencia de pediatría para toda Navarra, que atendió 40.379 urgencias en 2014. A todos los pacientes menores de 5 años con infección respiratoria de vías bajas y que habían sido ingresados en la unidad de Cuidados Intensivos pediátrica (UCI), en planta o en la sala de observación, se les tomó una muestra para detección del VRS mediante lavado nasal. Para ello, se utilizó una jeringa introduciendo 3 ml de suero salino fisiológico estéril en el interior de las fosas nasales; se recogió el líquido en un recipiente estéril y se dividió en 2 alícuotas. Con una parte (1 ml) se realizó en la sala de urgencias un test de detección rápida de antígeno VRS por inmunocromatografía (BinaxNOW® RSV Card Allere Scarborough Inc. USA). De la misma muestra se envió otra alícuota al servicio de Microbiología para realización de técnicas de RT-PCR del virus influenza A y B, y VRS (RealCycler FLURSV, Progenie Molecular). En las muestras positivas para VRS se determinó subgrupo A y B (RSV RT-PCR kit 1.0 RealStar®, Altona diagnostics). Cuando no pudieron ser analizadas inmediatamente, las muestras se conservaron refrigeradas entre 4 y 8º C.
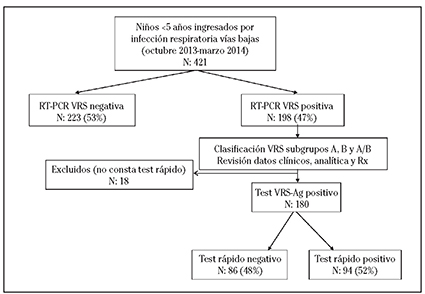
En el presente estudio se consultó la historia clínica informatizada de todos los pacientes menores de 5 años con un resultado de RT-PCR positivo para VRS (Figura 1) y se recogieron las siguientes variables demográficas y clínicas: sexo, edad en meses, subgrupo VRS-A o VRS-B, mes de realización del diagnóstico, antecedentes de prematuridad, patología crónica (displasia broncopulmonar, cardiopatía compleja, enfermedad neuromuscular, síndrome de Down y otras)12, saturación de oxígeno basal a la llegada a urgencias, temperatura máxima, días de fiebre, días de estancia media, días de oxígeno suplementario, hallazgos en la radiografía de tórax, datos analíticos de coinfección bacteriana, diagnóstico y destino al alta. Los hallazgos radiológicos se clasificaron en tres categorías: normal, alteraciones mínimas (hiperinsuflación, infiltrados peribronquiales parahiliares, infiltrados intersticiales), y condensación o atelectasia en una categoría por la dificultad para distinguirlas en la imagen radiológica13. En la analítica de sangre los niveles de procalcitonina >0,5 ng/ml y/o proteína C reactiva >20 mg/l se consideraron sugestivos de coinfección bacteriana asociada14)(15. Entre los motivos de ingreso se consideraron la edad menor de 4-6 semanas, insuficiencia respiratoria de saturación de oxígeno <92%, afectación del estado general, rechazo de la alimentación y distrés respiratorio moderado-severo, apneas y presencia de comorbilidades (prematuridad, displasia broncopulmonar, cardiopatía congénita hemodinámicamente significativa, enfermedad neuromuscular e inmunodeficiencia)16.
El estudio fue aprobado por el Comité Ético de Investigación Clínica de Navarra, y los datos fueron anonimizados previamente a su análisis.
Se calcularon porcentajes para variables categóricas y se compararon mediante el test de Chi-cuadrado o la prueba exacta de Fisher. Para las variables cuantitativas se obtuvieron la mediana y el rango intercuartil (RIC) y se compararon mediante el test U de Mann-Whitney. El análisis se realizó mediante el paquete estadístico SPSS.20 (Statistical Package of Social Science), considerando significativos los resultados p<0,05.
Resultados
Desde el 1 de octubre de 2013 al 15 de marzo de 2014 ingresaron 421 niños menores de 5 años con infección respiratoria de vías bajas, de los cuales 198 fueron positivos para VRS mediante RT-PCR. Once (5%) fueron positivos a ambos subgrupos VRS-A/B, 55 (28%) a VRS-A y 132 (67%) a VRS-B.
El 51% de los niños ingresados con infección por el VRS fueron varones, la mediana de edad fue de 4 meses. El 91% de los casos eran menores de 2 años y el 71% menores de un año. El número de ingresos con confirmación de VRS descendió progresivamente con la edad (p<0,001).
El 88% de los casos de infección por VRS se produjo en los meses de diciembre y enero (pico en diciembre: 53%), sin diferencias significativas en la distribución mensual de los subgrupos A y B (p=0,870) (Figura 2).
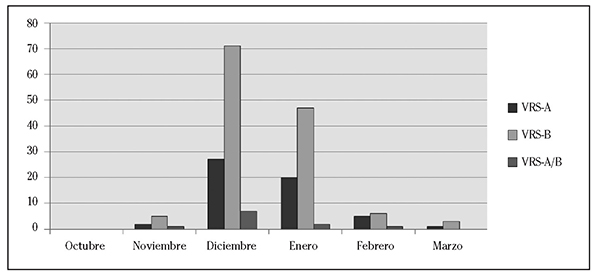
Figura 2 Distribución temporal de los casos confirmados (N=198) de virus respiratorio sincitial (VRS) por subgrupos según mes.
La saturación de oxígeno al ingreso tuvo una mediana de 95,0%, la temperatura rectal de 39,0º C y la duración de la fiebre de 1 día. La mediana de duración del ingreso fue de 2 días y la del oxígeno fue de 1 día. Todas estas variables no difirieron significativamente entre los casos de cada subgrupo. Los casos con coinfección por ambos subgrupos tuvieron mayor mediana de duración del ingreso (4 días) y del oxígeno (3 días), pero ninguna de estas diferencias alcanzó significación estadística (Tabla 1).
Tabla 1 Características demográficas y clínicas de los casos de infección por virus respiratorio sincitial. Comparación entre subgrupos A, B y coinfección A/B
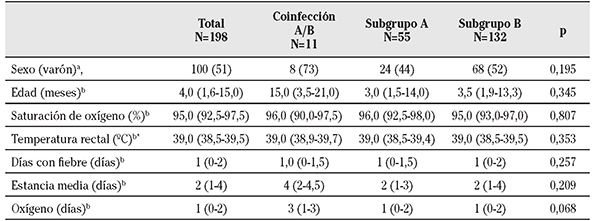
a. N (%); b. mediana (rango intercuartil); *. dato disponible en 130 niños.
En función de los antecedentes clínicos, los casos se repartieron entre niños previamente sanos, niños con antecedente de prematuridad y niños con patología crónica (displasia broncopulmonar, cardiopatía compleja, enfermedades neuromusculares de debut en periodo de lactante, síndrome de Down y otras), sin que se observase asociación estadísticamente significativa entre estos antecedentes y afectación predominante por uno de los dos subgrupos (Tabla 2).
Tabla 2 Análisis comparativo de la infección por virus respiratorio sincitial por subgrupo A, B y coinfección A/B, según patología previa, resultados de la analítica de sangre, radiología, tipo de atención médica y diagnóstico al alta

*Comparación mediante la prueba exacta de Fisher de las características de los casos debidos exclusivamente al subgrupo A y los debidos al B.
En 104 niños (52%) se dispuso del resultado de la analítica de sangre, de los cuales el 32% tenían la proteína C reactiva >20 mg/l y la procalcitonina >0,5 ng/ml, el 29% tenía elevada sólo la proteína C reactiva y el 8% sólo la procalcitonina. En 142 niños (72%) se realizó radiografía de tórax, y se encontró condensación o atelectasia en el 28% de los casos y alteraciones mínimas en el 24%. El diagnóstico al alta más frecuente fue de bronquiolitis aguda (67%), seguido por la bronquitis (20%). Ninguna de todas estas características clínicas y pronósticas evaluadas presentó asociación estadísticamente significativa con alguno de los dos subgrupos (Tabla 2).
El 6% de los casos fueron dados de alta el mismo día al domicilio, el 22% ingresó en la sala de observación, el 68% en planta y el 4% en UCI pediátrica (Tabla 2). Un niño con síndrome polimalformativo falleció en la UCI pediátrica por síndrome de distrés respiratorio agudo.
En 180 niños se había realizado el test de diagnóstico rápido sobre la misma muestra en la que se realizó la RT-PCR para VRS. La sensibilidad del RADT fue del 52% (IC 95%: 45-60) para detectar infección por VRS. Para el VRS-A la sensibilidad fue del 69% (IC 95%: 56-80), y para VRS-B fue del 44% (IC 95%: 35-53). La sensibilidad para la detección de infección por el VRS-A fue significativamente más alta que para el VRS-B (p<0,001).
Discusión
La mayor parte de los casos de infección por el VRS (88%) ocurrió en los meses de diciembre y enero, con pico en diciembre, como han descrito otros autores17)(18)(19. El subgrupo más frecuente fue el VRS-B, que se detectó en el 67% de los casos, porcentaje similar al del estudio publicado recientemente por Gimferrer y col en un hospital de Cataluña referido también en la temporada 2013-201418, mientras que en otro estudio llevado a cabo en la misma temporada en Palma de Mallorca por Reina y col predominó el subgrupo A (75%)20. En el 5% de los casos se detectó la coinfección por los subgrupos A y B, similar a lo encontrado en estudios previos18)(19. Otros estudios que analizaron varias temporadas también encontraron cocirculación de ambos subgrupos, con alternancia de uno sobre otro según la temporada3)(21.
El patrón epidemiológico encontrado en la infección por el VRS es consistente dentro de la variabilidad de esta infección entre temporadas y lugares19)(22.
Coincidiendo con varios estudios, no encontramos diferencias estadísticamente significativas en las manifestaciones clínicas, radiológicas o analíticas, ni en la gravedad o en el pronóstico, entre los casos debidos al subgrupo VRS-A y VRS-B3)(23. Sin embargo, algunos autores han observado mayor gravedad clínica en los casos debidos al subgrupo A4, y otros en los debidos al subgrupo B5.
En nuestro estudio observamos que la coinfección por VRS-A/B prolongó la estancia media y el número de días de oxígeno; sin embargo, el número de coinfecciones fue pequeño y estas comparaciones no fueron estadísticamente significativas. Estudios previos muestran que la coinfección por distintos virus se asocia a una mayor prolongación del curso clínico24, aunque este punto sigue en investigación con resultados controvertidos25.
Como en otras series, la mayoría de los niños que ingresaron por el VRS eran previamente sanos26. No encontramos preferencia de uno de los dos subgrupos por los niños con prematuridad o con patología de base, aunque el número de casos en nuestro estudio fue pequeño para sacar conclusiones definitivas.
En el 52% de los niños se realizó analítica de sangre y en el 72% radiografía de tórax, porcentajes similares a los de un estudio previo en España, aunque la edad media de los niños de aquel estudio era menor27. Siendo una infección viral, el elevado número de pruebas complementarias solicitadas puede estar relacionado con la edad de los niños atendidos (49% menores de 3 meses).
Tomando como resultado de referencia el obtenido mediante la RT-PCR para VRS, estimamos la sensibilidad del test de diagnóstico rápido, que fue significativamente menor que la indicada por el fabricante (89%), tanto para el total de casos (52%) como para cada uno de los subgrupos (p<0,001). Este resultado es similar al observado en otros estudios incluídos en un metaanálisis que muestra una sensibilidad del RADT de esta misma marca comercial respecto RT-PCR, que varía desde 41-83%28. La sensibilidad del RADT para el subgrupo VRS-A (69%) fue significativamente más alta que para el VRS-B (44%). Esta diferente sensibilidad ha sido descrita por otros autores y podría deberse a que el test rápido va dirigido a la detección cualitativa de la proteína F (de fusión), que aun siendo esta una proteína más conservada que la proteína G, presenta variaciones entre los 2 subgrupos29.
Nuestro estudio tiene varias limitaciones. Es un estudio retrospectivo, lo que impidió disponer de todas las variables para todos los casos. Se incluyeron sólo niños atendidos en la unidad de Urgencias de pediatría del hospital y que requirieron estancia hospitalaria, lo que supone una selección de las presentaciones más graves. Por tanto, estos resultados podrían no ser extrapolables a pacientes de atención primaria. Dado que está realizado en una sola comunidad autónoma y durante una sola temporada, los resultados podrían no ser generalizables, teniendo en cuenta la amplia variabilidad geográfica y temporal que puede tener la epidemiología del VRS30. No se analizó la coinfección por otros virus respiratorios, pero el posible sesgo afectaría probablemente por igual a los dos subgrupos.
Nuestro estudio tiene también varias fortalezas a destacar. La determinación de RADT en la unidad de Urgencias y la comparación con la RT-PCR para VRS en el servicio de Microbiología, a partir del mismo lavado nasal, garantiza la igualdad de las alícuotas, que fueron analizadas mediante las dos técnicas por personas distintas, desconocedoras del resultado de la otra prueba. Además, la muestra se obtuvo tan pronto se decidió el ingreso del niño por sus manifestaciones clínicas, siendo este el momento en que la sensibilidad de las pruebas es más alta, debido a la mayor excreción viral.
Como conclusión, comparamos en una temporada las características clínicas y diagnósticas de la infección por subgrupos A y B del VRS en niños menores de 5 años hospitalizados y no encontramos diferencias en su presentación clínica, gravedad y pronóstico. Además, evaluamos la sensibilidad del test rápido RADT frente a la RT-PCR y nuestros resultados muestran que el RADT tiene una baja sensibilidad en general, y especialmente para la detección de VRS-B, por lo que puede llevar a infraestimar el número de casos de infección respiratoria de vías bajas que se deben al VRS. Por ello, en nuestra experiencia no resulta fiable para establecer las medidas de aislamiento con el fin de evitar el contagio nosocomial, ni para la toma de decisiones clínicas. En caso de obtener un resultado negativo en el RADT, los pediatras deberían considerar la realización de RT-PCR para VRS, que aunque más cara y menos rápida, es más fiable para el diagnóstico de la infección VRS.