INTRODUCCIÓN
El género Rothia pertenece al orden Actinomycetales, correspondiente a la familia Micrococcaceae e incluye, al menos, cuatro especies: R. dentocariosa, R. mucilaginosa, R. nasimurium y R. amarae1. Las dos últimas se encuentran en ratones y en agua de desagüe y las dos primeras forman parte de la microbiota de la cavidad orofaríngea. Rothia spp. se asocia habitualmente con caries dentales y enfermedades periodontales2) y R. mucilaginosa no se ha considerado un agente patógeno frecuente en pacientes imnunocompetentes3. Hasta el año 2000, era conocida como Stomatococcus mucilaginosus y raramente se consideraba como causante de infección en humanos. Sin embargo, puede ser responsable de infecciones respiratorias y sistémicas y tener un importante papel etiopatogénico en infecciones de vías respiratorias bajas en pacientes con EPOC/bronquiectasias, inmunodeprimidos con bacteriemia y de la infección de material protésico4. Su prevalencia no es bien conocida en la actualidad.
Presentamos el caso de un paciente inmunocompetente diagnosticado de infección pulmonar por R. mucilaginosa, tras su aislamiento en numerosas muestras respiratorias como germen único y, por tanto, considerado el agente etiológico de la infección, que se manifestó como bronconeumonía en forma de múltiples nódulos pulmonares.
CASO CLÍNICO
Varón de 74 años con antecedentes de hipertensión arterial, fibrilación auricular permanente, asma bronquial y prótesis de ambas caderas. Ingresó en otro hospital por un cuadro de tos y expectoración mucopurulenta verdosa, fiebre de 39 ºC y disnea de mínimo esfuerzo. Con el diagnóstico de neumonía basal derecha fue tratado con Ceftriaxona y Levofloxacino y posteriormente con Voriconazol tras el aislamiento de escasas colonias de Aspergillus spp. en cultivo de esputo. Ante la mala evolución clínica, persistencia de la fiebre, expectoración purulenta y empeoramiento de la insuficiencia respiratoria se decide cambiar el tratamiento a Piperacilina/Tazobactam asociado a Amikacina. A los quince días del ingreso presentó vómitos hemáticos, distensión abdominal e hiponatremia grave con bajo nivel de conciencia y fue trasladado a nuestro centro para continuar tratamiento y posible ingreso en Unidad de Cuidados Intensivos.
En la radiografía de tórax se apreciaron infiltrados nodulares en hemitórax derecho y cardiomegalia global (Figura 1A). La radiografía de abdomen mostraba dilatación de asas intestinales. En los análisis de sangre destacaron hiponatremia de 110 mEq/L, 11,4 g/dL de hemoglobina, 11.000/mm3 leucocitos con 92% neutrófilos, y 2,4 g/dL de albúmina.
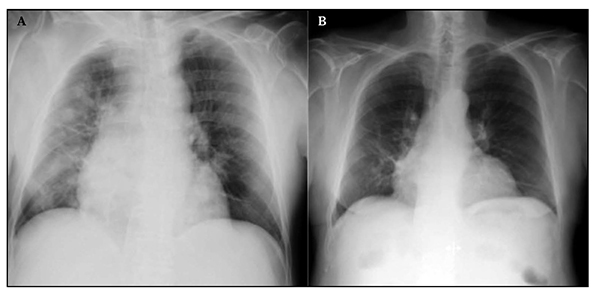
Figura. 1 A: Rx. Cardiomegalia e infiltrados nodulares en hemotórax derecho. B: Rx. Desaparición de los nódulos.
El tratamiento antibiótico iniciado se prolongó siete días más y se realizó gastroscopia, comprobando la presencia de ectasias bulbares sin signos de sangrado reciente.
En la radiografía de tórax persistían los infiltrados pulmonares en hemitórax derecho y se solicitó nuevo cultivo de esputo por abundante expectoración mucopurulenta muy viscosa. Los antígenos de Neumococo y Legionella en orina y los hemocultivos fueron negativos. La TAC torácica fue informada como extensa bronconeumonía bilateral de predominio en lóbulo inferior derecho con pérdida de volumen, adenopatías mediastínicas de hasta 1 cm y formaciones nodulares en lóbulo superior derecho.
El cultivo de esputo mostró abundante crecimiento de R. mucilaginosa en tres muestras de buena calidad, por lo que se cambió el tratamiento a Ceftriaxona, según antibiograma (Tabla 1). Los cultivos de hongos fueron negativos. Ante la persistencia de nódulos pulmonares se realizó broncoscopia apreciando mucosa bronquial hiperémica y edematosa. El broncoaspirado (BAS) fue negativo para malignidad, micobacterias y hongos y positivo para R. mucilaginosa, en cultivo puro. Ante la tórpida evolución con los tratamientos antibióticos recibidos, se decidió cambiar a Linezolid IV.
Tabla 1 Antibiograma de R. mucilaginosa
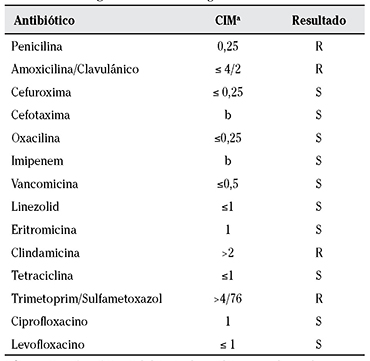
a Concentración mínima inhibitoria; b antibiograma disco-placa; R: resistente; S: sensible.
El paciente fue dado de alta a los 24 días de ingreso para continuar Linezolid oral en domicilio hasta completar 21 días de tratamiento. Dos semanas tras el alta se encontraba afebril, con escasa tos no productiva y se comprobó desaparición de los nódulos pulmonares en la radiografía de tórax (Figura 1B). Nuevos cultivos de esputo resultaron negativos y tras más de dos años de seguimiento el paciente no ha vuelto a ingresar por infecciones respiratorias.
DISCUSIÓN
La identificación microbiológica de R. mucilaginosa resulta difícil ya que bioquímicamente es poco activa y puede confundirse con Micrococcus, Streptococcus o Staphylococcus5. Crece bien en agar chocolate y agar sangre en atmósfera con 5% de CO2. Macroscópicamente las colonias, convexas, mucoides, blanquecinas y no hemolíticas, destacan por su consistencia gomosa y firme adherencia al agar1.
Desde el año 2014 la identificación de R. mucilaginosa y otros microorganismos de difícil diagnóstico se realiza en nuestro hospital mediante espectrofotometría de masas MALDI-TOF MS (Matrix Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry) que permite la identificación de los microorganismos mediante el análisis de proteínas, a partir de colonias o directamente de muestras6)(7. Durante 2014, se identificó R. mucilaginosa en 43 cultivos de un total de 1.401 muestras respiratorias positivas (esputos, BAS y lavado broncoalveolar), lo que representa un 3,1% de dichos aislamientos.
Los principales factores de riesgo para las infecciones por Rothia son las neoplasias hematológicas y neutropenias severas2. Otros factores son la diabetes mellitus, enolismo, hepatopatía crónica, valvulopatías, drogas intravenosas8 e infección por VIH2, así como catéteres intravasculares y prótesis8, lugares donde tiene capacidad de adherirse y formar parte del biofilm, favoreciendo la aparición de infecciones4.
R. mucilaginosa fue considerada por primera vez causante de infección en humanos en el año 1978, en un caso de endocarditis tras cateterismo cardiaco9. En los últimos años se ha descrito como patógeno oportunista, produciendo infección en inmunodeprimidos y se considera agente causal de bacteriemias, endocarditis, artritis sépticas, infecciones respiratorias1, del SNC, urinarias, osteomielitis, peritonitis en pacientes en diálisis peritoneal, infecciones de piel y tejidos blandos, endoftalmitis e infecciones protésicas2, entre otras.
Es un agente infrecuente de infección del tracto respiratorio inferior y su aislamiento en muestras respiratorias debe ser evaluado con precaución10, diferenciando si se trata de un contaminante o del agente causal de la enfermedad11. Siempre que la situación lo requiera, se recomienda disponer de un cultivo de broncoscopia (BAS o lavado broncoalveolar5) por su mayor valor diagnóstico.
Los procesos respiratorios que puede provocar, varían desde bronquitis a neumonías(4)(5)(12)(13, abscesos pulmonares8 o incluso empiemas pleurales4)(5. Además, las neumonías por Rothia pueden presentar cavitaciones, a menudo con mayor gravedad del cuadro, y obligan a plantear diagnóstico diferencial con otros procesos como la tuberculosis11.
Ramos y col4 destacan entre las infecciones pulmonares causadas por R. mucilaginosa, bronquiectasias sobreinfectadas, empiemas, neumonías y bronquitis. En el estudio de Baeza y col, el 57% de pacientes con Rothia en esputo padecían EPOC con bronquiectasias, por lo que se considera que este germen debe tenerse en cuenta en dichos pacientes, al igual que en fumadores5, pacientes con fibrosis pulmonar y asma10, incluso inmunocompetentes.
El papel que puede tener en las reagudizaciones de pacientes EPOC con bronquiectasias no está aclarado. Se podría especular con la similitud entre la adhesión de Rothia al endotelio bronquial dañado de pacientes con bronquiectasias y el poder de adhesión que tiene el microorganismo sobre la placa de agar formando colonias mucilaginosas4.
La guía Mensa de terapéutica antimicrobiana14 presenta Vancomicina como tratamiento de elección en las infecciones por R. mucilaginosa, y penicilina G o un macrólido como tratamientos alternativos. Dado que muestra un patrón de sensibilidad variable a betalactámicos, aminoglucósidos, macrólidos y fluorquinolonas, el tratamiento debe individualizarse según antibiograma13) y la gravedad del cuadro clínico. No existen puntos de corte establecidos para definir la sensibilidad antimicrobiana de Rothia1. La duración del tratamiento antibiótico seleccionado es variable y puede oscilar de siete a 21 días3) según la evolución clínica, que suele ser favorable en la mayoría de casos.
Nuestro paciente padecía EPOC, factor predisponente de la infección, y era portador de prótesis de cadera, por lo que se valoró el posible riesgo de infección protésica que no se confirmó. Destacamos la mala respuesta a los tratamientos empíricos con Ceftriaxona y Levofloxacino, considerados como sensibles, así como a Piperacilina/Tazobactam. En este caso el fallo terapéutico puede ser debido al efecto inóculo y a la extensión de las lesiones pulmonares. La buena respuesta a Linezolid, también sensible, la atribuimos a su gran actividad frente a gérmenes Gram positivos y a la buena difusión en tejido pulmonar, a pesar de no estar incluido en las guías terapéuticas frente a Rothia.
Ante diversas patologías graves, incluidas las neumonías, debemos tener presente el poder patógeno de Rothia, ya que su diagnóstico parece estar infravalorado.














