Introducción
Aproximadamente cuatro millones de personas padecen enfermedad renal crónica (ERC) en España: de ellas 61.764 están en tratamiento renal sustitutivo (TRS), la mitad en diálisis y el resto con un trasplante renal funcionante. Cada año 6.800 personas con ERC progresan hasta la necesidad de seguir uno de los tres tipos de tratamiento: hemodiálisis (HD), principalmente hospitalaria, diálisis peritoneal (DP) domiciliaria y trasplante renal1.
La prevalencia de la ERC aumenta progresivamente con el envejecimiento (en mayores de 64 años es del 22 %2 y se incrementa hasta el 40 % en mayores de 80 años3), y con otras enfermedades como la hipertensión arterial (HTA), la diabetes mellitus (DM) y la aterosclerosis3.
Los pacientes con enfermedad renal crónica avanzada (ERCA) son pacientes con comorbilidad, frágiles4 y crónicos complejos3. En ellos la valoración integral5 puede ayudar a identificar situaciones de mal pronóstico, resultando útil en el proceso de toma de decisiones6, así como a abordar todas sus necesidades desde el punto de vista físico y emocional.
Se define envejecimiento como un proceso continuo, heterogéneo, universal e irreversible que determina una pérdida de la capacidad de adaptación de forma progresiva7. Aunque la vejez no se considera una contraindicación absoluta para el inicio del tratamiento renal sustitutivo (TRS)8, la decisión de comenzar o no diálisis es difícil y compleja. Trabajos previos han cuestionado el beneficio del TRS en el anciano, por aumento del deterioro funcional9, caídas10, mala calidad de vida11, aumento de síntomas y escasa supervivencia8.
El tratamiento renal conservador (TRC) en la ERCA es una opción válida en ancianos que, por su comorbilidad o situación funcional, no van a obtener un beneficio clínicamente relevante del TRS6. No es simplemente la ausencia de diálisis sino que supone un manejo integral del paciente, con intervenciones para retrasar la progresión de la ERC, toma de decisiones compartida, manejo activo de los síntomas, comunicación detallada del pronóstico, soporte psicológico, social, familiar y planificación de los cuidados al final de la vida6 12. Todo programa de ERCA conservadora debe ir acompañado de un plan eficaz y organizado de cuidados paliativos13.
Muchos de los trabajos que analizan la supervivencia del anciano en TRS y TRC son retrospectivos, heterogéneos en criterios de inclusión y no tienen en cuenta la valoración integral14. Se necesitan trabajos que proporcionen información pronóstica de las distintas modalidades de tratamiento en el anciano con ERCA para fomentar la toma de decisiones12.
Por ello, los objetivos del estudio fueron comparar la supervivencia en pacientes con ERC mayores de 75 años que inician tratamiento conservador o tratamiento sustitutivo e identificar qué variables están relacionadas con el inicio de ambos tratamientos.
Material y métodos
Estudio analítico de cohortes, observacional y prospectivo de pacientes atendidos en el Servicio de Nefrología del Hospital Universitario Miguel Servet de Zaragoza.
Se analizaron dos grupos: pacientes incidentes en TRC y en TRS (modalidad HD hospitalaria y DP), con un reclutamiento desde el 1 de enero del 2015 hasta el 1 de mayo del 2017. Se incluyeron pacientes mayores de 75 años con capacidad para realizar la entrevista clínica, excluyéndose aquellos pacientes con necesidad de diálisis puntual.
El proceso de decisión compartida fue llevado a cabo por el nefrólogo responsable del paciente, teniendo en cuenta los criterios de TRC descritos en el Registro de Enfermos Renales de Aragón: filtrado glomerular estimado (eFG) inferior a 20 mL/min/1,73 m2 en dos determinaciones analíticas separadas tres meses.
Estimando una mortalidad anual del 30 % en el grupo de TRC y del 20 % en el TRS, con un nivel de confianza unilateral del 95 %, una potencia del 80 % y unas pérdidas del 15 %, el tamaño muestral calculado fue de 90 pacientes por grupo.
Las valoraciones se realizaron por el equipo investigador mediante entrevista clínica. Los antecedentes personales, datos analíticos y de fallecimiento se recogieron de la historia clínica hospitalaria.
Se recogieron las siguientes variables:
- Variables demográficas: edad (años) y sexo.
- Variables clínicas:
Índice de Masa Corporal (IMC): peso/talla2 (Kg/m2).
Antecedentes de patología previa: HTA, DM, evento vascular previo (EVP) (cardiopatía isquémica. CI, enfermedad cerebrovascular o enfermedad vascular periférica), causa ERCA.
Comorbilidad: riesgo de mortalidad predicho por el índice de Charlson ajustado a edad15, validado en población general y en pacientes urémicos como herramienta útil para predecir riesgo de mortalidad. Se consideró riesgo alto entre 6-7 puntos y muy alto ≥8 puntos.
- Variables psicosociales:
Situación funcional para actividades básicas de la vida diaria (ABVD) valorada mediante el Índice de Barthel16: se define totalmente dependiente si <20 puntos, dependencia severa de 21 a 40 puntos, dependencia moderada de 41 a 60, dependencia ligera de 61 a 90, e independencia de 91 a 100 puntos.
Valoración cognitiva realizada mediante el Test de Pfeiffer17, test rápido de cribado, ampliamente utilizado por su brevedad y fácil ejecución. Una puntuación ≥3 puntos (errores) indica que puede existir deterioro cognitivo.
Identificación de fragilidad mediante el cuestionario FRAIL18, test sencillo que, a diferencia de los criterios de Fried, no requiere de dinamómetro para valorar la fuerza muscular. Los pacientes se clasifican como frágiles cuando suman entre 3 y 5 puntos.
Valoración nutricional mediante el Mini-Nutritional Assessment Short-Form19 (MNA-SF), versión preferida del MNA en el ámbito comunitario y hospitalario por su facilidad de uso para identificar ancianos desnutridos (≤ 7 puntos), en riesgo de desnutrición (8-11) o con buena situación nutricional (≥12).
Situación social determinada por la Escala Sociofamiliar de Gijón (versión de Barcelona)20; versión validada para la predicción del riesgo de institucionalización. Una puntuación <7 indica buena situación social, 8-9 puntos situación intermedia y >10 puntos deterioro social.
- Variables analíticas: filtrado glomerular estimado por la fórmula Chronic Kidney Disease Epidemiology Collaboration (eFG-CKD-EPI) (mL/min/1,73 m2), proteinuria (g/L), albúmina (g/dL), proteína C reactiva ultrasensible (mg/dL), péptido natriurético (pg/mL), hormona paratiroidea (pg/mL), calcio (mg/dL) y fósforo (mg/dL).
La variable dependiente principal del estudio fue la mortalidad total. Para cada fallecimiento se recogió la causa principal y la fecha.
El seguimiento concluyó con el fallecimiento del paciente, con la fecha de la pérdida de contacto o con la fecha de cierre del estudio el 31 de diciembre de 2017. Se realizaron visitas programadas a los cero, doce y 24 meses de la entrada en el estudio, con recogida de las variables anteriormente descritas, que analizan las diferentes esferas de salud.
Este estudio fue aprobado por el Comité Ético de Investigación Clínica de Aragón (CEICA) cumpliéndose las normas éticas de la Declaración de Helsinki de 1975 (revisión de octubre del 2000). Todos los pacientes firmaron consentimiento informado antes de su inclusión.
Las variables cuantitativas se describieron con la media y desviación estándar (DE) o con la mediana y rango intercuartil (RIC), dependiendo de la normalidad de la variable, mientras que las cualitativas se expresaron con frecuencias y porcentajes. Las variables cuantitativas se compararon con t de Student o la prueba no paramétrica U de Mann-Whitney. Para la comparación de variables cualitativas se utiliza el test de χ2 con evaluación de tendencia lineal en variables con categorías ordenadas.
Las tasas de mortalidad se expresan por cada 1.000 pacientes-mes. Se determinó la supervivencia con el método de Kaplan-Meier, y las funciones de supervivencia para distintas categorías de una variable se compararon con la prueba log Rank. La contribución independiente de las variables iniciales a la mortalidad se evaluó mediante regresión de Cox, con estimación de las hazard ratio (HR) y de sus correspondientes intervalos de confianza del 95 % (IC95 %). Las variables introducidas en los modelos multivariantes se eligieron según su sentido clínico o la asociación estadística mostrada en el análisis univariante (p<0,1). La contribución del TRS respecto al TRC a la supervivencia del paciente se evaluó con ajuste progresivo en modelos sucesivos para potenciales factores de confusión: modelo 1: edad y sexo; modelo 2: añadiendo la puntuación del índice de Charlson al modelo 1; modelo 3: añadiendo la puntuación del índice de Barthel al modelo 2; modelo 4: añadiendo la puntuación del cuestionario MNA-SF al modelo 3; modelo 5: añadiendo la fragilidad al modelo 4.
Se evaluó la interacción entre tipo de tratamiento y características iniciales de los pacientes. Cuando se obtuvo un resultado significativo se procedió a realizar análisis estratificado. Las asociaciones con p<0,05 fueron consideradas significativas. Se utilizó SPSS versión 22.0.
Resultados
Se incluyeron en el estudio 119 pacientes: 82 en TRC y 37 pacientes en TRS. Se excluyeron tres pacientes de cada grupo: dos en TRC por no firmar el consentimiento informado, y un paciente en TRC y tres en TRS por imposibilidad de llevar a cabo la entrevista clínica.
Las características basales de los pacientes en ambos tratamientos se recogen en Tabla 1. Los pacientes en TRC fueron más ancianos (con seis años más de edad media) y tuvieron tres puntos más de IMC y casi el doble de prevalencia de evento vascular previo. Las causas de ERCA más frecuentes en TRC fueron nefroangioesclerosis y nefropatía diabética, y en TRS glomerulopatía, nefropatía tubulointersticial y poliquistosis. Todos los pacientes obtuvieron puntuaciones muy altas en el índice de Charlson, con 0,9 puntos más de media en el grupo TRS.
Tabla 1. Características basales de los pacientes en tratamiento renal conservador (TRC) y sustitutivo (TRS)
| Grupo TRC | Grupo TRS | p (χ2) | |
|---|---|---|---|
| n= 82 | n= 37 | ||
| % | % | ||
| Características demográficas | |||
| Edad (años)* | 84,79 (3,99) | 78,89 (2,25) | <0,001a |
| Sexo (varones) | 50 | 54,1 | 0,6 |
| Características clínicas | |||
| IMC (kg/m2)* | 28,62 (4,71) | 25,58 (5,79) | 0,005a |
| HTA | 98,8 | 100 | 0,5 |
| DM | 46,3 | 40,5 | 0,5 |
| Evento Vascular Previo$ | 56,1 | 29,7 | 0,008 |
| Causa de ERCA | 0,003 | ||
| NAE | 9,8 | 29,7 | |
| ND | 53,7 | 8,1 | |
| NAE/ND | 15,9 | 13,5 | |
| NTI | 6,1 | 13,5 | |
| GN | 2,4 | 8,1 | |
| PQHR | 0 | 8,1 | |
| Otras | 12,1 | 19 | |
| Índice Charlson* | 8,9 (1,40) | 8,0 (1,95) | 0,001a |
| Características psicosociales | |||
| Índice Barthel | <0,0001 | ||
| Independiente | 4,9 | 32,4 | |
| Dependencia ligera | 69,5 | 64,9 | |
| Dependencia moderada | 13,4 | 2,7 | |
| Dependencia severa | 2,4 | 0 | |
| Dependencia total | 9,8 | 0 | |
| Pfeiffer ≥3 | 26,3 | 8,1 | 0,024 |
| Fragilidad | 78 | 54,1 | 0,003 |
| MNA test | 0,037 | ||
| Malnutrición | 17,3 | 8,1 | |
| Riesgo malnutrición | 50,6 | 40,5 | |
| Estado nutricional normal | 32,1 | 51,4 | |
| Sociofamiliar Gijón | 0,014 | ||
| Buena | 79,3 | 97,3 | |
| Intermedia | 17,1 | 2,7 | |
| Deterioro | 3,7 | 0 | |
| Características analíticas | |||
| eFG CKD-EPI(ml/min/1,73 m2)* | 16,38 (2,85) | 9,17 (2,22) | <0,001a |
| Proteinuria(g/L)* | 0,72 (1,34) | 1,70 (2,05) | 0,300a |
| Albúmina (g/dL)* | 3,82 (0,49) | 3,49 (0,44) | 0,001a |
| PTH (pg/mL)** | 178,45 (115,13-303,38) | 352,0 (163,0-413,35) | 0,005b |
| PCRu (mg/dL)** | 0,35 (0,13-1,64) | 0,70 (0,22-1,51) | 0,298b |
| NT-ProBNP (pg/mL)** | 3.715,0 (1.761,75-10.953,75) | 3.542,0 (921,0-22.949,0) | 0,887b |
| Calcio (mg/dL)* | 9,39 (0,63) | 9,05 (0,81) | 0,004a |
| Fósforo (mg(dL)* | 3,78 (0,64) | 4,88 (1,07) | <0,001a |
* media (DE); **: mediana (rango intercuartil); a: t de Student; b: U de Mann-Whitney. IMC: índice de masa corporal; HTA: hipertensión arterial; DM: diabetes mellitus; $: cardiopatía isquémica, enfermedad cerebrovascular o enfermedad vascular periférica; ERCA: enfermedad renal crónica avanzada; NAE: nefroangioesclerosis; ND: nefropatía diabética; NTI: nefropatía tubulointersticial; GN: glomerulopatía; PQHR: poliquistosis; eFG CKD-EPI: filtrado glomerular estimado por la fórmula Chronic Kidney Disease Epidemiology Collaboration; PTH: hormona paratiroidea (nTRC=66); PCRu: proteína C reactiva ultrasensible (nTRC=37); NT-ProBNP: péptico natriurético (nTRC=20, nTRS=15).
Aunque la prevalencia de síndromes geriátricos fue elevada en ambos grupos, lo fue más en TRC. Así, mientras que un tercio del grupo TRS era independiente según la escala de Barthel para la realización de las ABVD, solo el 5 % del grupo TRC lo fue. Una cuarta parte de los pacientes en TRC presentaron ≥3 errores en el test de Pfeiffer para cribado de deterioro cognitivo frente al 8,1 % de los pacientes en TRS. Además, los pacientes en TRC tuvieron mayor prevalencia de fragilidad, doble porcentaje de malnutrición y mayor deterioro sociofamiliar al inicio del tratamiento (20 % menos de pacientes con buena situación respecto al 97 % del grupo TRS).
A la entrada en el estudio, los pacientes en TRC tenían valores superiores de albúmina, eFG-CKD-EPI y calcio, y valores menores de hormona paratiroidea y fósforo.
Durante el seguimiento fallecieron 38 pacientes en TRC (46,3 %) y 7 pacientes en el grupo de TRS (18,9 %). Las causas más frecuentes de muerte de pacientes en TRC fueron la cardiovascular (39,5 %) y la relacionada con la propia evolución de la ERC (36,8 %), y la neoplásica (42,9 %) y la cardiovascular (28,6 %) en pacientes en TRS.
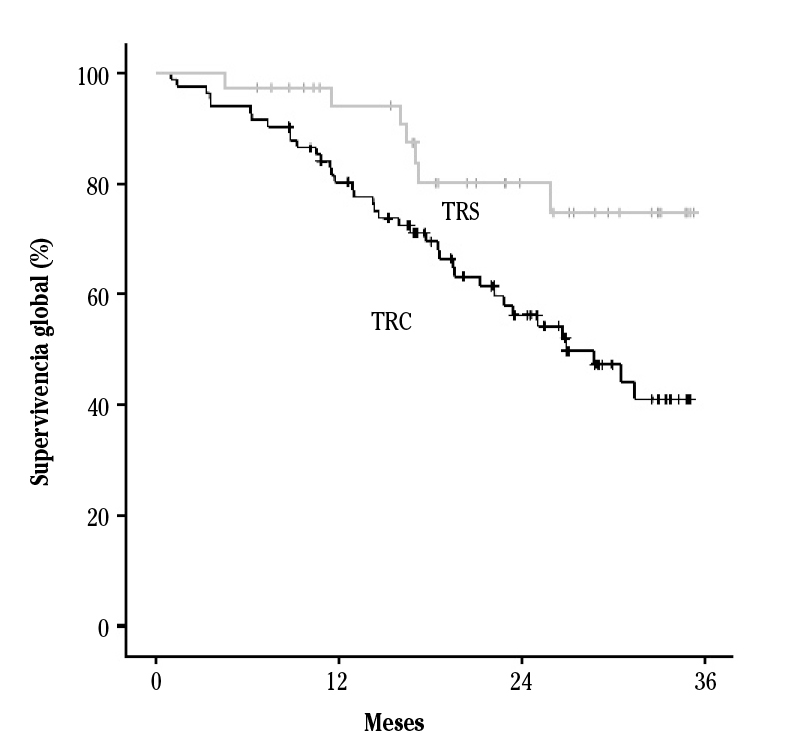
La tasa de mortalidad en TRC fue 23/1.000 pacientes-mes y en TRS de 8,7/1.000 pacientes-mes. La mediana de supervivencia de los pacientes en TRC fue 26,9 meses (IC95 %: 19,6-34,2). En TRS no se alcanzó la mediana de supervivencia, siendo la media 30,57 meses (IC95 %: 27,46-33,67); esta mayor supervivencia para los pacientes en TRS fue significativa (p= 0,014) (Fig.1).
En el análisis univariante, estar en TRS frente a TRC se asoció a un 63 % menos de mortalidad, y la existencia de un evento vascular previo la duplicó. Otras variables asociadas con la mortalidad se exponen en la Tabla 2.
Tabla 2. Predictores univariantes de mortalidad (regresión de Cox)
| HR | IC 95 % | p | |
|---|---|---|---|
| Modalidad de Tratamiento: TRS | 0,37 | 0,16-0,84 | 0,018 |
| TRC | 1 | - | |
| Edad (años) | 0,97 | 0,94-1,01 | 0,19 |
| eFG (mL/min/1,73 m2) | 1 | 0,94-1,08 | 0,78 |
| Proteinuria (g/L) | 1,17 | 1,003-1,38 | 0,04 |
| Albúmina (g/dL) | 0,49 | 0,26-0,91 | 0,025 |
| PTH (pg/mL) | 1 | 0,99-1,001 | 0,76 |
| Evento vascular previo: sí | 2,22 | 1,20-4,10 | 0,01 |
| no | 1 | - | |
| Indice Charlson (puntos) | 1,47 | 1,24-1,73 | <0,001 |
| Indice de Barthel (puntos) | 0,98 | 0,96-0,99 | <0,001 |
| Test de Pfeiffer: ≥ 3 puntos | 1,12 | 1,03-1,22 | 0,007 |
| <3 puntos | 1 | - | |
| Fragilidad: sí | 0,29 | 0,12-0,70 | 0,006 |
| no | 1 | - | |
| MNA-SF (puntos) | 0,82 | 0,73-0,91 | <0,001 |
HR: hazard ratio; IC95%: intervalos de confianza del 95%; TRS: tratamiento renal sustitutivo; TRC: tratamiento renal conservador; eFG-CKD-EPI: filtrado glomerular estimado por la fórmula Chronic Kidney Disease Epidemiology Collaboration; PTH: hormona paratiroidea; MNA-SF: Mini-Nutritional Assessment Short-Form.
Dadas las diferencias al inicio en las características de los pacientes en ambas modalidades de tratamiento, se realizó un ajuste multivariante progresivo para delimitar el efecto real del tratamiento. Al ajustar el modelo progresivamente por comorbilidad, situación funcional, nutricional y fragilidad, se perdió la ventaja de supervivencia de la diálisis: hubo una atenuación clínicamente relevante de la HR (>10 %) y una pérdida de la significación estadística a partir del ajuste por situación funcional determinada por el índice de Barthel (Tabla 3). En los sucesivos modelos multivariantes puede observarse que la comorbilidad fue el principal factor predictivo de mortalidad en los pacientes ancianos con ERCA: por cada punto de incremento del índice de comorbilidad de Charlson, la mortalidad aumentaba un 40 %, una asociación significativa (p=0,001) en el modelo 5 con ajuste completo por edad, sexo, situación funcional, nutricional y fragilidad.
Tabla 3. Análisis multivariante con ajuste progresivo por edad, sexo, comorbilidad, situación funcional, nutricional y fragilidad (grupo completo)
| Ajuste 1: | Ajuste 2: | Ajuste 3: | Ajuste 4: | Ajuste 5: | |
|---|---|---|---|---|---|
| edad, sexo | 1 + Charlson | 2 + Barthel | 3 + MNA-SF | 4 + fragilidad | |
| Variables | HR (95 %IC) | HR (95 %IC) | HR (95 %IC) | HR (95 %IC) | HR (95 %IC) |
| p | p | p | p | p | |
| Tratamiento (TRS/TRC) | 0,33 (0,15-0,75) | 0,39 (0,17-0,89) | 0,51 (0,21-1,22) | 0,48 (0,19-1,14) | 0,49 (0,19-1,14) |
| 0,008 | 0,025 | 0,13 | 0,09 | 0,11 | |
| Edad | 0,02 (0,94-0,99) | 0,97 (0,95-1,005) | 0,98 (0,95-1,008) | 0,98 (0,95-1,01) | 0,98 (0,95-1,01) |
| (años) | 0,17 | 0,11 | 0,17 | 0,23 | 0,23 |
| Sexo | 1,63 (0,89-3,01) | 1,35 (0,75-2,52) | 1,26 (0,72-2,52) | 1,37 (0,72-2,60) | 1,36 (0,71-2,60) |
| (varón/mujer) | 0,11 | 0,34 | 0,34 | 0,33 | 0,34 |
| Charlson (puntos) | 1,44 (1,20-1,74) | 1,42 (1,20-1,74) | 1,42 (1,17-1,72) | 1,40 (1,15-1,71) | |
| <0,0001 | <0,0001 | <0,0001 | 0,001 | ||
| Barthel (puntos) | 0,98 (0,97-1,00) | 0,99 (0,98-1,01) | 1,00 (0,98-1,01) | ||
| 0,05 | 0,92 | 0,95 | |||
| MNA-SF (puntos) | 0,86 (0,73-1,011) | 0,87 (0,74-1,03) | |||
| 0,06 | 0,11 | ||||
| Fragilidad | 1,52 (0,57-4,01) | ||||
| (sí/no) | 0,39 | ||||
Ajuste 1: por edad y sexo; Ajuste 2: por edad, sexo y comorbilidad (índice de Charlson); Ajuste 3: por edad, sexo, comorbilidad (índice de Charlson) y situación funcional (índice de Barthel); Ajuste 4: por edad, sexo, comorbilidad (índice de Charlson) situación funcional (índice de Barthel) y nutricional (cuestionario MNA-SF); Ajuste 5: por edad, sexo, comorbilidad (índice de Charlson) situación funcional (índice de Barthel), nutricional (cuestionario MNA-SF).y fragilidad (sí/no).
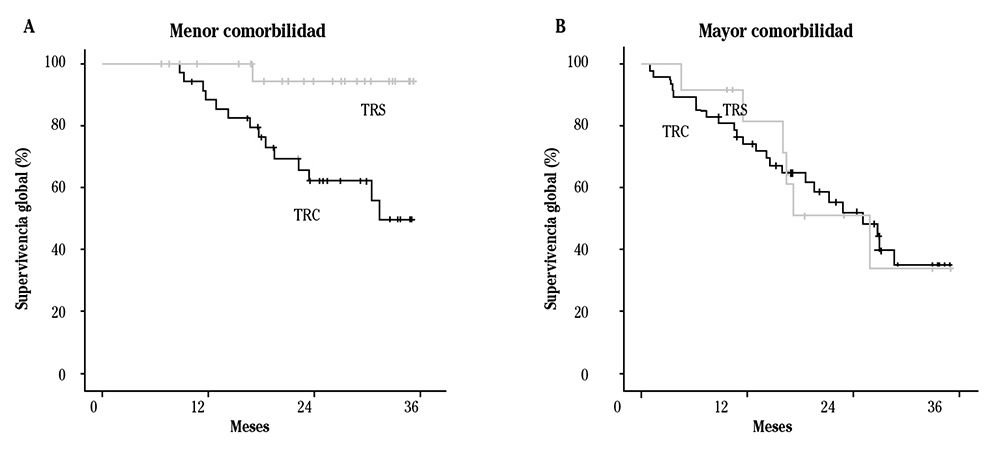
Dado que la interacción entre modalidad de tratamiento y comorbilidad fue significativa (p=0,05), se realizó un análisis estratificado por grado de comorbilidad (menor comorbilidad, índice de Charlson ≤8 puntos vs mayor comorbilidad, índice de Charlson >8). En pacientes de menor comorbilidad la HR del tratamiento (TRS vs TRC) fue 0,28: la supervivencia fue mayor cuando eran tratados con TRS que de forma conservadora (media de supervivencia 34,25 meses vs 27,29 meses, p=0,007). Por el contrario, en pacientes con mayor comorbilidad, la HR del tratamiento fue 0,75 pero no hubo diferencias significativas en la media de supervivencia de ambos tratamientos (22,37 vs 22,90 meses, p=0,980), por lo que en pacientes con índice de Charlson mayor de 8 puntos, el TRS no demostró una mejora de la supervivencia respecto al TRC (Fig. 2).
Discusión
En el presente trabajo se ha comprobado cómo los pacientes en TRC son pacientes con evolución hacia la cronicidad y pluripatológicos: 56 % de los pacientes habían tenido un evento vascular previo, 46 % eran diabéticos y la puntuación media en el índice de Charlson era de 9. Aunque la supervivencia de los pacientes en TRS es más prolongada, esto puede justificarse por la diferente comorbilidad entre ambos grupos. De hecho, la ventaja sobre la mortalidad se pierde cuando consideramos pacientes con elevada comorbilidad, definida en nuestro estudio como una puntuación de Charlson mayor a 8 puntos.
En ambos tratamientos es elevada la prevalencia de síndromes geriátricos, aunque es más importante, y por tanto diferenciadora, en TRC. Los pacientes en TRC tuvieron mayor comorbilidad y deterioro funcional, como se describió en los estudios de Smith21 y Teruel22 y col, y mayor riesgo de malnutrición y deterioro social como describieron Brown11 y Jolly y col23. Las características del paciente renal hacen que sea fundamental la implantación de equipos multidisciplinares que coordinen la atención entre especialistas y valoren al paciente desde una visión integra24 (repercusión clínica, funcional, cognitiva, psicoafectiva, social), especialmente en las últimas fases de la enfermedad.
Los resultados del estudio muestran una supervivencia mediana relevante para los pacientes en TRC: 26,9 meses, afines al trabajo de Wong25 (mediana de supervivencia 23 meses). A pesar de que el seguimiento fue de 3 años, el grupo de TRS no alcanzó un 50 % de mortalidad, por lo que solo hemos podido proporcionar datos de media de supervivencia: 30,5 meses y similares a los encontrados en el estudio de Brown y col11 (media de 33 meses). La neoplasia fue la principal causa de muerte en este grupo. Según el último registro nacional1 es la tercera causa de fallecimiento en TRS, en aumento en los últimos años: nuestros resultados podrían justificarse por el reducido tamaño muestral y número de eventos del grupo de pacientes en TRS.
Para la mayoría de los trabajos, heterogéneos en criterios de inclusión y metodología12 14, la supervivencia es más prolongada para los pacientes en diálisis23 26. Sin embargo, los resultados son distintos al tener en cuenta a los pacientes más ancianos o con mayor comorbilidad (especialmente CI)27-28. Chanda y col29 analizaron un subgrupo de pacientes mayores de 75 años y tras el ajuste por edad, comorbilidad y diabetes, la modalidad de tratamiento no obtuvo un beneficio significativo de supervivencia. Además, en los pacientes con mayor comorbilidad, la diálisis tan solo obtuvo cinco meses de supervivencia con respecto al TRC, sin diferencias significativas, similar a los resultados de este trabajo.
Hay que destacar la comorbilidad como factor predictivo de mortalidad (40 % por cada punto que aumentaba el índice de Charlson) al igual que en otros estudios11 29-30, por lo que en pacientes ancianos con ERCA la comorbilidad puede ser una consideración clave en el proceso de toma de decisiones. La edad no alcanzó significación estadística como predictor de mortalidad a diferencia de los estudios anteriores: una explicación pudiera ser una mayor edad registrada en nuestros pacientes, con diferencias más acentuadas respecto a la edad media de los pacientes de Chanda y col (TRC: 77,5 años, DE= 7,6; TRS: 58,5 años; DE= 15)29. La fragilidad no fue buen predictor de mortalidad. Una explicación puede estar en relación con el instrumento de medida utilizado (escala de Frail), a diferencia de otros estudios que utilizan la escala de Fried31.
Las fortalezas del trabajo son que se trata de un estudio que profundiza sobre el conocimiento de los pacientes en TRC. Mediante el análisis multivariante se ha podido ajustar por factores tan importantes como la situación funcional o nutricional, a diferencia de otros trabajos que por su naturaleza retrospectiva no permiten este ajuste. Analiza de una forma integral al paciente anciano, un grupo cada vez más numeroso y poco visible por la ausencia de registros en TRC, tal y como pone de manifiesto la última reunión KDIGO sobre cuidados paliativos renales6 12.
Dentro de las limitaciones, se trata de un trabajo con un tamaño muestral reducido que resta potencia estadística a nuestros resultados. No obstante, no hemos tenido pérdidas de seguimiento, por lo que no hubo sesgo de selección. Pudimos observar un sesgo de indicación de tratamiento, quizás inducido por las características iniciales de los pacientes; sin un ensayo clínico aleatorizado elegido (diseño que no puede llevarse a cabo por barreras éticas) es difícil atribuir las verdaderas diferencias de supervivencia en ambos grupos a la modalidad de tratamiento. Esta limitación fue parcialmente superada mediante el ajuste progresivo para los diferentes síndromes geriátricos considerados.
En conclusión, en nuestro grupo de pacientes ancianos con ERCA la ventaja del TRS respecto a la terapia conservadora en términos de supervivencia se reduce considerablemente cuando se ajusta para los diferentes síndromes geriátricos analizados. Se ha demostrado que la comorbilidad medida por el índice de Charlson es predictor independiente de mortalidad y que en pacientes ancianos con Charlson >8 puntos, el TRS no mejora la supervivencia.
La comorbilidad, la situación funcional y cognitiva, la fragilidad y situación nutricional deben ser tenidas en cuenta en el proceso de toma de decisiones. Necesitamos registros y nuevos trabajos que informen sobre qué pacientes pueden beneficiarse de esta terapia aunque la decisión final debe ser compartida con el paciente una vez informado de la forma más individualizada posible.