INTRODUCCIÓN
La leishmaniasis es un grupo de enfermedades causadas por parásitos protozoarios del género Leishmania transmitidas por flebótomos hembras que sigue siendo un importante problema de salud en numerosos países en desarrollo. Según los datos de la Organización Mundial de la Salud, la leishmaniasis es endémica en 98 países y anualmente se registran alrededor de un millón de casos, con una mortalidad estimada superior a 20.000 defunciones por año1,2. En Europa la enfermedad se debe principalmente a Leishmania infantum, y es hipoendémica en países de la cuenca mediterránea; se han descrito casos en Albania, Bosnia, Bulgaria, Chipre, Croacia, España, Francia, Grecia, Italia, Macedonia del Norte, Malta, Montenegro, Portugal y Turquía3.
Existen más de veinte especies patógenas de Leishmania que causan tres formas principales de manifestación clínica en el ser humano: leishmaniasis cutánea, la forma más común, leishmaniasis mucocutánea y leishmaniasis visceral o kala-azar, que afecta a órganos internos y es la forma más grave de la enfermedad, casi siempre fatal si no se trata1,2. El periodo de incubación de la forma cutánea es de una semana a varios meses, mientras que en la visceral oscila desde 10 días hasta dos años4. Actualmente no se dispone de una vacuna eficaz y los principales tratamientos administrados son, entre otros, antimoniales pentavalentes, la anfotericina B y la miltefosina5. Uno de los retos actuales es encontrar dianas terapéuticas y nuevos tratamientos activos, seguros y asequibles6,7.
MATERIAL Y MÉTODOS
Para la elaboración de esta revisión se realizó una búsqueda exhaustiva de la información disponible en bases de datos accesibles a nivel nacional y regional. Se consultaron artículos de revisión e investigación, informes y boletines epidemiológicos, y protocolos de vigilancia, entre otros, y se combinaron los datos obtenidos de cada una de las fuentes. En caso de discrepancia entre los datos publicados, se tomó en consideración la información procedente de informes y boletines oficiales o la más actualizada. Se excluyeron los artículos de opinión y publicaciones basadas en documentos sin validación experimental o respaldo de organismos oficiales.
Los datos sobre la situación epidemiológica de la leishmaniasis humana en España proceden de artículos de revisión e investigación, informes anuales de la Red Nacional de Vigilancia Epidemiológica (RENAVE)8, estudios epidemiológicos publicados en el Boletín Epidemiológico Semanal de la RENAVE3, artículos de la Revista Española de Salud Pública9 y el protocolo de vigilancia de la leishmaniasis de la Red de Vigilancia Epidemiológica de la Comunidad de Madrid4 (las Figuras 1 y 2 se generaron a partir de estas mismas fuentes).
Los datos sobre leishmaniasis en Navarra se obtuvieron de artículos de revisión10 e investigación11,12 y de los Boletines de Salud Pública de Navarra publicados periodicamente13; se completaron y contrastaron con los informes anuales de la RENAVE8. La información correspondiente a las regiones limítrofes se recogió de los boletines e informes propios de cada provincia: boletines epidemiológicos de La Rioja14, informes de Salud Pública y boletines epidemiológicos de la CAPV15 e informes actuales e históricos; datos históricos (tablas y gráficos) y Boletín Epidemiológico semanal de Aragón16; se completó y contrastó con los informes anuales de la RENAVE8.
Finalmente, se emplearon fuentes de información adicionales, como los datos publicados por el Centro de Coordinación de Alertas y Emergencias Sanitarias17 y los presentados en los talleres previos al XV Congreso de Salud Ambiental18.
RESULTADOS
Agente y vector
Los protozoos del género Leishmania presentan dos estadios en su ciclo de vida: el promastigote, forma infectiva flagelada que se desarrolla en el tracto digestivo del flebótomo hembra para después migrar a la probóscide del insecto, y el amastigote, forma aflagelada con localización intracelular en los vertebrados10. El ciclo de transmisión se inicia cuando un flebótomo hembra succiona sangre de un huésped en el que se encuentran amastigotes de Leishmania4. A pesar de que la leishmaniasis está considerada una zoonosis, siendo el humano un hospedador accidental, en algunos casos es una antropozoonosis (transmisión persona a persona mediada por el vector)4. También se ha descrito la transmisión entre consumidores de drogas por vía parenteral que comparten jeringuillas y mediante transfusiones de sangre4.
Los principales vectores de la leishmaniasis son los flebótomos del género Phlebotomus (Europa, Asia y África) y Lutzomyia (América). Estos vectores son de pequeño tamaño (inferior a 3 mm), de cuerpo peludo y de color amarillo pálido, antenas largas y delgadas y probóscide o trompa larga. Requieren para su desarrollo temperaturas en torno a los 20-25ºC, aunque pueden ser activos desde los 16ºC9. Las principales especies aisladas en España son Phlebotomus perniciosus, la más abundante y distribuida por la mayoría de las zonas de la península; Sergentomyia minuta, más densamente distribuida en hábitats rurales, y Phlebotomus ariasi, ligada a ambientes más frescos y húmedos como los territorios limítrofes con el norte de Portugal y el sur de Francia (por ejemplo, Navarra)17.
Recientemente se han encontrado especies de flebótomos en lugares no descritos hasta la fecha11. Además, en los últimos años se ha incrementado la densidad del vector y se ha prolongado su periodo de actividad19, lo que plantea que los cambios ambientales y el calentamiento global están teniendo un impacto en la densidad, la dispersión y los patrones de actividad de los vectores en toda Europa11.
Hospedador
El principal reservorio de la leishmaniasis es el perro, seguido del hombre y la liebre. Se han observado casos clínicos de la enfermedad en gatos y equinos, presentando signos cutáneos sin lesiones viscerales. El parásito ha sido aislado de otros mamíferos silvestres como el zorro, el lobo, el gato montés, la gineta, la nutria, la garduña y el lince; sin embargo, se necesitan más estudios para dilucidar si estos últimos pueden actuar como reservorios activos20,21.
Los estudios de seroprevalencia en perros en España publicados entre 1985 y 201921-23, han sugerido unas tasas de infección que varían entre el 2 y el 57,1% según el área11. Las provincias con mayor seroprevalencia fueron Islas Baleares, Orense (Galicia), Málaga (Andalucía) y Cáceres (Extremadura), seguidas de Gerona (Cataluña), Córdoba y Granada (Andalucía), y Alicante (Valencia). Se ha observado que alrededor del 50% de los perros infectados son asintomáticos17, y varios autores han demostrado que estos animales pueden ser reservorios y, en consecuencia, juegan un papel activo en la transmisión de la enfermedad24. Este hecho se ha demostrado también experimentalmente, donde perros asintomáticos infectados naturalmente resultaban muy infectivos para los flebótomos5.
Un estudio reciente ha proporcionado información sobre la prevalencia y distribución de Leishmania en carnívoros silvestres en Asturias, mostrando presencia generalizada y una alta prevalencia (33% para los lobos y 40% para todos los carnívoros silvestres estudiados)25, con un aumento en la prevalencia en lobos durante la última década20. Estos datos resaltaron la incidencia de la patología en Asturias, considerada hasta entonces como una región no endémica26, y apoyan la propuesta del cambio climático como causa importante de la propagación del parásito25.
El mismo estudio25 destacó la presencia de leishmaniasis en gatos monteses. Si bien los resultados se basaron en un tamaño de muestra muy pequeño, el hecho de que los tres gatos monteses examinados dieran positivo en Leishmania reveló la necesidad de incluir tanto gatos salvajes como domésticos en los programas de vigilancia, a fin de comprender mejor el papel de estos felinos en la epidemiología del parásito25.
Leishmaniasis en España
En España, al igual que en el resto de Europa, la leishmaniasis es principalmente debida a Leishmania infantum, que produce formas tanto cutáneas como viscerales.
La enfermedad sigue tres patrones de presentación: endémico, en el que los casos de enfermedad se presentan de forma esporádica y el perro actúa como principal reservorio; casos asociados a coinfección con el virus de la inmunodeficiencia humana (VIH) o a situaciones de inmunodepresión, y brotes epidémicos9.
Los primeros casos descritos fueron diagnosticados en el delta del Ebro por Pittaluga en 1912; desde entonces la leishmaniasis ha sido objeto de estudios epidemiológicos10 hasta convertirse en una enfermedad de declaración obligatoria (EDO) en 1982. Posteriormente, se creó la RENAVE (Real Decreto 2210/1995), que describe cómo se han de vigilar las EDO, y entre cuyas funciones está la recogida sistemática de la información epidemiológica, su análisis e interpretación, y la difusión de sus resultados y recomendaciones27. Además de la creación de RENAVE, se clasificó la leishmaniasis como enfermedad endémica de ámbito regional y dejó de ser de notificación obligatoria en aquellas comunidades autónomas (CCAA) donde la enfermedad no se consideraba endémica. A raíz de esta modificación, muchas CCAA dejaron de notificar los casos de leishmaniasis porque no la consideraban endémica de su zona, hecho que dio como resultado la infraestimación de la enfermedad en el país. Por ello, años después se decidió revalorar la consideración de zona endémica comparando, en el periodo 2005-2010, los casos notificados a la RENAVE con los registrados en el Conjunto Mínimo Básico de Datos (CMBD) a partir de altas hospitalarias con leishmaniasis como primer diagnóstico. La RENAVE define caso probable como aquel que cumple los criterios clínicos y epidemiológicos (infección por VIH o contacto con animal infectado), y caso confirmado como aquel que cumple criterios clínicos y algún criterio de laboratorio3. Al comparar ambas fuentes se observó que la mayoría de las CCAA habían registrado casos en el CMBD mientras que solo diez CCAA habían notificado algún caso a la RENAVE, estimándose una subnotificación de casi el 50%17. Por tanto, se observó la necesidad de reforzar el sistema de vigilancia epidemiológica en el que la enfermedad se consideraba endémica de ámbito regional, y de incluir la leishmaniasis como EDO a nivel nacional17. Esta modificación se llevó a cabo en 2015, y está contribuyendo a conocer el estado real de la enfermedad en el país. Desde entonces, se han incluido variables nuevas, entre ellas la categoría clínica3.
Entre 2005 y 2010 hubo una media anual de alrededor de 100 casos/año (Fig. 1). Los picos de 2011 y 2012 se deben principalmente al brote de leishmaniasis que tuvo lugar en la Comunidad de Madrid, el mayor brote de leishmaniasis humana en Europa hasta la fecha28; se detectó a mediados de 2009 y alcanzó su valor máximo en 2012, año en el que aportó el 71% de los casos notificados a nivel nacional8.
En los últimos años se observó una tendencia ascendente de casos, debida en parte a la modificación vigente desde 2014 la cual aumentó el número de CCAA declarantes, entre ellas la Comunidad Valenciana que fue la comunidad con más registros en los años 2017 y 2018 (n=219); este aumento no parece ser la consecuencia de una mayor presencia de población susceptible18. Las CCAA que más casos han sumado desde 2012 son la Comunidad de Madrid, Cataluña, Islas Baleares y Andalucía.
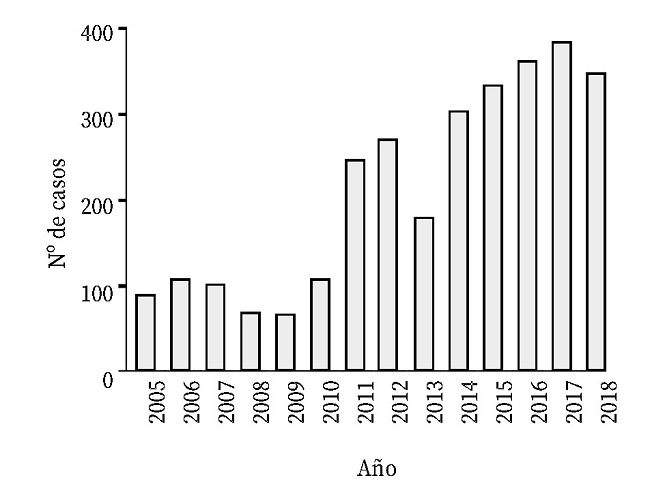
Figura 1. Casos totales de leishmaniasis notificados en España en el periodo 2005-2018. Información obtenida de los informes anuales y boletines epidemiológicos semanales de la RENAVE3,8.
Dado que los datos registrados en el periodo 2005-2013 corresponden a las notificaciones estables de ocho CCAA (Andalucía, Aragón, Baleares, Extremadura, Madrid, Murcia, Navarra y La Rioja) y posteriormente se recogió la información de 15 CCAA (las ocho anteriores y Canarias, Castilla y León, Castilla-La Mancha, Cataluña, Galicia, País Vasco y Valencia) y de las dos ciudades autónomas de Ceuta y Melilla, y que la población de cada comunidad autónoma es diferente, en la figura 2 se presenta el número de casos de leishmaniasis por millón de habitantes, teniendo en cuenta la suma de la población de las CCAA declarantes cada año.
Leishmaniasis en Navarra
Los primeros casos de leishmaniasis descritos en Navarra (España) se diagnosticaron en 1976 en Ansoáin, Lodosa y Dicastillo, iniciando el seguimiento epidemiológico de la enfermedad en esta comunidad10. Desde entonces se han publicado varios trabajos en los que se abarcan distintos aspectos de la enfermedad como su vector, la distribución geográfica y la prevalencia.
Sesma y Barricarte10 mencionan uno de los primeros estudios sobre leishmaniasis en Navarra, realizado por Armendáriz y Eguaras en 1983, que identificó cuatro especies de flebótomos (P. perniciosus, P. ariasi, S. minuta y P. papatasi) distribuidos en 21 localidades de la comunidad foral10. En 2020, Gálvez y col. publicaron una revisión11 sobre la leishmaniasis canina a nivel nacional, que incluyó los resultados obtenidos previamente por Sesma y Barricarte (1997)10. Dichos investigadores calculan una seropositivad del 5,9% de leishmaniasis canina en Navarra de un total de 653 muestras analizadas10,11. Se ha estimado recientemente una seroprevalencia cercana al 18% en perros de Navarra, a partir de 72 muestras obtenidas de cuatro clínicas veterinarias entre 2017 y 201812.
En las CCAA limítrofes a Navarra se han descrito seroprevalencias del 24,6% en Aragón, 5% en País Vasco12 y 6,1% en La Rioja11. Actualmente, Navarra, País Vasco y La Rioja están consideradas zonas hipoendémicas (riesgo intermedio) y Aragón endémica (riesgo intermedio-alto)11.
Desde 1976 hasta 2018 se han diagnosticado 53 casos de leishmaniasis humana, equivalentes a 0,95 casos/año. Predomina la forma visceral (49% del total), aunque se han registrado 15 casos de leishmaniasis cutánea (Fig. 3). Los casos informados entre 1976 y 1997 se recogieron en el Instituto de Salud Pública de Navarra, combinando los casos declarados al sistema de EDO junto con los obtenidos por búsqueda activa de otras fuentes10. Los datos correspondientes al periodo 1998-2018 se han extraído del Boletín de Salud Pública de Navarra publicado periódicamente13, en la mayoría de los cuales no consta información sobre sexo, edad y tipo de leishmaniasis de las personas afectadas. La prevalencia de pacientes inmunodeprimidos en el periodo 1998-2018 fue del 10%13.
La Tabla 1 recoge los casos totales acumulados y la tasa media anual de leishmaniasis en Navarra y las CCAA limítrofes en el periodo 1998-2018. Aragón tiene la mayor tasa de incidencia, con un máximo de 1,1 casos/100.000 habitantes en 2001. La Rioja registró el valor más alto en 2000 con 0,76 caso/100.000 habitantes, Navarra en 2016 con 0,47 casos/100.000 habitantes, y el País Vasco en 2010 con 0,18 casos/100.000 habitantes.
Tabla 1. Casos totales de leishmaniasis humana y tasa media anual. (1998-2018) en Navarra y zonas limítrofes.
| 1998-2018 | ||
|---|---|---|
| Casos totales | Tasa media anual (media de casos/100.000 habitantes-año) | |
| Navarra | 0 | 0,16 |
| La Rioja | 5 | 0,23 |
| País Vasco | 4 | 0,08 |
| Aragón | 120 | 0,44 |
Datos tomados del Boletín de Salud Pública de Navarra13, Boletín Epidemiológico de La Rioja14, Boletín Epidemiológico de la Comunidad Autónoma del País Vasco15 y Boletín Epidemiológico Semanal de Aragón16).
Si comparamos la tasa de incidencia de los últimos diez años con la década anterior, Aragón es la única comunidad que ha disminuido esta cifra, mientras que Navarra y La Rioja casi han duplicado el número de casos por 100.000 habitantes; el País Vasco también presenta un aumento en la incidencia.
En Navarra se notificaron en 2019 cuatro casos de leishmaniasis visceral, alcanzando una tasa de incidencia de 0,61 casos/100.000 habitantes, la mayor registrada desde 1992, año en el que fue de 0,96 caso/100.000 habitantes.
DISCUSIÓN
A pesar de que desde 2015 ha aumentado el número de CCAA notificantes en España, se sospecha una importante subdeclaración de leishmaniasis, estimada en un 25-40% para la leishmaniasis visceral y casi un 100% para la cutánea4.
La leishmaniasis se está expandiendo en Europa, especialmente en países endémicos como Italia y España, por lo que distintos autores hablan de ella como una enfermedad emergente4,29,30. Varios estudios han indicado que el aumento de las temperaturas promoverá la expansión de los flebotomos hacia regiones más septentrionales de Europa, donde actualmente no están establecidos11,30. Además, el aumento de temperatura acelera el ciclo de desarrollo de L. infantum en el vector e incrementa su infectividad11.
También aumenta la propagación del parásito la adopción de animales infectados procedentes de áreas endémicas; en Alemania y Reino Unido se ha observado que perros diagnosticados con leishmaniasis habían sido previamente infectados en países mediterráneos11. En el caso de los humanos, se ha destacado el aumento de pacientes inmunodeprimidos (sujetos que reciben terapia para enfermedades autoinmunes, cáncer o trasplantes que dan como resultado una reducción de la inmunidad celular), más susceptibles a las infecciones y, por tanto, a la progresión a leishmaniasis sintomática, tal y como se ha visto en pacientes con coinfección por leishmaniasis y VIH/SIDA29.
La seroprevalencia de la leishmaniasis canina en Navarra fue del 5,9% en 19979 y del 18% en 202012. Si bien el número de muestras analizadas en cada uno de los estudios fue muy diferente (653 frente a 72), el hecho de que la prevalencia descrita actualmente sea tres veces superior a la apuntada en 1997 puede indicar un aumento real de prevalencia en la provincia.
Dado el importante papel de los perros como reservorio y el alto porcentaje de canes asintomáticos infectados, son varias CCAA que han presentado campañas para la prevención y el diagnóstico de la enfermedad en animales, entre ellas, la presentada por el Colegio Oficial de Veterinarios de Navarra junto con el Gobierno de Navarra en 2013, que tiene por objeto sensibilizar a la ciudadanía en general, y a los dueños de animales de compañía en particular, sobre su importancia31. En esta campaña se remarcó la necesidad de aumentar las medidas de prevención (uso de repelentes, collares y mosquiteras, vacunación, evitar que el animal duerma en el exterior) y realizar pruebas de forma regular para facilitar una detección precoz de la enfermedad, a fin de tratar a tiempo los casos positivos31.Otra de las medidas para mejorar el control de la leishmaniasis es la obligación de identificar perros, gatos y hurones mediante microchips homologados, vigente desde 2019 por la Ley Foral 19/2019 de Protección de los Animales de Compañía en Navarra.
En definitiva, se concluye que, si bien la incidencia de leishmaniasis humana en España no supone una situación de elevada preocupación, es una realidad. Por ello, es necesario vigilar globalmente su evolución considerando todos los aspectos que contribuyen (el agente patógeno, el vector, el medio ambiente y el reservorio) bajo el enfoque una sola salud / one health32. La gestión de las poblaciones de flebótomos y la puesta en marcha de estrategias para reducir el número de animales infectados permitirán disminuir la carga parasitaria y, por tanto, minimizar el riesgo de infección tanto para los animales como para los humanos.
















