INTRODUCCIÓN
El dolor es un concepto que implica tres dimensiones: sensorial-discriminativa, afectivo-motivacional y cognitivo-evaluativa. La Asociación Internacional para el Estudio del Dolor lo define como una experiencia sensorial subjetiva y emocional desagradable, asociada con una lesión presente o potencial1. La experiencia del dolor resulta de la interacción de factores fisiológicos, genéticos, cognitivos, afectivos, conductuales, culturales, sociales y familiares; ningún factor, por sí solo, explica adecuadamente las causas de dolor2.
Según su duración el dolor se clasifica en agudo y crónico; el crónico dura más de seis meses y, dado que persiste más allá del tiempo habitual necesario para la reparación tisular, carece de valor biológico aparente porque no actúa como defensa para el organismo3,4. La patogenia del dolor crónico es compleja, con cambios neuro-bioquímicos y estructurales en el sistema nervioso central no relacionados con la propia lesión y el estímulo doloroso5. Puede provocar un deterioro relacional y funcional en los pacientes, causando ansiedad, depresión, disminución de la calidad de vida, alteración del sueño y reducción de la productividad laboral, entre otras consecuencias que conllevan notables costes asistenciales y laborales5,6.
Según la Sociedad Española de Reumatología (SER), existen más de 250 clases de enfermedades reumáticas diferentes; la artritis reumatoide (AR), la artritis psoriásica (AP) y la espondilitis anquilosante (EA) son las más prevalentes. Los fármacos antirreumáticos modificadores de la enfermedad (FAME) son los únicos que han demostrado reducir las manifestaciones de la enfermedad reumatológica o retrasar su progresión. Pueden ser FAME tradicionales o FAME biológicos (moléculas complejas que inhiben dianas terapéuticas claves en la patogenia de la enfermedad)21,22.
Las enfermedades reumáticas son la causa más frecuente de dolor crónico no maligno7-11, que es el síntoma principal y generalmente más frecuente. Según la Encuesta Nacional de Salud del Ministerio de Sanidad y Consumo de 2011, el 18,29% de la población española refirió estar diagnosticada de artritis, artrosis o reumatismo, con una prevalencia superior a cualquier otro proceso crónico12. El binomio dolor-enfermedad reumática presenta una alta comorbilidad asociada, una importante pérdida de capacidad funcional y una disminución de la calidad de vida de los pacientes, siendo una de las principales causas de incapacidad laboral13-18.
En 2017 se realizó el estudio prospectivo sobre evaluación del dolor en Reumatología (EVADOR)20. Describió una prevalencia muy elevada de dolor (86%), generalmente crónico (81%), con una intensidad media/moderada (puntuación 4-6 en la escala visual analógica, EVA), que era tratado con antiinflamatorios no esteroideos (AINE) (46%) y opioides (23,5%; 18,9% débiles y 4,6% potentes). El uso de opioides fue mayor al descrito (<7%) en 2002 por el estudio EPIDOR (estudio epidemiológico del dolor en las consultas de Reumatología)19 ante prevalencias similares de dolor crónico, que era intenso en más de dos tercios de los pacientes en revisión.
Alrededor del 40% de los pacientes con enfermedades reumáticas presentan un control insatisfactorio del dolor19,23,24. Para alcanzar un manejo correcto es esencial evaluar sistemáticamente la intensidad del dolor, su efecto en la calidad de vida y en la funcionalidad de los pacientes, y su respuesta al tratamiento analgésico24. La escalera analgésica de la Organización Mundial de la Salud es una herramienta útil para el correcto uso de las terapias farmacológicas analgésicas, compuesta por tres escalones que progresan desde los analgésicos no opioides hasta los opioides más potentes25.
El objetivo del estudio fue evaluar la presencia, intensidad y localización del dolor en pacientes con patologías reumáticas en tratamiento con FAME biológicos y analizar las variables asociadas al control del dolor.
MMATERIAL Y MÉTODOS
Estudio observacional, retrospectivo, unicéntrico, realizado en la unidad de pacientes externos del Servicio de Farmacia del hospital de Barbastro entre febrero y agosto de 2020. Esta unidad desarrolla una atención farmacéutica especializada a los pacientes externos que requieren tratamiento con fármacos de dispensación hospitalaria, colaborando de forma estrecha con el médico responsable y con el equipo de enfermería.
En el estudio se incluyeron los pacientes atendidos en la unidad, de cualquier sexo y raza, mayores de 18 años, con diagnóstico confirmado de AR, AP o EA y en seguimiento por el Servicio de Reumatología del hospital, en tratamiento con FAME biológicos con duración superior a tres meses.
La fuente principal de información para la obtención de datos demográficos, clínicos, y farmacológicos fue el módulo de atención a pacientes externos del programa informático Farmatools Dominion®. Como fuente secundaria de información se utilizó la Historia Clínica Electrónica del hospital. El estudio obtuvo el dictamen favorable del Comité Ético de Investigación Clínica de Aragón.
Se recogieron las siguientes variables:
- Demográficas: sexo y edad.
- Clínicas: enfermedad reumatológica diagnosticada, presencia de dolor, localización del dolor, intensidad del dolor (puntuación EVA: 0 = ausencia de dolor, 1-3: leve, 4-6: moderado, 7-10: severo, 9-10: muy severo); una puntuación EVA >4 se consideró dolor no controlado20,26.
- Farmacológicas: tipo de FAME biológicos, tipo y frecuencia de FAME tradicionales, tipo y frecuencia de fármacos analgésicos, pauta de analgésicos (pautado y si precisa), frecuencia de fármacos coadyuvantes y corticoesteroides.
El tratamiento estadístico de los datos se realizó con el programa IBM SPSS Statistics® versión 25. Las variables cuantitativas se describieron con medidas de tendencia central (media) y dispersión (DE), y las variables cualitativas mediante frecuencias y porcentajes. La asociación entre dos variables cualitativas se analizó con la prueba Chi-cuadrado (χ2) y entre cuantitativas con la rho de Spearman. El nivel de confianza fijado en las comparaciones fue del 95%, aceptándose como significativas las diferencias con valores p< 0,05.
RESULTADOS
Se incluyeron 138 pacientes en el estudio; 98 (71%) eran mujeres y la edad media fue 56 años (DE: 11,96; rango 28-85). El diagnóstico de la enfermedad reumatológica fue EA en casi la mitad de los casos (n = 65; 47%), 28% AP (n = 39) y 25% AR (n = 34).
Todos los pacientes incluidos en el estudio tomaban FAME biológicos, mayormente anti TNF-α (63,8%); el 60,1% de los pacientes tomaba tratamiento concomitante con FAME tradicionales ( Tabla 1), la mayoría (86,7%) con un solo fármaco y el resto con dos.
El 81,2% de los pacientes (n = 112) presentaban dolor, localizado más frecuentemente en miembros superiores (86,2% de los pacientes, el 73,2% de ellos en las manos), los inferiores (71%; 69,6% en rodillas) y la columna (31%; 57% lumbar).
Tabla 1. Fármacos antirreumáticos modificadores de la enfermedad (FAME) utilizados por los pacientes según su mecanismo de acción.
| Tipo de FAME | n (%) |
|---|---|
| Biológicos | 138 (100) |
| Anti TNF-α | 89 (64,5) |
| Adalimumab | 34 (24,6) |
| Etanercept | 31 (22,5) |
| Golimumab | 20 (14,5) |
| Certolizumab | 4 (2,9) |
| Inhibidores | 49 (35,5) |
| IL-17A (secukinumab) | 29 (21,0) |
| JAK (tofacitinib/baricitinib) | 11 (8,0) |
| IL-12/IL-23 (ustekinumab) | 5 (3,6) |
| IL-6 (tofacitinib) | 4 (2,9) |
| Tradicionales* | 83 (60,1) |
| Metotrexato | 43 (51,8) |
| Vía oral | 27 (32,5) |
| Vía subcutánea | 16 (19,3) |
| Leflunomida | 24 (28,9) |
| Salazopirina | 12 (14,4) |
| Hidroxicloroquina | 10 (12) |
| Azatioprina | 5 (6) |
*:algunos pacientes tomaban más de uno.
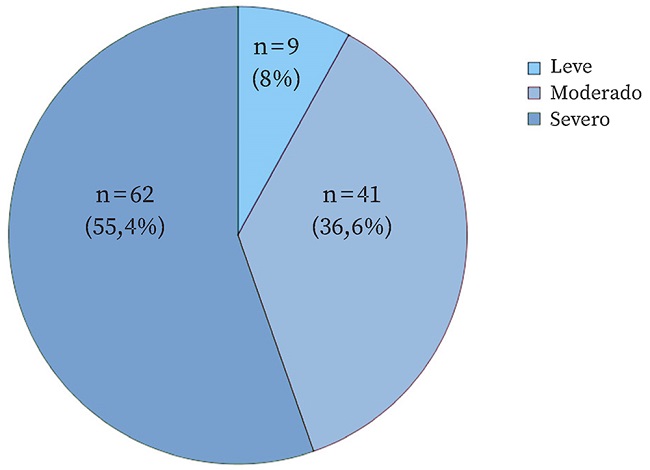
La intensidad global fue moderada (puntuación media EVA: 6,5; DE: 1,96), pero más de la mitad de los pacientes (55,4%) presentaban dolor severo y el 12,5% muy severo (Fig. 1). El 84,8% de los pacientes con dolor no lo tenían controlado (EVA >4) (n = 95).
El 83,3% de los pacientes (n = 115) estaban en tratamiento con algún fármaco analgésico, incluidos nueve que no referían dolor. Seis de los pacientes que presentaban dolor no recibían ningún tratamiento analgésico por decisión propia (5,4%). Solo el 12,3% de los pacientes (n = 17) en tratamiento con FAME biológicos no presentaban dolor a pesar de no recibir tratamiento analgésico.
Los pacientes tomaban entre uno y cuatro fármacos analgésicos (media: 1,8; DE: 0,9; los AINE y el paracetamol fueron los tratamientos analgésicos más frecuentes (60 y 52,2%, respectivamente). El 77,1% de los 48 pacientes que tenían prescritos opioides tomaban opioides menores ( Tabla 2). El uso de coadyuvantes fue poco frecuente: solo nueve pacientes (7,8%) tomaban antidepresivos (duloxetina) y anticonvulsivantes (gabapentina). Además, 18 pacientes (15,7%) tomaban de forma concomitante corticoesteroides, siendo el deflazacort el fármaco de elección en todos ellos.
Tabla 2. Cantidad y tipo de analgésicos en tratamiento concomitante para 115 pacientes.
| Fármacos analgésicos | n (%) |
|---|---|
| Número | |
| 1 | 55 (47,8) |
| 2 | 30 (26,1) |
| 3 | 25 (21,8) |
| 4 | 5 (4,3) |
| Tipo | |
| Paracetamol | 60 (52,2) |
| Metamizol | 20 (17,4) |
| AINE | 69 (60,0) |
| Coxibs | 30 (26,0) |
| Ibuprofeno | 20 (17,4) |
| Naproxeno | 15 (13,0) |
| Indometacina | 4 (3,5) |
| Diclofenaco | 2 (1,7) |
| Oxicams | 1 (0,9) |
| Nabumetona | 1 (0,9) |
| Opioides menores | 48 (41,7) |
| Tramadol | 37 (32,2) |
| Opioides mayores | 17 (14,8) |
| Tapentadol | 8 (6,9) |
| Fentanilo | 5 (4,3) |
| Oxicodona | 2 (1,7) |
| Buprenorfina | 2 (1,7) |
| Otros | 4 (3,5) |
La mayoría de los pacientes con tratamiento analgésico percibía una reducción en la intensidad del dolor tras la toma (n = 63; 54,8%), o incluso la desaparición del mismo (7,8%; n = 9). El resto de pacientes (n = 34; 29,6%) no notaban mejoría; hubo nueve pacientes con tratamiento analgésico que no tenían dolor. De los 21 pacientes (18,3%) que tenían prescrito el tratamiento analgésico únicamente en pauta si precisa, el 76,2% presentaban dolor moderado (EVA 4-6). Solo nueve pacientes (7,8%) tenían prescrita la analgesia de forma pautada y si precisa.
La mayoría de los pacientes que recibían tratamiento analgésico (86,8%) no tenían controlado el dolor. Tres de los seis pacientes que no tomaban tratamiento analgésico tenían el dolor controlado ( Tabla 3).
Tabla 3. Control del dolor en pacientes con dolor (n = 112) con y sin tratamiento analgésico.
| Tratamiento analgésico | Global | Dolor controlado | |
|---|---|---|---|
| Sí | No | ||
| Sí | 106 (94,6) | 14 (13,2) | 92 (86,8) |
| No | 6 (5,4) | 3 (50) | 3 (50) |
| Total con dolor | 17 (15,2) | 95 (84,8) | |
La frecuencia de dolor controlado fue mayor en los pacientes en tratamiento con AINE (14,5%) frente a los pacientes en tratamiento con opioides (8,3%).
Se encontró una correlación débil pero estadísticamente significativa entre el número de analgésicos y el grado de dolor (rho de Spearman = 0,264; p = 0,006). Los pacientes en tratamiento con solo un analgésico presentaron la puntuación EVA media más baja (5,35; DE: 2,90) ( Tabla 4). La mayoría de los pacientes que tomaban más de un tratamiento analgésico presentaban dolor severo (dos, tres o cuatro analgésicos) (70, 72 y 60%, respectivamente). El 68,8% de los pacientes en tratamiento con opioides y el 82,3% con opioides mayores presentaban dolor severo.
Tabla 4. Grado de dolor y puntuación EVA según número de analgésicos tomados por los pacientes (n = 115).
| Analgésicos n | Grado de dolor | n (%) | Puntuación EVA: media (DE); rango |
|---|---|---|---|
| Uno | 55 (47,8) | 5,35 (2,90); 0-10 | |
| Ausencia | 8 (14,5) | ||
| Leve | 5 (9,1) | ||
| Moderado | 23 (41,8) | ||
| Severo | 19 (34,5) | ||
| Dos | 30 (26,1) | 6,5 (2,17); 0-9 | |
| Ausencia | 1 (3,3) | ||
| Leve | 1 (3,3) | ||
| Moderado | 7 (23,3) | ||
| Severo | 21 (70) | ||
| Tres | 25 (21,7) | 6,8 (2,04); 1-10 | |
| Leve | 2 (8) | ||
| Moderado | 5 (20) | ||
| Severo | 18 (72) | ||
| Cuatro | 5 (4,3) | 7 (1); 6-8 | |
| Moderado | 2 (40) | ||
| Severo | 3 (60) | ||
DISCUSIÓN
Los resultados de este estudio describen las características de los pacientes externos con enfermedad reumática en tratamiento con FAME biológicos en nuestro hospital, la frecuencia y características del dolor y su relación el tratamiento analgésico recibido.
La edad y sexo de los pacientes son los característicos de las enfermedades reumatológicas19,20. La elevada prevalencia de dolor fue similar a la obtenida en otros estudios19,20. Llama la atención que, aunque la intensidad media fue moderada, más de la mitad de los pacientes presentaban dolor severo, con una frecuencia de dolor no controlado que duplica la descrita en otros estudios (84,8 vs 40%)23,24.
Los miembros superiores fueron la localización más frecuente del dolor, principalmente en las manos porque son las articulaciones afectadas con mayor frecuencia y rapidez en las artritis inflamatorias (AR, AP y EA).
Una amplia mayoría de los pacientes (83,3%) trataba el dolor con algún analgésico, dato muy similar al obtenido en el estudio EVADOR (82%)20. Los analgésicos más utilizados fueron los AINE, principalmente coxibs, al igual que en los estudios EPIDOR y EVADOR19,20, pero mientras la frecuencia de uso de AINE fue muy similar al del estudio EPIDOR (58%)19, fue superior a la del estudio EVADOR20 tanto para AINE (60 vs 46%) como para coxibs (26 vs 11%).
El uso de analgésicos más potentes en nuestro estudio (14,8%) fue superior al del estudio EVADOR (5%)20. Cabe destacar que, tal y como indica el Consenso de la SER para el uso de opioides en el tratamiento del dolor reumático24, el uso de analgésicos más potentes (opioides mayores) se aconseja cuando los opioides menores hayan fracasado en el control del dolor o en los casos de dolor intenso (EVA ≥7). Esta recomendación coincide con los datos obtenidos en nuestro estudio, ya que la mayoría (82,3%) de los pacientes en tratamiento con opioides mayores presentaban dolor severo.
El dolor no estaba controlado en la mayoría de los pacientes, lo que podría relacionarse con el número de analgésicos y con la pauta de prescripción de los mismos. En nuestro estudio, casi la mitad de pacientes (47,8%) estaban en tratamiento con un solo fármaco analgésico, a pesar de que para tratar el dolor crónico es preferible la analgesia combinada o multimodal, por sus efectos aditivos/sinérgicos y porque este tipo de dolor involucra más de un mecanismo nociceptivo27,28. Además, el 18% de los pacientes tenían prescrito el tratamiento analgésico solo si precisa, cuando esta pauta únicamente es recomendable en casos de dolor agudo, dolor irruptivo, o en pacientes con dolor muy controlado; el 76% de ellos presentaban dolor moderado (EVA 4-6). Para tratar el dolor crónico se recomienda prescribir fármacos en pauta fija junto con un fármaco en pauta si precisa, lo que solo se observó en el 8% de los pacientes del estudio. Todo ello, puede dar lugar a un control insatisfactorio del dolor; de hecho, en nuestro estudio el 86,8% de los pacientes en tratamiento analgésico no tenían controlado el dolor.
La principal limitación del estudio es que el tamaño del grupo sin tratamiento analgésico es muy pequeño, por lo que no es posible realizar comparaciones directas entre los grupos. Una de las fortalezas del estudio es la recogida de datos en la práctica clínica real, mediante el contacto directo con los pacientes. Este estudio puede ser el punto de partida para la optimización del tratamiento analgésico, consiguiendo así el correcto control del dolor en pacientes con patologías reumáticas y, por tanto, una mejora significativa de la calidad de vida de los pacientes.
En conclusión, la prevalencia de dolor fue elevada, de intensidad severa en más de la mitad de los casos y no controlado con su tratamiento analgésico habitual, lo que pone de manifiesto que el tratamiento eficaz del dolor en los pacientes con enfermedades reumatológicas continúa siendo un desafío que debemos priorizar, debido a su efecto directo sobre la calidad de vida de los pacientes. El tratamiento del dolor es complejo y requiere un abordaje integral e individualizado con estrategias terapéuticas precisas y adaptadas a cada paciente y al tipo de dolor a fin de mejorar los resultados en salud.