Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Pediatría Atención Primaria
versión impresa ISSN 1139-7632
Rev Pediatr Aten Primaria vol.12 no.45 Madrid ene./mar. 2010
PEDIATRÍA BASADA EN LA EVIDENCIA
Tratamiento preventivo para la migraña en niños: cuándo y cómo
Preventive therapy in migraine disorders: when and how
N.R. García Lara, M.E. Frías García
Pediatras. CS General Ricardos. Servicio Madrileño de Salud, Área 11. Madrid.
Este artículo se publica simultáneamente con la revista electrónica Evidencias en Pediatría (EeP, www.evidenciasenpediatria.es).
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
RESUMEN
Conclusiones de los autores: aunque se han estudiado diversos fármacos en la profilaxis de la migraña en niños, la mayoría de los ensayos clínicos son de tamaño muestral pequeño y no están metodológicamente bien diseñados. Hay más datos de flunarizina y propranolol aunque la evidencia clínica no es consistente. Sobre el topiramato se concluye que su eficacia debe ser confirmada en más estudios bien diseñados.
Comentario de los revisores: topiramato y flunarizina muestran una evidencia clínica aceptable en la reducción de la frecuencia de migraña y su intensidad en niños. La evidencia relativa a propranolol es controvertida, por lo que se reservaría como fármaco de segunda elección. Los tres fármacos son seguros. Para establecer una evidencia sólida sería prioritaria la realización de ensayos clínicos de gran tamaño y bien diseñados con los tres fármacos citados.
Palabras clave: Trastornos migrañosos. Prevención y control. Niño. Adolescente.
ABSTRACT
Authors´ conclusion: despite the fact that several drugs to prevent migraines have been studied in children, most trials have small size and poor design. Flunarizine and propranolol are the best studied drugs although the clinical evidence is not consistent enough. In relation to topiramate, its effectiveness has to be confirmed in more adequately designed studies.
Reviewers´ commentary: topiramate and flunarizine show acceptable evidence reducing frequency and intensity of migraines in children. Propranolol has controversial evidence, so it is advisable to keep it for second choice. All three drugs are safe. There is an urgent need to perform well designed and large trials to establish solid evidence with topiramate, flunarizine and propranolol.
Key words: Migraine disorders. Prevention and control. Child. Adolescent.
Escenario clínico
Acude al centro de salud una niña de 12 años de edad, diagnosticada de migraña sin aura hace cuatro años. La madre está muy preocupada porque en los últimos meses ha aumentado mucho la frecuencia de los episodios ("varios al mes") y, consecuentemente, está faltando mucho al colegio, lo que parece estar repercutiendo en su rendimiento académico. La paciente tiene asma episódico y rinitis alérgica. La madre también está diagnosticada de migraña.
La madre le pregunta al pediatra si no se le puede dar algún medicamento para que tenga menos migrañas, ya que ella estuvo un tiempo con "Sumial" y le fue muy bien. Se explica a la madre que, antes de iniciar un tratamiento preventivo, se necesita confirmar la frecuencia real de los episodios y la repercusión de los mismos sobre la vida de la niña. Acuerdan elaborar un "diario" en el que apunten los episodios de migraña, sus características, duración e intensidad mediante una escala del 1 al 10, si tuvo que faltar al colegio, si precisó analgesia, así como cualquier otro factor que pueda haber actuado como desencadenante (dieta, menstruación, estrés ).
Semanas después acuden a consulta con el registro acordado. Se objetiva una media de 5 episodios al mes, con una duración de entre 24 y 48 horas. En todos los episodios faltó al colegio y precisó tratamiento farmacológico (ibuprofeno). Algunos episodios podían relacionarse con el inicio de la menstruación o situaciones de estrés.
El pediatra considera que la niña se beneficiaría de un tratamiento farmacológico para disminuir la frecuencia e intensidad de las migrañas. Se plantea qué tratamiento sería el más adecuado.
Pregunta clínica
En niños y adolescentes con episodios de migraña frecuentes, con repercusión importante en su calidad de vida, ¿qué tratamiento farmacológico se ha demostrado eficaz y seguro para disminuir su frecuencia e intensidad?
Búsqueda bibliográfica
Fecha de búsqueda: 18 de diciembre de 2009.
1. Metabuscador TRIP: http://tripdatabase.com. Estrategia de búsqueda: migraine AND prophylaxis AND children marcando la opción "title" y filtrando por "revisiones sistemáticas".
2. Base de datos MEDLINE. Estrategia de búsqueda: (Migraine OR headache) AND (prevention OR preventive OR prophylactic OR prophylaxis) AND ("Child"[Mesh]) AND "Adolescent" [Mesh]). Se introdujeron además los límites "type of study": "Meta-analysis" y "review".
3. Base de datos EMBASE (1980-2009). Estrategia de búsqueda: migraine AND prevention AND children.
4. Biblioteca Cochrane Plus (Registro de revisiones sistemáticas).
Tras revisar las referencias recuperadas, se encuentran de interés para responder a nuestra pregunta 3 estudios1-3.
Resumen estructurado de los estudios seleccionados
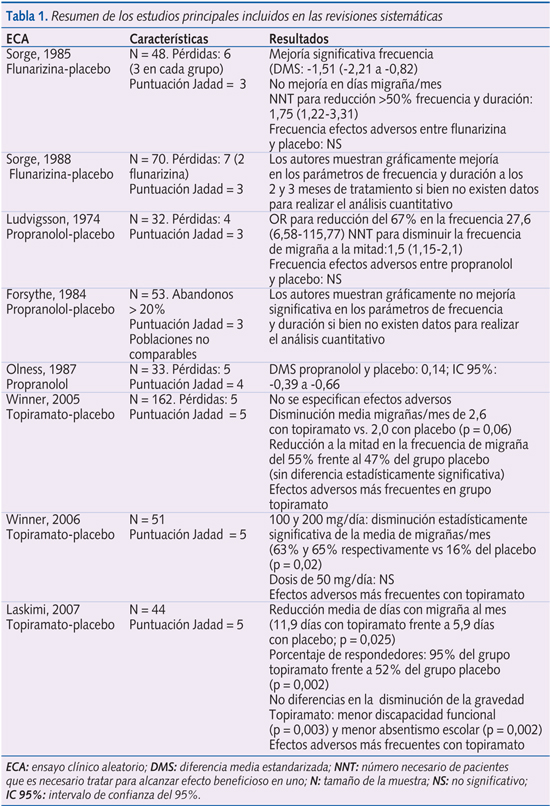
En la tabla 1 se describen las características de los principales estudios incluidos en las tres revisiones sistemáticas analizadas.
Victor S, Ryan SW. Drugs for preventing migraine headaches in children. Cochrane Database Syst Rev 2003;4: CD002761.
Objetivo: describir y analizar la evidencia procedente de ensayos controlados sobre la eficacia y tolerabilidad de fármacos, usados de forma mantenida, para prevenir la recurrencia y/o disminuir la intensidad de los episodios en los niños con migrañas de repetición.
Diseño: revisión sistemática.
Fuentes de datos: Base de Datos Cochrane de Ensayos Controlados (CENTRAL), MEDLINE, y EMBASE, desde 1966 hasta 2002. Búsqueda adicional de estudios en las referencias bibliográficas de los artículos principales y en libros dedicados a la cefalea.
Selección de los estudios: ensayos clínicos controlados aleatorizados (ECA), prospectivos realizados en niños (menores de 18 años) diagnosticados de migraña.
Los criterios de inclusión fueron: a) estudios con pacientes diagnosticados de migraña según la International Headache Society de 1988 (IHS); b) estudios que incluyen las características habituales para diferenciar la migraña de la cefalea tensional; c) estudios en los que los pacientes refieren tener "migrañas" aunque no estén definidos los criterios diagnósticos. Se excluyeron los estudios en los que no quedaba claro la diferencia entre migraña y cefalea tensional.
Los estudios incluidos debían evaluar los fármacos usados regularmente para prevenir la recurrencia de la migraña y/o reducir su intensidad comparándolos con placebo u otro fármaco, ninguna otra intervención o psicoterapia.
Se encontraron 38 estudios. Fueron excluidos 18. Los 20 estudios seleccionados habían sido publicados entre 1974 y 1993.
Extracción de los datos: dos investigadores, por separado, extrajeron, evaluaron y codificaron los datos de cada estudio. Se evaluó la validez interna mediante la escala de Jadad de 1996.
La variable principal fue la frecuencia de cefalea, estandarizándola a 28 días, y las variables secundarias fueron: intensidad, duración y cantidad de fármacos usados como tratamiento sintomático en cada episodio de migraña.
Resultados principales: para cuatro fármacos (L-5-hydroxitriptófano [L5HTP], flunarizina, propranolol, clonidina) había dos o más estudios. Para seis fármacos (trazodona, L5HTP, propranolol, flunarizina, papaverina, nimodipino) estaba recogida la variable efecto en la frecuencia de migrañas.
Los tamaños muestrales comprendían desde 19 hasta 70 sujetos, contabilizando un total de 645 niños. El porcentaje de pérdidas varió del 5 al 30%. Dos estudios superaron el 20% de pérdidas y en ninguno se demostró la efectividad del fármaco estudiado.
Quince estudios compararon once fármacos con placebo, y 14 eran aleatorizados y doble ciego. Seis compararon dos fármacos.
Ninguno de los 20 ECA obtuvo la puntuación máxima de 5 en la escala de Jadad para la validez interna.
En dos ECA, en los que se comparó propranolol (Ludvigsson, 1974) y flunarizina (Sorge, 1985) con placebo, se objetivó un beneficio a favor de los fármacos para disminuir la frecuencia de los episodios de migraña. A continuación se analizan estos y otros ECA de estos dos fármacos frente a placebo.
El estudio de Ludvigsson et al. (puntuación de 3 en la escala de Jadad) evaluó la eficacia de propranolol frente a placebo en un ECA cruzado doble ciego en 32 pacientes. Cada período duró 13 semanas, sin período de lavado entre ambos. La dosis fue de 60 mg repartidos en 3 dosis en < 35 kg y 120 mg en 4 dosis para mayores de dicho peso. Se perdieron durante el seguimiento cuatro pacientes. Sólo proporcionaron como medida de resultado la frecuencia de episodios de migraña. Para una reducción del 67% en la frecuencia, su odds ratio (OR) es de 27,6 (intervalo de confianza del 95% [IC 95%]: 6,6-115,8) a favor de propranolol (p < 0,001). El número necesario de sujetos a tratar (NNT) para disminuir la frecuencia de migraña a la mitad en un paciente fue de 1,5 (IC 95%: 1,2-2,1). El efecto adverso más común fue la dificultad para conciliar el sueño en dos de los pacientes, sin encontrarse diferencias significativas entre los grupos comparados.
Forsythe et al. realizaron un ECA cruzado con propranolol y placebo. Se efectuó en 53 niños. Existió un 26% de pérdidas durante el seguimiento. Los resultados se proporcionaron sólo de forma gráfica haciendo imposible su cálculo cuantitativo por parte de los revisores. Los efectos adversos reportados fueron: aumento del apetito (7,5%), dolor abdominal, empeoramiento de las migrañas, amenorrea y ganancia de peso (todos con una frecuencia del 5%).
Olness et al. (puntuación de 4 en la escala de Jadad) realizaron un ECA cruzado con 33 pacientes, que incluyó 3 grupos: placebo-placebo, propranolol-placebo y placebo-propranolol. La dosis empleada fue de 3 mg/kg/día en 3 dosis. El periodo de lavado fue de 1 semana. Hubo 5 pérdidas. No se encontraron diferencias significativas entre propranolol y placebo en cuanto a la frecuencia media de migrañas mensuales. No se especificaron los efectos adversos.
Sorge et al. (puntuación de 3 en la escala de Jadad) estudiaron la eficacia de flunarizina frente a placebo en un ECA realizado en 48 niños (5 mg en dosis única nocturna durante 12 semanas en el grupo intervención). Seis pacientes se perdieron durante el seguimiento, tres en cada grupo. Se constató la existencia de una diferencia significativa a favor de flunarizina en la disminución de la frecuencia (diferencia de medias estandarizada [DMS]: -1,51; IC 95%: -2,21 a -0,82), pero no de la duración de la migraña. Para una reducción del 50% en la frecuencia y duración, la OR fue de 13,6 (IC 95%: 3,01-59,8) a favor del flunarizina (p < 0,001). El NNT para reducir al 50% la duración y frecuencia de los episodios de migraña fue de 1,75 (IC 95%: 1,22-3,1). Los efectos adversos no fueron mayores en el grupo de flunarizina; los más frecuentes fueron somnolencia, molestias gastrointestinales, ganancia de peso y fatiga.
Sorge et al. (puntuación de 4 en la escala de Jadad), realizaron un ECA cruzado con dos grupos de tratamiento (placebo-flunarizina y flunarizina-placebo). Cada período de tratamiento fue de 12 semanas (dosis única nocturna de 5 mg) con un periodo de lavado de un mes. Se consideraron sólo válidos los resultados del primer periodo analizado, dado el corto periodo de lavado. Se realizó en 70 niños; se perdieron siete pacientes, dos en grupo de la flunarizina y cinco en el de placebo. Aunque los autores encontraron diferencias significativas en la reducción de la frecuencia y duración a favor de flunarizina a los 2 y 3 meses, estos resultados sólo se proporcionaron de modo gráfico, por lo que no se pudo realizar un análisis cuantitativo independiente. Los efectos secundarios más frecuentes fueron incremento de peso (22%) y somnolencia (10%).
Los estudios realizados con nimodipino, timolol, papaverina, pizotifeno, trazodona, L5HTP, clonidina, metoclopramida y domperidona, concluyen que no son fármacos eficaces para disminuir los episodios de migraña. Los estudios disponibles para ciproheptadina, fenobarbitona, fenitoína, amitriptilina, carbamacepina, metoprolol y piracetam, fueron excluídos por distintos motivos.
Conclusión de los autores: la calidad de la evidencia disponible para el uso de distintos fármacos empleados para prevenir los episodios de migraña es pobre. El tamaño muestral de los estudios es pequeño, sin planificar el mínimo tamaño para que el estudio tenga suficiente potencia estadística. Se estudiaron fármacos muy diversos y existió una gran heterogeneidad entre los estudios disponibles. A pesar de la falta de significación de muchos de los resultados los autores concluyen que no tienen evidencia suficiente para decir que no sean efectivos. Proponen, a la luz de los resultados obtenidos con la flunarizina y el propranolol, centrar los estudios en estos dos fármacos, sobre todo en éste último, ya que su NNT es menor (1 frente a 2). Los ECA deberían solventar en su diseño los problemas metodológicos expuestos, deberían ser multicéntricos y captando a los pacientes desde atención primaria.
Conflicto de intereses: no consta.
Fuente de financiación: International Headache Society.
Damen L, Bruijn J, Verhagen AP, Berger MY, Passchier J, Koes BW. Prophylactic treatment of migraine in children. Part 2. A systematic review of pharmacological trials. Cephalalgia. 2006;26:497-505.
Objetivo: evaluar la eficacia del tratamiento farmacológico preventivo para la migraña en la población de menores de 18 años.
Diseño: revisión sistemática.
Fuentes de datos: bases de datos de PubMed, EMBASE, PsycInfo, Web of Science, Cinahl y CENTRAL. Periodo de búsqueda: hasta junio de 2004. Se realizó una búsqueda adicional de estudios en las referencias bibliográficas de los artículos principales.
Selección de los estudios: ECA o ensayos controlados no aleatorizados (ECNA) de fármacos utilizados como tratamiento preventivo de la migraña. Los episodios de migraña debían cumplir los criterios definidos para distinguirlos de otros tipos de cefalea. La población de estudio de los estudios debía ser al menos de 18 niños. Se incluyeron sólo aquellos que medían al menos una de las siguientes variables de resultado: intensidad, frecuencia, duración y mejoría. No se aplicaron restricción de estudios por idioma ni antigüedad. No se contactó con los autores de los estudios por la antigüedad de los mismos.
Extracción de los datos: dos autores evaluaron de forma independiente la calidad metodológica de los estudios incluidos en la "Delphi list"4. Si hubo desacuerdo se solventó mediante consenso y, en caso de no existir, por un tercer autor. La extracción de datos fue realizada por un autor y supervisada por un segundo.
Se calculó la DMS con su IC 95% para las variables continuas y el riesgo relativo (RR) para las dicotómicas. DMS > 0 ó RR > 1 representan un resultado favorable a favor del grupo de intervención. Los ensayos cruzados se analizaron como "paralelos" debido a la falta de datos de ambos periodos; sólo en aquellos casos en los que éstos se facilitaban se realizó el análisis del primer periodo.
Resultados principales: se identificaron 3.492 publicaciones de las cuales cumplieron criterios de inclusión 20, 16 ECA y 4 ECNA. Once tenían un diseño cruzado. Sólo ocho se consideraron de alta calidad metodológica.
Se encontró que existía evidencia limitada a favor de que la flunarizina fuera más efectiva que placebo (son los dos ECA de Sorge et al. detallados en el primer estudio). El RR calculado del estudio de Sorge et al. fue de 4 (1,6-9,97).
La evidencia relativa a propranolol es contradictoria. En esta revisión se incluyeron los mismos tres ECA que en el primer estudio. En el ECA de Ludvigsson et al. el RR fue de 6,35 (1,71-23,54) a favor de propranolol; en el de Forsythe et al. no se pudo realizar ningún análisis cuantitativo por falta de datos; y en el de Olness et al. fue de 0,14 (mostrando ausencia de diferencia significativa entre propranolol y placebo.
Los ensayos clínicos que compararon clonidina, papaverina o trazodona frente a placebo no encontraron diferencias significativas en ninguno de las medidas de resultado. Los trabajos que estudiaron timolol, pizotifeno y óxido de magnesio no aportaron suficientes datos para poder estimar el efecto de la intervención.
Un ensayo clínico de baja calidad metodológica (Lutschg et al.), comparó tratamiento con flunarizina y propranolol mostrando diferencias no significativas entre ambos grupos en los resultados.
Conclusión de los autores: la mayoría de los estudios tienen limitaciones metodológicas e incluyen muestras pequeñas de pacientes. En la medición de los efectos adversos debería incluirse conceptos como tales como calidad de vida, satisfacción del niño y de los padres, y no sólo su descripción y frecuencia. Flunarizina y propranolol han sido los fármacos mejor estudiados, pero se necesitan estudios con mejor calidad y tamaños de muestra mayores. Entre las posibles razones que explican la ausencia de resultados favorables en los estudios seleccionados realizados se señala la evolución espontánea favorable natural de la migraña, el pequeño tamaño muestral y el uso de una medida principal de resultado demasiado exigente (el fármaco se consideró eficaz si la mejoría clínica estuvo por encima de 50%).
Conflicto de intereses: no consta.
Fuente de financiación: Netherlands Organization for Health Research and Development.
Bakola E, Skapinakis P, Tzoufi M, Damigos D, Mavreas V. Anticonvulsant drugs for pediatric migraine prevention: an evidence-based review. Eur J Pain. 2009;13:893-901.
Objetivo: analizar la evidencia disponible sobre la eficacia y seguridad de los anticonvulsivantes para el tratamiento profiláctico de la migraña en los niños.
Diseño: revisión sistemática.
Fuentes de datos:
1. PubMed sin restricción de idioma, desde 1966 hasta septiembre de 2008; descriptores: (migraine [MeSH]OR headache) AND (prevention OR preventive OR prophylactic OR prophylaxis) AND (children OR adolecent OR pediatric OR child OR adolescence OR pediatrics) AND (anticonvulsivant OR antiepileptic OR valproic acid OR divalproex OR levetiracetam OR topiramate OR zosinamide OR lamotrigine OR gabapentine OR carbamazepine OR oxcarbamazepine OR phenytoin).
2. EMBASE (1980-2007).
3. CENTRAL (2008, Issue 1).
4. Búsqueda manual en la bibliografía de los principales estudios de revisiones sistemáticas y ensayos clínicos.
Selección de los estudios: ECA, ECNA y ensayos no controlados (series prospectivas de casos). La población de estudio fue de al menos ocho participantes, niños y adolescentes de edad inferior a 18 años, diagnosticados de migraña según los criterios de la ISH de 1988 (International Classification of Headache Disorders I, ICHD I) o ICHD II Headache Classification Subcomité of the International Headache Society, 1988, 2004). Los estudios incluidos debían evaluar el uso habitual de un fármaco anticonvulsivante para prevenir la recurrencia de los episodios de migraña y/o reducir su intensidad comparándolos con otro tratamiento farmacológico o placebo. Se excluyeron las revisiones, estudios que incluían adultos y niños en los que no quedaran claros los resultados de cada grupo y estudios que no distinguieran entre migraña y otro tipo de cefalea.
Extracción de los datos: dos investigadores, por separado evaluaron los datos de cada estudio y un tercer autor lo revisó. Si hubo desacuerdo, este fue solucionado por consenso. Para analizar la eficacia se consideró la frecuencia, la intensidad y la duración de los episodios de migraña. El nivel de evidencia de los estudios se catalogó según los criterios de la Agency for Healthcare Research and Quality Muir-Gray 1997; AHR 2008).
Se evaluó la validez interna mediante la escala de Jadad. No se evaluó la validez metodológica de los estudios no controlados ni de los estudios retrospectivos ya que se considera que la evidencia que resulta de los mismos es débil.
Resultados principales: de los 196 estudios recuperados por los criterios de búsqueda se seleccionaron catorce. Los fármacos estudiados fueron topiramato (4 ECA y 2 ECNA), valproato (2 ECA, 1 ensayo no controlado y 2 revisiones retrospectivas de historias clínicas), levitiracetam, zonisamida (ambos con una revisión de historias clínicas) y propranolol frente a valproato (1 ECA).
Analizamos a continuación sólo los estudios posteriores a las búsquedas realizadas en los dos artículos previos y los de mayor calidad: ECA.
El ECA de Winner et al. (puntuación de 5 en la escala de Jadad), estudió en 162 niños de 6 a 15 años la eficacia de topiramato (se inició con 25 mg al día aumentándose la dosis en 8 semanas hasta 2-3 mg/kg/día, máximo 100-200 mg/día que se mantuvo durante 12 semanas) frente a placebo. Analizaron 157 pacientes (análisis por intención de tratar). En el grupo de topiramato se objetivó una disminución de la media de episodios de migraña al mes (variable principal) de 2,6 frente al 2,0 del grupo placebo (p = 0,06; marginal pero no significativa). La respuesta al topiramato, definida como la reducción a la mitad en la frecuencia de episodios de migraña, fue del 55% frente al 47% del grupo placebo (sin diferencia estadísticamente significativa). Los efectos adversos más frecuentes en el grupo del topiramato fueron: infecciones de vía respiratoria alta (19%), anorexia (13%), pérdida de peso (10%), gastroenteritis (9%), parestesias (8%) y somnolencia (8%).
El ECA de Winner et al. (puntuación de 5 en escala de Jadad) recopiló los datos de 3 ECA previos diseñados de forma similar (Brandes, 2004; Diener, 2004; Silbertsein, 2004) de 51 adolescentes de 12 a 17 años a los que durante 26 semanas se administró topiramato a dosis de 50, 100 y 200 mg/día o placebo. Sólo la administración de 100 mg y 200 mg al día obtuvo una disminución estadísticamente significativa en la media de episodios de migraña al mes (63% y 65% respectivamente frente a un 16% del placebo (p = 0,02 para la dosis de 100 mg/día y p = 0,04 para 200 mg/día). Los efectos adversos más frecuentes en el grupo del topiramato frente a placebo fueron: parestesias (30% vs. 17%), infecciones de vía respiratoria alta (30% vs. 8%) y pérdida de peso (22% vs. 8%).
Lakshimi et al. (puntuación de 5 en escala de Jadad), realizaron un ECA con 44 niños de 8 a 14 años durante 4 meses comparando topiramato, 100 mg/día en dos dosis frente a placebo. Existieron diferencias estadísticamente significativas en la reducción de la media de días con migraña al mes (11,9 días frente a 5,9 días; p = 0,025). El porcentaje de respondedores (definido como la reducción a la mitad en la frecuencia de migrañas) fue de 95% del grupo del topiramato frente a 52% del grupo placebo (p = 0,002). No se encontró diferencia en la disminución de la gravedad entre ambos grupos. El topiramato se asoció a una menor discapacidad funcional (p = 0,003) y menor absentismo escolar (p = 0,002). Los efectos adversos fueron más frecuentes en el grupo de topiramato: pérdida de peso (80% vs.14%), pérdida de apetito (24% vs. 0%) y menor concentración en la escuela (19% vs. 9%).
Un ECA (Apostol et al.) estudió 3 dosificaciones diferentes de valproato sódico (250 mg, 500 mg y 1.000 mg en una dosis diaria durante 12 semanas) frente a placebo. El estudio incluyó a 305 adolescentes de entre 12 y 17 años. No se encontraron diferencias significativas en la media de reducción del número de días con migraña o en la calidad de vida medida por PedMIDAS.
En ninguno de los estudios de esta revisión se calcularon los intervalos de confianza. No existen ECA de levetiracetam o zonisamida.
Conclusión de los autores: el uso de anticonvulsivantes para la prevención de la migraña no está suficientemente respaldado por un número adecuado de ensayos clínicos bien diseñados. El topiramato es el único que parece ser efectivo, aunque no se puede concluir con certeza por falta de estudios bien diseñados. Esta revisión encuentra una fuerte evidencia para contraindicar el uso de valproato como fármaco para prevenir los episodios de migraña. El perfil de seguridad de estos fármacos en la población infantil le confiere una ventaja para seguir realizando ECA controlados, priorizando estudios sobre el topiramato.
Conflicto de intereses: no consta.
Fuente de financiación: ninguna.
Comentario crítico
Justificación: los tratamientos farmacológicos preventivos frente a la migraña han sido poco estudiados en niños y, como sucede en otras áreas de la pediatría, los fármacos utilizados provienen de la extrapolación de estudios realizados en adultos.
La Asociación Americana de Neurología considera que los siguientes siete contextos clínicos justifican el inicio de una terapia preventiva5-7: migrañas recurrentes que por su intensidad interfieren significativamente con la actividad diaria a pesar del tratamiento agudo, gran frecuencia de migrañas, contraindicación, sobreutilización o falta de control del dolor, efectos secundarios de la medicación en fase aguda, coste de la terapia aguda y preventiva, preferencia del paciente o presencia de variantes migrañosas poco frecuentes. La mayoría de los estudios que evalúan tratamientos preventivos exigen una frecuencia mensual de al menos 3-4 episodios5-7.
Validez o rigor científico: los estudios revisados cumplen los principales criterios de validez científico exigibles a una RS. Las poblaciones de estudio sólo incluyen niños y/o adolescentes.
Los dos primeros estudios incluyen sólo ensayos clínicos controlados; en el primero se añade además la exigencia de que éstos sean randomizados. Sin embargo, cuentan con las siguientes limitaciones: muchos estudios no especifican los métodos de randomización y enmascaramiento; son antiguos (publicados en su mayoría antes de 1995); tienen tamaños muestrales pequeños y son heterogéneos en su diseño (tanto en las pautas de tratamiento como en las variables principales estudiadas). Incluyen como variables la reducción en la frecuencia de migraña o la intensidad pero ninguno mide la repercusión en la calidad de vida del paciente.
El tercero de los estudios viene a completar los dos anteriores y permite extraer la evidencia existente más actualizada sobre los fármacos anticonvulsivantes. Aunque incluye, además de ensayos clínicos, series prospectivas no controladas y revisiones retrospectivas de historias clínicas, se realizó una análisis por separado de los distintos estudios según su nivel de calidad y no se combinaron los resultados. Se incluyen ensayos clínicos de topiramato y valproato sódico de alta calidad metodológica; tienen un tamaño muestral grande e incluyen, entre las variables de resultado, además de la disminución en la frecuencia e intensidad de los episodios de migraña, el impacto sobre la calidad de vida del paciente.
Importancia clínica: topiramato, estudiado en 3 ECA de alta calidad metodológica, se muestra como un fármaco prometedor por su eficacia; asimismo muestra un perfil de seguridad aceptable. Dos ECA (Winner 2006 y Lakshmi 2007) encuentran, a favor de topiramato, un efecto cuantitativamente importante y estadísticamente significativo. Sin embargo, el ECA con mayor tamaño muestral (Winner 2005) no encontró diferencias significativas entre topiramato y placebo. Los resultados de los dos primeros estudios son esperanzadores pero no se pueden establecer conclusiones firmes acerca de la efectividad de topiramato. En cuanto a los efectos secundarios, parece ser un fármaco seguro si bien es importante monitorizar estrechamente los efectos secundarios que pueden limitar su uso (pérdida de apetito, dificultades en la concentración, parestesias).
El valproato sódico no se muestra eficaz en un ECA bien diseñado con un gran tamaño muestral en ninguna de las dosificaciones estudiadas, por lo que se desaconseja su uso para la prevención de la migraña en niños.
Los estudios realizados con zonisamida y levetiracetam son de escasa calidad metodológica, por lo que no pueden establecerse conclusiones respecto a su uso.
En dos ECA (Sorge et al., 1985 y 1988) flunarizina se mostró más eficaz que placebo en la disminución de la frecuencia de episodios de migraña, pero sólo en uno de ellos en la duración de los mismos. Además hay que considerar la importante limitación de que en el segundo ECA los resultados del estudio sólo se mostraron gráficamente, no pudiéndose confirmar por expertos independientes los resultados favorables obtenidos. El perfil de efectos secundarios referidos en ambos ECA es aceptable.
La evidencia científica relacionada con propranolol es contradictoria y las importantes limitaciones de los ECA existentes impiden establecer conclusiones firmes en cuanto a su eficacia en la prevención de los episodios de migraña en niños. En tres ECA se comparó propranolol con placebo. Sólo en uno (Ludvigsson, 1974) el fármaco se muestra más eficaz que placebo en la reducción de frecuencia de migrañas. Sin embargo, en dos ECA posteriores (Forsythe, 1984; Olness, 1987) no se mostró más eficaz que placebo para disminuir la frecuencia y/o duración mensual de los episodios de migraña. Las limitaciones del ECA de Forsythe, poblaciones de estudio poco comparables y porcentaje de abandonos mayor del 20%, recomiendan prudencia en la interpretación de sus resultados. En cuanto a su seguridad, propranolol muestra un perfil de efectos secundarios aceptable en los tres ECA.
Otros fármacos se han estudiado en ensayos bien diseñados, no mostrando mayor eficacia que placebo. Se incluyen antidepresivos como trazodona y pizotifeno, antagonistas del calcio como nimodipino, antihipertensivos como clonidina, betabloqueantes como timolol y otros como L-5-hydroxitriptófano u óxido de magnesio.
No existen actualmente estudios controlados con ciproheptadina o amitriptilina, lo que debería desaconsejar su uso a pesar de que sean fármacos incluidos en algunas guías clínicas pediátricas8.
Se precisarían más ECA de alta calidad y adecuado tamaño muestral para poder establecer una evidencia sólida. Parece aconsejable que se hicieran con aquellos fármacos que ya han demostrado cierta eficacia terapéutica y un aceptable perfil de seguridad como flunarizina, propranolol y topiramato. Podrían plantearse asimismo ECA con ciproheptadina o amitriptilina.
En cuanto a la duración óptima del tratamiento preventivo existe una importante heterogeneidad en la duración de los tratamientos en los ECA incluidos. En las guías clínicas este aspecto es escasamente abordado; incluimos las recomendaciones dadas en una reciente revisión de la migraña en niños8. Establecen una duración del tratamiento de entre 6 y 12 meses o la posibilidad de cubrir el periodo escolar, suspendiéndolo en vacaciones. En niños pequeños se aconsejan periodos más cortos (entre 6-8 semanas). En todos los casos se recomienda el descenso paulatino semanal de dosis hasta suspenderlo.
Aplicabilidad en la práctica clínica: a la luz de la literatura disponible, la evidencia científica es más consistente en cuanto a la efectividad de topiramato y flunarizina, reservándose el propranolol como fármaco de segunda elección. Los tres fármacos muestran un perfil de efectos secundarios conocidos aceptable. Los siguientes efectos adversos comunicados podrían limitar el cumplimiento del tratamiento con los fármacos valorados: incremento de peso (sobre todo en niños mayores > 10 años) y fatiga-somnolencia ) con flunarizina (esto se podría combatir administrándolo en una única dosis nocturna; pérdida de apetito y peso, parestesias y cambios en la capacidad de concentración que podrían entorpecer el rendimiento escolar con topiramato; en cuanto a propranolol lo más importante sería considerar las contraindicaciones (principalmente asma y arritmias).
Los tres fármacos referidos están disponibles en España, el propranolol no tiene especialidad farmacéutica genérica mientras que los otros dos sí. De todos modos el coste de propranolol es el menor de los tres. El topiramato es aproximadamente diez veces más caro que los otros dos para un tratamiento de dos meses.
Conflicto de intereses de los autores del comentario: no existen.
Resolución del escenario
Cuando la familia vuelve a nuestra consulta para iniciar el tratamiento farmacológico, se le explican las posibilidades terapéuticas que existen, pareciendo más razonable comenzar con flunarizina, dejando el topiramato como segunda opción en caso de insuficiente efectividad o aparición de efectos secundarios que limiten su cumplimiento (sobre todo incremento de peso dada la edad de la paciente). En cuanto al tratamiento con propranolol, que planteó la madre en un principio, no parece la mejor opción, no solo por la menor efectividad sino por los antecedentes de asma de la paciente.
En cuanto a la duración del tratamiento existe heterogeneidad entre los estudios, de modo que lo más razonable parece seguir las recomendaciones incluidas en las guías clínicas que plantean mantener el tratamiento durante 6 meses, con un descenso progresivo de dosis semanal hasta suspenderlo. No obstante, se decide hacer un control clínico en 3 meses, recomendando que continúe elaborando el "diario de cefaleas", así como efectuar un seguimiento en cualquier momento de los posibles efectos adversos del tratamiento.
Bibliografía
1. Víctor S, Ryan SW. Drugs for preventing migraine headaches in children. Cochrane Database Syst Rev 2003;4:CD002761. [ Links ]
2. Damen L, Bruijn J, Verhagen AP, Berger MY, Passchier J, Koes BW. Prophylactic treatment of migraine in children. Part 2. A systematic review of pharmacological trials. Cephalalgia. 2006;26:497-505. [ Links ]
3. Bakola E, Tzoufi M, Damigos D, Mavreas V. Anticonvulsant drugs for pediatric migraine prevention: An evidence-based review. Eur J Pain. 2009;13:893-901. [ Links ]
4. Verhagen AP. The Delphi list: a criteria list for quality assessment of randomized clinical trials for conducting systematic reviews developed by Delphi consensus. J Clin Epidemiol. 1998;51:1235-41. [ Links ]
5. Lewis D, Ashwal S, Hersey A, Hirtz D, Yonker M, Silberstein S. Practice Parameter: Pharmacological treatment of migraine headache in children and adolescents. American Academy of Neurology Quality Standard Subcommitee and the Practice Comite of the Chile Neurology Society. Neurology. 2004;63:2215-22. [ Links ]
6. Sillberstein SD. Practice parameter: evidence-based guidelines for migraine headache(an evidence-based review): Report of the Quality Standars Subcomittee of the American Academy of Neurology. Neurology. 2000;55: 754-62. [ Links ]
7. Eiland LS, Jenkins LS, Durham SH. Pediatric migraine: pharmacologic agents for prophylaxis. Ann Pharmacother. 2007;41:1181-90. [ Links ]
8. Lewis D. Pediatric Migraine. Neurol Clin. 2009;27:481-501. [ Links ]