Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Pediatría Atención Primaria
versión impresa ISSN 1139-7632
Rev Pediatr Aten Primaria vol.17 supl.24 Madrid jun. 2015
FLASHES PEDIÁTRICOS AEPap EN PATOLOGÍA INFECCIOSA
Vacunas antivaricela y antimeningococo B
Pilar Lupiani Castellanos
CS Barrio de La Salud. Santa Cruz de Tenerife. España
Dirección para correspondencia
Vacuna frente a varicela
La varicela es la primoinfección del virus varicela-zóster. El herpes zóster (HZ) se produce por la reactivación del virus, lo que ocurre sobre todo en las situaciones de inmunodepresión.
Es una infección inmunoprevenible, que presenta ondas cíclicas cada 2-3 años.
Ante la ausencia de vacunación en un país, toda la cohorte de nacidos en el año es susceptible de padecer la varicela. Son más susceptibles los menores de 15 años y centrándose más entre los 2-6 años. A los 14 años más del 90% de la población ha padecido la enfermedad y a los 35 años el 95%.
El HZ aparece tras una reactivación del virus que ha permanecido latente en los pares craneales o en los ganglios raquídeos de la médula espinal, tras la primoinfección. Un 15-20% de los que padecieron una varicela desarrollarán algún momento de su vida un HZ. La reactivación se produce por una disminución de la inmunidad celular como consecuencia de algunos tratamientos y/o enfermedades que conllevan inmunosupresión o de manera natural, con el envejecimiento.
La varicela es una enfermedad exantemática, cuyas lesiones son bastante características y permiten hacer el diagnóstico en la mayoría de los casos. La trasmisión es persona a persona, o por contacto directo por las secreciones de las lesiones o por las secreciones respiratorias, con un periodo de incubación entre 14-16 días (10-21 días) Según las autoridades, el curso de la infección es “benigna” en los pequeños, con complicaciones leves y poco frecuentes, aumentando estas en adolescentes. Dichas complicaciones, entre un 2-6%, pueden ir desde la sobreinfección bacteriana hasta complicaciones neurologías o pulmonares. Las secuelas a largo plazo son de entre el 0,4-3,1% de los hospitalizados. Los pacientes inmunodeprimidos son los que presentan mayor riesgo de una varicela grave, aunque la mayoría de complicaciones, hospitalizaciones y muertes se producen en pacientes inmunológicamente sanos.
Hay dos vacunas en España, Varilrix® y Varivax®; la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) las ha catalogado de “uso hospitalario”, por lo que se ha restringido su venta libre, como ocurre en el resto de los países de la Unión Europea.
Las vacunas son inmunógenas, efectivas y seguras.
El Sistema Nacional de Salud (SNS) recomienda la vacunación en adolescentes, entre 10-14 años, que no hayan padecido la enfermedad, a los que se administran dos dosis, y pacientes de riesgo:
• Pacientes con leucemia linfoblástica aguda.
• Pacientes sometidos a tratamiento inmunosupresor.
• Pacientes con trasplante programado de órganos.
• Pacientes con enfermedades crónicas.
• Contactos inmediatos sanos de pacientes de riesgo.
En este momento tienen incluida la vacuna de varicela en su calendario vacunal: Navarra (15 meses y 3 años), Ceuta (18 meses y 2 años) y Melilla (15 meses y 2 años).
A nivel nacional, en la era prevacunal (1998-2004) la presentación de la varicela estaba muy estable con una incidencia media de 549 casos/100 000 habitantes. En periodo posvacunal (2005-2012) la incidencia media fue de 372 casos/100 000 habitantes, con un cambio significativo en la tendencia y una disminución promedio anual del 7% (Figura 1).
Se ha acusado a la vacunación de forma privada, siguiendo las recomendaciones de las sociedades científicas, de que puede llevar un aumento de la incidencia de HZ en la edad adulta. En el Informe sobre la situación de la varicela y el herpes zóster en España 1998-2012 del Centro Nacional de Epidemiología indica en sus conclusiones que: “En las comunidades con vacunación de varicela en adolecentes susceptibles y con vacunación en la infancia fuera del calendario de vacunación la tasa de hospitalización global por Herpes Zóster se redujo en un 9% en el periodo post-vacunación frente al periodo prevacunación”, y que: “En las comunidades que vacunan a los adolescentes y vacunan en la infancia dentro del Calendario de Vacunación (Navarra, Comunidad de Madrid, Ceuta y Melilla), la tasa de hospitalización global por herpes zóster no se ha modificado después de la introducción de la vacuna”.
Hasta 2012, las cifras oficiales de hospitalización por HZ se han mantenido constantes (Tabla 1).
Según el informe del European Centre for Disease Prevention and Control (ECDC) de enero de 2015, hay seis países, Alemania, Austria, Chipre, Grecia, Letonia y Luxemburgo y algunas regiones de España e Italia que vacunan de forma universal. El resto lo realizan a los adolescentes susceptibles y pacientes de riesgo. La vacunación universal ha puesto en evidencia la reducción rápida de los casos de varicela y las complicaciones tanto en vacunados como no vacunados. Hasta el momento del informe tampoco hay pruebas claras de que, la vacunación en las primeras edades, lleven a un aumento de HZ en los adultos.
Según la revisión del impacto de la vacunación frente a varicela realizada en Estados Unidos entre 1995-2009 se ha observado una disminución muy importante de la incidencia y de las complicaciones, hospitalizaciones y muertes. De forma indirecta se ha observado también una disminución en menores de 12 meses y adultos (grupos no vacunados).
En España, la incidencia de la varicela ha aumentado un 13,2% en 2014 (160 956 casos) frente al año 2013 (142 180 casos), desde que el Ministerio de Sanidad decidiera suspender la venta de la vacuna en farmacias.
Al cierre de este resumen, el actual Ministro de Sanidad ha realizado unas declaraciones en las que se plantea estudiar el levantamiento del bloqueo de la vacuna de la varicela y el hablar con las comunidades autónomas sobre la posibilidad de administrar de nuevo la vacuna en edades tempranas.
Vacuna frente al meningococo B
La Neisseria meningitidis es una bacteria (coco gram positivo) potencialmente grave para el ser humano, siendo este el único reservorio. La encontramos como flora habitual a nivel nasofaríngeo (portador asintomático) en un 5-10% en la población general, llegando en los adolescentes hasta el 25%. La trasmisión es por la inhalación de gotitas de secreciones respiratorias. Cinco de los serogrupos producen el 90% de las enfermedades meningocócica invasivas y son el A, B, C, Y, y W. En Europa y regiones industrializadas los más frecuentes son el meningococo B (MenB) y el meningococo C (MenC).
Las formas clínicas más frecuentes de la enfermedad meningocócica invasiva (EMI) son la meningitis (la más frecuente, sobre un 50%, con una letalidad del 10%) y la sepsis (menos frecuente, entre un 5-20%, con mayor mortalidad, hasta un 40%) y también se pueden presentar cuadros mixtos. De los supervivientes, hasta un 20% presentan secuelas graves (sordera, amputaciones).
En la actualidad el serogrupo B es el más frecuente en España, y sobre todo desde el año 2000 con la introducción de la vacuna frente al meningococo C. Esto no ocurre por un desplazamiento de la infección hacia el serogrupo B, que se ha mantenido de manera estable, sino por el importante descenso de la EMI por serogrupo C. Se ha observado un aumento de los casos en adolescentes por serogrupo C, por lo que en 2012 un grupo de países europeos decidieron ampliar la vacunación con un refuerzo de la vacuna frente a MenC en los adolescentes entre 11-12 años (incluida España).
En 2012, según el informe del ECDC, 28 países de la Unión Europea y el área Económica Europea comunicaron 3463 casos confirmados de EMI, de los cuales 335 ocurrieron en España. El 68% fueron por el serogrupo B, observándose un pequeño descenso desde 2008. Predomina en la edad pediátrica, sobre todo en el grupo de los menores entre 1-4 años, el 83%. El hecho de tener en la actualidad una vacuna frente al MenB podrá ayudar a disminuir la incidencia de la EMI.
La vacuna se obtiene por ingeniería genética “vacunología inversa” y es activa frente a cuatro proteínas de la superficie del meningococo B (4CMenB). Es una vacuna “adsorbida”, fijada a un compuesto de aluminio, que ayuda a mejorar la respuesta inmune. Dicha respuesta se ha evaluado y demostrado con la realización de diez ensayos clínicos, incluyendo todas las franjas de edad. Induce memoria inmunológica. También se ha demostrado su seguridad en nueve ensayos clínicos. Las reacciones adversas locales más frecuentes son el eritema, la hinchazón y sensibilidad local. La fiebre de ≥ 38 °C puede aparecer, siendo aún más frecuente, cuando esta vacuna se administra concomitantemente a las vacunas rutinarias de la infancia.
La eficacia clínica de Bexsero® no se ha evaluado mediante ensayos clínicos, sino que se ha deducido mediante estudios de inmunogenicidad, estudiando la respuesta de anticuerpos bactericidas mediada por complemento humano (hABS) frente a cada uno de los antígenos de la vacuna.
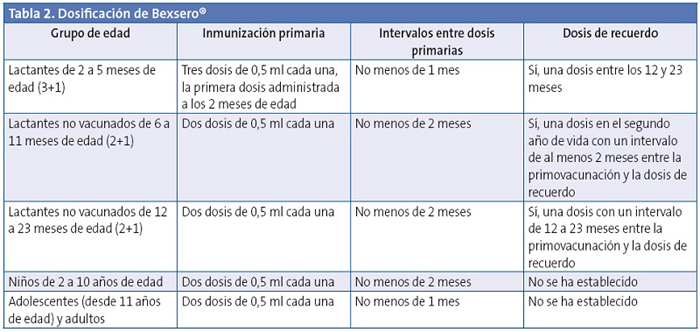
Bexsero® es compatible con las demás vacunas incluidas en los calendarios sistemáticos regionales y con las no incluidas, como las vacunas antineumocócicas, de rotavirus y de varicela (Tabla 2). La excepción la constituyen las vacunas antimeningocócicas C (pendiente de finalización de un estudio que estarán disponibles este año). Está autorizada en pacientes mayores de dos meses.
La Agencia Europea del Medicamento, en 2013, emitió una autorización para la comercialización de la vacuna Bexsero® frente al MenB, valida en toda la Unión Europea.
Esta vacuna está aprobada en Alemania, Australia, Austria, Bélgica, Bulgaria, Canadá, Chile, Chipre, Croacia, Dinamarca, EE. UU., Eslovaquia, Eslovenia, Estonia, España, Finlandia, Francia, Grecia, Holanda, Hungría, Islandia, Irlanda, Italia, Letonia, Liechtenstein, Lituania, Luxemburgo, Malta, Noruega, Polonia, Portugal, Reino Unido, República Checa, Rumania y Suiza. En Europa la vacuna está disponible en farmacias y en algunos de estos países o regiones se ha aprobado la inclusión en los programas nacionales o regionales de inmunización, como Alemania (Sajonia), Italia (Basilicata, Puglia y Toscana), República Checa, Australia y Canadá (Quebec). El Reino Unido la introdujo en su calendario vacunal en marzo de 2014. En EE. UU., Bexsero® se licitó en enero de 2015, siendo la segunda vacuna frente a MenB con un esquema de dos dosis separadas por un mes. En octubre de 2014, la Food and Drug Administration (FDA) aprobó la comercialización de la primera vacuna frente al meningococo B, llamada Trumenba® con un esquema de tres dosis (0, 2 y 6 meses). Ambas podrán ser administradas a personas de 10 a 25 años.
En España, en abril de 2013, la Agencia Española del Medicamento emitió un informe sobre la utilidad terapéutica de la vacuna meningocócica del grupo B, Bexsero®. Se aprueba la vacuna pero: “En base a la ausencia de datos de eficacia clínica con esta vacuna, con una incidencia actualmente contenida de enfermedad meningocócica por serogrupo B, y a la espera de obtener datos de efectividad postautorización, y ante la ausencia, en estos momentos, de recomendaciones oficiales de uso por parte de Salud Pública, se recomienda establecer el uso hospitalario de la vacuna Bexsero®, hasta que Salud Pública determine, en el seno del Consejo Interterritorial del Sistema Nacional de Salud, el objetivo o la política que se va a seguir con respecto al uso de esta vacuna”.
Las indicaciones financiadas, a día de hoy, están restringidas a los siguientes grupos:
• Personas con asplenia o disfunción esplénica grave (anemia de células falciformes) y en aquellos con resección quirúrgica programada.
• Personas con deficiencia de properdina o con deficiencias de factores terminales del complemento (incluyendo las que reciben o van a recibir eculizumab).
• Personas que han sufrido un episodio de EMI (inicialmente se contemplaba más de un episodio, pero basándose en estudios que demuestran que el haber padecido un episodio incrementa el riesgo de padecer episodios posteriores).
• Personal de laboratorio (técnicos de laboratorio y microbiólogos) que trabaje con muestras que potencialmente puedan contener N. meningitidis.
• El posicionamiento del CAV sobre la vacuna Bexsero® La vacuna presenta un perfil de vacuna que se debería incluir en el calendario oficial y debería estar disponible en las farmacias para su administración en todos los niños mayores de dos meses.
Conflicto de intereses
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
Abreviaturas
AEMPS: Agencia Española del Medicamento y Productos Sanitarios • ECDC: European Centre for Disease Prevention and Control • EMI: enfermedad meningocócica invasiva • FDA: Food and Drug Administration • hABS: anticuerpos bactericidas mediada por complemento humano • HZ: herpes zóster • MenB: meningococo B • MenC: meningococo C • SNS: Sistema Nacional de Salud.
Bibliografía
1. Baxter R, Tran TN, Ray P, Lewis E, Fireman B, Black S, et al. Impact of vaccination on the epidemiology of varicella: 1995-2009. Pediatrics. 2014;134:24-30. [ Links ]
2. Bonanni P, Breuer J, Gershon A, Gershon M, Hryniewicz W, Papaevangelou V, et al. Varicella vaccination in Europe -taking the practical approach. BMC Med. 2009;7:26. [ Links ]
3. CAV-AEP. Las vacunas frente a la varicela son “de uso hospitalario” en España. En: Comité Asesor de Vacunas de la AEP (en línea) (consultado el 29/05/2015). Disponible en http://vacunasaep.org/profesionales/que-pasa-con-la-vacuna-de-la-varicela. [ Links ]
4. CAV-AEP. Meningococo. Manual de vacunas en línea de la AEP. En: Comité Asesor de Vacunas de la AEP (en línea) (consultado el 29/05/2015). Disponible en http://vacunasaep.org/documentos/manual/cap-30. [ Links ]
5. CAV-AEP. Varicela. Manual de vacunas en línea de la AEP. En: Comité Asesor de Vacunas de la AEP (en línea) (consultado el 29/05/2015). Disponible en http://vacunasaep.org/documentos/manual/cap-41. [ Links ]
6. Centro Nacional de Epidemiología. Informe sobre la situación de la varicela y el herpes zóster en España 1998-2012. Madrid, mayo 2014. En: Instituto de Salud Carlos III (en línea) (consultado el 29/05/2015). Disponible en www.isciii.es/ISCIII/es/contenidos/fd-servicios-cientifico-tecnicos/fd-vigilancias-alertas/fd-enfermedades/fd-enfermedades-prevenibles-vacunacion/InformeVaricela_HZ_1998-2012.pdf. [ Links ]
7. Centro Nacional de Epidemiología. Resultados de la vigilancia epidemiológica de las enfermedades transmisibles. En: Instituto de Salud Carlos III (en línea) (consultado el 29/05/2015). Disponible en http://gesdoc.isciii.es/gesdoccontroller?action=download&id=21/01/2015-3962d0c4cd. [ Links ]
8. Cisterna Cáncer R (coord.). Documento de consenso sobre prevención de herpes zóster y neuralgia post-herpética. En: Vactodate (en línea) (consultado el 29/05/2015). Disponible en http://vactodate.es/descargas/documentos/documento_de_consenso_sobre_prevencion_del_herpes_zoster.pdf. [ Links ]
9. EMA. Bexsero. En: European Medicine Agency (en línea) (consultado el 29/05/2015). Disponible en http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/002333/human_med_001614.jsp&mid=WC0b01ac058001d124. [ Links ]
10. European Centre for Disease Prevention and Control. Annual epidemiological report 2014 -Vaccine reventable diseases invasive bacterial diseases. En: ECDC (en línea) (consultado el 29/05/2015). Disponible en http://ecdc.europa.eu/en/publications/Publications/AER-VPD-IBD-2014.pdf. [ Links ]
11. European Centre for Disease Prevention and Control. Varicella vaccination in the European Union. En: European Centre for Disease Prevention and Control (en línea) (consultado el 29/05/2015). Disponible en http://ecdc.europa.eu/en/publications/Publications/Varicella-Guidance-2015.pdf. [ Links ]
12. Gil A, Barranco D, Batalla J, Bayas JM, Campins M, Gorrotxategi P, et al. Prevención de la enfermedad meningocócica por el serogrupo B mediante una vacuna de 4 componentes. An Pediatr (Barc). 2014;80:259.e1-259.e23. [ Links ]
13. Grande Tejada AM. Enfermedad meningocócica por el serogrupo B. En: Sociedad de Pediatría de Atención Primaria de Extremadura (en línea) (consultado el 29/05/2015). Disponible en http://www.spapex.org/foro-pediatrico/2014/enfermedad-meningococica-por-el-serogrupo-b. [ Links ]
14. Grupo de Trabajo MenB. Ponencia de Programas y Registro de Vacunaciones. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad, Servicios Sociales e Igualdad, 2013. Vacuna frente a enfermedad meningocócica invasora por serogrupo B y su posible utilización en Salud Pública. Junio de 2013. Disponible en https://www.msssi.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/docs/MenB.pdf. [ Links ]
15. Informe de utilidad terapéutica de vacunas. Vacuna meningocócica del grupo B, Bexsero®. En: Ministerio de Sanidad, Servicios Sociales e Igualdad (en línea) (consultado el 29/05/2015). Disponible en http://www.aemps.gob.es/medicamentosUsoHumano/vacunas/infoUtilTerapeutica/home.htm. [ Links ]
16. JCVI position statement on use of Bexsero® meningococcal B vaccine in the UK March 2014 En: GOV.UK (en línea) (consultado el 29/05/2015). Disponible en https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/294245/JCVI_Statement_on_MenB.pdf. [ Links ]
17. Moreno-Pérez D, Álvarez García FJ, Arístegui Fernández J, Cilleruelo Ortega MJ, Corretger Rauet JM, et al. Vacunación frente al meningococo B. Posicionamiento del Comité Asesor de Vacunas de la Asociación Española de Pediatría. An Pediatr (Barc). 2015;82:198.e1-198.e9. Disponible en: http://dx.doi.org/10.1016/j.anpedi.2014.09.004. [ Links ]
18. Red Nacional de Vigilancia Epidemiológica. Boletín Epidemiológico Semanal en Red. Informe semanal de vigilancia 20 de enero de 2015. En: Instituto Carlos III (en línea). Disponible en http://www.isciii.es/ISCIII/es/contenidos/fd-servicios-cientifico-tecnicos/fd-vigilancias-alertas/fd-boletines/fd-boletin-epidemiolo gico-semanal-red/IS-150120-WEB.pdf. [ Links ]
19. Rivero Calle I, Rodríguez-Tenreiro Sánchez C, Martinón-Torres F. Vacunas antimeningocócicas. Situación epidemiológica mundial y estrategias de prevención mediante la vacunación. Enferm Infecc Microbiol Clin.2015;33:257-67. [ Links ]
20. Varicela. Epidemiología y situación actual. Vacunas: características y eficacia/efectividad. Recomendaciones de vacunación y sus implicaciones en salud pública. Mayo 2005. En: Ministerio de Sanidad, Servicios Sociales e Igualdad (en línea) (consultado el 29/05/2015). Disponible en www.msssi.gob.es/ciudadanos/proteccionSalud/vacunaciones/docs/VARICELA1.pdf. [ Links ]
21. WHO. Varicella and herpes zoster vaccines: WHO position paper, June 2014. Wkly Epidemiol Rec. 2014;89:265-87. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Pilar Lupiani Castellanos
lupiani.pilar@gmail.com