Introducción
El 31 de diciembre de 2019, la Comisión Municipal de Salud y Sanidad de Wuhan (provincia de Hubei, China) informó sobre un grupo de 27 casos de neumonía de etiología desconocida, incluyendo siete casos graves, con una exposición común a un mercado mayorista de marisco, pescado y animales vivos en la ciudad de Wuhan. El inicio de los síntomas del primer caso fue el 8 de diciembre de 2019 presentando fiebre, tos seca, disnea y hallazgos radiológicos con infiltrados pulmonares bilaterales. El 7 de enero de 2020, las autoridades chinas identificaron como agente causante del brote un nuevo tipo de virus de la familia Coronaviridae (que ha sido denominado nuevo coronavirus, COVID-19). El 30 de enero de 2020, la OMS declara que el nuevo brote de coronavirus es una emergencia de salud pública de importancia internacional (https://www.who.int/es/news/item/27-04-2020-who-timeline---covid-19 ).
En España hasta 02 de Setiembre de 2022 se notificaron 13.352.019 casos confirmados de COVID-19 (de ellos 2.626.018 en Cataluña) y 112.804 fallecidos (20.432 en Cataluña)1. El eCDC (Centro Europeo de Prevención y control de enfermedades), al inicio de la pandemia publicó que entre el 9 y el 26% de los casos COVID-19 diagnosticados correspondían a trabajadores sanitarios2.
Las medidas de control de la epidemia, cómo el uso de mascarillas filtrantes de partículas, el distanciamiento físico con incluso el aislamiento de la población, la ventilación y el rastreo de los contactos y su cuarentena, ayudaron a controlar la propagación. Sin embargo, no fueron suficientes siendo necesario recurrir a la vacunación masiva de la población en cuanto se ha dispuesto de vacunas específicas3. Se ensayaron distintos tipos de vacunas de nueva creación: vacunas de RNA mensajero (RNAm), vacunas por vector viral, vacunas de subunidades proteicas y vacunas de virus atenuados o inactivados4,5.
En octubre de 2021 fueron cuatro las vacunas aprobadas para su uso por parte de la Agencia Europea del Medicamento. Dos vacunas RNAm, Comirnaty® de Pfizer-BionTech o también llamada BNT162b2 (Comirnaty recibió una autorización de comercialización condicional válida en toda la UE el 21 de diciembre de 2020) y Spikevax® de Moderna o también llamada RNAm-1273 (COVID-19 Vaccine Moderna recibió una autorización de comercialización condicional válida en toda la Unión Europea el 6 de enero de 2021); y dos vacunas por vector viral: Vaxzetria® de Astra Zeneca y COVID-19 Vaccine® de Janssen, además de otras 22 vacunas que son aprobadas en diferentes países fuera de la UE2,5,6. En España, la vacunación contra la COVID-19 se inicia en diciembre de 2020 con una estrategia vacunal poblacional que priorizaba a los trabajadores sanitarios y sociosanitarios, y a los usuarios de residencias y centros sociosanitarios2,5,7).
Diferentes estudios han demostrado que la administración de 2 dosis de 30µgr de BNT162b2 (Comirnaty®) producen títulos de anticuerpos neutralizantes para el Síndrome Respiratorio Agudo por Coronavirus-2 (SARS-CoV-2) y respuestas suficientes de T CD8+ y CD4+ de tipo Th1 especificas contra el antígeno8. En un estudio prospectivo de cohortes en sanitarios y otros trabajadores esenciales de los Estados Unidos, una pauta de una dosis de Spikevax® mostró una eficacia vacunal (EV) frente a la infección (sintomática o asintomática) del 80% y con dos dosis del 90%. En otro estudio similar se alcanzó una EV de 96,3% (IC 95% 91,3-98,4), y no se encontraron diferencias en función de factores como la edad (menos y más de 50 años), grupo étnico, patología concomitante o número de contactos con pacientes5.
Las vacunas disponibles actualmente frente a COVID-19 han demostrado su eficacia en la reducción del riesgo de infección con síntomas, de infección asintomática y de la carga viral en el caso de producirse una infección asintomática9. Algunos estudios han demostrado una reducción de la infección del 92% con la vacuna BNT162b2 (PfizerBioNTech) o de un 86% en un estudio en trabajadores10.
El 2 de septiembre de 2022, en España se habían administrado un total de 95.676.799 de dosis de vacuna frente a la COVID-19 con 40.633.204 personas que habían recibido la pauta completa de vacunación11. Se alcanzaron coberturas vacunales muy elevadas, oscilando desde el 93% en las personas entre los 60 y 69 años, al 78% en la franja de edad 18-39 años, así como una EV frente a hospitalización del 71% y el 68%, y frente a defunción del 69% y 80%, para ambos grupos de edad, respectivamente12.
Así pues, las vacunas RNAm han demostrado ser eficaces frente a la reducción de la transmisión, hospitalización y defunción, y por ello probablemente habrá que seguirlas administrando. Por otro lado, son vacunas de nueva creación de las que existe un conocimiento limitado de sus posibles efectos secundarios. En este sentido, el objetivo del presente estudio es comparar los efectos adversos a corto plazo entre las vacunas RNAm disponibles en sanitarios/as.
Material y metodos
Se trata de un estudio prospectivo llevado a cabo en el período comprendido entre 12/01/2021 y 20/08/2021. La población de estudio fue constituida por los/las trabajadores/as sanitarios/as, estudiantes de ciencias de la salud de la Universitat Rovira i Virgili y los trabajadores de empresas subcontratadas que realizaban tareas en centros sanitarios o sociosanitarios de la comarca del Baix Camp y Tarragonés, en Cataluña (España), que acudieron voluntariamente a vacunarse frente a la COVID-19 en el centro de vacunación para profesionales del Hospital Universitari Sant Joan de Reus. La población vacunada fueron hombres y mujeres de 17 a 71 años de edad en el momento de la vacunación y fue realizada por un equipo estable de 8 enfermeras. A todos los vacunados se les informó de la vacuna administrada.
Para la vacunación se utilizaron las siguientes vacunas: RNAm: 0,3 mL (30 μg/dosis) de vacuna Comirnaty® de BioNTech & Pfizer13 y 0,5 mL (100 µg/dosis) de vacuna Spikevax® de Moderna & Lonza14, ambas vacunas con el mismo tipo de aguja intramuscular 23G y aplicada en músculo deltoides. La vacuna se aplicaba perpendicularmente al plano de piel. Todas las personas que recibieron la segunda dosis de vacuna habían sido vacunadas previamente con el mismo tipo de vacuna y por el mismo equipo de vacunación al menos 28 días antes de recibir la segunda dosis.
Después de recibir cada dosis de vacuna, a todos los vacunados se les solicitó que respondieran a un cuestionario autoautoadministrado de síntomas atribuibles a la reactogenicidad de la vacuna aparecidos en los 7 días posteriores, y que debían remitir al centro de vacunación una vez cumplimentado. En la figura 1 se muestra mediante un flujograma la distribución de las personas vacunadas y las encuestas recibidas. El cuestionario recogía tipo de vacuna y lote, fecha de vacunación, sexo, edad, presencia o no de efectos adversos, fecha de inicio del efecto adverso e intensidad de este, así como una serie de actividades limitadas o impedidas tras la vacunación. Las variables dependientes fueron por un lado los efectos adversos registrados: dolor, rubor, hematoma y flogosis en el punto de inyección; fatiga, cefalea, escalofríos, artralgias, náuseas y/o vómitos, adenopatías, fiebre menor a 38 grados (temperatura axilar entre 36,5 y 38 grados) y fiebre superior a 38 grados. Por otro lado, se registraron las actividades impedidas o limitadas, (existencia o no, y la duración): necesidad de incapacidad temporal, limitaciones para las actividades de la vida diaria, conducción de vehículos, poder realizar ejercicio físico y capacidad para mover la extremidad en que se había realizado la punción.
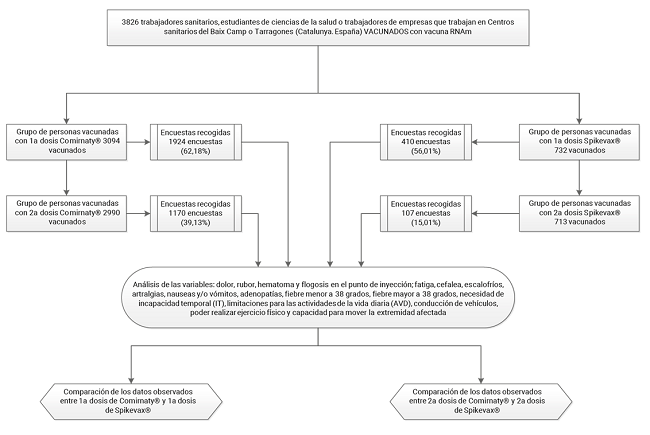
Figura 1. Efectos adversos a la primera y segunda dosis de vacuna Comirnaty® y Spikevax® y sus consecuencias, en los/as trabajadores/as de una institución sanitaria. Flujograma del procedimiento de recogida de datos.
Los distintos cuestionarios recogidos después de la administración de cada una de las dosis eran revisados y se rechazaron los cuestionarios incompletos. Todos los cuestionarios de Comirnaty® (primera y segunda dosis) fueron admitidos como válidos y de los recibidos de Spikevax® se rechazaron 5 de la primera dosis y 3 de la segunda por contener datos incompletos.
Se calculó la prevalencia y su intervalo de confianza del 95% (IC95%) de los efectos adversos recogidos en los cuestionarios. Se usaron pruebas de chi-cuadrado y valores de p para comparar la distribución de los efectos adversos entre los dos tipos de vacunas, y se calcularon las razones de probabilidad o odds ratio (OR) y sus IC95% para evaluar la fuerza de la asociación, considerando como grupo de referencia los que recibieron la vacuna Comirnaty®. Para el cálculo de los IC95% se utilizó la función estadística de Excel 365 para un valor de Z de 1.96 y para el cálculo de OR se ha utilizado MedCalc Statistical Software versión 20.210 (MedCalc Software bv, Ostend, Bèlgica; https://www.medcalc.org; 2020).
Resultados
En total, se recogieron 1924 cuestionarios válidos para la primera dosis de la vacuna Comirnaty® con una tasa de respuesta del 62,18%, y de 1170 (tasa de respuesta del 39,13%) para la segunda dosis. Respecto a la vacuna Spikevax® se obtuvieron 410 cuestionarios válidos (tasa de respuesta del 56,01%) para la primera dosis y 107 cuestionarios válidos (tasa de respuesta del 15,01%) para la segunda dosis. Las tasas de respuesta fueron superiores para las mujeres (excepto para la segunda dosis de Spikevax®), y para los grupos de edad entre 41 y 70 años (Tabla 1).
Tabla 1. Tasa de respuesta (TR) a la encuesta sobre efectos adversos (EA) de la vacunación, según tipo de vacuna y dosis, sexo y edad.
| Primera dosis Comirnaty® | Segunda dosis Comirnaty® | Primera dosis Spikevax® | Segunda dosis Spikevax® | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Vacunados | Encuesta EA | TR por 100 | Vacunados | Encuesta EA | TR por 100 | Vacunados | Encuesta EA | TR por 100 | Vacunados | Encuesta EA | TR por 100 | ||||
| SEXO | |||||||||||||||
| Mujeres | 2297 | 1469 | 63,95 | 2222 | 901 | 40,55 | 559 | 315 | 56,35 | 544 | 76 | 13,97 | |||
| Hombres | 797 | 455 | 57,09 | 768 | 269 | 35,03 | 173 | 95 | 54,91 | 169 | 31 | 18,34 | |||
| EDAD (años) | |||||||||||||||
| 17-20 | 287 | 176 | 61,32 | 287 | 67 | 23,34 | 109 | 65 | 59,63 | 108 | 4 | 3,70 | |||
| 21-30 | 945 | 569 | 60,21 | 919 | 277 | 30,14 | 253 | 154 | 60,87 | 245 | 25 | 10,20 | |||
| 31-40 | 469 | 265 | 56,50 | 446 | 153 | 34,30 | 122 | 54 | 44,26 | 119 | 19 | 15,97 | |||
| 41-50 | 638 | 407 | 63,79 | 615 | 284 | 46,18 | 127 | 75 | 59,06 | 122 | 24 | 19,67 | |||
| 51-60 | 565 | 378 | 66,90 | 542 | 279 | 51,48 | 94 | 47 | 50,00 | 92 | 26 | 28,26 | |||
| 61-70 | 183 | 128 | 69,95 | 176 | 110 | 62,50 | 24 | 15 | 62,50 | 24 | 9 | 37,50 | |||
| >70 | 3 | 1 | 33,33 | 2 | 0 | 0,00 | 1 | 0 | 0,00 | 1 | 0 | 0,00 | |||
| ns/nc | 4 | 0 | - | 3 | - | 2 | - | 2 | - | ||||||
| TOTAL | 3094 | 1924 | 62,18 | 2990 | 1170 | 39,13 | 732 | 410 | 56,01 | 713 | 107 | 15,01 | |||
Después de la administración de la primera dosis de la vacuna Comirnaty® un 67,3% de los participantes presentaron algún efecto adverso, frente a un 76,1% para Spikevax®. Tanto en las mujeres como en los hombres, la prevalencia fue superior para Spikevax® (OR 1,43 IC95% 1,07-1,91; OR 1,77 IC95% 1,10-2,84, respectivamente). No hubo diferencias respecto a la edad (Tabla 1 y https://archivosdeprevencion.eu/index.php/aprl/article/view/265/174 Tabla suplementaria 1). Todos los efectos adversos estudiados, cuando se presentan, se iniciaron en las primeras 24 horas tras la administración de la dosis de vacuna (datos no mostrados).
Para cada uno de los síntomas reportados, se observó una prevalencia superior en los que recibieron la primera dosis de vacuna Spikevax®, excepto para las mialgias (OR 1,37 IC95% 0,98-1,92) aunque sí en el grupo de edad 17 a 40 años, y las adenopatías (OR 0,98 IC95% 0,43-2,24). En las mujeres, se observó una mayor reactogenicidad a la vacuna Spikevax® respecto a la Comirnaty® para todos los síntomas, excepto estos dos últimos y el dolor local. En cambio, los hombres presentaron diferencias entre ambas vacunas, excepto para el hematoma en el punto de inyección, las artralgias y la fiebre >38ºC. (Tabla 1 y Tabla suplementaria 1). En general, las OR son superiores en mujeres que en hombres, aunque los IC95% se solapan, excepto para la flogosis y las náuseas/vómitos. En cuanto a la edad, se observaron diferencias, siendo estas superiores en los jóvenes. Para el dolor local, las artralgias, náuseas y vómitos, y fiebre >38ºC no se observaron diferencias en el grupo de mayor edad (Tabla 1 y Tabla suplementaria 1).
Respecto a la segunda dosis, la vacuna Spikevax® también mostró una mayor prevalencia de algún efecto adverso en comparación con la vacuna Comirnaty® (OR 2,32 IC95% 1,28-4,22), en los hombres (OR 5,88 IC95% 1,74-19-84) y para los mayores de 40 años (OR 2,37 IC95% 1,14-4,90), aunque no se observó un efecto superior en las mujeres y los jóvenes. Solo se observaron diferencias para el dolor, flogosis y el enrojecimiento locales, y la fiebre. En cuanto al sexo, los hombres presentaron mayor reactogenicidad para todos los síntomas, excepto para el hematoma local, mialgias, artralgias y adenopatías; en cambio las mujeres sólo mostraron una mayor prevalencia de fiebre tras la vacuna Spikevax®. Los vacunados con la segunda dosis de Spikevax® de edad entre 17 y 40 años presentaron una prevalencia superior de enrojecimiento local, flogosis y fiebre respecto a los vacunados con la vacuna Comirnaty®; y los mayores de 40 años dolor local y fiebre inferior a 38ºC (Tabla 2 y Tabla suplementaria 1).
Tabla 2. Diferencias de los efectos adversos a la primera dosis de vacuna según el tipo de vacuna, sexo y edad: Comirnaty® (categoría de referencia) versus Spikevax®.
| PRIMERA DOSIS Comirnaty® | PRIMERA DOSIS Spikevax® | OR (IC95%)* | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Casos | Prevalencia (por 100) | (IC95%) | Casos | Prevalencia (por 100) | (IC95%) | ||||
| Algún efecto adverso | 1305 | 67,83 | (65,74-69,91) | 312 | 76,10 | (71,97-80,23) | 1,51 (1,18-1,93) | ||
| Mujeres | 1049 | 71,41 | (69,10-73,72) | 246 | 78,10 | (73,53-82,66) | 1,43 (1,07-1,91) | ||
| Hombres | 256 | 56,26 | (51,71-60,82) | 66 | 69,47 | (60,21-78,73) | 1,77 (1,10-2,84) | ||
| 17 a 40 años | 758 | 75,05 | (72,38-77,72) | 219 | 80,22 | (75,49-84,95) | 1,35 (0,97-1,88) | ||
| >40 años | 547 | 59,85 | (56,67-63,02) | 93 | 67,88 | (60,06-75,70) | 1,42 (0,97-2,08) | ||
| Dolor local | 1296 | 67,36 | (65,26-69,45) | 299 | 72,93 | (68,63-77,23) | 1,30 (1,02-1,65) | ||
| Mujeres | 1043 | 71,00 | (68,68-73,32) | 234 | 74,29 | (69,46-79,11) | 1,18 (0,89-1,56) | ||
| Hombres | 253 | 55,60 | (51,04-60,17) | 65 | 68,42 | (59,07-77,77) | 1,73 (1,08-2,77) | ||
| 17 a 40 años | 758 | 75,05 | (72,38-77,72) | 212 | 77,66 | (72,71-82,60) | 1,16 (0,84-1,59) | ||
| >40 años | 538 | 58,86 | (55,67-62,05) | 32 | 51,61 | (39,17-64,05) | 0,75 (0,44-1,25) | ||
| Enrojecimiento local | 190 | 9,88 | (8,54-11,21) | 68 | 16,59 | (12,98-20,19) | 1,81 (1,34-2,45) | ||
| Mujeres | 177 | 12,05 | (10,38-13,71) | 60 | 19,05 | (14,71-23,38) | 1,72 (1,24-2,37) | ||
| Hombres | 13 | 2,86 | (1,33-4,39) | 8 | 8,42 | (2,84-14,01) | 1,13 (1,26-7,77) | ||
| 17 a 40 años | 104 | 10,30 | (8,42-12,17) | 47 | 17,22 | (12,74-21,69) | 1,81 (1,25-2,63) | ||
| >40 años | 86 | 9,41 | (7,52-11,30) | 21 | 15,33 | (9,30-21,36) | 1,74 (1,04-2,92) | ||
| Hematoma en punto inyección | 82 | 4,26 | (3,36-5,16) | 34 | 8,29 | (5,62-10,96) | 2,03 (1,34-3,07) | ||
| Mujeres | 76 | 5,17 | (4,04-6,31) | 31 | 9,84 | (6,55-13,13) | 2,00 (1,29-3,10) | ||
| Hombres | 6 | 1,32 | (0,27-2,37) | 3 | 3,16 | -(0,36-6,67) | 2,44 (0,60-9,93) | ||
| 17 a 40 años | 52 | 5,15 | (3,79-6,51) | 24 | 8,79 | (5,43-12,15) | 1,78 (1,07-2,94) | ||
| >40 años | 30 | 3,28 | (2,13-4,44) | 10 | 7,30 | (2,94-11,66) | 2,32 (1,11-4,86) | ||
| Flogosis | 298 | 15,49 | (13,87-17,11) | 103 | 25,12 | (20,92-29,32) | 1,83 (1,42-2,36) | ||
| Mujeres | 265 | 18,04 | (16,07-20,01) | 81 | 25,71 | (20,89-30,54) | 1,57 (1,18-2,09) | ||
| Hombres | 33 | 7,25 | (4,87-9,64) | 22 | 23,16 | (14,68-31,64) | 3,85 (2,13-6,98) | ||
| 17 a 40 años | 176 | 17,43 | (15,09-19,77) | 76 | 27,84 | (22,52-33,16) | 1,83 (1,34-2,49) | ||
| >40 años | 122 | 13,35 | (11,14-15,55) | 27 | 19,71 | (13,05-26,37) | 1,59 (1,00-2,53) | ||
| Fatiga | 494 | 25,68 | (23,72-27,63) | 160 | 39,02 | (34,30-43,75) | 1,83 (1,41-2,36) | ||
| Mujeres | 412 | 28,05 | (25,75-30,34) | 133 | 42,22 | (36,77-47,68) | 1,88 (1,46-2,41) | ||
| Hombres | 82 | 18,02 | (14,49-21,55) | 27 | 28,42 | (19,35-37,49) | 1,81 (1,09-2,99) | ||
| 17 a 40 años | 298 | 29,50 | (26,69-32,32) | 113 | 41,39 | (35,55-47,23) | 1,69 (1,28-2,22) | ||
| >40 años | 196 | 21,44 | (18,78-24,11) | 47 | 34,31 | (26,36-42,26) | 1,91 (1,30-2,82) | ||
| Cefalea | 405 | 21,05 | (19,23-22,87) | 127 | 30,98 | (26,50-35,45) | 1,68 (1,32-2,13) | ||
| Mujeres | 347 | 23,62 | (21,45-25,79) | 106 | 33,65 | (28,43-38,87) | 1,64 (1,26-2,13) | ||
| Hombres | 58 | 12,75 | (9,68-15,81) | 21 | 22,11 | (13,76-30,45) | 1,94 (1,11-3,39) | ||
| 17 a 40 años | 230 | 22,77 | (20,19-25,36) | 88 | 32,23 | (26,69-37,78) | 1,61 (1,20-2,16) | ||
| >40 años | 175 | 19,15 | (16,60-21,70) | 39 | 28,47 | (20,91-36,02) | 1,68 (1,12-2,52) | ||
| Mialgias | 173 | 8,99 | (7,71-10,27) | 49 | 11,95 | (8,81-15,09) | 1,37 (0,98-1,92) | ||
| Mujeres | 146 | 9,94 | (8,41-11,47) | 41 | 13,02 | (9,30-16,73) | 1,36 (0,94-1,96) | ||
| Hombres | 27 | 5,93 | (3,76-8,10) | 8 | 8,42 | (2,84-14,01) | 1,46 (0,64-3,32) | ||
| 17 a 40 años | 82 | 8,12 | (6,43-9,80) | 36 | 13,19 | (9,17-17,20) | 1,72 (1,13-2,61) | ||
| >40 años | 91 | 9,96 | (8,02-11,90) | 13 | 9,49 | (4,58-14,40) | 0,95 (0,51-1,75) | ||
| Artralgias | 191 | 9,93 | (8,59-11,26) | 78 | 19,02 | (15,23-22,82) | 2,13 (1,59-2,84) | ||
| Mujeres | 168 | 11,44 | (9,81-13,06) | 70 | 22,22 | (17,63-26,81) | 2,21 (1,62-3,02) | ||
| Hombres | 23 | 5,05 | (3,04-7,07) | 8 | 8,42 | (2,84-14,01) | 1,73 (0,75-3,99) | ||
| 17 a 40 años | 78 | 7,72 | (6,08-9,37) | 53 | 19,41 | (14,72-24,11) | 2,88 (1,97-4,20) | ||
| >40 años | 113 | 12,36 | (10,23-14,50) | 25 | 18,25 | (11,78-24,72) | 1,58 (0,98-2,55) | ||
| Nauseas o vómitos | 81 | 4,21 | (3,31-5,11) | 28 | 6,83 | (4,39-9,27) | 1,66 (1,07-2,59) | ||
| Mujeres | 70 | 4,77 | (3,68-5,85) | 26 | 8,25 | (5,22-11,29) | 1,80 (1,13-2,87) | ||
| Hombres | 11 | 2,42 | (1,01-3,83) | 2 | 2,11 | -(0,78-4,99) | 0,87 (0,19-3,98) | ||
| 17 a 40 años | 42 | 4,16 | (2,93-5,39) | 20 | 7,33 | (4,24-10,42) | 1,82 (1,05-3,16) | ||
| >40 años | 39 | 4,27 | (2,96-5,58) | 8 | 5,84 | (1,91-9,77) | 1,40 (0,64-3,7) | ||
| Adenopatías | 35 | 1,82 | (1,22-2,42) | 7 | 1,71 | (0,45-2,96) | 0,98 (0,43-2,24) | ||
| Mujeres | 30 | 2,04 | (1,32-2,77) | 6 | 1,90 | (0,40-3,41) | 0,93 (0,38-2,26) | ||
| Hombres | 5 | 1,10 | (0,14-2,06) | 1 | 1,05 | -(1,00-3,10) | 0,96 (0,11-8,29) | ||
| 17 a 40 años | 25 | 2,48 | (1,52-3,43) | 7 | 2,56 | (0,69-4,44) | 1,04 (0,44-2,42) | ||
| >40 años | 10 | 1,09 | (0,42-1,77) | 0 | 0,00 | (0,00-0,00) | 0,31 (0,02-5,38) | ||
| Fiebre < 38º C | 78 | 4,05 | (3,17-4,94) | 53 | 12,93 | (9,68-16,17) | 3,51 (2,43-5,07) | ||
| Mujeres | 61 | 4,15 | (3,13-5,17) | 41 | 13,02 | (9,30-16,73) | 3,45 (2,28-5,24) | ||
| Hombres | 17 | 3,74 | (1,99-5,48) | 12 | 12,63 | (5,95-19,31) | 3,72 (1,71-8,09) | ||
| 17 a 40 años | 48 | 4,75 | (3,44-6,06) | 43 | 15,75 | (11,43-20,07) | 3,75 (2,42-5,80) | ||
| >40 años | 30 | 3,28 | (2,13-4,44) | 10 | 7,30 | (2,94-11,66) | 2,32 (1,11-4,86) | ||
| Fiebre > 38º C | 21 | 1,09 | (0,63-1,56) | 19 | 4,63 | (2,60-6,67) | 4,40 (2,34-8,26) | ||
| Mujeres | 18 | 1,23 | (0,66-1,79) | 17 | 5,40 | (2,90-7,89) | 4,60 (2,34-9,03) | ||
| Hombres | 3 | 0,66 | -(0,08-1,40) | 2 | 2,11 | -(0,78-4,99) | 3,24 (0,53-19,66) | ||
| 17 a 40 años | 13 | 1,29 | (0,59-1,98) | 18 | 6,59 | (3,65-9,54) | 5,41 (2,62-11,19) | ||
| >40 años | 8 | 0,88 | (0,27-1,48) | 1 | 0,73 | -(0,70-2,16) | 0,83 (0,10-6,71) | ||
*OR (IC95%): Odds ratio (intervalo de confianza del 95%). Categoría de referencia: Comirnaty®
El análisis de las consecuencias de los efectos adversos muestra que para la primera dosis de Spikevax® la probabilidad de presentar una incapacidad temporal, limitaciones para las actividades de la vida diaria, tener que evitar el ejercicio físico, conducir y movilizar el brazo que recibió la punción, es superior a la primera dosis de vacuna Comirnaty®. Estas diferencias se observan para todas estas consecuencias en las mujeres y los jóvenes, excepto el tener que evitar el ejercicio físico y movilizar el brazo afectado que también se muestra para los hombres y para los mayores de 40 años (Tabla 4 y Tabla suplementaria 2). Respecto a la segunda dosis de ambas vacunas, se observan estas diferencias para las limitaciones de las actividades de la vida diaria y en ambos sexos y grupos de edad, tener que evitar el ejercicio físico, excepto para los jóvenes, y evitar conducir, excepto para los hombres (Tabla 5 y Tabla suplementaria 2). La duración más frecuente reportada de la limitación de ejercicio físico fue de 2 días para ambas vacunas excepto para la segunda dosis de Spikevax® que fue de 1 día; la mayoría de los pacientes que evitaron el ejercicio lo hicieron entre 1 y 3 días; las mujeres y los grupos de edad más jóvenes requirieron con mayor frecuencia limitar la movilidad del brazo y la mayoría lo hicieron entre 1 y 3 días (datos no mostrados).
Tabla 3. Diferencias de las consecuencias de los efectos adversos a la primera dosis de vacuna según el tipo de vacuna, sexo y edad: Comirnaty® (categoría de referencia) versus Spikevax®.
| PRIMERA DOSIS Comirnaty® | PRIMERA DOSIS Spikevax® | OR (IC95%)* | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Casos | Prevalencia (por 100) | (IC95%) | Casos | Prevalencia (por 100) | (IC95%) | |||||
| Incapacidad temporal | 31 | 1,61 | (1,05-2,17) | 18 | 4,39 | (2,41-6,37) | 2,80 (1,55-5,06) | |||
| Mujeres | 26 | 1,77 | (1,10-2,44) | 16 | 5,08 | (2,65-7,50) | 2,97 (1,57-5,60) | |||
| Hombres | 5 | 1,10 | (0,14-2,06) | 2 | 2,11 | -(0,78-4,99) | 1,93 (0,37-10,13) | |||
| 17 a 40 años | 14 | 1,39 | (0,67-2,11) | 14 | 5,13 | (2,51-7,74) | 3,84 (1,81-8,17) | |||
| >40 años | 17 | 1,86 | (0,98-2,74) | 4 | 2,92 | (0,10-5,74) | 1,59 (0,53-4,79) | |||
| Limitaciones para AVD** | 95 | 4,94 | (3,97-5,91) | 57 | 13,90 | (10,55-17,25) | 3,11 (2,19-4,40) | |||
| Mujeres | 78 | 5,31 | (4,16-6,46) | 54 | 17,14 | (12,98-21,30) | 3,69 (2,55-5,35) | |||
| Hombres | 17 | 3,74 | (1,99-5,48) | 3 | 3,16 | -(0,36-6,67) | 0,84 (0,24-2,93) | |||
| 17 a 40 años | 48 | 4,75 | (3,44-6,06) | 41 | 15,02 | (10,78-19,26) | 3,54 (2,28-5,50) | |||
| >40 años | 47 | 5,14 | (3,71-6,57) | 4 | 6,45 | (0,34-12,57) | 1,27 (0,44-3,65) | |||
| Evitar ejercicio físico | 229 | 11,90 | (10,46-13,35) | 99 | 24,15 | (20,00-28,29) | 2,36 (1,81-3,07) | |||
| Mujeres | 188 | 12,80 | (11,09-14,51) | 77 | 24,44 | (19,70-29,19) | 2,20 (1,63-2,97) | |||
| Hombres | 41 | 9,01 | (6,38-11,64) | 22 | 23,16 | (14,68-31,64) | 3,04 (1,71-5,41) | |||
| 17 a 40 años | 144 | 14,26 | (12,10-16,41) | 76 | 27,84 | (22,52-33,16) | 2,32 (1,69-3,19) | |||
| >40 años | 85 | 9,30 | (7,42-11,18) | 23 | 16,79 | (10,53-23,05) | 1,97 (1,19-3,25) | |||
| Evitar conducir | 53 | 2,75 | (2,02-3,49) | 26 | 6,34 | (3,98-8,70) | 2,39 (1,48-3,87) | |||
| Mujeres | 43 | 2,93 | (2,07-3,79) | 25 | 7,94 | (4,95-10,92) | 2,86 (1,72-4,75) | |||
| Hombres | 10 | 2,20 | (0,85-3,54) | 1 | 1,05 | -(1,00-3,10) | 0,47 (0,06-3,74) | |||
| 17 a 40 años | 20 | 1,98 | (1,12-2,84) | 17 | 6,23 | (3,36-9,09) | 3,29(1,70-6,37) | |||
| >40 años | 33 | 3,61 | (2,40-4,82) | 9 | 6,57 | (2,42-10,72) | 1,88 (0,88-4,01) | |||
| Evitar movilizar el brazo | 267 | 13,88 | (12,33-15,42) | 117 | 28,54 | (24,17-32,91) | 2,48 (1,93-3,18) | |||
| Mujeres | 231 | 15,72 | (13,86-17,59) | 100 | 31,75 | (26,61-36,89) | 2,49 (1,89-3,28) | |||
| Hombres | 36 | 7,91 | (5,43-10,39) | 17 | 17,89 | (10,19-25,60) | 2,47 (1,32-4,60) | |||
| 17 a 40 años | 189 | 18,71 | (16,31-21,12) | 98 | 35,90 | (30,21-41,59) | 2,43 (1,81-3,26) | |||
| >40 años | 78 | 8,53 | (6,72-10,35) | 19 | 13,87 | (8,08-19,66) | 1,72 (1,01-2,95) | |||
*OR (IC95%): Odds ratio (intervalo de confianza del 95%). Categoría de referencia: Comirnaty®
**AVD = actividades de la vida diaria
Tabla 4. Diferencias de los efectos adversos a la segunda dosis de vacuna según el tipo de vacuna, sexo y edad: Comirnaty® (categoría de referencia) versus Spikevax®.
| PRIMERA DOSIS Comirnaty® | PRIMERA DOSIS Spikevax® | OR (IC95%)* | |||||
|---|---|---|---|---|---|---|---|
| Casos | Prevalencia (por 100) | (IC95%) | Casos | Prevalencia (por 100) | (IC95%) | ||
| Algún efecto adverso | 885 | 75,64 | (73,18-78,10) | 94 | 87,85 | (81,66-94,04) | 2,32 (1,28-4,22) |
| Mujeres | 720 | 79,91 | (77,29-82,53) | 66 | 86,84 | (79,24-94,44) | 1,66 (0,84-3,29) |
| Hombres | 165 | 61,34 | (55,52-67,16) | 28 | 90,32 | (79,91-100,73) | 5,88 (1,74-19,84) |
| 17 a 40 años | 413 | 83,10 | (79,80-86,39) | 44 | 91,21 | (83,22-99,20) | 2,24 (0,78-6,39) |
| >40 años | 472 | 70,13 | (66,68-73,59) | 50 | 84,75 | (75,57-93,92) | 2,37 (1,14-4,90) |
| Dolor local | 787 | 67,26 | (64,58-69,95) | 87 | 81,31 | (73,92-88,70) | 2,11 (1,28-3,49) |
| Mujeres | 645 | 71,59 | (68,64-74,53) | 61 | 80,26 | (71,31-89,21) | 1,61 (0,90-2,89) |
| Hombres | 142 | 52,79 | (46,82-58,75) | 26 | 83,87 | (70,92-96,82) | 4,65 (1,73-12,47) |
| 17 a 40 años | 389 | 78,27 | (74,64-81,90) | 43 | 89,58 | (80,94-98,23) | 2,39 (0,92-6,18) |
| >40 años | 398 | 59,14 | (55,42-62,85) | 44 | 74,58 | (63,47-85,69) | 2,03 (1,11-3,71) |
| Enrojecimiento local | 215 | 18,38 | (16,16-20,60) | 32 | 29,91 | (21,23-38,58) | 1,89 (1,22-2,94) |
| Mujeres | 201 | 22,31 | (19,59-25,03) | 22 | 28,95 | (18,75-39,14) | 1,42 (0,84-2,39) |
| Hombres | 14 | 5,20 | (2,55-7,86) | 10 | 32,26 | (15,80-48,71) | 8,67 (3,44-21-88) |
| 17 a 40 años | 78 | 15,69 | (12,50-18,89) | 13 | 27,08 | (14,51-39,66) | 1,99 (1,01-3,94) |
| >40 años | 137 | 20,36 | (17,31-23,40) | 19 | 32,20 | (20,28-44,13) | 1,86 (1,04-3,31) |
| Hematoma en punto inyección | 83 | 7,09 | (5,62-8,57) | 11 | 10,28 | (4,53-16,03) | 1,50 (0,77-2,91) |
| Mujeres | 77 | 8,55 | (6,72-10,37) | 8 | 10,53 | (3,63-17,43) | 1,26 (0,58-2,72) |
| Hombres | 6 | 2,23 | (0,47-4,00) | 3 | 9,68 | -(0,73-20,09) | 4,70 (1,11-19,82) |
| 17 a 40 años | 34 | 6,84 | (4,62-9,06) | 6 | 12,50 | (3,14-21,86) | 1,94 (0,77-4,90) |
| >40 años | 49 | 7,28 | (5,32-9,24) | 5 | 8,47 | (1,37-15,58) | 1,18 (0,45-3,08) |
| Flogosis | 261 | 22,31 | (19,92-24,69) | 37 | 34,58 | (25,57-43,59) | 1,84 (1,20-2,80) |
| Mujeres | 240 | 26,64 | (23,75-29,52) | 26 | 34,21 | (23,54-44,88) | 1,43 (0,87-2,35) |
| Hombres | 21 | 7,81 | (4,60-11,01) | 11 | 35,48 | (18,64-52,33) | 6,49 (2,75-15,35) |
| 17 a 40 años | 107 | 21,53 | (17,92-25,14) | 18 | 37,50 | (23,80-51,20) | 2,19 (1,17-4,07) |
| >40 años | 154 | 22,88 | (19,71-26,06) | 19 | 32,20 | (20,28-44,13) | 1,60 (0,90-2,84) |
| Fatiga | 604 | 51,62 | (48,76-54,49) | 64 | 59,81 | (50,52-69,10) | 1,37 (0,91-2,05) |
| Mujeres | 513 | 56,94 | (53,70-60,17) | 46 | 60,53 | (49,54-71,52) | 1,16 (0,72-1,87) |
| Hombres | 91 | 33,83 | (28,17-39,48) | 18 | 58,06 | (40,69-75,44) | 2,71 (1,27-5,77) |
| 17 a 40 años | 291 | 58,55 | (54,22-62,88) | 31 | 64,58 | (51,05-78,11) | 1,29 (0,70-2,39) |
| >40 años | 313 | 46,51 | (42,74-50,28) | 33 | 55,93 | (43,26-68,60) | 1,46 (0,86-2,49) |
| Cefalea | 458 | 39,15 | (36,35-41,94) | 45 | 42,06 | (32,70-51,41) | 1,12 (0,75-1,68) |
| Mujeres | 395 | 43,84 | (40,60-47,08) | 31 | 40,79 | (29,74-51,84) | 0,88 (0,55-1,42) |
| Hombres | 63 | 23,42 | (18,36-28,48) | 14 | 45,16 | (27,64-62,68) | 2,69 (1,26-5,77) |
| 17 a 40 años | 220 | 44,27 | (39,90-48,63) | 25 | 52,08 | (37,95-66,22) | 1,37 (0,76-2,47) |
| >40 años | 238 | 35,36 | (31,75-38,98) | 20 | 33,90 | (21,82-45,98) | 0,94 (0,53-1,64) |
| Mialgias | 285 | 24,36 | (21,90-26,82) | 25 | 23,36 | (15,35-31,38) | 0,94 (0,59-1,51) |
| Mujeres | 249 | 27,64 | (24,72-30,56) | 21 | 27,63 | (17,58-37,69) | 1 (0,59-1,69) |
| Hombres | 36 | 13,38 | (9,31-17,45) | 4 | 12,90 | (1,10-24,70) | 0,96 (0,32-2,90) |
| 17 a 40 años | 124 | 24,95 | (21,15-28,75) | 13 | 27,08 | (14,51-39,66) | 0,82 (0,42-1,60) |
| >40 años | 161 | 23,92 | (20,70-27,15) | 12 | 20,34 | (10,07-30,61) | 0,81 (0,42-1,57) |
| Artralgias | 343 | 29,32 | (26,71-31,92) | 35 | 32,71 | (23,82-41,60) | 1,17 (0,76-1,78) |
| Mujeres | 310 | 34,41 | (31,30-37,51) | 27 | 35,53 | (24,77-46,29) | 1,05 (0,64-1,71) |
| Hombres | 33 | 12,27 | (8,35-16,19) | 8 | 25,81 | (10,40-41,21) | 2,49 (1,03-6,02) |
| 17 a 40 años | 132 | 26,56 | (22,68-30,44) | 15 | 31,25 | (18,14-44,36) | 1,26 (0,66-2,39) |
| >40 años | 211 | 31,35 | (27,85-34,86) | 20 | 33,90 | (21,82-45,98) | 1,12 (0,64-1,97) |
| Nauseas o vómitos | 131 | 11,20 | (9,39-13,00) | 12 | 11,21 | (5,24-17,19) | 1,00 (0,53-1,87) |
| Mujeres | 121 | 13,43 | (11,20-15,66) | 11 | 14,47 | (6,56-22,38) | 1,09 (0,56-2,13) |
| Hombres | 10 | 3,72 | (1,46-5,98) | 1 | 3,23 | -(2,99-9,45) | 0,86 (0,11-6,99) |
| 17 a 40 años | 59 | 11,87 | (9,03-14,71) | 7 | 14,58 | (4,60-24,57) | 1,27 (0,54-2,95) |
| >40 años | 72 | 10,70 | (8,36-13,03) | 5 | 8,47 | (1,37-15,58) | 0,77 (0,30-1,99) |
| Adenopatías | 62 | 5,30 | (4,02-6,58) | 4 | 3,74 | (0,14-7,33) | 0,69 (0,24-1,94) |
| Mujeres | 52 | 5,77 | (4,25-7,29) | 2 | 2,63 | -(0,97-6,23) | 0,44 (0,10-1,85) |
| Hombres | 10 | 3,72 | (1,46-5,98) | 2 | 6,45 | -(2,20-15,10) | 1,79 (0,37-8,55) |
| 17 a 40 años | 28 | 5,63 | (3,61-7,66) | 3 | 6,25 | -(0,60-13,10) | 1,12 (0,33-3,82) |
| >40 años | 34 | 5,05 | (3,40-6,71) | 1 | 1,69 | -(1,60-4,99) | 0,32 (0,04-2,41) |
| Fiebre < 38º C | 188 | 16,07 | (13,96-18,17) | 37 | 34,58 | (25,57-43,59) | 2,76 (1,79-4,23) |
| Mujeres | 162 | 17,98 | (15,47-20,49) | 22 | 28,95 | (18,75-39,14) | 1,86 (1,10-3,14) |
| Hombres | 26 | 9,67 | (6,13-13,20) | 15 | 48,39 | (30,79-65,98) | 8,76 (3,89-19,74) |
| 17 a 40 años | 104 | 20,93 | (17,35-24,50) | 21 | 43,75 | (29,72-57,78) | 2,94 (1,60-5,41) |
| >40 años | 84 | 12,48 | (9,98-14,98) | 16 | 27,12 | (15,77-38,46) | 2,61 (1,41-4,84) |
| Fiebre > 38º C | 53 | 4,53 | (3,34-5,72) | 13 | 12,15 | (5,96-18,34) | 2,91 (1,53-5,53) |
| Mujeres | 49 | 5,44 | (3,96-6,92) | 12 | 15,79 | (7,59-23,99) | 3,26 (1,65-6,44) |
| Hombres | 4 | 1,49 | (0,04-2,93) | 1 | 3,23 | -(2,99-9,45) | 2,21 (0,24-20,41) |
| 17 a 40 años | 28 | 5,63 | (3,61-7,66) | 9 | 18,75 | (7,71-29,79) | 3,86 (1,70-8,77) |
| >40 años | 25 | 3,71 | (2,29-5,14) | 4 | 6,78 | (0,36-13,19) | 1,88 (0,63-5,61) |
OR (IC95%): Odds ratio (intervalo de confianza del 95%). Categoría de referencia: Comirnaty®
Tabla 5. Diferencias de las consecuencias de los efectos adversos a la segunda dosis de vacuna según el tipo de vacuna, sexo y edad: Comirnaty® (categoría de referencia) versus Spikevax®.
| SEGUNDA DOSIS Comirnaty® | SEGUNDA DOSIS Spikevax® | OR (IC95%)* | |||||
|---|---|---|---|---|---|---|---|
| Casos | Prevalencia (por 100) | (IC95%) | Casos | Prevalencia (por 100) | (IC95%) | ||
| Incapacidad temporal | 76 | 6,50 | (5,08-7,91) | 12 | 11,21 | (5,24-17,19) | 1,82 (0,65-3,46) |
| Mujeres | 66 | 7,33 | (5,62-9,03) | 9 | 11,84 | (4,58-19,11) | 1,70 (0,81-3,56) |
| Hombres | 10 | 3,72 | (1,46-5,98) | 3 | 9,68 | -(0,73-20,09) | 2,77 (0,72-10,68) |
| 17 a 40 años | 32 | 6,44 | (4,28-8,60) | 5 | 10,36 | (1,76-18,97) | 1,69 (0,63-4,56) |
| >40 años | 44 | 6,54 | (4,67-8,41) | 7 | 11,86 | (3,61-20,12) | 1,92 (0,82-4,58) |
| Limitaciones para AVD** | 225 | 19,23 | (16,97-21,49) | 40 | 37,38 | (28,22-46,55) | 2,51 (1,65-3,81) |
| Mujeres | 201 | 22,31 | (19,59-25,03) | 32 | 42,11 | (31,00-53,21) | 2,53 (1,56-4,10) |
| Hombres | 24 | 8,92 | (5,52-12,33) | 8 | 25,81 | (10,40-41,21) | 3,55 (1,43-8,80) |
| 17 a 40 años | 104 | 20,93 | (17,35-24,50) | 20 | 41,67 | (27,72-55,61) | 2,70 (1,46-4,98) |
| >40 años | 121 | 17,98 | (15,08-20,88) | 20 | 33,90 | (21,82-45,98) | 2,34 (1,32-4,15) |
| Evitar ejercicio físico | 285 | 24,36 | (21,90-26,82) | 40 | 37,38 | (28,22-46,55) | 1,85 (1,23-2,80) |
| Mujeres | 237 | 26,30 | (23,43-29,18) | 28 | 36,84 | (26,00-47,69) | 1,63 (1,00-2,66) |
| Hombres | 48 | 17,84 | (13,27-22,42) | 12 | 38,71 | (21,56-55,86) | 2,91 (1,32-6,39) |
| 17 a 40 años | 140 | 28,17 | (24,21-32,12) | 20 | 41,67 | (27,72-55,61) | 1,82 (0,99-3,34) |
| >40 años | 145 | 21,55 | (18,44-24,65) | 20 | 33,90 | (21,82-45,98) | 1,87 (1,06-3,30) |
| Evitar conducir | 89 | 7,61 | (6,09-9,13) | 21 | 19,63 | (12,10-27,15) | 2,97 (1,76-5,01) |
| Mujeres | 76 | 8,44 | (6,62-10,25) | 18 | 23,68 | (14,13-33,24) | 3,37 (1,89-6,01) |
| Hombres | 13 | 4,83 | (2,27-7,40) | 3 | 9,68 | -(0,73-20,09) | 2,11 (0,57-7,86) |
| 17 a 40 años | 30 | 6,04 | (3,94-8,13) | 8 | 16,67 | (6,12-27,21) | 3,11 (1,34-7,24) |
| >40 años | 59 | 8,77 | (6,63-10,90) | 13 | 22,03 | (11,46-32,61) | 2,94 (1,50-5,75) |
| Evitar movilizar el brazo | 169 | 14,44 | (12,43-16,46) | 23 | 21,50 | (13,71-29,28) | 1,62 (0,99-2,64) |
| Mujeres | 156 | 17,31 | (14,84-19,78) | 19 | 25,00 | (15,26-34,74) | 1,59 (0,92-2,75) |
| Hombres | 13 | 4,83 | (2,27-7,40) | 4 | 12,90 | (1,10-24,70) | 2,92 (0,89-9,58) |
| 17 a 40 años | 92 | 18,51 | (15,10-21,93) | 13 | 27,08 | (14,51-39,66) | 1,63 (0,83-3,21) |
| >40 años | 77 | 11,44 | (9,04-13,85) | 10 | 16,95 | (7,38-26,52) | 1,58 (0,77-3,25) |
*OR (IC95%): Odds ratio (intervalo de confianza del 95%). Categoría de referencia: Comirnaty®
**AVD = actividades de la vida diaria
Finalmente, tanto para la vacuna Comirnaty® como Spikevax®, se observó una mayor prevalencia de síntomas tras la segunda que tras la primera dosis (Comirnaty® 67,43% IC95% 65,74-69,91 vs. 75,64% IC95% 73,18-78,20; Spikevax® 76,10% IC95% 71,97-80,23 vs. 87,85% IC 95% 81,66-94,04), y tanto en mujeres como en los jóvenes. El mismo patrón se observa para las consecuencias de los efectos adversos tras la administración de la primera vs. la segunda dosis de Comirnaty®, siendo menos claro para la vacuna Spikevax® (Tabla suplementaria 1).
Discusión
En nuestro estudio hemos detectado, en general, una mayor reactogenicidad frente a la vacuna Spikevax® respecto a Comirnaty®, especialmente en las mujeres y los jóvenes de 17 a 40 años, y tras la administración de la segunda dosis, que aparecieron en general en las primeras 24 horas y fueron de corta duración. Las consecuencias, de corta duración también en general, sobre diversos aspectos y actividades laborales y extra-laborales de estos efectos adversos fue también superior para Spikevax® y para ambas dosis de cada vacuna. Los efectos adversos para ambas vacunas fueron más frecuentes tras la segunda dosis, así como sus consecuencias para Comirnaty®, y especialmente en mujeres y jóvenes.
Las Tablas 6 y 7 resumen una comparativa de nuestros resultados con los de otros autores, respecto a los porcentajes de efectos adversos estudiados tras la primera y segunda dosis de vacuna, respectivamente, tanto de Spikevax® como Comirnaty®
Tabla 6. Comparación de la frecuencia (%) de efectos adversos a las vacunas RNAm contra la COVID-19, y sus consecuencias, primera dosis: revisión de la literatura.
| Comirnaty® Inglés et al. | Comirnaty® Polack FP et al8 | Comirnaty® CDC16 (>55 - 18 a 55 a) | Comirnaty® Bae S et al18 | Comirnaty® Palomo-Palomo et al19 | Spikevax® Inglés et al | Spikevax® Baden LR et al3 | Spikevax® CDC17 (>55 - 18 a 55 a) | Spikevax® Okumura et al25 | |
|---|---|---|---|---|---|---|---|---|---|
| % | % | % | % | % | % | % | % | % | |
| Efectos adversos | |||||||||
| Algún efecto adverso | 67,83 | 80,10 | 76,10 | ||||||
| Dolor local | 67,36 | 71-83 | 71,10-83,10 | 70,00 | 74,60 | 72,93 | 83,70 | 74,00-86,90 | 87,60 |
| Rubor local | 9,88 | 5,00 | 4,50-4,70 | 2,50 | 16,59 | 2,80 | 2,30-3,00 | 5,60 | |
| Hematoma en punto inyección | 4,26 | 8,29 | |||||||
| Flogosis | 4,26 | 6,00-7,00 | 5,80-6,50 | 5,10 | 25,12 | 6,10 | 4,40-6,70 | 17,80 | |
| Fatiga | 25,68 | 34,00-47,00 | 34,10-47,40 | 37,50 | 9,30 | 39,02 | 37,20 | 38,50 | 17,80 |
| Cefalea | 21,05 | 25,00-42,00 | 25,20-41,90 | 24,20 | 11,30 | 30,98 | 32,70 | 33,30-35,40 | 23,90 |
| Mialgias | 8,99 | 14,00-21,00 | 13,90-21,30 | 33,60 | 11,95 | 22,70 | 19,80-23,70 | 22,80 | |
| Artralgias | 9,93 | 9,00-11,00 | 8,60-11,00 | 9,40 | 5,50 | 19,02 | 16,60 | 16,40-16,60 | 11,20 |
| Nauseas o vómitos | 4,21 | 0,00-1,00 | 0,50-1,20 | 6,10 | 1,40 | 6,83 | 8,30 | 5,20-9,30 | 3,50 |
| Adenopatías | 1,82 | 1,71 | 10,20 | 6,10-11,60 | |||||
| Fiebre < 38º C | 4,05 | 12,93 | |||||||
| Fiebre > 38º C | 1,09 | 1,00-4,00 | 1,40-3,70 | 6,90 | 1,40 | 4,63 | 0,80 | 0,30-0,90 | 30,90 |
| Consecuencias efectos adversos | |||||||||
| Incapacidad temporal | 1,61 | 4,39 | |||||||
| Limitaciones para AVD* | 4,94 | 13,90 | |||||||
| Evitar Ejercicio físico | 11,90 | 24,15 | |||||||
| Evitar conducir | 2,75 | 6,34 | |||||||
| Evitar movilizar brazo | 13,88 | 28,54 | |||||||
*AVD = actividades de la vida diaria
Tabla 7. Comparación de la frecuencia (%) de efectos adversos a las vacunas RNAm contra la COVID-19, y sus consecuencias, segunda dosis: revisión de la literatura.
| Comirnaty® Inglés et al. | Comirnaty® Polack FP et al8 | Comirnaty® CDC16 (>55 - 18 a 55 a) | Comirnaty® Kadali et al21* | Comirnaty® Powell AA et al22 | Comirnaty® Palomo-Palomo et al19 | Spikevax® Inglés et al | Spikevax® Baden LR et al3 | Spikevax® CDC17 (>55 - 18 a 55 a) | Spikevax® Okumura et al25 | Spikevax® Kadali RAK et al29** | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| % | % | % | % | % | % | % | % | % | % | % | |
| Efectos adversos | |||||||||||
| Algún efecto adverso | 75,64 | 87,85 | |||||||||
| Dolor local | 67,26 | 66,00-78,00 | 77,80 | 88,04 | 26,30 | 64,80 | 81,31 | 88,20 | 83,40-90,10 | 86,00 | 94,21 |
| Rubor local | 18,38 | 6,00-7,00 | 5,90 | 7,50 | 29,91 | 8,60 | 7,40-9,00 | 14,50 | |||
| Hematoma en punto inyección | 7,09 | 10,28 | |||||||||
| Flogosis | 22,31 | 6,00-7,00 | 6,30 | 5,48 | 34,58 | 12,20 | 10,80-12,60 | 19,60 | 15,05 | ||
| Fatiga | 51,62 | 51,00-59,00 | 50,50-59,40 | 25,10 | 59,81 | 65,30 | 58,40-67,60 | 32,40 | 65,74 | ||
| Cefalea | 39,15 | 39,00-52,00 | 39,00-51,70 | 18,00 | 26,80 | 42,06 | 58,60 | 46,40-62,80 | 54,20 | 59,26 | |
| Mialgias | 24,36 | 29,00-37,00 | 28,70-37,30 | 45,70 | 23,36 | 58,00 | 46,90-61,30 | 38,50 | 54,17 | ||
| Artralgias | 29,32 | 19,00-22,00 | 18,90-21,90 | 16,56 | 12,80 | 18,50 | 32,71 | 42,80 | 34,90-45,20 | 44,70 | 24,77 |
| Nauseas o vómitos | 11,20 | 1,00-2,00 | 0,70-1,90 | 15,94 | 3,00 | 8,70 | 11,21 | 19,00 | 11,80-21,30 | 6,70 | 26,62 |
| Adenopatías | 5,30 | 3,36 | 3,74 | 14,20 | 8,40-16,00 | ||||||
| Fiebre < 38º C | 16,07 | 34,58 | |||||||||
| Fiebre > 38º C | 4,53 | 11,00-16,00 | 10,90-15,80 | 9,80 | 13,20 | 12,15 | 15,50 | 10,20-17,40 | 87,70 | 35,65 | |
| Consecuencias efectos adversos | |||||||||||
| Incapacidad temporal | 6,50 | 11,21 | |||||||||
| Limitaciones para AVD | 19,23 | 37,38 | 25,00 | ||||||||
| Evitar ejercicio físico | 24,36 | 37,38 | |||||||||
| Evitar conducir | 7,61 | 19,63 | |||||||||
| Evitar movilizar brazo | 14,44 | 21,50 | |||||||||
*El estudio no discrimina entre síntomas a la primera i la segunda dosis, pero refiere que sólo el 7% de los participantes habían recibido una única dosis, por lo que la sintomatología post-vacunación ha sido considerada en el grupo de segundas dosis.
**El estudio no discrimina entre síntomas a la primera i la segunda dosis, pero refiere que sólo el 18.29% de los participantes habían recibido una única dosis por lo que la sintomatología post-vacunación ha sido considerada en el grupo de segundas dosis.
***AVD = actividades de la vida diaria.
En nuestro estudio, al igual que en la bibliografía consultada1,2,16-18, se determina una mayor reactogenicidad con la vacuna Spikevax® respecto a la vacuna Comirnaty®, diferencias que podrían explicarse tanto por una mayor volumen inyectado (0,5 versus 0,3 mL), como por una mayor cantidad y concentración de RNAm que contiene cada vacuna (200 µgr/mL versus 100 µgr/mL)2 o por la distinta concentración de adyuvantes y excipientes.
Nuestro estudio también es coincidente con otros estudios en cuanto a determinar el dolor en el punto de inyección, la fatiga, la cefalea y el malestar general como los efectos adversos más prevalentes en estas vacunas2,3,8,16,17,19-24. En pocos de los artículos consultados se analizan los eventos adversos en función del sexo, pero en los que se considera la variable sexo, nuestro resultados son coincidentes con una mayor frecuencia en las mujeres respecto a los hombres para todos los eventos2,19,25 excepto en el estudio de Bae et al18 que no encuentra diferencias significativas por razón de sexo para Comirnaty® probablemente por tratarse de una muestra pequeña de casos, ya que sí las evidencia para una vacuna de vector viral con una muestra mayor.
Las diferencias en la frecuencia de cada uno de los efectos adversos en los distintos artículos y en nuestro estudio (Tablas 6 y 7) pueden ser atribuibles a la proporción de hombres y mujeres así como a las distintas distribuciones entre los grupos etarios en la demografía de las poblaciones objeto de cada estudio. En nuestro estudio no se ha considerado la posibilidad de haber padecido COVID-19 previamente a la vacunación, dado que no disponíamos de ese dato en un gran número de vacunados. Teniendo en cuenta que haber padecido COVID-19 antes de la vacunación puede inducir una mayor reactogenicidad a la vacuna2,15,26-28, la no consideración de esta variable podría suponer un sesgo de los resultados.
Las actividades para la vida cotidiana y evitar conducir se vieron más limitadas en las segundas dosis que en las primeras dosis para ambas vacunas y estadísticamente significativo más frecuentemente con Spikevax® que con Comirnaty. La necesidad de una incapacidad laboral temporal, evitar el ejercicio físico y evitar movilizar el brazo siguió el mismo patrón, pero sin demostrar significación estadística, probablemente por un numero escaso de casos. Existen pocos estudios que analicen la variable necesidad de ausentarse del trabajo por razones de salud para poder comparar con nuestros datos observados.
Nuestro estudio no carece de limitaciones. En primer lugar, los cuestionarios utilizados no incluían posibles reacciones adversas tardías que quedan fuera del presente estudio. En segundo lugar, la menor tasa de respuesta de encuestas validas en la segunda dosis de vacuna Spikevax® puede justificar la falta de diferencias significativas por género y grupos de edad en la mayor reactividad de la segunda dosis de esta vacuna. Las bajas tasas de respuesta en las segundas dosis de vacuna, especialmente en el caso de la vacuna Spikevax®, puede suponer un sesgo de selección por una posible sobrerrepresentación de los individuos que presentaron algún efecto adverso o alguna limitación en sus actividades respecto a los que no sufrieron tales efectos o fueron de carácter leve. Sin embargo para algunos efectos adversos nuestra tasa de aparición es inferior que la publicada en otros estudios2,15,26-28.
Aun contando con una baja variabilidad en la aplicación de la vacuna, dado que se trataba de un grupo reducido y estable de enfermeras y que se consensuó la técnica de aplicación entre ellas (mismo tipo de aguja, inyección perpendicular a la piel, etc.), no puede descartarse, especialmente en la reactogenicidad local, un cierto sesgo relacionado con la forma de aplicación de la vacuna.
Las diferencias encontradas en la reactogenicidad entre las dos vacunas administradas, teniendo en cuenta que la asignación de una u otra era aleatoria (dependía de la disponibilidad de vacunas distribuidas), no es probable que pueda ser debido a un sesgo de selección.
En conclusión, hemos observado una mayor reactogenicidad tanto en la primera dosis como en la segunda dosis de la vacuna Spikevax® respecto a Comirnaty®, especialmente en mujeres y grupo de edad entre 17 y 40 años, así como las consecuencias de estos efectos adversos. Y globalmente la segunda dosis está asociada a una frecuencia superior de efectos adversos y sus consecuencias. Esta información añade conocimiento que puede ser muy útil al planificar nuevas campañas de vacunación en sanitarios. En el caso hipotético que fuera posible, también podría contribuir a seleccionar la vacuna con mayor aceptación y menos efectos adversos en este colectivo esencial.














