INTRODUCCIÓN
Según la Organización Mundial de la Salud (OMS) la prevalencia mundial de la Diabetes Mellitus (DM) en 2014 fue del 9% entre los adultos mayores de 18 años1.
Las úlceras de Pie Diabético (PD), una de las principales complicaciones de los pies de estos pacientes, pueden ser prevenibles con una adecuada estrategia que comprenda cribado, clasificación del riesgo y medidas efectivas de prevención y tratamiento2.
El riesgo de aparición de úlceras o amputaciones aumenta en las personas diabéticas que presentan los siguientes factores de riesgo: edad avanzada o tiempo de evolución de la DM superior a 10 años, control glucémico deficiente o no controlado (HbA1c elevada), la pérdida de sensación en la región distal del pie al monofilamento de 10 g “Semmes Weinstein”, neuropatía periférica con entumecimiento y pérdida de la sensación protectora (LOPS), fumar, dislipemia e hipertensión arterial, deformidades o hiperqueratosis del pie, heloma o herida preulcerativa, enfermedad vascular periférica (EVP), historia o antecedentes de úlcera o amputación en el pie, amputación, calzado no adecuado, deterioro visual (retinopatía avanzada), movilidad articular disminuida, nefropatía diabética o insuficiencia renal (especialmente pacientes en diálisis), nivel socioeconómico bajo, alcoholismo, aislamiento social o higiene deficiente de pies3.
De tal forma, que existen factores predisponentes, neuropatía diabética asociada a macro y microangiopatía, dando lugar a un pie vulnerable de alto riesgo; factores precipitantes o desencadenantes, como el traumatismo mecánico, desencadenando una úlcera o necrosis, y factores agravantes, que determinarán el pronóstico de la extremidad e incluyen la infección que provoca daño tisular extenso, la isquemia que retrasa la cicatrización y la neuropatía que evita la identificación de la lesión y del factor precipitante4.
La termografía infrarroja (TI) es una técnica que permite medir la temperatura o el calor irradiado a distancia de un cuerpo y sin necesidad de contacto físico con el objeto a estudiar, mediante la captación de la radiación infrarroja del espectro electromagnético5. Es una técnica segura, no invasiva y de bajo coste que permite el registro rápido y sin contacto con el paciente de la energía irradiada del cuerpo6.
La circulación sanguínea es el principal mecanismo de transferencia de calor en el cuerpo humano, dicho calor emana sobre la superficie de la piel y rodea el flujo sanguíneo en los trayectos arteriovenosos7. La termografía infrarroja muestra los gradientes de temperatura en las regiones afectadas con trastornos vasculares indicando un flujo sanguíneo anormal. El contraste de temperatura en las regiones afectadas es de aproximadamente 0.7 a 1°C por encima de las regiones normales, debido a la lenta circulación sanguínea8. Existen publicaciones además que sugieren que las variaciones de la temperatura dérmica de 2.2 °C podrían ser útiles en la vigilancia de la piel9.
Los profesionales sanitarios deben revisar las recomendaciones de realización del examen completo del pie para obtener un conocimiento más preciso y adecuado de las pruebas a desarrollar10.
MATERIAL Y MÉTODOS
Se plantea un estudio descriptivo, transversal y observacional11. La muestra para este estudio se compone de un total de 479 sujetos encuadrados en dos grupos, grupo casos (personas con diabetes) y grupo control (personas sin diabetes). El grupo casos compuesto de un total de 277 personas, con una edad media de 63.41 años, de los cuales 138 son hombres (49.8%) y 139 son mujeres (50.2%). De igual modo para el grupo controles, el número consistió en 202 usuarios, con una edad media de 61.92 años, de los cuales 99 son hombres (49%) y 103 son mujeres (51%).
El grupo casos incluye a todos lo pacientes con un diagnóstico preciso de Diabetes Mellitus de acuerdo a los criterios para el diagnóstico de diabetes de la Asociación Americana de Diabetes (ADA)10. Los criterios de inclusión fueron; tener diabetes mellitus diagnosticada y aceptar la participación firmando el consentimiento informado. Se excluyeron aquellos sujetos que, aunque padeciendo diabetes, presentaran fractura o cirugía reciente en miembro inferior, limitaciones sensorio-perceptivas que les impidiera responder a la evaluación o pudieran interferir en el seguimiento, pacientes con diabetes gestacional y/o hiperhidrosis plantar.
El grupo control incluye sujetos sin diabetes mellitus diagnosticada, residentes de la comunidad autónoma de Extremadura, de ambos sexos, que aceptaron participar en el estudio firmando el debido consentimiento informado. Como criterios de exclusión se esTablecen; la presencia de fractura o cirugía reciente en miembro inferior, presenten limitaciones sensorio-perceptivas que les impida responder a la evaluación y que interfiera con el seguimiento, el rechazo a participar en el estudio, y que padezcan hiperhidrosis plantar o sudoración excesiva en los pies.
La recogida de datos se realizó en las instalaciones de la Clínica Podológica de la Universidad de Extremadura en Plasencia (Cáceres-Spain) y en varios centros de salud pertenecientes al Servicio Extremeño de Salud de la Consejería de Sanidad y Políticas Sociales. En nuestro estudio, la temperatura media de la sala de realización de las pruebas estuvo entre 22.63 ± 2.28 ºC, con una humedad relativa del 33.50 ± 8.10 %12.
Se confirmó el diagnóstico de diabetes con la evaluación de los valores de glucosa y hemoglobina glicosilada de la última analítica13. Se realizó una entrevista a todos los sujetos del estudio y se procedió a la exploración física rutinaria. Para minimizar el sesgo inter e intra explorador, todas las intervenciones se llevaron a cabo por dos clínicos cualificados y adiestrados en la materia14.
Las variables utilizadas se agruparon en siete apartados, las pertenecientes al apartado de datos antropométricos (edad, peso, talla, IMC y perímetro abdominal), constantes vitales (temperatura corporal, tensión arterial sistólica, tensión arterial diastólica, pulso y saturación de oxígeno) y aquellas relacionadas con el diagnóstico y evolución de la DM (años de diagnóstico, glucemia basal, nivel de HbA1c, colesterol total, niveles de HDL y LDL colesterol). De igual modo, las relacionadas con la presencia de factores de riesgo (consumo de tabaco y alcohol, presencia de arteriosclerosis, hipertensión arterial, cardiopatía isquémica u obesidad), las relacionadas con la actividad física realizada (sedentarismo, caminar, correr u otras), las relacionadas con la valoración de neuropatía (monofilamento de Semmens - Weinstein, diapasón de 128 mHz, reflejos rotuliano y aquíleo) y las relacionadas con la valoración de vasculopatía (inspección de la piel, pulso poplíteo, pulso tibial posterior y pulso pedio, valoración del relleno capilar, valoración del dolor al caminar y del dolor en reposo).
El investigador informó a los usuarios del estudio sobre el origen, el propósito, el uso de los datos y, en general, sobre todos los aspectos que podrían influir en su participación. Esta investigación se basó en el cumplimiento efectivo de los principios de ética, teniendo en cuenta la firma del consentimiento informado previo a la realización del estudio en personas, teniendo en cuenta todos los aspectos esTablecidos al respecto y el informe favorable de la Comisión de Bioética. Bioseguridad de la Universidad de Extremadura; siguiendo los principios esTablecidos en la Declaración de la Metodología Médica Mundial de Helsinki.
El análisis estadístico se ha realizado utilizando el paquete estadístico IBM SPSS Statistics 22. Para el análisis descriptivo se han calculado el número de pacientes (N), los valores medios, desviación típica (D.T.), mínimo, máximo y percentiles 25, 50 y 75 P25, P50y P75. Prueba T para muestras independientes. Compara muestras independientes cuando los valores de las variables cumplen los criterios paramétricos. Todas las decisiones tomadas se han hecho con un nivel de confianza del 95 por ciento.
RESULTADOS
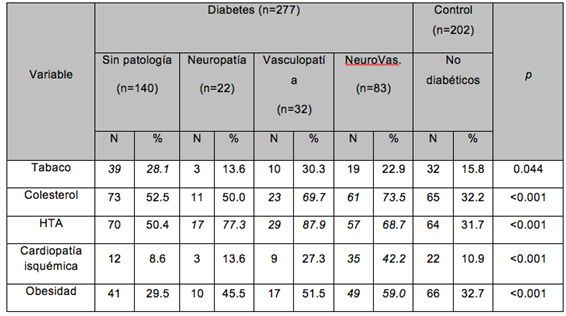
Al contrastar los datos antropométricos y valores de los parámetros vitales entre el grupo Diabetes y el grupo control (no Diabetes), se observan diferencias significativas (p<0.050), con un mayor peso (p=0.048), IMC (p=0.042), perímetro abdominal (p<0.001), tensión arterial sistólica (p=0.003) y tensión arterial diastólica (p=0.015), así como el pulso (p<0.001) en el grupo de diabéticos que en el grupo de control (Tabla 1).
Tabla 1. Datos antropométricos y constantes vitales del Grupo Diabetes y del Grupo Control.
(DT, Desviación típica; Mín, Mínimo; Máx, Máximo; IMC, Índice de Masa Corporal; TA, Tensión Arterial)
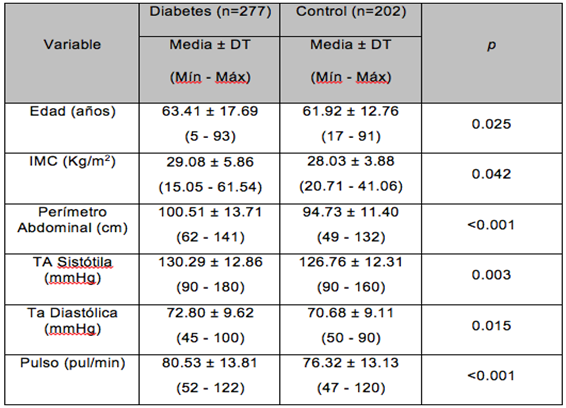
Al desglosar los datos antropométricos entre las categorías del grupo Diabetes y el grupo control (no Diabetes), se observan diferencias significativas (p<0.050), con una mayor edad de los subgrupos neuropatía, vasculopatía y neurovasculopatía frente al grupo sin patología (p<0.001), la temperatura corporal es similar en todos los grupos aunque el grupo neurovascular es significativamente mayor que el grupo sin patología (p=0.048), en cuanto al IMC es mayor en los subgrupos neuropatía, vasculopatía y neurovasculopatía que sin patología y no diabéticos (p<0.001), así como el perímetro abdominal es mayor en todos los subgrupos de Diabetes frente a no diabéticos (p<0.001) (Tabla 2).
Tabla 2. Datos antropométricos del Grupo Diabetes desglosado y del Grupo Control.
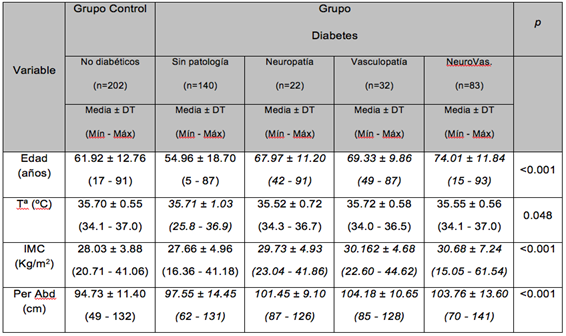
(DT, Desviación típica; Mín, Mínimo; Máx, Máximo; IMC, Índice de Masa Corporal; NeuroVas, Neurovasculopatía; Tª, Temperatura; Per Abd, Perímetro Abdominal)
En el grupo Diabetes, los resultados descripticos en cuanto al diagnóstico y evolución de la DM, en la fecha de recogida de la información, es de 16.89 años de evolución de patología diabética, con una glucemia basal media de 138.96 mg/dL, 12.96 mg/dL por encima del valor esTablecido como patológico (≥ 126 - 130 mg/dL); una Hemoglobina Glicosilada de 7.32 %, valor superior de 0.82 % al criterio esTablecido de diagnóstico de DM (≥ 6.5 %), y un perfil lipídico completo, cumpliendo criterios de normalidad, de 166.61 mg/dL de Colesterol Total (< 200 mg/dl), 52.38 mg/dL de Colesterol HDL (> 50 mg/dl) y 92.78 mg/dL de Colesterol LDL (< 100 mg/dl) (Tabla 3).
Tabla 3. Datos de diagnóstico y evolución del Grupo Diabetes.
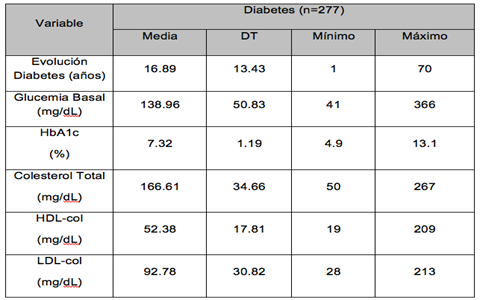
(DT, Desviación típica; HbA1c, Hemoglobina glicosilada)
Por tanto, los valores siguen un comportamiento acepTable de los criterios de normalidad de dichos parámetros de la American Diabetes Association.
Al desglosar los factores de riesgo entre las categorías del grupo Diabetes y el grupo control (no Diabetes), se observan diferencias significativas (p<0.050), con un mayor índice tabáquico en el subgrupo sin patología frente a los no diabéticos (p=0.048), la presencia de colesterol e HTA es significativamente mayor que el grupo sin patología y no diabéticos (p<0.001), la cardiopatía isquémica es mayor en los subgrupos neurovasculopatía frente a sin patología y no diabéticos (p<0.001), así como la obesidad es mayor en todos los subgrupos de Diabetes frente a no diabéticos (p<0.001) (Tabla 4).
DISCUSIÓN
Tras el estudio estadístico de las variables de estudio, se puede afirmar que la relación entre los diferentes factores de riesgo asociados a la aparición del pie diabético han sido significativas. Los primeros resultados obtenidos sobre factores de riesgo en los datos antropométricos son claros en tres variables específicas, peso, IMC y perímetro abdominal.
Los pacientes con DM registraron unos valores noTablemente superiores peso (p=0.048), IMC (p=0.042), perímetro abdominal (p<0.001), que los del grupo de control. Destaca también la varianza de los datos sobre la tensión arterial sistólica (p=0.003) y tensión arterial diastólica (p=0.015) siendo inferior en el grupo de control.
La relevancia de estos datos es respaldada por diferentes estudios que han asociado factores de riesgo cardiovascular, como el sobrepeso o la obesidad, así como la Hipertensión arterial, en pacientes diabéticos con el desarrollo de la neuropatía diabética y el pie diabético15.
Tesfaye en un estudio realizado a pacientes con DM 2 sin ninguna complicación, registró que, de los 1172 componentes de la muestra, 276 habían desarrollado una neuropatía tras un seguimiento de evaluación de siete años. La incidencia acumulada de neuropatía se relacionó con el valor de la hemoglobina glicosilada y la duración de la diabetes, pero tras el ajuste de estos factores, los autores destacaron un índice de masa corporal más alto, hipertensión y tabaquismo de una manera significativa con la incidencia acumulada de neuropatía15.
Los niveles más altos de lipoproteínas totales y colesterol y triglicéridos de baja densidad, también fueron considerados un factor de riesgo en el estudio de Tesfaye15. A diferencia que en el estudio de Tesfaye, en el presentado en este trabajo el perfil lipídico completo cumplía con los criterios de normalidad, de 166.61 mg/dL de Colesterol Total (< 200 mg/dl), 52.38 mg/dL de Colesterol HDL (> 50 mg/dl) y 92.78 mg/dL de Colesterol LDL (< 100 mg/dl) por otro lado la Hemoglobina Glicosilada fue de 7.32 %, un valor superior de 0.82 % al criterio esTablecido de diagnóstico de DM (≥ 6.5 %).
Pero estos datos han de analizarse bajo la perspectiva muestral, es decir mientras que en la investigación que se ha llevado a cabo se incluyeron pacientes con ambos tipos de diabetes DM1 y 2, el de Tesfaye, solo incluyó pacientes del tipo 1, por lo que podría haber diferencias con respecto al número de pacientes con DM 2 que hubieran podido desarrollar la patología y que factores de riesgo hubieran influenciado en mayor medida tal desarrollo. Por otro lado, en el estudio de Tesfaye el tamaño de la muestra 1172, el seguimiento de 7 años, el método de evaluación y la no diferenciación de género, marcan la diferencia.
Este último dato es destacado, debido a que la suposición de la influencia del género en el desarrollo de las úlceras del pie ha sido controvertida, con algunos estudios que esTablecen el sexo masculino como factor de riesgo debido a que por un lado son más propensos a tener algunos de los predictores independientes claves como una mayor prevalencia de neuropatía periférica16,17, tabaquismo y factores de riesgo cardiovasculares18,19 y por otro lado, por las investigaciones que avalan que los hombres tienen casi el doble de probabilidades de tener la neuropatía sensorial, el tipo más común de neuropatía asociada con la ulceración del pie diabético, que las mujeres, y tienen anormalidades en la conducción nerviosa que son más graves16,20.
Esto se contrapone a estudios recientes que esTablecen una prevalencia con respecto a la neuropatía periférica diabética superior en las mujeres21,22. En nuestra investigación la muestra de pacientes diabéticos fue de un 49.8% de hombres y 50.2% de mujeres, pero no se tuvo en cuenta el género como variable interviniente en la investigación.
La edad avanzada o el tiempo de evolución de la DM superior a 10 años son también factores de riesgo importantes con respecto al desarrollo de las complicaciones asociadas a la DM como el pie diabético. En el presente estudio, la edad media de los pacientes con DM era variada dependiendo de la patología o no a la que estaban asociadas.
La media del grupo con DM sin otra patología asociada era de 54.96 ± 18.70 y representaban más del 50% de la muestra con DM. Siendo el rango más joven por encima incluso del grupo de control. La media de edad del grupo de pacientes con DM que padecían neuropatía 67.97 ± 11.20 y solo representaban el 8% de la muestra, el grupo con vasculopatía el 11% de la muestra se situó en 69.33 ± 9.86 y el de mayor edad que representaba casi el 30% tenía una media de edad de 74.01 ± 11.84 y padecía complicaciones neurovasculares.
Los datos son coherentes con respecto a otros estudios realizados en relación con la edad y las posibles complicaciones asociadas a la DM. En el estudio de Rahman23, en el que se intentó relacionar la prevalencia de diversas complicaciones microvasculares con factores antropomórficos, identificar las diversas características clínicas y bioquímicas relacionadas con estas complicaciones en sujetos con diabetes tipo II, los resultados demostraron que los factores de riesgo para desarrollar cualquier forma de complicación microvascular fue una edad avanzada, en este estudio la edad de aquellos con neuropatía diabética fue mayor (63.3 ± 13.1 años) una varianza de apenas 4 puntos con respecto al que se presenta en este artículo, esto ya fue ratificado por otras investigaciones previas24. Por otro lado, el grupo de control se encontraba en una media de edad de 61.92 ± 12.76.
Es importante destacar que, si bien como se mencionó al principio en el análisis realizado el IMC del grupo con DM, fue superior en su conjunto al del de control, si se analizan los datos desglosados del grupo con DM, se pueden destacar diferencias noTables.
El grupo con menor IMC de entre los dos grupos, fuel el perteneciente a los pacientes con DM sin patología asociada 27.66 ± 4.96, seguido solo por menos de medio punto del grupo de control con 28.03 ± 3.88. Esto puede deberse a la diferencia de edad entre el grupo de control y esta parte del grupo de DM, el grupo de DM sin patología presenta la media de edad más baja del desglose. Lo sorprendente es que los datos se invierten en el análisis de los datos del perímetro abdominal siendo 94.73 ± 11.40 y 97.55 ± 14.45 para el grupo de control y el de DM sin patología respectivamente.
En el resto de los grupos todos registran un mayor IMC correlacionado con un mayor perímetro abdominal en comparación con el grupo de control. Pero hasta qué punto esto puede ser un predictor de complicaciones o de pie diabético. Diferentes estudios han relacionado un alto IMC, y un perímetro abdominal elevados específicamente con la DM 225,26,27.
Pero incluso hay investigadores que otorgan mayor valor a una medición por encima de la otra, por ejemplo, Flegal apoya el uso de la circunferencia de la cintura como una medida de la obesidad para predecir el riesgo para la salud. Entre sus argumentos están que la circunferencia de la cintura ha demostrado ser un buen o mejor predictor que el índice de masa corporal del síndrome metabólico, diabetes, enfermedad cardiovascular y mortalidad por todas las causas; proporciona información sobre el riesgo de salud además del índice de masa corporal; y es conceptualmente fácil de medir, aunque requiere cierto entrenamiento y estandarización28.
Sin embargo, otros han notado que la sustitución del índice de masa corporal por la circunferencia de la cintura como un indicador del riesgo de enfermedad cardiovascular y diabetes puede ser una simplificación excesiva29. Algunos contraargumentos son que la circunferencia de la cintura está fuertemente correlacionada con el índice de masa corporal30.
La circunferencia de la cintura no diferencia entre la grasa subcutánea y la grasa visceral; no se ha demostrado que exista una asociación consistente entre la circunferencia de la cintura con grasa visceral después del ajuste por edad e índice de masa corporal; y la distribución de grasa corporal es diferente en los estratos de raza, sexo y edad.
CONCLUSIONES
Se puede concluir afirmando que el estudio de los diferentes factores de riesgo es clave en el diagnóstico del pie de riesgo. Se puede esTablecer con rotundidad que la edad es evidente un condicionante, ya que las edades avanzadas se corresponden con un IMC y perímetro abdominal mayor. Unido al análisis mediante termografía infrarroja en la evaluación del pie de riesgo es útil para el diagnóstico y prevención de zonas comprometidas del pie, evitando así el desencadenante evidente en los daños propios de un pie diabético. La prevención en dichos pacientes se considera fundamental para una mejora en la calidad de vida, disminuyendo a su vez costes en servicios sanitarios propios de los caros tratamientos de las complicaciones de un pie diabético.











 texto en
texto en